苏教版高中化学必修第一册专题2研究物质的基本方法2.3人类对原子结构的认识课件(共46张PPT)
文档属性
| 名称 | 苏教版高中化学必修第一册专题2研究物质的基本方法2.3人类对原子结构的认识课件(共46张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-23 09:46:15 | ||
图片预览









文档简介
(共46张PPT)
2.3人类对原子结构的认识
1.了解原子是由原子核和核外电子构成的。
2.掌握质子数、中子数、质量数及核电荷数之间的关系。
3.了解核素、同位素等概念。
4.了解核外电子的分层排布,掌握1~18号元素的核外电子排布情况。
【学习目标】
一、人类认识原子结构的历程
二、原子的构成
三、原子核外电子排布
一、人类认识原子结构的历程
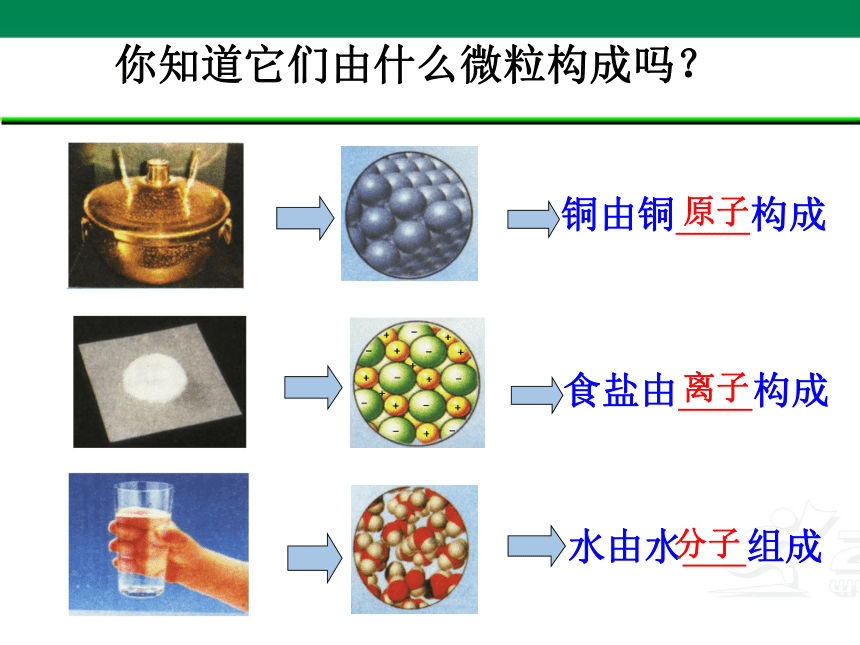
水由水 组成
食盐由 构成
你知道它们由什么微粒构成吗?
铜由铜 构成
分子
离子
原子
请大家结合初中学过的知识及教材P44-45的短文,思考下列几个问题。
1、原子结构模型的演变经历了哪几个重要阶段?
2、用简洁的语言表达各阶段(道尔顿、汤姆生、卢瑟福、玻尔)对原子结构模型的认识特点?
3、请你谈谈从原子结构的演变得到什么启迪?
【历史足迹】
1803年 道尔顿[英]:“实心球”模型
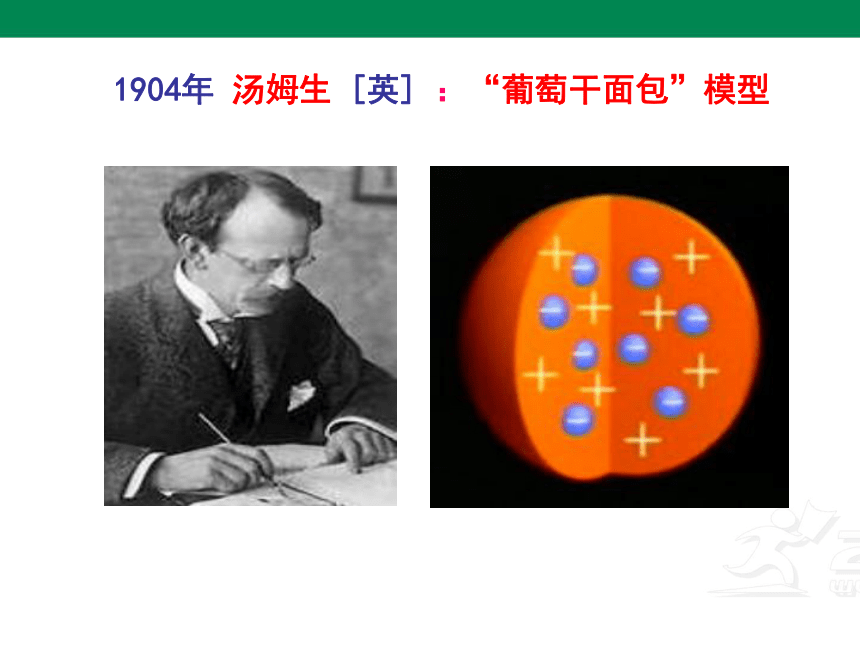
1904年 汤姆生 [英] :“葡萄干面包”模型
1911年 卢瑟福 [英]:
“核式”模型
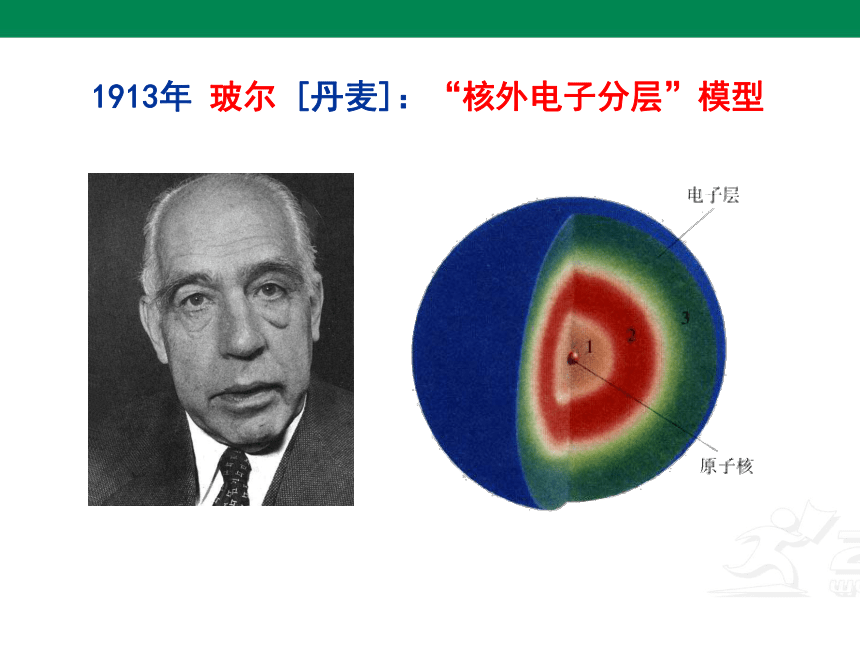
1913年 玻尔 [丹麦]:“核外电子分层”模型
历 程 原子模型
从原子结构模型的演变历史中,主要有哪些科学家提出了哪些原子模型呢?
在认识过程中,科学家运用了哪些科学研究方法?
1803年 道尔顿
“实心球”模型
1904年 汤姆生
“葡萄干面包”模型
1911年 卢瑟福
“核式”模型
1913年 玻 尔
“核外电子分层”模型
启迪:(1) 化学认识发展过程中的继承、积累、突破和革命。
(2) 实验方法是科学研究的一种重要方法,实验手段的不断进步是化学科学的关键
(3) 科学研究、科学发现是无止境的。
二、原子的构成
原子
原子核
核外电子
质子
中子
1.原子的组成和表示方法
(1)组成
一个质子带一个单位的正电荷
不带电荷
一个电子带一个单位的负电荷
交流与讨论
原子的组成
原子 原子核 质子
中子
核外电子
电量/C 质量/kg 相对质量
1.602 ×10-19 1 .673 × 10-27 1.007
0 1.675 × 10-27 1.008
1.602 × 10-19 9.109 × 10-31 1/1836
请同学们根据上表比较这三种粒子的质量大小和带电荷情况?得到什么样的结论
◆三种粒子的质量都很小
◆质子和中子的质量基本相等,电子的质量最小
◆质子带正电荷,中子不带电,电子带负电
◆质子和电子带电量相等,电性相反
结论:
【思考】原子的质量集中在原子核上
还是原子核外呢?为什么?
相对于质子和中子,电子的质量很小,可以忽略不计,原子的质量主要由原子核决定
原子 质子数
(Z) 中子数
(N) 质子数+中子数
(A) 相对原子质量
F 9 10 18.998
Na 11 12 22.990
Al 13 14 26.986
19
23
27
X
Z
A
F
9
19
Na
11
23
Al
13
27
完成教材47页的问题解决。
A
Z
X
X原子的质子数
(2)原子表示方法
X表示元素符号
表示X原子的质量数
1.原子的组成和表示方法
粒子
符号 质子数
Z 中子数N 质量数
A
O 8 18
Al 14 27
Ar 18 22
Cl
H
A
X
Z
Cl
35
17
H
1
1
10
O
18
8
Ar
13
Al
27
13
40
40
18
17
18
35
1
0
1
1.是不是所有的原子核都是由质子和中子构成的呢?
2.原子的质子数,中子数,电子数和质量数的之间关系?
质量数=质子数+中子数
X
A
Z
——元素符号
质量数 ——
核内质子数——
(核电荷数)
X
A
Z
原子
原子核
核外电子(Z)
质子(Z)
中子(N=A - Z)
总结:原子的表示方法
A
Z
X
c+
-
-
+d
e
A:
Z:
e:
c:
d:
质量数
质子数
一个分子中原子个数
离子所带电荷数
化合价
中各个字母的含义:
2.原子构成微粒之间的数量关系
质量数=原子的近似相对原子质量
注意:只是数值上相等,但意义不一样
(1)质量数
将原子核内所有的质子和中子的相对质量
取整数,加起来所得到的数值称为质量数
(2)各微粒之间的关系
①核电荷数=核内质子数=核外电子数=原子序数
②质量数(A)=质子数(Z)+中子数(N)
③构成原子、离子的微粒之间的数量关系
原子: 核电荷数(Z)=核内质子数=核外电子数
阳离子:核电荷数(Z)=核内质子数 核外电子数
核内质子数(Z)=核外电子数 电荷数
阴离子:核电荷数(Z)=核内质子数 核外电子数
核内质子数=核外电子数 电荷数
+
>
<
Al Al3+ Cl Cl-
质子数 13 13 17 17
电子数 13 10 17 18
—
总结分析:用 AZX表示原子:
1.求中性原子的中子数:N=
2.求阴离子的中子数,AXn-共有x个电子,
则N=
3.求阳离子的中子数,AXn+共有x个电子,
则N=
4.求中性分子或原子团的中子数,1H216O分子中,
则 N=
A-Z
A-X+n
A-X-n
0+8=8
质量数(A) 质子数(Z) 中子数(N) 核外电子数
Na 23 11
S 32 16
12
11
16
16
12
10
16
18
Z+N
Z-n
X-m
A+m-X
11
10
10
9
OH-
NH4+
Xn+
Xm-
A
Z
N
x
Na+
S2-
23
11
32
16
比 较
8O 8 O
1、它们属于同一种元素吗
2、它们是同一种原子吗
18
16
探究讨论
核组成
质子数
中子数
质量数
学 名
俗 称
1
1
1
1
1
0
2
3
2
氕
氘
氚
重氢
超重氢
H
1
1
H
2
1
H
3
1
试比较三种原子的异同,指出它们之间的关系。
质子数相同
中子数不同,质量数不同
属同种元素
不同种原子
概念:具有相同质子数的同一类原子的总称。
1H
1
1H
2
1H
3
氕(pie),氘(dao),氚(chuan)
3.元素、核素和同位素
(1)元素:
概念:具有一定质子数和一定中子数的一种原子称为一种核素。
(2)核素
3.元素、核素和同位素
特点:同一核素的原子结构完全相同,同一元素的不同核素的原子核内中子数不同。
17 Cl
35
6 C
14
8 O
18
(3)同位素
概念:质子数相同、质量数(或中子数)不同的核素互称为同位素。
126C 136C 146C
11H 21H 31H
氕 氘 氚
D T
23492U 23592U 23892U
制造氢弹
①质子数相同 核外电子数相同
化学性质
几乎完全相同
②中子数不同 物理性质不同 用途不同
特点:属于同位素的各种核素的化学性质几乎相同。
H2O、D2O、T2O的物理性质不同,化学性质几乎相同。
③天然存在的元素,各同位素在自然界的含量占该元素总量的百分比(即物质的量百分含量)基本上是固定的。
请尝试用图像来表述元素、核素、同位素三者间的关系
合作与实践
总结
在原子中:
核电荷数=质子数= 核外电子数 = 原子序数
质量数(A) = 质子数 (Z)+ 中子数(N)
质量数=原子的近似相对原子质量
元素
核素1
核素2
同位素
X
A
Z
【巩固练习】
1H 、D、T、16O 、17O、18O有
种原子, 种元素,
; 属同位素。
6
2
816O、 817O、818O
8
8
8
1
1H 、D、T
1
三、原子核外电子排布
讨论并尝试用各种形象的图示来描述“碳原子核外6个电子的分层排布”。
原子核
电子层
2
8
+10
原子结构示意图
核电荷数
1.原子核外电子排布
观察上面几种原子的核外电子排布:
1、请画出Na、Mg、O 、Cl元素原子的结构示意图。
2、解释He、Ne、Ar化学性质稳定的原因?
观
察
与
思
考
Mg
+12
8
2
2
O
+8
6
2
+12
8
2
Mg2+
+8
8
2
O2-
Mg2+
O2-
提出观点:
思考:请从原子结构角度提出可能的观点:解释镁原子与氧原子形成氧化镁的过程。
2.原子的稳定性
(1)稳定结构
原子最外层有8个电子(He为2)处于稳定,既不容易失去电子又不容易得到电子,即
(如:He、Ne、Ar等)
(2)不稳定结构
原子容易失去电子或容易得到电子转化最外电子层上为8(有些为2)个电子的稳定结构。
(如:失去: Na、Mg、Al 得到: F、O、Cl)
在MgO和NaCl的形成过程中,原子核有没有变化?什么粒子在变化?
交流与讨论
Mg
+12
8
2
2
O
+8
6
2
+12
8
2
Mg2+
+8
8
2
O2-
Mg2+
O2-
分析NaCl、MgO中各元素的化合价,找出化合价与得失电子的数目的关系。
分析MgO和NaCl形成过程的电子得失情况,又能得出什么结论呢?
+11
8
2
Na+
+17
8
8
2
Cl-
Na+
Cl-
Na
+11
8
1
2
Cl
+17
8
7
2
氯化钠的形成
Mg
+12
2
2
8
O
+8
6
2
2e-
Mg2+
+12
2
8
O2-
+8
8
2
Mg2+
O2-
注意:
①元素化合价:失去的电子数=正价数值
最高正价=最外层电子数
得到的电子数=负价数值
(1)活泼金属元素小于4个容易失去电子形成8电子稳定结构;最外层电子等于4个,相对稳定,不容易失去和得到电子
(2)活泼非金属元素最外层电子数大于4个,容易得到电子形成8电子稳定结构;
3. 原子核外电子排布与元素的化学性质的关系
②元素的化学性质主要由最外层电子数决定
1、用下面的结构示意图的字母填空:
(1)属于金属原子的是---------;
(2)属于非金属原子的是-----;
(3)属于离子结构示意图的是-- ---;
(4)具有稳定结构的是-------。
课堂检测:
A
B
C
C
2.氧原子的质量数为16,质子数为8,
那么它的中子数是多少?( )
3. 钠原子的质量数为23,中子数为12,那么它的质子数是多少?核外电子数是多少?
4. 硫的二价阴离子的核外电子数是18,中子数为17,那么它的质量数是多少?( )
解:因为 S2- 的核外电子数是18,即硫原子得
到 2 个电子后,是18,那么硫原子的核外电子数是16,则16+17=33。
8
11
33
11
5.据报道,上海某医院正在研究用放射性的一
种碘 治疗肿瘤。该碘原子的核内的中子数与核外电子数之差是
I
125
53
A、72 B、19 C、53 D、125
B
6.某二价阴离子,核外有18个电子,质量数为32,则其中子数为:
A、12 B、14 C、16 D、18
C
【巩固练习 】
粒子符号 质子数 电子数
S2-
NH4+
OH-
AXn+ a
AYm- b
16
18
11
10
9
10
a-n
b-m
2.3人类对原子结构的认识
1.了解原子是由原子核和核外电子构成的。
2.掌握质子数、中子数、质量数及核电荷数之间的关系。
3.了解核素、同位素等概念。
4.了解核外电子的分层排布,掌握1~18号元素的核外电子排布情况。
【学习目标】
一、人类认识原子结构的历程
二、原子的构成
三、原子核外电子排布
一、人类认识原子结构的历程
水由水 组成
食盐由 构成
你知道它们由什么微粒构成吗?
铜由铜 构成
分子
离子
原子
请大家结合初中学过的知识及教材P44-45的短文,思考下列几个问题。
1、原子结构模型的演变经历了哪几个重要阶段?
2、用简洁的语言表达各阶段(道尔顿、汤姆生、卢瑟福、玻尔)对原子结构模型的认识特点?
3、请你谈谈从原子结构的演变得到什么启迪?
【历史足迹】
1803年 道尔顿[英]:“实心球”模型
1904年 汤姆生 [英] :“葡萄干面包”模型
1911年 卢瑟福 [英]:
“核式”模型
1913年 玻尔 [丹麦]:“核外电子分层”模型
历 程 原子模型
从原子结构模型的演变历史中,主要有哪些科学家提出了哪些原子模型呢?
在认识过程中,科学家运用了哪些科学研究方法?
1803年 道尔顿
“实心球”模型
1904年 汤姆生
“葡萄干面包”模型
1911年 卢瑟福
“核式”模型
1913年 玻 尔
“核外电子分层”模型
启迪:(1) 化学认识发展过程中的继承、积累、突破和革命。
(2) 实验方法是科学研究的一种重要方法,实验手段的不断进步是化学科学的关键
(3) 科学研究、科学发现是无止境的。
二、原子的构成
原子
原子核
核外电子
质子
中子
1.原子的组成和表示方法
(1)组成
一个质子带一个单位的正电荷
不带电荷
一个电子带一个单位的负电荷
交流与讨论
原子的组成
原子 原子核 质子
中子
核外电子
电量/C 质量/kg 相对质量
1.602 ×10-19 1 .673 × 10-27 1.007
0 1.675 × 10-27 1.008
1.602 × 10-19 9.109 × 10-31 1/1836
请同学们根据上表比较这三种粒子的质量大小和带电荷情况?得到什么样的结论
◆三种粒子的质量都很小
◆质子和中子的质量基本相等,电子的质量最小
◆质子带正电荷,中子不带电,电子带负电
◆质子和电子带电量相等,电性相反
结论:
【思考】原子的质量集中在原子核上
还是原子核外呢?为什么?
相对于质子和中子,电子的质量很小,可以忽略不计,原子的质量主要由原子核决定
原子 质子数
(Z) 中子数
(N) 质子数+中子数
(A) 相对原子质量
F 9 10 18.998
Na 11 12 22.990
Al 13 14 26.986
19
23
27
X
Z
A
F
9
19
Na
11
23
Al
13
27
完成教材47页的问题解决。
A
Z
X
X原子的质子数
(2)原子表示方法
X表示元素符号
表示X原子的质量数
1.原子的组成和表示方法
粒子
符号 质子数
Z 中子数N 质量数
A
O 8 18
Al 14 27
Ar 18 22
Cl
H
A
X
Z
Cl
35
17
H
1
1
10
O
18
8
Ar
13
Al
27
13
40
40
18
17
18
35
1
0
1
1.是不是所有的原子核都是由质子和中子构成的呢?
2.原子的质子数,中子数,电子数和质量数的之间关系?
质量数=质子数+中子数
X
A
Z
——元素符号
质量数 ——
核内质子数——
(核电荷数)
X
A
Z
原子
原子核
核外电子(Z)
质子(Z)
中子(N=A - Z)
总结:原子的表示方法
A
Z
X
c+
-
-
+d
e
A:
Z:
e:
c:
d:
质量数
质子数
一个分子中原子个数
离子所带电荷数
化合价
中各个字母的含义:
2.原子构成微粒之间的数量关系
质量数=原子的近似相对原子质量
注意:只是数值上相等,但意义不一样
(1)质量数
将原子核内所有的质子和中子的相对质量
取整数,加起来所得到的数值称为质量数
(2)各微粒之间的关系
①核电荷数=核内质子数=核外电子数=原子序数
②质量数(A)=质子数(Z)+中子数(N)
③构成原子、离子的微粒之间的数量关系
原子: 核电荷数(Z)=核内质子数=核外电子数
阳离子:核电荷数(Z)=核内质子数 核外电子数
核内质子数(Z)=核外电子数 电荷数
阴离子:核电荷数(Z)=核内质子数 核外电子数
核内质子数=核外电子数 电荷数
+
>
<
Al Al3+ Cl Cl-
质子数 13 13 17 17
电子数 13 10 17 18
—
总结分析:用 AZX表示原子:
1.求中性原子的中子数:N=
2.求阴离子的中子数,AXn-共有x个电子,
则N=
3.求阳离子的中子数,AXn+共有x个电子,
则N=
4.求中性分子或原子团的中子数,1H216O分子中,
则 N=
A-Z
A-X+n
A-X-n
0+8=8
质量数(A) 质子数(Z) 中子数(N) 核外电子数
Na 23 11
S 32 16
12
11
16
16
12
10
16
18
Z+N
Z-n
X-m
A+m-X
11
10
10
9
OH-
NH4+
Xn+
Xm-
A
Z
N
x
Na+
S2-
23
11
32
16
比 较
8O 8 O
1、它们属于同一种元素吗
2、它们是同一种原子吗
18
16
探究讨论
核组成
质子数
中子数
质量数
学 名
俗 称
1
1
1
1
1
0
2
3
2
氕
氘
氚
重氢
超重氢
H
1
1
H
2
1
H
3
1
试比较三种原子的异同,指出它们之间的关系。
质子数相同
中子数不同,质量数不同
属同种元素
不同种原子
概念:具有相同质子数的同一类原子的总称。
1H
1
1H
2
1H
3
氕(pie),氘(dao),氚(chuan)
3.元素、核素和同位素
(1)元素:
概念:具有一定质子数和一定中子数的一种原子称为一种核素。
(2)核素
3.元素、核素和同位素
特点:同一核素的原子结构完全相同,同一元素的不同核素的原子核内中子数不同。
17 Cl
35
6 C
14
8 O
18
(3)同位素
概念:质子数相同、质量数(或中子数)不同的核素互称为同位素。
126C 136C 146C
11H 21H 31H
氕 氘 氚
D T
23492U 23592U 23892U
制造氢弹
①质子数相同 核外电子数相同
化学性质
几乎完全相同
②中子数不同 物理性质不同 用途不同
特点:属于同位素的各种核素的化学性质几乎相同。
H2O、D2O、T2O的物理性质不同,化学性质几乎相同。
③天然存在的元素,各同位素在自然界的含量占该元素总量的百分比(即物质的量百分含量)基本上是固定的。
请尝试用图像来表述元素、核素、同位素三者间的关系
合作与实践
总结
在原子中:
核电荷数=质子数= 核外电子数 = 原子序数
质量数(A) = 质子数 (Z)+ 中子数(N)
质量数=原子的近似相对原子质量
元素
核素1
核素2
同位素
X
A
Z
【巩固练习】
1H 、D、T、16O 、17O、18O有
种原子, 种元素,
; 属同位素。
6
2
816O、 817O、818O
8
8
8
1
1H 、D、T
1
三、原子核外电子排布
讨论并尝试用各种形象的图示来描述“碳原子核外6个电子的分层排布”。
原子核
电子层
2
8
+10
原子结构示意图
核电荷数
1.原子核外电子排布
观察上面几种原子的核外电子排布:
1、请画出Na、Mg、O 、Cl元素原子的结构示意图。
2、解释He、Ne、Ar化学性质稳定的原因?
观
察
与
思
考
Mg
+12
8
2
2
O
+8
6
2
+12
8
2
Mg2+
+8
8
2
O2-
Mg2+
O2-
提出观点:
思考:请从原子结构角度提出可能的观点:解释镁原子与氧原子形成氧化镁的过程。
2.原子的稳定性
(1)稳定结构
原子最外层有8个电子(He为2)处于稳定,既不容易失去电子又不容易得到电子,即
(如:He、Ne、Ar等)
(2)不稳定结构
原子容易失去电子或容易得到电子转化最外电子层上为8(有些为2)个电子的稳定结构。
(如:失去: Na、Mg、Al 得到: F、O、Cl)
在MgO和NaCl的形成过程中,原子核有没有变化?什么粒子在变化?
交流与讨论
Mg
+12
8
2
2
O
+8
6
2
+12
8
2
Mg2+
+8
8
2
O2-
Mg2+
O2-
分析NaCl、MgO中各元素的化合价,找出化合价与得失电子的数目的关系。
分析MgO和NaCl形成过程的电子得失情况,又能得出什么结论呢?
+11
8
2
Na+
+17
8
8
2
Cl-
Na+
Cl-
Na
+11
8
1
2
Cl
+17
8
7
2
氯化钠的形成
Mg
+12
2
2
8
O
+8
6
2
2e-
Mg2+
+12
2
8
O2-
+8
8
2
Mg2+
O2-
注意:
①元素化合价:失去的电子数=正价数值
最高正价=最外层电子数
得到的电子数=负价数值
(1)活泼金属元素小于4个容易失去电子形成8电子稳定结构;最外层电子等于4个,相对稳定,不容易失去和得到电子
(2)活泼非金属元素最外层电子数大于4个,容易得到电子形成8电子稳定结构;
3. 原子核外电子排布与元素的化学性质的关系
②元素的化学性质主要由最外层电子数决定
1、用下面的结构示意图的字母填空:
(1)属于金属原子的是---------;
(2)属于非金属原子的是-----;
(3)属于离子结构示意图的是-- ---;
(4)具有稳定结构的是-------。
课堂检测:
A
B
C
C
2.氧原子的质量数为16,质子数为8,
那么它的中子数是多少?( )
3. 钠原子的质量数为23,中子数为12,那么它的质子数是多少?核外电子数是多少?
4. 硫的二价阴离子的核外电子数是18,中子数为17,那么它的质量数是多少?( )
解:因为 S2- 的核外电子数是18,即硫原子得
到 2 个电子后,是18,那么硫原子的核外电子数是16,则16+17=33。
8
11
33
11
5.据报道,上海某医院正在研究用放射性的一
种碘 治疗肿瘤。该碘原子的核内的中子数与核外电子数之差是
I
125
53
A、72 B、19 C、53 D、125
B
6.某二价阴离子,核外有18个电子,质量数为32,则其中子数为:
A、12 B、14 C、16 D、18
C
【巩固练习 】
粒子符号 质子数 电子数
S2-
NH4+
OH-
AXn+ a
AYm- b
16
18
11
10
9
10
a-n
b-m
