苏教版高中化学必修第一册专题3从海水中获得的化学物质3.3海洋化学资源的综合利用课件(共26张PPT)
文档属性
| 名称 | 苏教版高中化学必修第一册专题3从海水中获得的化学物质3.3海洋化学资源的综合利用课件(共26张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 5.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-23 09:47:41 | ||
图片预览







文档简介
(共26张PPT)
专题3 第三单元 海洋化学资源的综合利用
第1、2课时 粗盐提纯、溴、碘的提取
海水
蒸发浓缩
过滤
粗盐
母液
CaCl2
Na2SO4
MgCl2
NaCl
NaOH
BaCl2
Na2CO3
Mg(OH)2 ,OH-
过量
BaSO4 , Ba2+
CaCO3 , CO32-
OH-
过量HCl
CO32-
蒸发浓缩
NaCl固体
BaCO3
操作原则“三必须”和“四原则”
1.“三必须”是:
(1) 除杂试剂必须过量
(2) 过量试剂必须除尽(因为过量试剂带入新的杂质)
(3) 除杂途径必须最佳
2.“四原则”是:
(1) 不增 提纯过程中不增加新的杂质
(2) 不减 不减少欲被提纯的物质
(3) 易分离 被提纯物与杂质容易分离
(4) 易复原 被提纯物质要复原
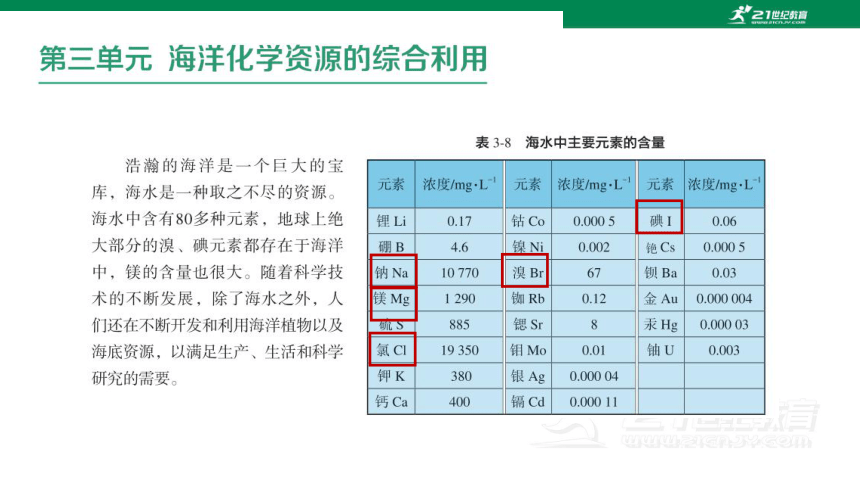
世界上99%的溴都蕴藏于大海中,溴在大海中主要是以溴离子的形式存在,我们如何从海水中的溴离子得到溴单质呢?
原理:2Br-+Cl2=Br2+2Cl-
1、溴的存在:
2、具体流程:
2Br-+Cl2=Br2+2Cl-
3、溴的应用:
(1)溴多用于制备药物。
(2)溴还是制造农业杀虫剂、阻燃剂的原料。
(3)溴化银可被用作医疗X射线胶片、胶片上的感光剂。
海水中的碘储存量很大,但由于浓度很低,目前工业上并不直接通过海水提取碘,而是以具有富集碘能力的海藻(或海带)为原料来提取碘。
4、碘的存在:
5、具体流程:
干海带
浸泡
浸出液
滤液
有机物沉淀
过滤
结晶过滤
粗碘
碘单质
提纯
水
NaOH溶液
H2SO4溶液、氧化剂
碱化
氧化
以I-存在
Cl2、H2O2
I-+Cl2=I2+2Cl-
干海带
灼烧
海带灰
浸泡
海带灰悬浊液
过滤
残渣
含碘离子溶液
氧化
通Cl2
含碘水溶液
萃取、分液
加入CCl4
含碘的有机溶液
提纯
碘单质
5、具体流程2:
6、碘的应用:
如果碘摄取过多,容易产生什么后果?
AgI
加碘食盐中加的是碘单质吗?(P82)
①深红棕色液体(唯一的液态非金属)
②易挥发(刺激性气味,有毒)
③具有强的腐蚀性
④ρBr2 >ρH2O
⑤保存在棕色试剂瓶中,用水液封。
液溴和溴蒸气
1、溴和碘的物理性质:(溴Br2)
①紫黑色晶体
②易升华
保存方法:棕色试剂瓶中密封保
碘蒸气
2、溴和碘的物理性质:(碘I2)
Br2和I2在水中的溶解度都很小,但易溶于酒精、苯、CCl4等有机溶剂。
3、溴和碘的化学性质:
氧化性:Cl2 > Br2 > I2
还原性: Cl - < Br- < I-
2NaBr + Cl2﹦2NaCl + Br2
2KI + Cl2 ﹦ 2KCl + I2
2KI + Br2 ﹦ 2KBr + I2
NaBr + AgNO3 = AgBr↓ + NaNO3
NaI + AgNO3 = AgI↓+ NaNO3
AgNO3溶液和稀硝酸
②现象:
产生浅黄色沉淀(含Br-)
产生黄色沉淀(含I-)
③方程式:
①试剂:
4、Br- 、I- 的检验
Cl-的检验?
AgBr
(淡黄色)
AgI
(黄色)
AgCl
(白色)
颜色逐渐加深
Cl-、Br-、I-的检验
Cl-
Br-
I-
硝酸酸化的AgNO3
AgCl ↓ 白
AgBr↓ 淡黄
AgI↓ 黄
沉淀法(Cl-、Br-、I-)
新制氯水
淀粉
蓝色
未知液
置换-淀粉(I-)
未知液
加CCl4
震荡,静置
加氯水
震荡
下层
下层
橙红色
紫红色
含Br-
含I-
置换-萃取( Br-、I-)
1.下列能使淀粉变蓝的物质是( )
A.KI B.KCI C.I2 D.Br2
2.下列物质中,不能使湿润的淀粉碘化钾试纸变蓝的是( )
A.碘水 B.溴水
C.氯化钾溶液 D.氯气
C
C
课堂练习
3.下列物质与其用途相符合的是 ( )
①Cl2—做消毒剂 ②AgBr—制胶卷、感光纸 ③AgI—人工降雨 ④碘—预防甲状腺肿大 ⑤淀粉—检验I2的存在 ⑥NaClO—漂白纺织物
A.②③④⑤⑥ B.①②③④⑤
C.②③④⑤ D.全部
D
课堂练习
4.海带中含碘元素。从海带中提取碘有如下步骤:①通入足量Cl2;②将海带焙烧成灰后加水搅拌;③加CCl4振荡;④用分液漏斗分液;⑤过滤。合理的操作顺序是 ( ) A.①②③④⑤ B.②⑤①③④
C.①③⑤②④ D.②①③⑤④
B
课堂练习
1、镁的存在:
自然界中的镁主要以化合态(MgCl2)的形式存在于地壳和海水中。
2、镁的提取:
贝壳
煅烧
CaO
蒸发结晶
HCl气流中加热脱水
过滤
水
无水MgCl2
氢氧化镁
海水
沉淀池
石灰乳
六水合氯化镁晶体
(MgCl2 6H2O)
MgCl2溶液
电解
HCl
Cl2
H2
Mg
②
①
③
⑤
④
⑥
氯化镁溶液直接蒸干能否得到氯化镁晶体?
如何检验氯气?
①CaCO3 === CaO+CO2
②CaO+H2O===Ca(OH)2
③Ca(OH)2+MgCl2===Mg(OH)2+CaCl2
④Mg(OH)2+2HCl===MgCl2+2H2O
⑤MgCl2 6H2O ====== MgCl2+6H2O
⑥MgCl2 === Mg+Cl2
高温
HCl气流
通电
镁是一种银白色的金属,密度小( =1.74g/cm-3),熔点较低,硬度较小,有良好的导电性、导热性和延展性,与其他金属(如铜、铝等)能形成性能优良的合金。
3、镁的物理性质:
4、镁的化学性质:
最外层有2个电子,在化学反应中容易失电子,形成镁离子,所以镁的化学性质很活泼,具有较强的还原性。
4、镁的化学性质:
Mg
与酸的反应
Mg+2H+=Mg2++H2
与非金属单质
O2
2Mg+O2 === 2MgO
Mg+Cl2 === MgCl2
Cl2
N2
3Mg+N2 === Mg3N2
与CO2反应
反应
现象
2Mg+CO2 === 2MgO+C
剧烈反应,发出耀眼的白光,集气瓶内壁附着有白色粉末和黑色粉末。
与H2O反应
与盐溶液反应
Mg+2H2O ==== Mg(OH)2+H2
Mg+CuSO4=Cu+MgSO4
点燃
点燃
点燃
点燃
3、镁的用途:
(1)镁合金的密度较小,但硬度和强度都较大,被广泛用于制造火箭、导弹和飞机的部件等。
(2)镁具有较强的还原性,在冶金工业中,常用作还原剂和脱氧剂。
(3)镁燃烧发出耀眼的白光,因此常用作信号弹。
(4)氧化镁的熔点高达2800℃,是优质的耐高温材料。
专题3 第三单元 海洋化学资源的综合利用
第1、2课时 粗盐提纯、溴、碘的提取
海水
蒸发浓缩
过滤
粗盐
母液
CaCl2
Na2SO4
MgCl2
NaCl
NaOH
BaCl2
Na2CO3
Mg(OH)2 ,OH-
过量
BaSO4 , Ba2+
CaCO3 , CO32-
OH-
过量HCl
CO32-
蒸发浓缩
NaCl固体
BaCO3
操作原则“三必须”和“四原则”
1.“三必须”是:
(1) 除杂试剂必须过量
(2) 过量试剂必须除尽(因为过量试剂带入新的杂质)
(3) 除杂途径必须最佳
2.“四原则”是:
(1) 不增 提纯过程中不增加新的杂质
(2) 不减 不减少欲被提纯的物质
(3) 易分离 被提纯物与杂质容易分离
(4) 易复原 被提纯物质要复原
世界上99%的溴都蕴藏于大海中,溴在大海中主要是以溴离子的形式存在,我们如何从海水中的溴离子得到溴单质呢?
原理:2Br-+Cl2=Br2+2Cl-
1、溴的存在:
2、具体流程:
2Br-+Cl2=Br2+2Cl-
3、溴的应用:
(1)溴多用于制备药物。
(2)溴还是制造农业杀虫剂、阻燃剂的原料。
(3)溴化银可被用作医疗X射线胶片、胶片上的感光剂。
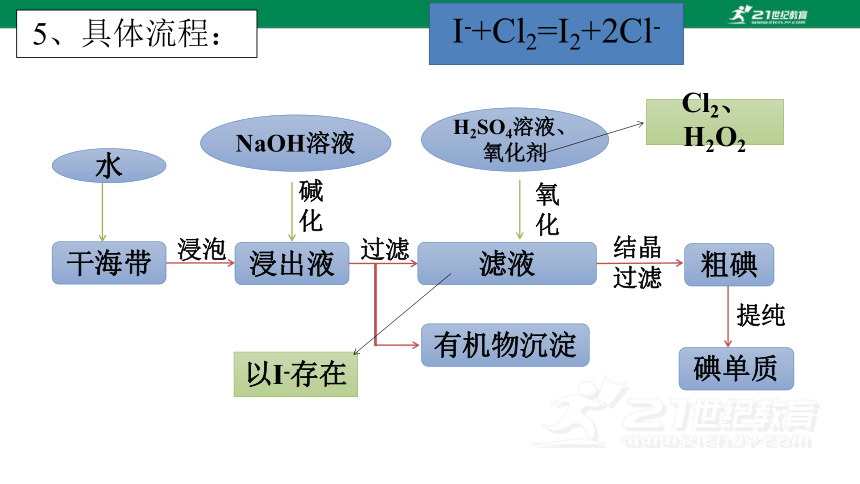
海水中的碘储存量很大,但由于浓度很低,目前工业上并不直接通过海水提取碘,而是以具有富集碘能力的海藻(或海带)为原料来提取碘。
4、碘的存在:
5、具体流程:
干海带
浸泡
浸出液
滤液
有机物沉淀
过滤
结晶过滤
粗碘
碘单质
提纯
水
NaOH溶液
H2SO4溶液、氧化剂
碱化
氧化
以I-存在
Cl2、H2O2
I-+Cl2=I2+2Cl-
干海带
灼烧
海带灰
浸泡
海带灰悬浊液
过滤
残渣
含碘离子溶液
氧化
通Cl2
含碘水溶液
萃取、分液
加入CCl4
含碘的有机溶液
提纯
碘单质
5、具体流程2:
6、碘的应用:
如果碘摄取过多,容易产生什么后果?
AgI
加碘食盐中加的是碘单质吗?(P82)
①深红棕色液体(唯一的液态非金属)
②易挥发(刺激性气味,有毒)
③具有强的腐蚀性
④ρBr2 >ρH2O
⑤保存在棕色试剂瓶中,用水液封。
液溴和溴蒸气
1、溴和碘的物理性质:(溴Br2)
①紫黑色晶体
②易升华
保存方法:棕色试剂瓶中密封保
碘蒸气
2、溴和碘的物理性质:(碘I2)
Br2和I2在水中的溶解度都很小,但易溶于酒精、苯、CCl4等有机溶剂。
3、溴和碘的化学性质:
氧化性:Cl2 > Br2 > I2
还原性: Cl - < Br- < I-
2NaBr + Cl2﹦2NaCl + Br2
2KI + Cl2 ﹦ 2KCl + I2
2KI + Br2 ﹦ 2KBr + I2
NaBr + AgNO3 = AgBr↓ + NaNO3
NaI + AgNO3 = AgI↓+ NaNO3
AgNO3溶液和稀硝酸
②现象:
产生浅黄色沉淀(含Br-)
产生黄色沉淀(含I-)
③方程式:
①试剂:
4、Br- 、I- 的检验
Cl-的检验?
AgBr
(淡黄色)
AgI
(黄色)
AgCl
(白色)
颜色逐渐加深
Cl-、Br-、I-的检验
Cl-
Br-
I-
硝酸酸化的AgNO3
AgCl ↓ 白
AgBr↓ 淡黄
AgI↓ 黄
沉淀法(Cl-、Br-、I-)
新制氯水
淀粉
蓝色
未知液
置换-淀粉(I-)
未知液
加CCl4
震荡,静置
加氯水
震荡
下层
下层
橙红色
紫红色
含Br-
含I-
置换-萃取( Br-、I-)
1.下列能使淀粉变蓝的物质是( )
A.KI B.KCI C.I2 D.Br2
2.下列物质中,不能使湿润的淀粉碘化钾试纸变蓝的是( )
A.碘水 B.溴水
C.氯化钾溶液 D.氯气
C
C
课堂练习
3.下列物质与其用途相符合的是 ( )
①Cl2—做消毒剂 ②AgBr—制胶卷、感光纸 ③AgI—人工降雨 ④碘—预防甲状腺肿大 ⑤淀粉—检验I2的存在 ⑥NaClO—漂白纺织物
A.②③④⑤⑥ B.①②③④⑤
C.②③④⑤ D.全部
D
课堂练习
4.海带中含碘元素。从海带中提取碘有如下步骤:①通入足量Cl2;②将海带焙烧成灰后加水搅拌;③加CCl4振荡;④用分液漏斗分液;⑤过滤。合理的操作顺序是 ( ) A.①②③④⑤ B.②⑤①③④
C.①③⑤②④ D.②①③⑤④
B
课堂练习
1、镁的存在:
自然界中的镁主要以化合态(MgCl2)的形式存在于地壳和海水中。
2、镁的提取:
贝壳
煅烧
CaO
蒸发结晶
HCl气流中加热脱水
过滤
水
无水MgCl2
氢氧化镁
海水
沉淀池
石灰乳
六水合氯化镁晶体
(MgCl2 6H2O)
MgCl2溶液
电解
HCl
Cl2
H2
Mg
②
①
③
⑤
④
⑥
氯化镁溶液直接蒸干能否得到氯化镁晶体?
如何检验氯气?
①CaCO3 === CaO+CO2
②CaO+H2O===Ca(OH)2
③Ca(OH)2+MgCl2===Mg(OH)2+CaCl2
④Mg(OH)2+2HCl===MgCl2+2H2O
⑤MgCl2 6H2O ====== MgCl2+6H2O
⑥MgCl2 === Mg+Cl2
高温
HCl气流
通电
镁是一种银白色的金属,密度小( =1.74g/cm-3),熔点较低,硬度较小,有良好的导电性、导热性和延展性,与其他金属(如铜、铝等)能形成性能优良的合金。
3、镁的物理性质:
4、镁的化学性质:
最外层有2个电子,在化学反应中容易失电子,形成镁离子,所以镁的化学性质很活泼,具有较强的还原性。
4、镁的化学性质:
Mg
与酸的反应
Mg+2H+=Mg2++H2
与非金属单质
O2
2Mg+O2 === 2MgO
Mg+Cl2 === MgCl2
Cl2
N2
3Mg+N2 === Mg3N2
与CO2反应
反应
现象
2Mg+CO2 === 2MgO+C
剧烈反应,发出耀眼的白光,集气瓶内壁附着有白色粉末和黑色粉末。
与H2O反应
与盐溶液反应
Mg+2H2O ==== Mg(OH)2+H2
Mg+CuSO4=Cu+MgSO4
点燃
点燃
点燃
点燃
3、镁的用途:
(1)镁合金的密度较小,但硬度和强度都较大,被广泛用于制造火箭、导弹和飞机的部件等。
(2)镁具有较强的还原性,在冶金工业中,常用作还原剂和脱氧剂。
(3)镁燃烧发出耀眼的白光,因此常用作信号弹。
(4)氧化镁的熔点高达2800℃,是优质的耐高温材料。
