苏教版高中化学必修第一册专题3从海水中获得的化学物质3.2金属钠及钠的化合物课件
文档属性
| 名称 | 苏教版高中化学必修第一册专题3从海水中获得的化学物质3.2金属钠及钠的化合物课件 |  | |
| 格式 | ppt | ||
| 文件大小 | 10.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-23 09:53:01 | ||
图片预览






文档简介
(共26张PPT)
PART
01
PART
02
PART
03
PART
04
金属 钠
钠的氧化物
钠 盐
焰色反应
目录
金属与非金属的反应
物理性质与化学性质
钠
钠在空气中的变化
钠的制备与用途
钠
实验一
钠在空气里缓慢氧化实验
钠
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
实验二
钠的燃烧实验
1.1 钠的性质
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
1
3
2
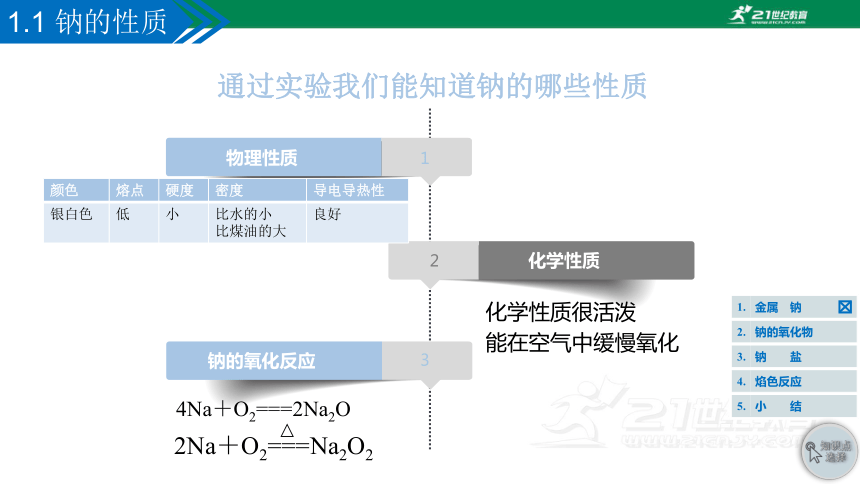
物理性质
钠的氧化反应
化学性质
化学性质很活泼
能在空气中缓慢氧化
4Na+O2===2Na2O
通过实验我们能知道钠的哪些性质
钠
2Na+O2===Na2O2
颜色 熔点 硬度 密度 导电导热性
银白色 低 小 比水的小
比煤油的大 良好
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
实验三
钠与水反应实验
1.1 钠的性质
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
实验四
钠与氯气反应实验
1.1 钠的性质
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
钠元素模型
钠
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
钠的化学反应
钠的化学性质与原子结构的关系
钠
①
②
③
④
水
常温
加热
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
1
2
钠的制备
钠的用途
电解熔融氯化钠来制取
2NaCl(熔融)=== 2Na + Cl2↑
① 制取钠的重要化合物,如Na2O2
② 制取钠钾合金作原子反应堆的导热剂
③ 作冶炼某些稀有金属的还原剂.如冶炼钛、铌、锆等
④ 用在发出黄色光的电光源上
钠
电解
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
铝的燃烧实验二
再取一块铝箔,用砂纸仔细打磨(或在酸中处理后,用水洗净),除去表面的保护膜,再加热至熔化。又有什么现象呢?
铝的燃烧实验一
用坩埚钳夹住一小铝箔(箔厚约0.1mm),在酒精灯上加热至融化,轻轻晃动。仔细观察你看到了什么现象?为什么会有这种现象?
钠
铝
钠
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
实验五
铝与氢氧化钠溶液反应实验
1.3 铝的性质
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
金属与盐酸和水的反应
钠
实验六
过氧化钠与水的反应实验
实验七
过氧化钠与二氧化碳反应实验
1
2
氧化钠
钠的氧化反应
过氧化钠
白色固体
可以与水和二氧化碳发生化合反应
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
淡黄色粉末状物质
可以与水和二氧化碳反应放出氧气
2Na2O2+2H2O = 4NaOH+O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
钠
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
碳酸钠与碳酸氢钠
钠
步骤 1g Na2CO3 1g NaHCO3
俗名 纯碱、苏打 小苏打
①加1mlH2O 白色粉末,加入水变成晶体,放热 细小白色粉末,加入水部分溶解,感不到热变化
②加10mlH2O 振荡后溶解 固体量减小
③ 1-2滴酚酞 溶液变红(较深) 溶液变浅红
初步结论 ① 溶解性:Na2CO3>NaHCO3;② 碱性:Na2CO3>NaHCO3
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
1
2
碳酸钠与酸的反应
钠的氧化反应
碳酸氢钠与酸的反应
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
NaHCO3 + HCl = NaCl + H2O + CO2↑
钠
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
与碱[Ca(OH)2]反应
碳酸钠:
Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH
当碳酸氢钠过量时:
2NaHCO3 + Ca(OH)2 = CaCO3↓ + Na2CO3 + 2H2O
当碳酸氢钠不足时:
NaHCO3 + Ca(OH)2 = CaCO3↓ + NaOH + H2O
与酸的反应
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑; NaHCO3 + HCl = NaCl + H2O + CO2↑
与碱[NaOH]反应
Na2CO3+ NaOH----------不反应NaHCO3+NaOH = Na2CO3+H2O
2.1 钠盐与碱的反应
与盐[CaCl2]反应
Na2CO3 + CaCl2 = 2NaCl + CaCO3↓
Na2CO3+BaCl2 = BaCO3↓+2NaCl
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
实验八
碳酸钠碳酸钾焰色反应实验
焰色反应
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
焰色反应的颜色
金属或金属离子 锂 铷 钙 锶 钡 铜 钾 钠
焰色反应的颜色 紫红色 紫色 砖红色 洋红色 黄绿色 绿色 紫色 黄色
焰色反应口诀:
黄钠绿铜锂紫红;
钾是紫色铷更浓;
钡锶钙色不一般;
黄绿洋红和砖红
钠
从钠原子结构特征认识钠的化学性质
铝的性质以及铝和氢氧化钠溶液的反应
氧化钠和过氧化钠的多角度对比
碳酸钠和碳酸氢钠的性质比较
焰色反应
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
01
钠在空气中氧化
02
钠在空气中加热
03
钠与水的反应
04
钠与盐酸的反应
完成化学反应方程式
钠
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
PART
01
PART
02
PART
03
PART
04
金属 钠
钠的氧化物
钠 盐
焰色反应
目录
金属与非金属的反应
物理性质与化学性质
钠
钠在空气中的变化
钠的制备与用途
钠
实验一
钠在空气里缓慢氧化实验
钠
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
实验二
钠的燃烧实验
1.1 钠的性质
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
1
3
2
物理性质
钠的氧化反应
化学性质
化学性质很活泼
能在空气中缓慢氧化
4Na+O2===2Na2O
通过实验我们能知道钠的哪些性质
钠
2Na+O2===Na2O2
颜色 熔点 硬度 密度 导电导热性
银白色 低 小 比水的小
比煤油的大 良好
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
实验三
钠与水反应实验
1.1 钠的性质
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
实验四
钠与氯气反应实验
1.1 钠的性质
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
钠元素模型
钠
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
钠的化学反应
钠的化学性质与原子结构的关系
钠
①
②
③
④
水
常温
加热
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
1
2
钠的制备
钠的用途
电解熔融氯化钠来制取
2NaCl(熔融)=== 2Na + Cl2↑
① 制取钠的重要化合物,如Na2O2
② 制取钠钾合金作原子反应堆的导热剂
③ 作冶炼某些稀有金属的还原剂.如冶炼钛、铌、锆等
④ 用在发出黄色光的电光源上
钠
电解
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
铝的燃烧实验二
再取一块铝箔,用砂纸仔细打磨(或在酸中处理后,用水洗净),除去表面的保护膜,再加热至熔化。又有什么现象呢?
铝的燃烧实验一
用坩埚钳夹住一小铝箔(箔厚约0.1mm),在酒精灯上加热至融化,轻轻晃动。仔细观察你看到了什么现象?为什么会有这种现象?
钠
铝
钠
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
实验五
铝与氢氧化钠溶液反应实验
1.3 铝的性质
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
金属与盐酸和水的反应
钠
实验六
过氧化钠与水的反应实验
实验七
过氧化钠与二氧化碳反应实验
1
2
氧化钠
钠的氧化反应
过氧化钠
白色固体
可以与水和二氧化碳发生化合反应
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
淡黄色粉末状物质
可以与水和二氧化碳反应放出氧气
2Na2O2+2H2O = 4NaOH+O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
钠
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
碳酸钠与碳酸氢钠
钠
步骤 1g Na2CO3 1g NaHCO3
俗名 纯碱、苏打 小苏打
①加1mlH2O 白色粉末,加入水变成晶体,放热 细小白色粉末,加入水部分溶解,感不到热变化
②加10mlH2O 振荡后溶解 固体量减小
③ 1-2滴酚酞 溶液变红(较深) 溶液变浅红
初步结论 ① 溶解性:Na2CO3>NaHCO3;② 碱性:Na2CO3>NaHCO3
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
1
2
碳酸钠与酸的反应
钠的氧化反应
碳酸氢钠与酸的反应
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
NaHCO3 + HCl = NaCl + H2O + CO2↑
钠
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
与碱[Ca(OH)2]反应
碳酸钠:
Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH
当碳酸氢钠过量时:
2NaHCO3 + Ca(OH)2 = CaCO3↓ + Na2CO3 + 2H2O
当碳酸氢钠不足时:
NaHCO3 + Ca(OH)2 = CaCO3↓ + NaOH + H2O
与酸的反应
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑; NaHCO3 + HCl = NaCl + H2O + CO2↑
与碱[NaOH]反应
Na2CO3+ NaOH----------不反应NaHCO3+NaOH = Na2CO3+H2O
2.1 钠盐与碱的反应
与盐[CaCl2]反应
Na2CO3 + CaCl2 = 2NaCl + CaCO3↓
Na2CO3+BaCl2 = BaCO3↓+2NaCl
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
实验八
碳酸钠碳酸钾焰色反应实验
焰色反应
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
焰色反应的颜色
金属或金属离子 锂 铷 钙 锶 钡 铜 钾 钠
焰色反应的颜色 紫红色 紫色 砖红色 洋红色 黄绿色 绿色 紫色 黄色
焰色反应口诀:
黄钠绿铜锂紫红;
钾是紫色铷更浓;
钡锶钙色不一般;
黄绿洋红和砖红
钠
从钠原子结构特征认识钠的化学性质
铝的性质以及铝和氢氧化钠溶液的反应
氧化钠和过氧化钠的多角度对比
碳酸钠和碳酸氢钠的性质比较
焰色反应
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
01
钠在空气中氧化
02
钠在空气中加热
03
钠与水的反应
04
钠与盐酸的反应
完成化学反应方程式
钠
1. 金属 钠
2. 钠的氧化物
3. 钠 盐
4. 焰色反应
5. 小 结
知识点选择
