苏教版高中化学必修第一册专题3从海水中获得的化学物质3.1氯及其化合物课件(共19张PPT)
文档属性
| 名称 | 苏教版高中化学必修第一册专题3从海水中获得的化学物质3.1氯及其化合物课件(共19张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 15.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-23 09:54:46 | ||
图片预览




文档简介
(共19张PPT)
氯及其化合物
氯气的化学性质
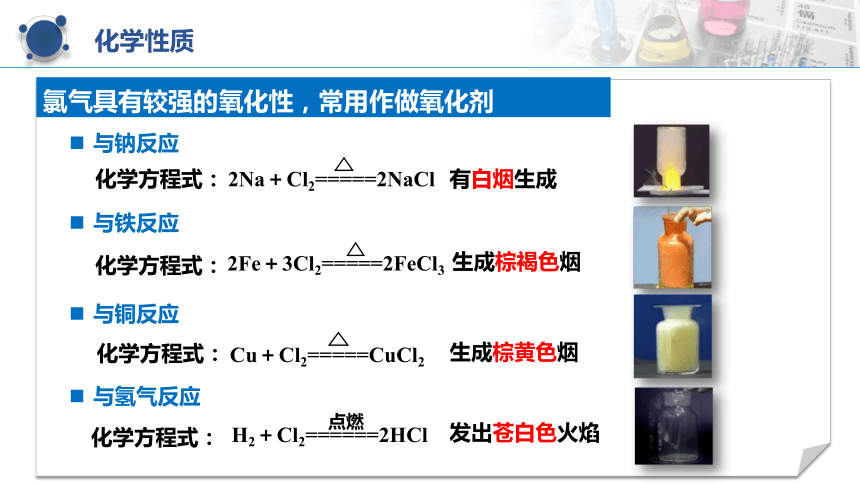
化学性质
与钠反应
与铁反应
化学方程式:
2Fe+3Cl2=====2FeCl3
与铜反应
化学方程式:
Cu+Cl2=====CuCl2
生成棕黄色烟
化学方程式:
2Na+Cl2=====2NaCl
有白烟生成
生成棕褐色烟
氯气具有较强的氧化性,常用作做氧化剂
与氢气反应
点燃
H2+Cl2======2HCl
化学方程式:
发出苍白色火焰
观察与比较
氯水中存在氯气分子
比较水溶液与原氯气的颜色,可得出什么结论?
氯气是黄绿色气体,氯水呈黄绿色
在25 ℃时,1体积的水可以溶解约2体积的氯气,氯气的水溶液称为氯水。
舍勒把氯气溶解在水里进行进一步研究,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用,所以他认为这种氯气具有漂白性。
法国化学家贝托莱听说舍勒发现了新气体,就根据自己的想法继续进行新气体的研究,最终他提出真正具有漂白作用的物质不是这种纯净的气体,而是它的水溶液。
谁的观点正确?
舍勒用氯气作了种种实验,发现它可溶于水,使水略有酸味;具有漂白作用,能使蓝色的纸条几乎变白,又能漂白有色花朵和绿叶。
化学史
实验探究
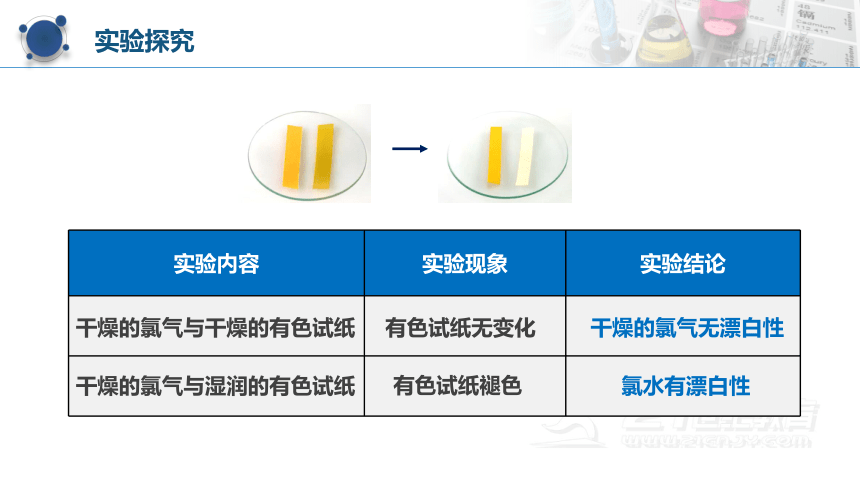
疑惑1:氯气具有漂白作用还是氯水具有漂白作用?
取干燥的和湿润的有色纸条(或布条)各一条。分别放入两个盛有干燥氯气的集气瓶中,盖上玻璃片,观察现象。
实验内容 实验现象 实验结论
干燥的氯气与干燥的有色试纸
干燥的氯气与湿润的有色试纸
有色试纸无变化
有色试纸褪色
干燥的氯气无漂白性
氯水有漂白性
实验探究
疑惑2:氯水中是否只含Cl2和H2O?氯气溶于水后有没有和水反应?
水没有漂白性,氯气分子没有漂白性。
氯气和水反应的产物是什么?
实验探究
因此氯气不仅仅只是单纯的溶解在水中,两者还发生了化学反应!
Cl2 + H2O → HCl
Cl2 → Cl-
0
-1
H+
怎样检验氯水中是否含有Cl-和H+?
实验探究
H+ 的检验
检验微粒 所用试剂或试纸 预期现象
H+
蓝色石蕊试纸
试纸变红
Mg、Zn等活泼金属
有气泡产生
NaHCO3等碳酸氢盐
有气泡产生
实验探究
H+和Cl-都没有漂白作用!
白色沉淀
Cl- 的检验
在洁净的试管中加入1mL新质氯水,再向试管中加入几滴硝酸盐溶液和稀硝酸,观察实验现象。
用石蕊试纸检验酸的酸性时,没有出现漂白现象;
蔬菜汤中放了盐(含Cl-),但蔬菜依然是绿色的
实验探究
疑惑3:氯气和水反应的产物除HCl外,还生成一种具有漂白性的物质,
它是什么?
Cl2+H2O → HCl +
元素守恒:这种具有漂白性的物质一定含有氧元素
?
氧化还原:Cl的化合价有-1、0、+1、+3、+5、+7
0
-1
HClO
+1
结论:干燥的Cl2没有漂白性,氯水具有漂白性是因为Cl2和水反应
生成了HClO
氯水中存在氯气分子
氯气是黄绿色气体,氯水呈黄绿色
疑惑4:
Cl2+H2O
HCl
HClO (次氯酸)
+
+1
氯气跟水反应生成盐酸和次氯酸,怎么氯水中还会有氯气分子存在呢?
Cl2+H2O
HCl
HClO
+
氯气和水的反应
实验探究
?
(可逆反应)
化学性质
①弱酸性
次氯酸是一种弱酸,酸性比碳酸还弱。
②强氧化性
HClO具有强氧化性,能杀死水中的病菌,起到消毒的作用,
具有一定的漂白性。
③不稳定性
次氯酸不稳定,容易分解放出氧气,在阳光照射下分解加快。
2HClO = = = 2HCl + O2 ↑
光照
次氯酸的性质
思考与讨论
新制氯水与久置氯水,其成分及性质有何不同?
新制氯水成分
Cl2、H2O、HCl、HClO
久置氯水成分
H2O、HCl
思考与讨论
主要成分 性质
液氯(纯净物)
新制氯水(混合物)
久置氯水(混合物)
Cl2、HCl、HClO
HCl
酸性、氧化性、漂白性
酸性
新制氯水保存
贮存于棕色瓶细口瓶,放避光阴凉处
对比液氯、新制氯水与久置氯水
Cl2
氧化性
实验室使用氯水要现配现用!
最初,人们直接用氯水作漂白剂,但因氯气的溶解度不大,而且生成的HClO不稳定,难以保存,使用起来很不方便,效果也不理想。在 Cl2与水反应原理的基础上,人们制得了次氯酸钠(NaClO)、次氯酸钙[Ca(ClO)2]等具有漂白作用的次氯酸盐。
化学性质
Cl2与碱的反应
氯气与氢氧化钠的反应
氯气与碱反应的实质上是:碱与氯气和水反应生成的酸发生中和反应
化学性质
与氢氧化钠溶液反应——制取漂白液
Cl2 + 2NaOH === NaCl + NaClO + H2O(有效成分:NaClO )
与石灰乳(Ca(OH)2 )反应——制取漂白粉/漂白精
2Cl2 + 2Ca(OH)2 === CaCl2 + Ca(ClO)2 + 2H2O (有效成分: Ca(ClO)2 )
化学性质
漂白原理
NaClO+CO2+H2O=Na2HCO3+HClO
Cl2与碱的反应
Ca(ClO) 2+ CO 2 + H2O = CaCO 3 ↓+ 2HClO
次氯酸盐与酸发生复分解反应生成HClO而起漂白作用。
谢谢观看
实验探究
用玻璃棒蘸取新制氯水,滴在蓝色石蕊试纸上,观察现象。
蓝色石蕊试纸变红,并且褪色 → 氯水中存在H+
氯及其化合物
氯气的化学性质
化学性质
与钠反应
与铁反应
化学方程式:
2Fe+3Cl2=====2FeCl3
与铜反应
化学方程式:
Cu+Cl2=====CuCl2
生成棕黄色烟
化学方程式:
2Na+Cl2=====2NaCl
有白烟生成
生成棕褐色烟
氯气具有较强的氧化性,常用作做氧化剂
与氢气反应
点燃
H2+Cl2======2HCl
化学方程式:
发出苍白色火焰
观察与比较
氯水中存在氯气分子
比较水溶液与原氯气的颜色,可得出什么结论?
氯气是黄绿色气体,氯水呈黄绿色
在25 ℃时,1体积的水可以溶解约2体积的氯气,氯气的水溶液称为氯水。
舍勒把氯气溶解在水里进行进一步研究,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用,所以他认为这种氯气具有漂白性。
法国化学家贝托莱听说舍勒发现了新气体,就根据自己的想法继续进行新气体的研究,最终他提出真正具有漂白作用的物质不是这种纯净的气体,而是它的水溶液。
谁的观点正确?
舍勒用氯气作了种种实验,发现它可溶于水,使水略有酸味;具有漂白作用,能使蓝色的纸条几乎变白,又能漂白有色花朵和绿叶。
化学史
实验探究
疑惑1:氯气具有漂白作用还是氯水具有漂白作用?
取干燥的和湿润的有色纸条(或布条)各一条。分别放入两个盛有干燥氯气的集气瓶中,盖上玻璃片,观察现象。
实验内容 实验现象 实验结论
干燥的氯气与干燥的有色试纸
干燥的氯气与湿润的有色试纸
有色试纸无变化
有色试纸褪色
干燥的氯气无漂白性
氯水有漂白性
实验探究
疑惑2:氯水中是否只含Cl2和H2O?氯气溶于水后有没有和水反应?
水没有漂白性,氯气分子没有漂白性。
氯气和水反应的产物是什么?
实验探究
因此氯气不仅仅只是单纯的溶解在水中,两者还发生了化学反应!
Cl2 + H2O → HCl
Cl2 → Cl-
0
-1
H+
怎样检验氯水中是否含有Cl-和H+?
实验探究
H+ 的检验
检验微粒 所用试剂或试纸 预期现象
H+
蓝色石蕊试纸
试纸变红
Mg、Zn等活泼金属
有气泡产生
NaHCO3等碳酸氢盐
有气泡产生
实验探究
H+和Cl-都没有漂白作用!
白色沉淀
Cl- 的检验
在洁净的试管中加入1mL新质氯水,再向试管中加入几滴硝酸盐溶液和稀硝酸,观察实验现象。
用石蕊试纸检验酸的酸性时,没有出现漂白现象;
蔬菜汤中放了盐(含Cl-),但蔬菜依然是绿色的
实验探究
疑惑3:氯气和水反应的产物除HCl外,还生成一种具有漂白性的物质,
它是什么?
Cl2+H2O → HCl +
元素守恒:这种具有漂白性的物质一定含有氧元素
?
氧化还原:Cl的化合价有-1、0、+1、+3、+5、+7
0
-1
HClO
+1
结论:干燥的Cl2没有漂白性,氯水具有漂白性是因为Cl2和水反应
生成了HClO
氯水中存在氯气分子
氯气是黄绿色气体,氯水呈黄绿色
疑惑4:
Cl2+H2O
HCl
HClO (次氯酸)
+
+1
氯气跟水反应生成盐酸和次氯酸,怎么氯水中还会有氯气分子存在呢?
Cl2+H2O
HCl
HClO
+
氯气和水的反应
实验探究
?
(可逆反应)
化学性质
①弱酸性
次氯酸是一种弱酸,酸性比碳酸还弱。
②强氧化性
HClO具有强氧化性,能杀死水中的病菌,起到消毒的作用,
具有一定的漂白性。
③不稳定性
次氯酸不稳定,容易分解放出氧气,在阳光照射下分解加快。
2HClO = = = 2HCl + O2 ↑
光照
次氯酸的性质
思考与讨论
新制氯水与久置氯水,其成分及性质有何不同?
新制氯水成分
Cl2、H2O、HCl、HClO
久置氯水成分
H2O、HCl
思考与讨论
主要成分 性质
液氯(纯净物)
新制氯水(混合物)
久置氯水(混合物)
Cl2、HCl、HClO
HCl
酸性、氧化性、漂白性
酸性
新制氯水保存
贮存于棕色瓶细口瓶,放避光阴凉处
对比液氯、新制氯水与久置氯水
Cl2
氧化性
实验室使用氯水要现配现用!
最初,人们直接用氯水作漂白剂,但因氯气的溶解度不大,而且生成的HClO不稳定,难以保存,使用起来很不方便,效果也不理想。在 Cl2与水反应原理的基础上,人们制得了次氯酸钠(NaClO)、次氯酸钙[Ca(ClO)2]等具有漂白作用的次氯酸盐。
化学性质
Cl2与碱的反应
氯气与氢氧化钠的反应
氯气与碱反应的实质上是:碱与氯气和水反应生成的酸发生中和反应
化学性质
与氢氧化钠溶液反应——制取漂白液
Cl2 + 2NaOH === NaCl + NaClO + H2O(有效成分:NaClO )
与石灰乳(Ca(OH)2 )反应——制取漂白粉/漂白精
2Cl2 + 2Ca(OH)2 === CaCl2 + Ca(ClO)2 + 2H2O (有效成分: Ca(ClO)2 )
化学性质
漂白原理
NaClO+CO2+H2O=Na2HCO3+HClO
Cl2与碱的反应
Ca(ClO) 2+ CO 2 + H2O = CaCO 3 ↓+ 2HClO
次氯酸盐与酸发生复分解反应生成HClO而起漂白作用。
谢谢观看
实验探究
用玻璃棒蘸取新制氯水,滴在蓝色石蕊试纸上,观察现象。
蓝色石蕊试纸变红,并且褪色 → 氯水中存在H+
