苏教版高中化学必修第一册专题5微观结构与物质的多样性5.2从微观结构看物质的多样性课件(共42张PPT)
文档属性
| 名称 | 苏教版高中化学必修第一册专题5微观结构与物质的多样性5.2从微观结构看物质的多样性课件(共42张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 7.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-23 09:58:47 | ||
图片预览








文档简介
(共42张PPT)
从微观结构看物质的多样性
专题5 微观结构与物质的多样性
(1)同一种元素能够形成几种不同的单质,这种现象称为同素异形现象
(2) 同一种元素能够形成几种不同的单质,这些单质之间互称为这种元素的 。
一、同素异形现象
1.同素异形现象和同素异形体
同素异形体
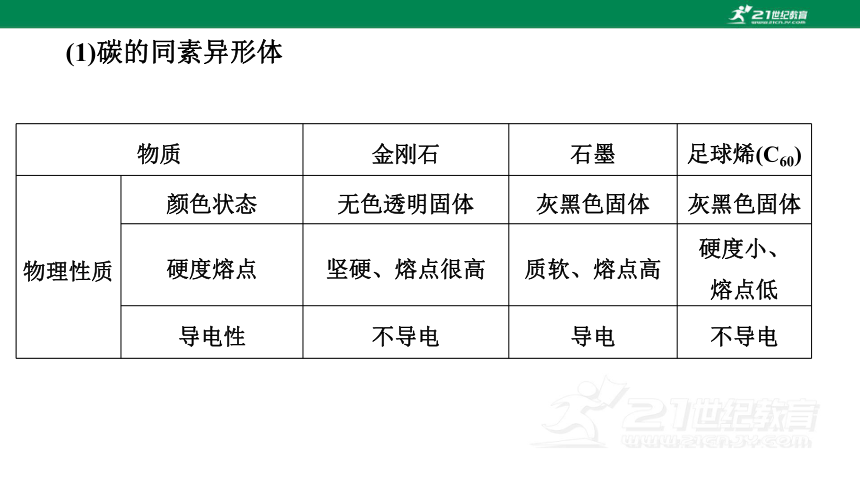
物质 金刚石 石墨 足球烯(C60)
物理性质 颜色状态 无色透明固体 灰黑色固体 灰黑色固体
硬度熔点 坚硬、熔点很高 质软、熔点高 硬度小、
熔点低
导电性 不导电 导电 不导电
(1)碳的同素异形体
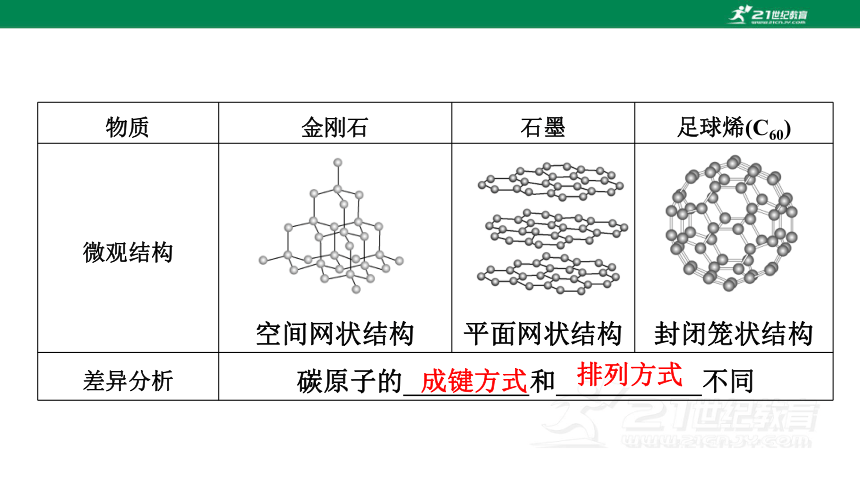
物质 金刚石 石墨 足球烯(C60)
微观结构
空间网状结构
平面网状结构
封闭笼状结构
差异分析 碳原子的 和 不同
成键方式
排列方式
(2)氧的同素异形体
成键方式
个数
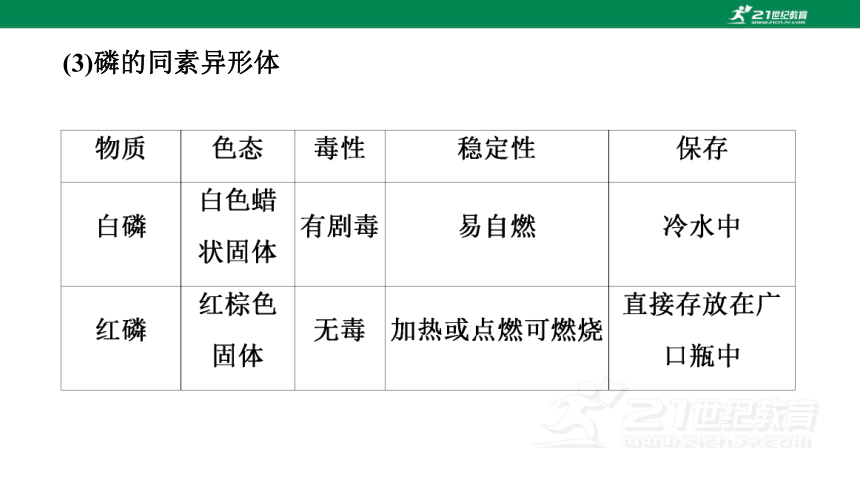
(3)磷的同素异形体
(1)组成元素:只含有一种元素
对同素异形体的理解
(2)物质类别:互为同素异形体的只能是单质
(3)性质关系:同素异形体之间的物理性质有差异,但化学性质相似
(4)相互转化:同素异形体之间的转化属于化学变化,因为转化过程中有化学键的断裂与形成
(5)同素异形体之间的转化既有单质参加,又有单质生成,但由于没有涉及化合价的变化,一般认为这种转化属于非氧化还原反应
(1)化合物具有相同的 ,但具有不同 的现象,称为同分异构现象
(2)分子式相同而结构 的化合物互称为同分异构体
(3)同分异构现象主要表现在有机化合物中
二、同分异构现象
1.同分异构现象和同分异构体
分子式
结构
不同
1.判断正误
(1)水、重水、超重水互为同素异形体
(2)CH3—CH===CH2与CH2CH2CH2互为同分异构体
分
子
结
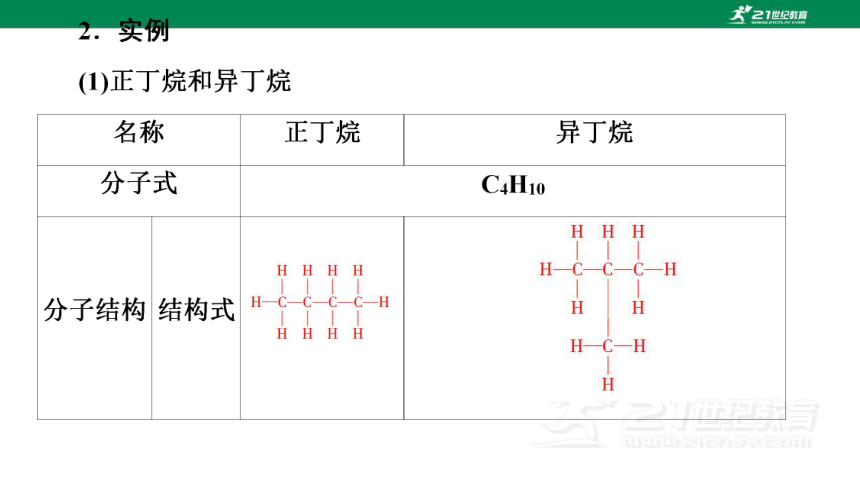
构 结构简式 CH3CH2CH2CH3
球棍模型
结论 分子结构不同
沸点 -0.5℃ -11.7℃
差异分析 原子的连接方法不同,化学键的类型相同,物质类别相同
C2H6O
不同
不同
不同
(1)从物质看:互为同分异构体的物质只能是化合物。它们之间的转化属于化学变化,若共存则为混合物
四角度认识同分异构体
(2)从分子式看:互为同分异构体的化合物,其分子式相同,相对分子质量也相同,但相对分子质量相同的化合物分子式不一定相同,如甲酸(HCOOH)和乙醇(CH3CH2OH)的相对分子质量均为46
(3)从结构看:互为同分异构体的化合物,空间结构不同
(4)从性质看:互为同分异构体的化合物,物理性质不同,化学性质可能相似
【学习小结】
同素异形体 同分异构体 同位素
相同点
不同点
研究对象
同一种元素
结构不同
分子式相同
分子结构不同
质子数相同的同种元素
中子数不同
单质
化合物
原子
3.下面列出了几组物质或微粒,请将合适的序号填写在空格上。
①金刚石与“足球烯”(C60);②D与T;③16O、17O和18O;④氧气(O2)与臭氧(O3);⑤乙醇(CH3CH2OH)和二甲醚(CH3OCH3)
(1)是同素异形体的 。
(2)是同位素的 。
(3)是同分异构体的 。
①④
②③
⑤
1.科学家发现C60后,近年又合成了许多球形分子,如C50、C70、C120、C540等,它们互称为( )
A.同一种物质 B.同分异构体
C.同素异形体 D.同位素
2.下列说法不正确的是( )
A.核素21H的中子数是0
B.12C和 14C互为同位素
C.金刚石、石墨和富勒烯互为同素异形体
D.CH3CH2OH和CH3OCH3互为同分异构体
(1)互为同位素的是 (填序号,下同)。
(2)互为同素异形体的是 。
(3)互为同分异构体的是 。
①
③
②
1.闪电时空气中有臭氧生成。下列说法正确的是( )
A.O3和O2互为同位素
B.O2比O3稳定
C.等体积O3和O2含有相同质子数
D.O3与O2的相互转变是物理变化
A
B
常见的晶体
雪花
食盐
干冰
钻石
紫水晶
石英
1.常见固体物质一般可分为晶体和非晶体。
有规则的几何外形,如氯化钠、金刚石、干冰等。
没有固定的熔点,一般也不具备规则的几何外形
三、晶体与非晶体
晶体
非晶体
NaCl
1.离子晶体
(1)概念:离子晶体是由______________________________________晶体。
(2)构成粒子为____________。
(3)作用力为________。
(4)性质:①熔点______ 、硬度______。
②______时不导电,在__________下或________中能够导电。
③无单个分子存在
(5)种类:强碱、部分金属氧化物、部分盐类
阴、阳离子按一定方式有规则地排列形成的
阴、阳离子
离子键
较高
较大
固态
熔融状态
水溶液
四、晶体类型
干冰
2.分子晶体
(1)概念:分子晶体是由____________________________________________
(2)构成微粒:______。
(3)作用力:______________。
(4)性质:①硬度____,熔、沸点____,晶体不导电。
②有单个分子存在,化学式就是分子式
(5)种类:卤素、氧气、氢气等多数非金属单质、稀有气体、非金属氢化 物、多数非金属氧化物
分子之间依靠分子间作用力按一定规则排列形成的晶体
分子
分子间作用力
小
低
3.共价晶体
(1)概念:共价晶体是由________________________________________的晶体。
(2)构成微粒:______。
(3)作用力:________。
(4)性质:熔、沸点____,硬度____,一般不导电。
(5)种类:金刚石、单晶硅、碳化硅、二氧化硅
原子间通过共价键结合形成的空间网状结构
原子
共价键
高
大
晶体 氯化钠 金刚石 二氧化硅 干冰
熔点/℃ 801 >3 550 1 723 -78
硬度 较硬 很硬 硬而脆 软
晶体类型 离子晶体 共价晶体 分子晶体
晶体特性 熔点较高硬度较大 熔点很高硬度很大 熔点较低硬度较小
4、金属晶体
常见金属晶体:
金属单质或合金如:钠、钾、铜
物理性质:
有金属光泽、导电、导热、延展性
晶体类型 离子晶体 共价晶体 分子晶体 金属晶体
晶体微粒 ____________ _____ _____ 金属阳离子、自由电子
形成晶体
的作用力 _______ ________ ___________
___________ 金属键
实例 氯化钠、
氢氧化钾 金刚石、二氧化硅 冰、干冰 Na、Zn
常见的几类晶体
阴、阳离子
原子
分子
离子键
共价键
分子间作用力(或氢键)
1.晶体类型判断方法:
(1)分析微粒种类:离子、分子、原子
(2)微粒间的相互作用力:离子键、分子间作用力、共价键、金属键
2.物质类别与晶体类型
(1)离子化合物(强碱和大多数盐)都是离子晶体
(2)共价分子(单质或化合物)是分子晶体
(3)常见的共价晶体,如二氧化硅、碳化硅、金刚石、晶体硅等
3、晶体的熔、沸点高低判断
(1)先看晶体的类型
不同晶体类型的物质其熔点的一般规律:共价晶体>离子晶体>分子晶体;但是要注意金属晶体的熔、沸点有的很高,如钨、铂等,有的则很低,如汞、铯等。
(2)同一晶体类型的物质,需比较晶体内部结构粒子间作用力,作用力越大,熔、沸点越高
①共价晶体:要比较共价键的强弱,一般地说,原子半径越小,形成的共价键越牢固,键能越大,其晶体熔、沸点越高。如熔点:金刚石>碳化硅>晶体硅。
②离子晶体:要比较离子键的强弱,一般地说,阴、阳离子的电荷数越大,离子半径越小,则离子间作用就越强,其离子晶体熔、沸点越高。如熔点:MgO>NaCl>KCl。
③分子晶体:含有氢键的分子晶体,熔、沸点较高。若无氢键,且组成和结构相似的物质,相对分子质量越大,熔、沸点越高,如:熔、沸点:HI>HBr>HCl。
2.下列各组中,既含有离子晶体、分子晶体,又含有原子晶体的是( )
A.KCl、H2SO4、P4
B.CO2、Na3PO4、Mg
C.NH4F、C60、金刚石
D.Si、SiO2、K2CO3
5.有几种晶体:A.水晶,B.冰醋酸,C.白磷,D.金刚石,E.晶体氩,F.干冰。
(1)属于分子晶体的是 ,直接由原子构成的分子晶体是 。
(2)属于原子晶体的化合物是 。
(3)直接由原子构成的晶体是 。
(4)受热熔化时,化学键不发生变化的是 ,需克服共价键的是 。
BCEF
E
A
ADE
BCF
AD
4.我们熟悉的食盐、金属、刨冰、钻石、水晶等都是晶体;而同样透明的玻璃却是非晶体。下列关于晶体和非晶体的本质区别的叙述中,正确的是( )
A.是否是具有规则几何外形的固体
B.是否是具有固定组成的物质
C.是否是具有美观对称的外形
D.内部构成微粒是否在空间呈有规则的重复排列
D
从微观结构看物质的多样性
专题5 微观结构与物质的多样性
(1)同一种元素能够形成几种不同的单质,这种现象称为同素异形现象
(2) 同一种元素能够形成几种不同的单质,这些单质之间互称为这种元素的 。
一、同素异形现象
1.同素异形现象和同素异形体
同素异形体
物质 金刚石 石墨 足球烯(C60)
物理性质 颜色状态 无色透明固体 灰黑色固体 灰黑色固体
硬度熔点 坚硬、熔点很高 质软、熔点高 硬度小、
熔点低
导电性 不导电 导电 不导电
(1)碳的同素异形体
物质 金刚石 石墨 足球烯(C60)
微观结构
空间网状结构
平面网状结构
封闭笼状结构
差异分析 碳原子的 和 不同
成键方式
排列方式
(2)氧的同素异形体
成键方式
个数
(3)磷的同素异形体
(1)组成元素:只含有一种元素
对同素异形体的理解
(2)物质类别:互为同素异形体的只能是单质
(3)性质关系:同素异形体之间的物理性质有差异,但化学性质相似
(4)相互转化:同素异形体之间的转化属于化学变化,因为转化过程中有化学键的断裂与形成
(5)同素异形体之间的转化既有单质参加,又有单质生成,但由于没有涉及化合价的变化,一般认为这种转化属于非氧化还原反应
(1)化合物具有相同的 ,但具有不同 的现象,称为同分异构现象
(2)分子式相同而结构 的化合物互称为同分异构体
(3)同分异构现象主要表现在有机化合物中
二、同分异构现象
1.同分异构现象和同分异构体
分子式
结构
不同
1.判断正误
(1)水、重水、超重水互为同素异形体
(2)CH3—CH===CH2与CH2CH2CH2互为同分异构体
分
子
结
构 结构简式 CH3CH2CH2CH3
球棍模型
结论 分子结构不同
沸点 -0.5℃ -11.7℃
差异分析 原子的连接方法不同,化学键的类型相同,物质类别相同
C2H6O
不同
不同
不同
(1)从物质看:互为同分异构体的物质只能是化合物。它们之间的转化属于化学变化,若共存则为混合物
四角度认识同分异构体
(2)从分子式看:互为同分异构体的化合物,其分子式相同,相对分子质量也相同,但相对分子质量相同的化合物分子式不一定相同,如甲酸(HCOOH)和乙醇(CH3CH2OH)的相对分子质量均为46
(3)从结构看:互为同分异构体的化合物,空间结构不同
(4)从性质看:互为同分异构体的化合物,物理性质不同,化学性质可能相似
【学习小结】
同素异形体 同分异构体 同位素
相同点
不同点
研究对象
同一种元素
结构不同
分子式相同
分子结构不同
质子数相同的同种元素
中子数不同
单质
化合物
原子
3.下面列出了几组物质或微粒,请将合适的序号填写在空格上。
①金刚石与“足球烯”(C60);②D与T;③16O、17O和18O;④氧气(O2)与臭氧(O3);⑤乙醇(CH3CH2OH)和二甲醚(CH3OCH3)
(1)是同素异形体的 。
(2)是同位素的 。
(3)是同分异构体的 。
①④
②③
⑤
1.科学家发现C60后,近年又合成了许多球形分子,如C50、C70、C120、C540等,它们互称为( )
A.同一种物质 B.同分异构体
C.同素异形体 D.同位素
2.下列说法不正确的是( )
A.核素21H的中子数是0
B.12C和 14C互为同位素
C.金刚石、石墨和富勒烯互为同素异形体
D.CH3CH2OH和CH3OCH3互为同分异构体
(1)互为同位素的是 (填序号,下同)。
(2)互为同素异形体的是 。
(3)互为同分异构体的是 。
①
③
②
1.闪电时空气中有臭氧生成。下列说法正确的是( )
A.O3和O2互为同位素
B.O2比O3稳定
C.等体积O3和O2含有相同质子数
D.O3与O2的相互转变是物理变化
A
B
常见的晶体
雪花
食盐
干冰
钻石
紫水晶
石英
1.常见固体物质一般可分为晶体和非晶体。
有规则的几何外形,如氯化钠、金刚石、干冰等。
没有固定的熔点,一般也不具备规则的几何外形
三、晶体与非晶体
晶体
非晶体
NaCl
1.离子晶体
(1)概念:离子晶体是由______________________________________晶体。
(2)构成粒子为____________。
(3)作用力为________。
(4)性质:①熔点______ 、硬度______。
②______时不导电,在__________下或________中能够导电。
③无单个分子存在
(5)种类:强碱、部分金属氧化物、部分盐类
阴、阳离子按一定方式有规则地排列形成的
阴、阳离子
离子键
较高
较大
固态
熔融状态
水溶液
四、晶体类型
干冰
2.分子晶体
(1)概念:分子晶体是由____________________________________________
(2)构成微粒:______。
(3)作用力:______________。
(4)性质:①硬度____,熔、沸点____,晶体不导电。
②有单个分子存在,化学式就是分子式
(5)种类:卤素、氧气、氢气等多数非金属单质、稀有气体、非金属氢化 物、多数非金属氧化物
分子之间依靠分子间作用力按一定规则排列形成的晶体
分子
分子间作用力
小
低
3.共价晶体
(1)概念:共价晶体是由________________________________________的晶体。
(2)构成微粒:______。
(3)作用力:________。
(4)性质:熔、沸点____,硬度____,一般不导电。
(5)种类:金刚石、单晶硅、碳化硅、二氧化硅
原子间通过共价键结合形成的空间网状结构
原子
共价键
高
大
晶体 氯化钠 金刚石 二氧化硅 干冰
熔点/℃ 801 >3 550 1 723 -78
硬度 较硬 很硬 硬而脆 软
晶体类型 离子晶体 共价晶体 分子晶体
晶体特性 熔点较高硬度较大 熔点很高硬度很大 熔点较低硬度较小
4、金属晶体
常见金属晶体:
金属单质或合金如:钠、钾、铜
物理性质:
有金属光泽、导电、导热、延展性
晶体类型 离子晶体 共价晶体 分子晶体 金属晶体
晶体微粒 ____________ _____ _____ 金属阳离子、自由电子
形成晶体
的作用力 _______ ________ ___________
___________ 金属键
实例 氯化钠、
氢氧化钾 金刚石、二氧化硅 冰、干冰 Na、Zn
常见的几类晶体
阴、阳离子
原子
分子
离子键
共价键
分子间作用力(或氢键)
1.晶体类型判断方法:
(1)分析微粒种类:离子、分子、原子
(2)微粒间的相互作用力:离子键、分子间作用力、共价键、金属键
2.物质类别与晶体类型
(1)离子化合物(强碱和大多数盐)都是离子晶体
(2)共价分子(单质或化合物)是分子晶体
(3)常见的共价晶体,如二氧化硅、碳化硅、金刚石、晶体硅等
3、晶体的熔、沸点高低判断
(1)先看晶体的类型
不同晶体类型的物质其熔点的一般规律:共价晶体>离子晶体>分子晶体;但是要注意金属晶体的熔、沸点有的很高,如钨、铂等,有的则很低,如汞、铯等。
(2)同一晶体类型的物质,需比较晶体内部结构粒子间作用力,作用力越大,熔、沸点越高
①共价晶体:要比较共价键的强弱,一般地说,原子半径越小,形成的共价键越牢固,键能越大,其晶体熔、沸点越高。如熔点:金刚石>碳化硅>晶体硅。
②离子晶体:要比较离子键的强弱,一般地说,阴、阳离子的电荷数越大,离子半径越小,则离子间作用就越强,其离子晶体熔、沸点越高。如熔点:MgO>NaCl>KCl。
③分子晶体:含有氢键的分子晶体,熔、沸点较高。若无氢键,且组成和结构相似的物质,相对分子质量越大,熔、沸点越高,如:熔、沸点:HI>HBr>HCl。
2.下列各组中,既含有离子晶体、分子晶体,又含有原子晶体的是( )
A.KCl、H2SO4、P4
B.CO2、Na3PO4、Mg
C.NH4F、C60、金刚石
D.Si、SiO2、K2CO3
5.有几种晶体:A.水晶,B.冰醋酸,C.白磷,D.金刚石,E.晶体氩,F.干冰。
(1)属于分子晶体的是 ,直接由原子构成的分子晶体是 。
(2)属于原子晶体的化合物是 。
(3)直接由原子构成的晶体是 。
(4)受热熔化时,化学键不发生变化的是 ,需克服共价键的是 。
BCEF
E
A
ADE
BCF
AD
4.我们熟悉的食盐、金属、刨冰、钻石、水晶等都是晶体;而同样透明的玻璃却是非晶体。下列关于晶体和非晶体的本质区别的叙述中,正确的是( )
A.是否是具有规则几何外形的固体
B.是否是具有固定组成的物质
C.是否是具有美观对称的外形
D.内部构成微粒是否在空间呈有规则的重复排列
D
