4.1.2 醇的重要应用(17张) 2024-2025学年高二化学苏教版选择性必修3
文档属性
| 名称 | 4.1.2 醇的重要应用(17张) 2024-2025学年高二化学苏教版选择性必修3 |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-22 10:14:37 | ||
图片预览





文档简介
(共17张PPT)
专题4 生活中常用的有机物——烃的含氧衍生物
第一单元 醇和酚
第2课时 醇的重要应用
古往今来无数咏叹酒的诗篇都证明酒是一种奇特而富有魅力的饮料。其中的溶质—酒精有哪些性质呢?
借问酒家何处有,
牧童遥指杏花村。
明月几时有,
把酒问青天。
1.认识醇的组成和结构特点。
2.认识醇类的物理性质。
3.列举醇类在日常生活中的重要应用,认识醇类物质对现代社会可持续发展的影响。
1.通过常见醇的物理性质及用途,认识醇类物质性质的变化规律,形成“结构决定性质的”的观念。(宏观辨识与微观探析)
2.认识醇类在日常生活中的重要作用,感受化学对科技进步和社会发展的重大贡献。(科学态度与社会责任)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
CH2CH2
OH OH
乙二醇
二元醇
CH2CH CH2
OH OH OH
丙三醇(甘油)
三元醇
一元醇
CH3OH
剧毒
用于能源领域如汽车燃料
工业酒精有毒!
汽车防冻剂
配制化妆品
甲醇
一、醇的分类
①根据羟基的数目
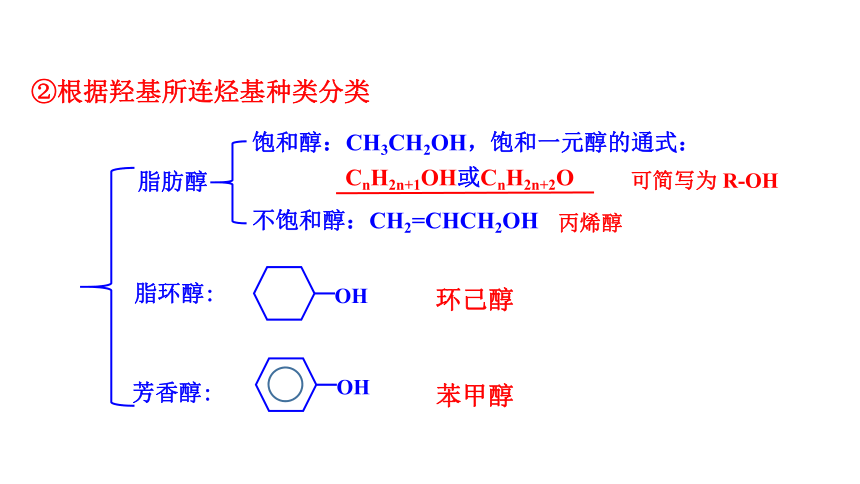
苯甲醇
环己醇
丙烯醇
②根据羟基所连烃基种类分类
可简写为 R-OH
脂肪醇
脂环醇:
芳香醇:
饱和醇:CH3CH2OH,饱和一元醇的通式:
CnH2n+1OH或CnH2n+2O
不饱和醇:CH2=CHCH2OH
OH
OH
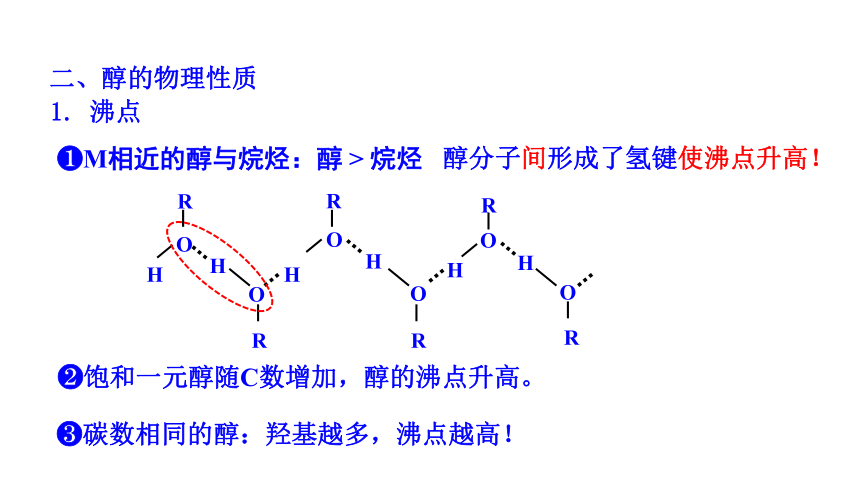
二、醇的物理性质
Μ相近的醇与烷烃:醇 > 烷烃
1. 沸点
醇分子间形成了氢键使沸点升高!
碳数相同的醇:羟基越多,沸点越高!
饱和一元醇随C数增加,醇的沸点升高。
R
R
R
R
R
R
O
O
O
O
O
O
H
H
H
H
H
H
2.水溶性
(1)低级醇(如甲、乙、丙醇)与水任意比混溶。
(2)随C数的增加,水溶性逐渐降低。
烃基-憎水基
羟基-亲水基
3.状态:无气体;C11以下液体; C12以上蜡状固体。
C1–C3与水任意比互溶;
C4-C11部分溶于水;C12以上不溶于水。
1.甲醇
甲醇起初来源于木材的干馏,俗称木糖或木醇,是无色透明的液体。甲醇有剧毒,误饮少量即会致眼睛失明甚至致人死亡。
三、醇的重要应用
【思考讨论】甲醇和乙烷的沸点悬殊很大,其原因是什么
相对分子质量 沸点 常温下状态
甲醇 32 64.7℃ 液体
乙烷 30 -88.6℃ 气态
甲醇分子间存在氢键,而乙烷分子间不存在氢键
2.乙二醇
乙二醇是一种无色、粘稠、有甜味的液体,主要用来生产聚酯纤维。乙二醇的水溶液凝固点很低,可作汽车发动机的抗冻剂。
3.丙三醇
丙三醇俗称甘油,,是无色粘稠,有甜味的液体,吸湿性强,有护肤作用,是重要的化工原料。
【思考交流】
丙三醇吸湿性强,有护肤作用,其原因是什么?
甘油能与水形成氢键,具有吸水性,起到保湿作用
醇
甲醇—用作燃料
乙二醇—用作抗冻剂
丙三醇—用作化工原料
羟基与饱和碳原子相连
结构
分类
根据羟基个数分为一元醇、二元醇、多元醇
物理
性质
一元醇沸点随分子中碳原
子数的增加逐渐升高
一元醇随着碳原子数的增
加,在水中的溶解度降低
醇沸点远远高于相对分子
质量相近的烷烃
1.下列物质与CH3OH互为同系物的是( )
A
A.
B.
C.
D.
CH2=CHCH2OH
2.下列关于乙醇的物理性质的应用中不正确的是( )
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分
C.由于乙醇能够以任意比与水互溶,所以酒厂可以勾兑各种浓度的酒
D.从化学学科角度看,俗语“酒香不怕巷子深”中包含乙醇容易挥发的性质
A
3.天文学家在太空发现一个长4 630亿千米的甲醇气团,这一天文发现为揭示“原始气体如何形成巨大恒星”提供了有力证据。下列关于醇的说法正确的是( )
A.甲醇能发生催化氧化反应
B.所有的醇都能发生消去反应
C.都符合通式CnH2n+1OH
D.醇与钠反应比水与钠反应剧烈
A
4.关于化合物甘油( ),下列说法正确的是( )
A.与乙醇互为同系物
B.能使酸性KMnO4溶液褪色
C.能发生水解反应
D.难溶于水,易溶于乙醇
B
5.连花清瘟胶囊(或颗粒)含有多种药物成分,广藿香醇是其中一种,其结构如图所示(分子式为C15H26O)。下列关于广藿香醇的叙述正确的是( )
D
A.属于环已醇的同系物
B.存在酚类或芳香醇类的同分异构体
C.能发生酯化反应,也容易被催化氧化生成酮
D.分子中含有六元环和甲基的数目均为4
专题4 生活中常用的有机物——烃的含氧衍生物
第一单元 醇和酚
第2课时 醇的重要应用
古往今来无数咏叹酒的诗篇都证明酒是一种奇特而富有魅力的饮料。其中的溶质—酒精有哪些性质呢?
借问酒家何处有,
牧童遥指杏花村。
明月几时有,
把酒问青天。
1.认识醇的组成和结构特点。
2.认识醇类的物理性质。
3.列举醇类在日常生活中的重要应用,认识醇类物质对现代社会可持续发展的影响。
1.通过常见醇的物理性质及用途,认识醇类物质性质的变化规律,形成“结构决定性质的”的观念。(宏观辨识与微观探析)
2.认识醇类在日常生活中的重要作用,感受化学对科技进步和社会发展的重大贡献。(科学态度与社会责任)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
CH2CH2
OH OH
乙二醇
二元醇
CH2CH CH2
OH OH OH
丙三醇(甘油)
三元醇
一元醇
CH3OH
剧毒
用于能源领域如汽车燃料
工业酒精有毒!
汽车防冻剂
配制化妆品
甲醇
一、醇的分类
①根据羟基的数目
苯甲醇
环己醇
丙烯醇
②根据羟基所连烃基种类分类
可简写为 R-OH
脂肪醇
脂环醇:
芳香醇:
饱和醇:CH3CH2OH,饱和一元醇的通式:
CnH2n+1OH或CnH2n+2O
不饱和醇:CH2=CHCH2OH
OH
OH
二、醇的物理性质
Μ相近的醇与烷烃:醇 > 烷烃
1. 沸点
醇分子间形成了氢键使沸点升高!
碳数相同的醇:羟基越多,沸点越高!
饱和一元醇随C数增加,醇的沸点升高。
R
R
R
R
R
R
O
O
O
O
O
O
H
H
H
H
H
H
2.水溶性
(1)低级醇(如甲、乙、丙醇)与水任意比混溶。
(2)随C数的增加,水溶性逐渐降低。
烃基-憎水基
羟基-亲水基
3.状态:无气体;C11以下液体; C12以上蜡状固体。
C1–C3与水任意比互溶;
C4-C11部分溶于水;C12以上不溶于水。
1.甲醇
甲醇起初来源于木材的干馏,俗称木糖或木醇,是无色透明的液体。甲醇有剧毒,误饮少量即会致眼睛失明甚至致人死亡。
三、醇的重要应用
【思考讨论】甲醇和乙烷的沸点悬殊很大,其原因是什么
相对分子质量 沸点 常温下状态
甲醇 32 64.7℃ 液体
乙烷 30 -88.6℃ 气态
甲醇分子间存在氢键,而乙烷分子间不存在氢键
2.乙二醇
乙二醇是一种无色、粘稠、有甜味的液体,主要用来生产聚酯纤维。乙二醇的水溶液凝固点很低,可作汽车发动机的抗冻剂。
3.丙三醇
丙三醇俗称甘油,,是无色粘稠,有甜味的液体,吸湿性强,有护肤作用,是重要的化工原料。
【思考交流】
丙三醇吸湿性强,有护肤作用,其原因是什么?
甘油能与水形成氢键,具有吸水性,起到保湿作用
醇
甲醇—用作燃料
乙二醇—用作抗冻剂
丙三醇—用作化工原料
羟基与饱和碳原子相连
结构
分类
根据羟基个数分为一元醇、二元醇、多元醇
物理
性质
一元醇沸点随分子中碳原
子数的增加逐渐升高
一元醇随着碳原子数的增
加,在水中的溶解度降低
醇沸点远远高于相对分子
质量相近的烷烃
1.下列物质与CH3OH互为同系物的是( )
A
A.
B.
C.
D.
CH2=CHCH2OH
2.下列关于乙醇的物理性质的应用中不正确的是( )
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分
C.由于乙醇能够以任意比与水互溶,所以酒厂可以勾兑各种浓度的酒
D.从化学学科角度看,俗语“酒香不怕巷子深”中包含乙醇容易挥发的性质
A
3.天文学家在太空发现一个长4 630亿千米的甲醇气团,这一天文发现为揭示“原始气体如何形成巨大恒星”提供了有力证据。下列关于醇的说法正确的是( )
A.甲醇能发生催化氧化反应
B.所有的醇都能发生消去反应
C.都符合通式CnH2n+1OH
D.醇与钠反应比水与钠反应剧烈
A
4.关于化合物甘油( ),下列说法正确的是( )
A.与乙醇互为同系物
B.能使酸性KMnO4溶液褪色
C.能发生水解反应
D.难溶于水,易溶于乙醇
B
5.连花清瘟胶囊(或颗粒)含有多种药物成分,广藿香醇是其中一种,其结构如图所示(分子式为C15H26O)。下列关于广藿香醇的叙述正确的是( )
D
A.属于环已醇的同系物
B.存在酚类或芳香醇类的同分异构体
C.能发生酯化反应,也容易被催化氧化生成酮
D.分子中含有六元环和甲基的数目均为4
