2025高三化学一轮复习萃取和反萃取导学案
文档属性
| 名称 | 2025高三化学一轮复习萃取和反萃取导学案 |  | |
| 格式 | docx | ||
| 文件大小 | 8.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-23 10:43:41 | ||
图片预览




文档简介
2025高三化学一轮复习萃取和反萃取导学案
课前预习案
【学习目标】
1.通过对“海带提碘”知识的复习形成物质分离提纯的思路模型,能初步运用相关知
识解决生产和生活中的简单问题,发展科学探究意识、创新意识。
2.理解萃取反萃取的原理,掌握相应的实验操作方法,培养实验安全意识和环保意识。
一、教材原型 用反萃取法将碘单质从碘的四氯化碳溶液中提取出来
在“海带提碘”实验中,通常以四氯化碳为萃取剂对生成的碘单质进行萃取、富集。那么,如何使碘单质从碘的四氯化碳溶液中提取出来呢?要解决这一问题,可采用反萃取法(将富集在四氯化碳中的碘单质利用化学转化法重新富集在水中)。具体步骤如下:
【问题1】反萃取的第一步在什么仪器中进行?写出加入浓NaOH溶液和45%的H2SO4溶液后发生的离子方程式?
【问题2】已知I2的沸点184℃,45℃左右就开始缓慢升华,CCl4沸点77℃。
还可以用什么方法分离?反萃取法较蒸馏法的优点是什么?
真题再现 (2024·浙江1月)为回收利用含I2的CCl4废液,某化学兴趣小组设计方案如下所示,下列说法不正确的是( )
A.步骤Ⅰ中,加入足量Na2CO3溶液充分反应后,上下两层均为无色
B.步骤Ⅰ中,分液时从分液漏斗下口放出溶液A
C.试剂X可用硫酸
D.粗I2可用升华法进一步提纯
二、必备知识梳理
1.萃取
(1)利用物质在两种互不相溶的溶剂中的 不同,将物质从一种溶剂转 移到另一种溶剂的过程。如用四氯化碳(CCl4)或苯萃取碘水中的碘。四氯化碳密度比水 ,萃取后碘的四氯化碳溶液在 层(呈紫红色);苯密度比水 ,有机层在 层。
(2)萃取剂的选择条件
。
(3)实验操作步骤
加萃取剂---振荡萃取--静止分层--分液分离
2.反萃取:用反萃取剂使被萃取物从 返回水相的过程,为萃取的逆过 程。反萃取过程具有简单、便于操作和周期短的特点,是溶剂萃取分离工艺流程中的一个重要环节。反萃取时所使用的水相溶液称为反萃(取)剂。根据被萃取物的性质,反萃取剂可以分为以下几类:
(1)酸性反萃取剂:如硫酸(H2SO4)、硝酸(HNO3)、盐酸(HCl)等,可用于反萃取碱性物质。
(2)碱性反萃取剂:如氢氧化钠(NaOH)、碳酸钠(Na2CO3)等,可用于反萃取酸性物质。
(3)络合剂:如EDTA、杯笼试剂等,可用于反萃取金属离子。
(4)中性萃取剂:如醇类、酮类等,用于反萃取不与反萃取剂发生化学反应的物质。
三、萃取法 反萃取法分离
(1)已知萃取剂A、B中pH对钴离子、锰离子萃取率的影响如图所示,为了除去Mn2+,应选择萃取剂______________(填“A”或“B”)。
(2)近年来,随着锂离子电池的广泛应用,废锂离子电池的回收处理至关重要。利用废锂离子电池正极材料(有 Al 、LiCoO2、 Ni 、 Mn 、 Fe 等)回收钴、镍、锂。控制水相 pH =5.2,温度25℃,分别用P507、Cyanex272作萃取剂,萃取剂浓度对萃取分离钻、镍的影响实验结果如图所示。
思考:结合题目信息,尝试命制1-2个问题
课堂探究案
【学习目标】
1.通过对“海带提碘”知识的复习形成物质分离提纯的思路,能初步运用相关知识解决生产和生活中的简单问题,发展科学探究意识、创新意识。
2.理解萃取反萃取的原理,掌握相应的实验操作方法,培养实验安全意识和环保意识。
考点一 有关实验操作的考查
【真题研习·规律探寻】
1.(高考题改编重组)判断下列说法是否正确
(1)用NaOH溶液除去溴苯中的溴单质,可以用分液的方法( )
(2)从含有I2的NaCl固体中提取I2,用CCl4溶解、萃取、分液( )
(3)用花生油萃取溴水中的溴( )
(4)回收水溶液中的I2:加入乙酸,分液,蒸发( )
(5)分离饱和碳酸钠溶液和乙酸乙酯,将分层的液体依次从下口放出( )
(6)向某无色溶液中先加入少量新制氯水,再加入CCl4,振荡,下层溶液呈紫红色,原溶液中一定存在I-( )
【归纳总结】物质分离提纯的思路
2.(2020·山东)实验室分离Fe3+和Al3+的流程如下:
已知Fe3+在浓盐酸中生成黄色配离子[FeCl4]-,该配离子在乙醚(Et2O,沸点34.6 ℃)中生成缔合物Et2O·H+·[FeCl4]-。下列说法错误的是( )
A.萃取振荡时,分液漏斗下口应倾斜向下
B.分液时,应先将下层液体由分液漏斗下口放出
C.分液后水相为无色,说明已达到分离目的
D.蒸馏时选用直形冷凝管
【问题1】浓盐酸酸化的作用是什么,反萃取操作时可否加入NaOH溶液
【问题2】分液时,漏斗中的液体很难流出,可能原因是?
【问题3】怎样操作才能使Fe3+尽可能多地从水相转移至有机相?
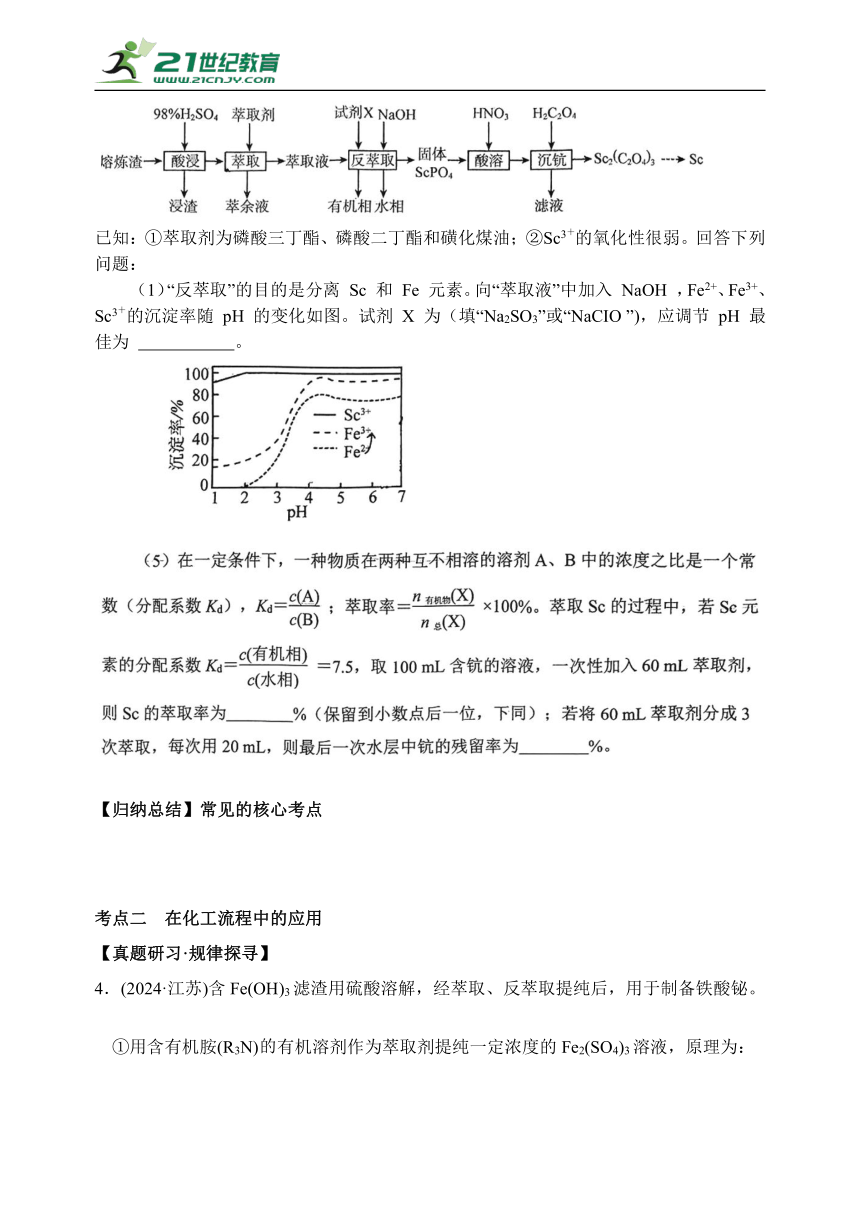
3.(2025·日照一模节选)以赤泥熔炼渣(主要成分为Fe2O3、SiO2、 CaO ,少量Sc2O3)为原料分离稀土元素镜( Sc )的一种工艺流程如下:
已知:①萃取剂为磷酸三丁酯、磷酸二丁酯和磺化煤油;②Sc3+的氧化性很弱。回答下列问题:
(1)“反萃取”的目的是分离 Sc 和 Fe 元素。向“萃取液”中加入 NaOH ,Fe2+、Fe3+、Sc3+的沉淀率随 pH 的变化如图。试剂 X 为(填“Na2SO3”或“NaCIO ”),应调节 pH 最佳为 。
【归纳总结】常见的核心考点
考点二 在化工流程中的应用
【真题研习·规律探寻】
4.(2024·江苏)含Fe(OH)3滤渣用硫酸溶解,经萃取、反萃取提纯后,用于制备铁酸铋。
①用含有机胺(R3N)有机溶剂作为萃取剂提纯一定浓度的Fe2(SO4)3溶液,原理为:
(有机层)
已知:
其他条件不变,水层初始pH在0.2~0.8范围内,随水层pH增大,有机层中Fe元素含量迅速增多的原因是 。
5.(2024·湖北节选)铍用于宇航器件的构筑。一种从其铝硅酸盐[Be3Al2]中提取铍的路径为
已知:Be2++4HABeA2(HA)2+2H+ 回答下列问题:
(1)“萃取分液”的目的是分离Be2+和Al3+,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是 。
(2)写出反萃取生成Na2[Be(OH)4]的化学方程式 “滤液2”可以进入_______步骤再利用。
【变式】萃取分离Co2+、Al3+的实验操作:向萃取分液后的有机相中加稀硫酸调 pH =3~4, 液可得CoSO4溶液, 可得Al2(SO4)3溶液。
【归纳总结】核心考点
考点三 特殊实验装置的分析应用--索氏提取器
6.(2019·全国卷Ⅱ改编)咖啡因是一种生物碱(易溶于水及乙醇,熔点234.5 ℃,100 ℃以上开始升华),有兴奋大脑神经和利尿等作用。茶叶中含咖啡因约1%~5%、单宁酸(Ka约为10-6,易溶于水及乙醇)约3%~10%,还含有色素、纤维素等。实验室从茶叶中提取咖啡因的流程如图所示。
索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题。
(1)提取过程不可选用明火直接加热,原因是 。与常规的萃取相比,采用索氏提取器的优点是 。
(2)提取结束后,用什么方法回收萃取液中的溶剂?
(3)与水相比,乙醇作为萃取剂的优点是?
(4)实验装置中冷凝管的作用是什么?
作业:完成课后巩固案
课后巩固案
1.(2024·湖北)关于物质的分离、提纯,下列说法错误的是( )
A.蒸馏法分离CH2Cl2和CCl4
B.过滤法分离苯酚和NaHCO3溶液
C.萃取和柱色谱法从青蒿中提取分离青蒿素
D.重结晶法提纯含有少量食盐和泥沙的苯甲酸
2.(2021·湖北)某兴趣小组为制备1-氯-2-甲基丙烷(沸点69 ℃),将2-甲基-1-丙醇和POCl3溶于CH2Cl2中,加热回流(伴有HCl气体产生)。反应完全后倒入冰水中分解残余的POCl3,分液收集CH2Cl2层,无水MgSO4干燥、过滤、蒸馏后得到目标产物。上述过程中涉及的装置或操作错误的是(夹持及加热装置略)( )
A B C D
3.(2023·福建)从苯甲醛和KOH溶液反应后的混合液中分离出苯甲醇和苯甲酸的过程如下:
已知甲基叔丁基醚的密度为0.74g·cm-。下列说法错误的是( )
A.“萃取”过程需振荡、放气、静置分层
B.“有机层”从分液漏斗上口倒出
C.“操作X”为蒸馏,“试剂Y”可选用盐酸
D.“洗涤”苯甲酸,用乙醇的效果比用蒸馏水好
4.(2022·江苏卷节选)实验室以二氧化铈Ce02废渣为原料制备Cl-含量少的,其部分实验过程如下:
(3)通过中和、萃取、反萃取、沉淀等过程,可制备含量少的。已知Ce3+能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
(水层)+3HA(有机层)Ce(A)3(有机层)+(水层)
①加氨水“中和”去除过量盐酸,使溶液接近中性。去除过量盐酸的目的是_______。
②反萃取的目的是将有机层Ce3+转移到水层。使Ce3+尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有_______(填两项)。
③与“反萃取”得到的水溶液比较,过滤溶液的滤液中,物质的量减小的离子有_______(填化学式)。
5. (2024·滨州二模)从阳极泥(主要成分有Cu、Fe3、Au、Ag2Se、Cu2S和NiSO4等)中回收Se和金属的部分工艺流程如图。
已知:
①该工艺中萃取原理为:(其中表示萃取剂,M2+表示金属离子)。
②S2O32-在碱性条件下很稳定,常温下可与Ag+络合: 。
回答下列问题:
(3)“滤液Ⅰ”中的阳离子主要有Cu2+、Ni2+,可使用萃取剂(RH)萃取分离。Cu2+和Ni2+的萃取率与水相初始PH、萃取剂浓度的关系如图。
则萃取Cu2+最佳的条件为_______和_______;“反萃取剂”最好选用_______(填化学式)。
该方法总反应的离子方程式为 ,该过程的催化剂有_______(填化学式)。
参考答案
课前预习
1.B
2.B
课堂探究案
1.√ × × × × × √
2.A
解析.A萃取振荡时,分液漏斗下口应向上倾斜, A 项错误;分液时,下层液体由下口放出,上层液体从上口倒出, B 项正确;分液后水相是含 Al 的溶液,为无色,若含有[ FeCl ,]则呈黄色, C 项正确;蒸馏时,为便于冷凝的乙醚流出,应选用直形冷凝管, D 项正确。故选 A 。
2 81.8% 6.4%
4.随水层pH增大,的浓度减小,的化学平衡向正反应方向移动,的化学平衡逆向移动,该平衡逆向移动引起浓度的增大,进一步促进萃取平衡向萃取方向移动,导致的浓度增大,因此,有机层中Fe元素含量迅速增多
5.“滤液1”中有Be2+和Al3+,加入含HA的煤油将Be2+萃取到有机相中,则水相1中含有Al3+,则向过量烧碱的溶液中逐滴加入少量水相1的溶液,可观察到的现象为:无明显现象。反萃取生成的化学方程式为 ,滤液2的主要成分为NaOH,可进入反萃取步骤再利用。
6.(1)乙醇易挥发,易燃 使用溶剂量少,可连续萃取(萃取效率高) (2)蒸馏乙醇沸点低,易浓缩 (3)蒸馏 (4)冷却挥发的乙醇
课后巩固案
1.B
解析:A.二氯甲烷和四氯化碳互溶,二者沸点不同,可以用蒸馏的方法将二者分离,A正确;
B.苯酚和碳酸氢钠都可以溶解在水中,不能用过滤的方法将二者分离,B错误;
C.将青蒿浸泡在有机溶剂中得到提取液,寻找合适的萃取剂可以利用萃取的方法将提取液中的青蒿素提取出来;也可以利用不同溶质在色谱柱上的保留时间不同将青蒿素固定在色谱柱上,在利用极性溶剂将青蒿素洗脱下来,得到纯净的青蒿素,C正确;
D.食盐和苯甲酸的溶解度二者差异较大,可以利用重结晶的方式将低温下溶解度较小的苯甲酸提纯出来,D正确;
2.B
解析:将2﹣甲基﹣1﹣丙醇和 POCl 溶于盛在三口烧瓶中的CH2Cl2中,搅拌、加热回流(反应装置中的球形冷凝管用于回流),制备产物, A 项正确;产生的 HCI 可用 NaOH 溶液吸收,但要防止倒吸,导气管不能直接插入 NaOH 溶液中, B 项错误;分 液收集CH2Cl2层需用到分液漏斗,振摇时需将分液漏斗倒转过来, C 项正确;蒸馏时 需要用温度计控制温度,冷凝水从下口进、上口出, D 项正确;故选 B 。
3.D
解析:根据萃取的具体操作,可知"萃取"过程需要振荡、放气、静置分层, A 项正确。萃取剂甲基叔丁基醚的密度为0.74g. cm -3,则有机层在上层,要从分液漏斗上口倒出, B 项正确。在萃取、分液后得到有机层和水层,水层用试剂 Y 调节 pH 后经结晶、过滤、洗涤、干燥得到苯甲酸,则有机层中含有甲醛和苯甲醇,二者可以通过蒸馏(“操作 X ”)分离;水层中含有苯甲酸钾和氢氧化钾,可用盐酸(“试剂 Y ”)调节 pH ,然后根据物质溶解度随温度变化的不同,经过一系列操作得到苯甲酸, C 项正确。苯甲酸溶于乙醇且可以和乙醇发生反应,则应用蒸馏水洗涤, D 项错误。
4. 降低溶液中氢离子的浓度,促进碳酸氢根离子的电离,增大溶液中碳酸根离子的浓度酸性条件,多次萃取
解析:①增大碳酸根离子的浓度有助于生成产物,故答案为:降低溶液中氢离子的浓度,促进碳酸氢根离子的电离,增大溶液中碳酸根离子的浓度;
②根据萃取原理可知,应选择的实验条件是酸性条件,为了使尽可能多地发生上述转移,可以采用多次萃取;
③“反萃取”得到的水溶液中含有浓度较大的,过滤后溶液中离子浓度较小,故答案为:;
5.pH 为6 萃取剂浓度为1% H2SO4
解析:据图可知,萃取Cu2+最佳的 pH 为6,最佳萃取剂浓度为1%,此时,Cu2+的萃取率较高,且和Ni2+的萃取率相差较大;"滤液 I "中主要含有Cu2+、Ni2+的硫酸盐,故"反萃取剂"最好选用H2SO4。
课前预习案
【学习目标】
1.通过对“海带提碘”知识的复习形成物质分离提纯的思路模型,能初步运用相关知
识解决生产和生活中的简单问题,发展科学探究意识、创新意识。
2.理解萃取反萃取的原理,掌握相应的实验操作方法,培养实验安全意识和环保意识。
一、教材原型 用反萃取法将碘单质从碘的四氯化碳溶液中提取出来
在“海带提碘”实验中,通常以四氯化碳为萃取剂对生成的碘单质进行萃取、富集。那么,如何使碘单质从碘的四氯化碳溶液中提取出来呢?要解决这一问题,可采用反萃取法(将富集在四氯化碳中的碘单质利用化学转化法重新富集在水中)。具体步骤如下:
【问题1】反萃取的第一步在什么仪器中进行?写出加入浓NaOH溶液和45%的H2SO4溶液后发生的离子方程式?
【问题2】已知I2的沸点184℃,45℃左右就开始缓慢升华,CCl4沸点77℃。
还可以用什么方法分离?反萃取法较蒸馏法的优点是什么?
真题再现 (2024·浙江1月)为回收利用含I2的CCl4废液,某化学兴趣小组设计方案如下所示,下列说法不正确的是( )
A.步骤Ⅰ中,加入足量Na2CO3溶液充分反应后,上下两层均为无色
B.步骤Ⅰ中,分液时从分液漏斗下口放出溶液A
C.试剂X可用硫酸
D.粗I2可用升华法进一步提纯
二、必备知识梳理
1.萃取
(1)利用物质在两种互不相溶的溶剂中的 不同,将物质从一种溶剂转 移到另一种溶剂的过程。如用四氯化碳(CCl4)或苯萃取碘水中的碘。四氯化碳密度比水 ,萃取后碘的四氯化碳溶液在 层(呈紫红色);苯密度比水 ,有机层在 层。
(2)萃取剂的选择条件
。
(3)实验操作步骤
加萃取剂---振荡萃取--静止分层--分液分离
2.反萃取:用反萃取剂使被萃取物从 返回水相的过程,为萃取的逆过 程。反萃取过程具有简单、便于操作和周期短的特点,是溶剂萃取分离工艺流程中的一个重要环节。反萃取时所使用的水相溶液称为反萃(取)剂。根据被萃取物的性质,反萃取剂可以分为以下几类:
(1)酸性反萃取剂:如硫酸(H2SO4)、硝酸(HNO3)、盐酸(HCl)等,可用于反萃取碱性物质。
(2)碱性反萃取剂:如氢氧化钠(NaOH)、碳酸钠(Na2CO3)等,可用于反萃取酸性物质。
(3)络合剂:如EDTA、杯笼试剂等,可用于反萃取金属离子。
(4)中性萃取剂:如醇类、酮类等,用于反萃取不与反萃取剂发生化学反应的物质。
三、萃取法 反萃取法分离
(1)已知萃取剂A、B中pH对钴离子、锰离子萃取率的影响如图所示,为了除去Mn2+,应选择萃取剂______________(填“A”或“B”)。
(2)近年来,随着锂离子电池的广泛应用,废锂离子电池的回收处理至关重要。利用废锂离子电池正极材料(有 Al 、LiCoO2、 Ni 、 Mn 、 Fe 等)回收钴、镍、锂。控制水相 pH =5.2,温度25℃,分别用P507、Cyanex272作萃取剂,萃取剂浓度对萃取分离钻、镍的影响实验结果如图所示。
思考:结合题目信息,尝试命制1-2个问题
课堂探究案
【学习目标】
1.通过对“海带提碘”知识的复习形成物质分离提纯的思路,能初步运用相关知识解决生产和生活中的简单问题,发展科学探究意识、创新意识。
2.理解萃取反萃取的原理,掌握相应的实验操作方法,培养实验安全意识和环保意识。
考点一 有关实验操作的考查
【真题研习·规律探寻】
1.(高考题改编重组)判断下列说法是否正确
(1)用NaOH溶液除去溴苯中的溴单质,可以用分液的方法( )
(2)从含有I2的NaCl固体中提取I2,用CCl4溶解、萃取、分液( )
(3)用花生油萃取溴水中的溴( )
(4)回收水溶液中的I2:加入乙酸,分液,蒸发( )
(5)分离饱和碳酸钠溶液和乙酸乙酯,将分层的液体依次从下口放出( )
(6)向某无色溶液中先加入少量新制氯水,再加入CCl4,振荡,下层溶液呈紫红色,原溶液中一定存在I-( )
【归纳总结】物质分离提纯的思路
2.(2020·山东)实验室分离Fe3+和Al3+的流程如下:
已知Fe3+在浓盐酸中生成黄色配离子[FeCl4]-,该配离子在乙醚(Et2O,沸点34.6 ℃)中生成缔合物Et2O·H+·[FeCl4]-。下列说法错误的是( )
A.萃取振荡时,分液漏斗下口应倾斜向下
B.分液时,应先将下层液体由分液漏斗下口放出
C.分液后水相为无色,说明已达到分离目的
D.蒸馏时选用直形冷凝管
【问题1】浓盐酸酸化的作用是什么,反萃取操作时可否加入NaOH溶液
【问题2】分液时,漏斗中的液体很难流出,可能原因是?
【问题3】怎样操作才能使Fe3+尽可能多地从水相转移至有机相?
3.(2025·日照一模节选)以赤泥熔炼渣(主要成分为Fe2O3、SiO2、 CaO ,少量Sc2O3)为原料分离稀土元素镜( Sc )的一种工艺流程如下:
已知:①萃取剂为磷酸三丁酯、磷酸二丁酯和磺化煤油;②Sc3+的氧化性很弱。回答下列问题:
(1)“反萃取”的目的是分离 Sc 和 Fe 元素。向“萃取液”中加入 NaOH ,Fe2+、Fe3+、Sc3+的沉淀率随 pH 的变化如图。试剂 X 为(填“Na2SO3”或“NaCIO ”),应调节 pH 最佳为 。
【归纳总结】常见的核心考点
考点二 在化工流程中的应用
【真题研习·规律探寻】
4.(2024·江苏)含Fe(OH)3滤渣用硫酸溶解,经萃取、反萃取提纯后,用于制备铁酸铋。
①用含有机胺(R3N)有机溶剂作为萃取剂提纯一定浓度的Fe2(SO4)3溶液,原理为:
(有机层)
已知:
其他条件不变,水层初始pH在0.2~0.8范围内,随水层pH增大,有机层中Fe元素含量迅速增多的原因是 。
5.(2024·湖北节选)铍用于宇航器件的构筑。一种从其铝硅酸盐[Be3Al2]中提取铍的路径为
已知:Be2++4HABeA2(HA)2+2H+ 回答下列问题:
(1)“萃取分液”的目的是分离Be2+和Al3+,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是 。
(2)写出反萃取生成Na2[Be(OH)4]的化学方程式 “滤液2”可以进入_______步骤再利用。
【变式】萃取分离Co2+、Al3+的实验操作:向萃取分液后的有机相中加稀硫酸调 pH =3~4, 液可得CoSO4溶液, 可得Al2(SO4)3溶液。
【归纳总结】核心考点
考点三 特殊实验装置的分析应用--索氏提取器
6.(2019·全国卷Ⅱ改编)咖啡因是一种生物碱(易溶于水及乙醇,熔点234.5 ℃,100 ℃以上开始升华),有兴奋大脑神经和利尿等作用。茶叶中含咖啡因约1%~5%、单宁酸(Ka约为10-6,易溶于水及乙醇)约3%~10%,还含有色素、纤维素等。实验室从茶叶中提取咖啡因的流程如图所示。
索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题。
(1)提取过程不可选用明火直接加热,原因是 。与常规的萃取相比,采用索氏提取器的优点是 。
(2)提取结束后,用什么方法回收萃取液中的溶剂?
(3)与水相比,乙醇作为萃取剂的优点是?
(4)实验装置中冷凝管的作用是什么?
作业:完成课后巩固案
课后巩固案
1.(2024·湖北)关于物质的分离、提纯,下列说法错误的是( )
A.蒸馏法分离CH2Cl2和CCl4
B.过滤法分离苯酚和NaHCO3溶液
C.萃取和柱色谱法从青蒿中提取分离青蒿素
D.重结晶法提纯含有少量食盐和泥沙的苯甲酸
2.(2021·湖北)某兴趣小组为制备1-氯-2-甲基丙烷(沸点69 ℃),将2-甲基-1-丙醇和POCl3溶于CH2Cl2中,加热回流(伴有HCl气体产生)。反应完全后倒入冰水中分解残余的POCl3,分液收集CH2Cl2层,无水MgSO4干燥、过滤、蒸馏后得到目标产物。上述过程中涉及的装置或操作错误的是(夹持及加热装置略)( )
A B C D
3.(2023·福建)从苯甲醛和KOH溶液反应后的混合液中分离出苯甲醇和苯甲酸的过程如下:
已知甲基叔丁基醚的密度为0.74g·cm-。下列说法错误的是( )
A.“萃取”过程需振荡、放气、静置分层
B.“有机层”从分液漏斗上口倒出
C.“操作X”为蒸馏,“试剂Y”可选用盐酸
D.“洗涤”苯甲酸,用乙醇的效果比用蒸馏水好
4.(2022·江苏卷节选)实验室以二氧化铈Ce02废渣为原料制备Cl-含量少的,其部分实验过程如下:
(3)通过中和、萃取、反萃取、沉淀等过程,可制备含量少的。已知Ce3+能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
(水层)+3HA(有机层)Ce(A)3(有机层)+(水层)
①加氨水“中和”去除过量盐酸,使溶液接近中性。去除过量盐酸的目的是_______。
②反萃取的目的是将有机层Ce3+转移到水层。使Ce3+尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有_______(填两项)。
③与“反萃取”得到的水溶液比较,过滤溶液的滤液中,物质的量减小的离子有_______(填化学式)。
5. (2024·滨州二模)从阳极泥(主要成分有Cu、Fe3、Au、Ag2Se、Cu2S和NiSO4等)中回收Se和金属的部分工艺流程如图。
已知:
①该工艺中萃取原理为:(其中表示萃取剂,M2+表示金属离子)。
②S2O32-在碱性条件下很稳定,常温下可与Ag+络合: 。
回答下列问题:
(3)“滤液Ⅰ”中的阳离子主要有Cu2+、Ni2+,可使用萃取剂(RH)萃取分离。Cu2+和Ni2+的萃取率与水相初始PH、萃取剂浓度的关系如图。
则萃取Cu2+最佳的条件为_______和_______;“反萃取剂”最好选用_______(填化学式)。
该方法总反应的离子方程式为 ,该过程的催化剂有_______(填化学式)。
参考答案
课前预习
1.B
2.B
课堂探究案
1.√ × × × × × √
2.A
解析.A萃取振荡时,分液漏斗下口应向上倾斜, A 项错误;分液时,下层液体由下口放出,上层液体从上口倒出, B 项正确;分液后水相是含 Al 的溶液,为无色,若含有[ FeCl ,]则呈黄色, C 项正确;蒸馏时,为便于冷凝的乙醚流出,应选用直形冷凝管, D 项正确。故选 A 。
2 81.8% 6.4%
4.随水层pH增大,的浓度减小,的化学平衡向正反应方向移动,的化学平衡逆向移动,该平衡逆向移动引起浓度的增大,进一步促进萃取平衡向萃取方向移动,导致的浓度增大,因此,有机层中Fe元素含量迅速增多
5.“滤液1”中有Be2+和Al3+,加入含HA的煤油将Be2+萃取到有机相中,则水相1中含有Al3+,则向过量烧碱的溶液中逐滴加入少量水相1的溶液,可观察到的现象为:无明显现象。反萃取生成的化学方程式为 ,滤液2的主要成分为NaOH,可进入反萃取步骤再利用。
6.(1)乙醇易挥发,易燃 使用溶剂量少,可连续萃取(萃取效率高) (2)蒸馏乙醇沸点低,易浓缩 (3)蒸馏 (4)冷却挥发的乙醇
课后巩固案
1.B
解析:A.二氯甲烷和四氯化碳互溶,二者沸点不同,可以用蒸馏的方法将二者分离,A正确;
B.苯酚和碳酸氢钠都可以溶解在水中,不能用过滤的方法将二者分离,B错误;
C.将青蒿浸泡在有机溶剂中得到提取液,寻找合适的萃取剂可以利用萃取的方法将提取液中的青蒿素提取出来;也可以利用不同溶质在色谱柱上的保留时间不同将青蒿素固定在色谱柱上,在利用极性溶剂将青蒿素洗脱下来,得到纯净的青蒿素,C正确;
D.食盐和苯甲酸的溶解度二者差异较大,可以利用重结晶的方式将低温下溶解度较小的苯甲酸提纯出来,D正确;
2.B
解析:将2﹣甲基﹣1﹣丙醇和 POCl 溶于盛在三口烧瓶中的CH2Cl2中,搅拌、加热回流(反应装置中的球形冷凝管用于回流),制备产物, A 项正确;产生的 HCI 可用 NaOH 溶液吸收,但要防止倒吸,导气管不能直接插入 NaOH 溶液中, B 项错误;分 液收集CH2Cl2层需用到分液漏斗,振摇时需将分液漏斗倒转过来, C 项正确;蒸馏时 需要用温度计控制温度,冷凝水从下口进、上口出, D 项正确;故选 B 。
3.D
解析:根据萃取的具体操作,可知"萃取"过程需要振荡、放气、静置分层, A 项正确。萃取剂甲基叔丁基醚的密度为0.74g. cm -3,则有机层在上层,要从分液漏斗上口倒出, B 项正确。在萃取、分液后得到有机层和水层,水层用试剂 Y 调节 pH 后经结晶、过滤、洗涤、干燥得到苯甲酸,则有机层中含有甲醛和苯甲醇,二者可以通过蒸馏(“操作 X ”)分离;水层中含有苯甲酸钾和氢氧化钾,可用盐酸(“试剂 Y ”)调节 pH ,然后根据物质溶解度随温度变化的不同,经过一系列操作得到苯甲酸, C 项正确。苯甲酸溶于乙醇且可以和乙醇发生反应,则应用蒸馏水洗涤, D 项错误。
4. 降低溶液中氢离子的浓度,促进碳酸氢根离子的电离,增大溶液中碳酸根离子的浓度酸性条件,多次萃取
解析:①增大碳酸根离子的浓度有助于生成产物,故答案为:降低溶液中氢离子的浓度,促进碳酸氢根离子的电离,增大溶液中碳酸根离子的浓度;
②根据萃取原理可知,应选择的实验条件是酸性条件,为了使尽可能多地发生上述转移,可以采用多次萃取;
③“反萃取”得到的水溶液中含有浓度较大的,过滤后溶液中离子浓度较小,故答案为:;
5.pH 为6 萃取剂浓度为1% H2SO4
解析:据图可知,萃取Cu2+最佳的 pH 为6,最佳萃取剂浓度为1%,此时,Cu2+的萃取率较高,且和Ni2+的萃取率相差较大;"滤液 I "中主要含有Cu2+、Ni2+的硫酸盐,故"反萃取剂"最好选用H2SO4。
同课章节目录
