2.2.1 醇 课件(共26张PPT)
文档属性
| 名称 | 2.2.1 醇 课件(共26张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-22 18:06:54 | ||
图片预览






文档简介
(共26张PPT)
第2章官能团与有机化学反应 烃的衍生物
第2节醇和酚
第1课时 醇及其性质
1、能根据分子组成和结构特点区分醇、酚和醚,
2、了解醇的分类方法,能认识到羟基数量的多少、烃基的大小对醇类熔沸点、溶解性等物理性质的影响。
3、了解醇的物理性质、用途和一些常见的醇,能够用系统命名法对简单的醇进行命名。
4、能基于官能团、化学键的特点分析和推断醇的化学性质。
1.能基于官能团、化学键的特点分析和推断醇的化学性质。能描述和分
析醇的重要反应,能书写相应的反应方程式。(宏观辨识与微观探析)
2. 能利用电负性的有关知识,分析醇分子中各种化学键的极性,判断碳氧键和氢氧键均属于强极性键,从而进一步推断出醇在一定条件下断键的位置,归纳出醇类可能发生的化学反应。(证据推理与模型认知)
3、能举例说明醇的反应机理(断键和成键规律),并且会设计醇到烯烃、卤代烃、醛、酮、酯的转化路线。(科学探究与创新意识)
消毒剂(75%的乙醇溶液)
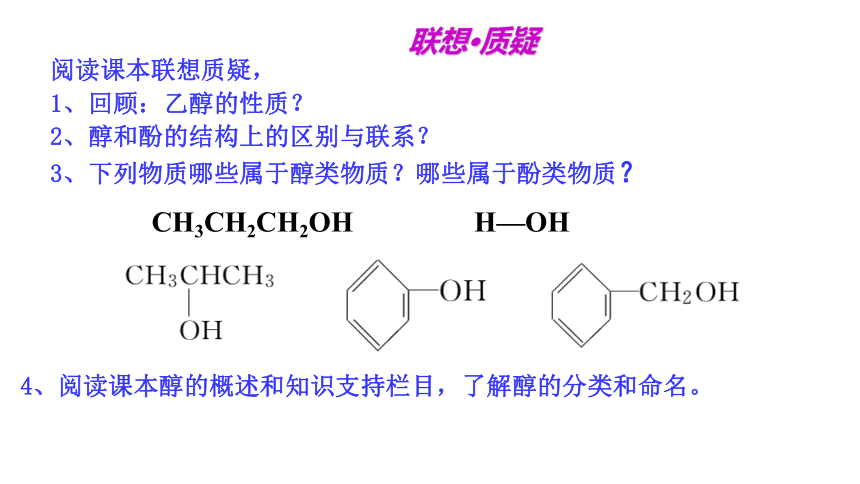
联想 质疑
阅读课本联想质疑,
1、回顾:乙醇的性质?
2、醇和酚的结构上的区别与联系?
3、下列物质哪些属于醇类物质?哪些属于酚类物质?
4、阅读课本醇的概述和知识支持栏目,了解醇的分类和命名。
CH3CH2CH2OH H—OH
一、醇的概述
1、醇及醇的用途
⑵醇的官能团:
名称:羟基 结构简式:—OH 电子式:
⑷醇的用途:
生产、生活中有重要应用,如用作溶剂、燃料、消毒剂及有机合成原料。
⑶饱和一元醇的通式:CnH2n+1OH(或CnH2n+2O)
⑴定义:脂肪烃烃分子中的氢原子或芳香烃侧链上的氢原子被羟基取代后的有机化合物称为醇。
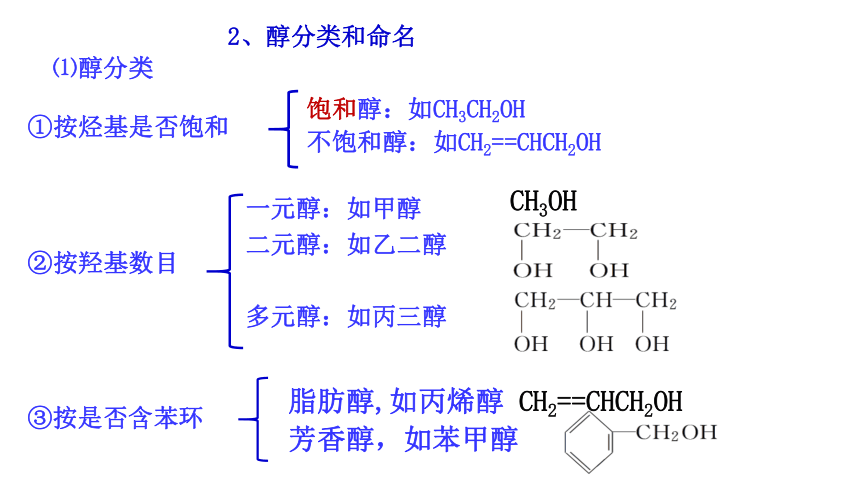
2、醇分类和命名
①按烃基是否饱和
饱和醇:如CH3CH2OH
不饱和醇:如CH2==CHCH2OH
⑴醇分类
一元醇:如甲醇
二元醇:如乙二醇
多元醇:如丙三醇
②按羟基数目
CH3OH
③按是否含苯环
脂肪醇,如丙烯醇 CH2==CHCH2OH
芳香醇,如苯甲醇
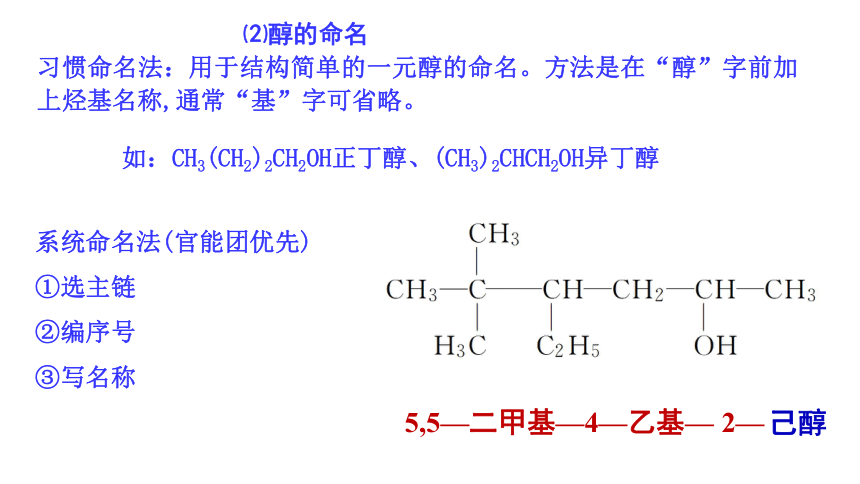
习惯命名法:用于结构简单的一元醇的命名。方法是在“醇”字前加上烃基名称,通常“基”字可省略。
系统命名法(官能团优先)
①选主链
②编序号
③写名称
⑵醇的命名
己醇
5,5—二甲基—4—乙基—
2—
如:CH3(CH2)2CH2OH正丁醇、(CH3)2CHCH2OH异丁醇
阅读课本,1、了解常见的醇的物理性质。
2、了解醇的熔沸点与水溶性的变化规律及的原因解释?
名称 俗名 色、味、态 毒性 水溶性 用途
甲醇 木醇 互溶 燃料、化工原料
乙二醇 甘醇 互溶 防冻剂、合成涤纶
丙三醇 甘油 互溶 制日用化妆品、制硝化甘油
3.三种重要的醇
无色、特殊气味、易挥发有毒液体
无毒
无毒
有毒
无色、无臭、具有甜味、黏稠液体
无色、无臭、具有甜味、黏稠液体
(2)溶解性
①碳原子数为1~3的饱和一元醇和多元醇能与水以任意比例互溶。碳原子数为4~11的饱和一元醇为油状液体,仅可部分溶于水。碳原子数目更多的高级醇为固体,不溶于水。
②含羟基较多的醇易溶于水。
4、物理性质
(1)沸点
①相对分子质量接近的饱和一元醇和烷烃或烯烃相比,饱和一
元醇的沸点远远高于烷烃或烯烃。
②饱和一元醇,随分子中碳原子数的增加沸点逐渐升高。
③碳原子数相同时,羟基个数越多,沸点越高。
⑷芳香醇的同分异构体:
5、醇的同分异构现象
⑵位置异构:
⑴碳链异构:
⑶类别异构(醇醚和酚):
CH3CH2CH2CH2OH和
CH3CH2CH2OH和
CH3CH2OH和CH3—O—CH3
(2)由于醇分子中羟基上氧原子的强吸电子作用,使α-H和β-H都较为活
泼。
阅读课本交流研讨栏目,分析醇分子的结构特点,并完成课本问
题。
(1)氧元素的电负性比氢元素和碳元素的电负性都大,醇分子中羟基上的
氧原子对共用电子的吸引能力强,共用电子偏向氧原子,从而使碳氧键和氢氧键都显出极性,容易断裂。
交流 研讨
①②:分子间脱水
断键部位和发生的反应:
①:醇和活泼金属的反应
醇和羧酸的酯化反应
②:和氢卤酸的取代反应
①③:催化氧化反应
②④:消去反应
⑴羟基的反应
⑵羟基中氢的反应
⑶醇的氧化
阅读课本,总结醇的化学性质。
二、醇的化学性质
①醇和氢卤酸的反应
CH3CH2—OH+H—Br CH3CH2Br+H2O
②醇分子间脱水生成醚
练习⑴写出2-丙醇、3-甲基-2-丁醇和氢溴酸反应。
③醇的消去反应
2CH3CH2OH CH3CH2OCH2CH3+H2O
练习⑵写出甲醇和乙醇、2-丙醇和3-甲基-2-丁醇在浓硫酸、140℃条件下的
反应。
1、羟基的反应
练习⑶发生消去反应的醇的结构特点是什么?
⑷写出2-丁醇、3-甲基-2-丁醇分别在浓硫酸、170℃条件下的的反应方程式。
2、羟基中氢的反应
④醇和金属的反应
⑤醇和羧酸的酯化反应
思考:⑸和金属钠与水的反应相比较,乙醇与水的反应现象有何异同?
为什么?
⑹写出2-丙醇、3-甲基-2-丁醇和金属钠的反应。
思考:⑺试写出2-丙醇和甲酸、苯甲酸和苯甲醇反应生成相应的酯的方程式,并分析断键和成键部位;试写出丙三醇和硝酸形成酯的方程式。
练习:⑻发生催化氧化反应的醇的结构特点是什么?
实验现象:红色的铜丝,火焰灼烧变黑,迅速伸入乙醇中,铜丝由黑色变红色,同时产生刺激性气味。
3、醇的氧化
⑥醇的催化氧化
⑼写出1-丙醇、2-丙醇催化氧化的反应方程式。
实验:把铜丝在酒精灯上加热,然后将红热的铜丝插入到乙醇中,反复数次。
4、醇的氧化
乙醇可以被酸性高锰酸钾(KMnO4)溶液氧化为乙酸,因而可以使酸性高锰酸钾溶液褪色。同时乙醇还可以被酸性K2Cr2O7溶液氧化,后者常被用于检查酒驾。
乙醇的燃烧也是氧化反应,所以乙醇可用作燃料。
⑦醇被其他强氧化剂氧化
⑧醇的燃烧反应
醇的转化
⑤
①
②
③
④
⑦
⑥
1、下列物质中既属于芳香化合物又属于醇的是( )
A. B.
C. D.CH3CH2OH
B
2、下列说法正确的是( )
A. 的名称为2-甲基-2-丙醇
B. 的名称为2-甲基-3,6-己二醇
C.
的名称为4-甲基-3,4-己二醇
D. 的名称为3,6-二己基-1-庚醇
A
3、分子式为C5H12O的醇类物质的同分异构体有 ( )
A.6种 B.7种 C.8种 D.9种
C
⑶位置异构:
⑵碳链异构:
⑴类别异构(醇、醚和酚):
1
2
3
4
1
2
3
1
4、乙醇、乙二醇(HOCH2CH2OH)、甘油(丙三醇:HOCH2CHOHCH2OH)分别与
足量金属钠作用,产生等量的氢气,则三种醇的物质的量之比为( )
A.6∶3∶2 B.1∶2∶3 C.3∶2∶1 D.4∶3∶2
A
5、丙烯醇(CH2==CH—CH2OH)可发生的化学反应有( )
①加成 ②氧化 ③燃烧 ④加聚 ⑤取代
A.①②③ B.①②③④
C.①②③④⑤ D.①③④
C
6、下列醇既能被催化氧化生成醛,又能发生消去反应生成烯烃的
是( )
A.CH3OH B.
C. D.
D
7、以下是丁醇的四种同分异构体:
A.CH3CH2CH2CH2—OH B.
C. D.
请根据乙醇在消去反应、催化氧化反应中变化的结构特点,回答以下问题(以下各问只需填写字母):
(1)在消去反应中能够得到两种消去产物的结构有____。
(2)只得到一种消去产物的结构是_________。
(3)能被氧化为含相同碳原子数的醛的结构是_______。
(4)不能被灼热的CuO氧化的醇的结构是____。
B
A、C、D
A、C
D
第2章官能团与有机化学反应 烃的衍生物
第2节醇和酚
第1课时 醇及其性质
1、能根据分子组成和结构特点区分醇、酚和醚,
2、了解醇的分类方法,能认识到羟基数量的多少、烃基的大小对醇类熔沸点、溶解性等物理性质的影响。
3、了解醇的物理性质、用途和一些常见的醇,能够用系统命名法对简单的醇进行命名。
4、能基于官能团、化学键的特点分析和推断醇的化学性质。
1.能基于官能团、化学键的特点分析和推断醇的化学性质。能描述和分
析醇的重要反应,能书写相应的反应方程式。(宏观辨识与微观探析)
2. 能利用电负性的有关知识,分析醇分子中各种化学键的极性,判断碳氧键和氢氧键均属于强极性键,从而进一步推断出醇在一定条件下断键的位置,归纳出醇类可能发生的化学反应。(证据推理与模型认知)
3、能举例说明醇的反应机理(断键和成键规律),并且会设计醇到烯烃、卤代烃、醛、酮、酯的转化路线。(科学探究与创新意识)
消毒剂(75%的乙醇溶液)
联想 质疑
阅读课本联想质疑,
1、回顾:乙醇的性质?
2、醇和酚的结构上的区别与联系?
3、下列物质哪些属于醇类物质?哪些属于酚类物质?
4、阅读课本醇的概述和知识支持栏目,了解醇的分类和命名。
CH3CH2CH2OH H—OH
一、醇的概述
1、醇及醇的用途
⑵醇的官能团:
名称:羟基 结构简式:—OH 电子式:
⑷醇的用途:
生产、生活中有重要应用,如用作溶剂、燃料、消毒剂及有机合成原料。
⑶饱和一元醇的通式:CnH2n+1OH(或CnH2n+2O)
⑴定义:脂肪烃烃分子中的氢原子或芳香烃侧链上的氢原子被羟基取代后的有机化合物称为醇。
2、醇分类和命名
①按烃基是否饱和
饱和醇:如CH3CH2OH
不饱和醇:如CH2==CHCH2OH
⑴醇分类
一元醇:如甲醇
二元醇:如乙二醇
多元醇:如丙三醇
②按羟基数目
CH3OH
③按是否含苯环
脂肪醇,如丙烯醇 CH2==CHCH2OH
芳香醇,如苯甲醇
习惯命名法:用于结构简单的一元醇的命名。方法是在“醇”字前加上烃基名称,通常“基”字可省略。
系统命名法(官能团优先)
①选主链
②编序号
③写名称
⑵醇的命名
己醇
5,5—二甲基—4—乙基—
2—
如:CH3(CH2)2CH2OH正丁醇、(CH3)2CHCH2OH异丁醇
阅读课本,1、了解常见的醇的物理性质。
2、了解醇的熔沸点与水溶性的变化规律及的原因解释?
名称 俗名 色、味、态 毒性 水溶性 用途
甲醇 木醇 互溶 燃料、化工原料
乙二醇 甘醇 互溶 防冻剂、合成涤纶
丙三醇 甘油 互溶 制日用化妆品、制硝化甘油
3.三种重要的醇
无色、特殊气味、易挥发有毒液体
无毒
无毒
有毒
无色、无臭、具有甜味、黏稠液体
无色、无臭、具有甜味、黏稠液体
(2)溶解性
①碳原子数为1~3的饱和一元醇和多元醇能与水以任意比例互溶。碳原子数为4~11的饱和一元醇为油状液体,仅可部分溶于水。碳原子数目更多的高级醇为固体,不溶于水。
②含羟基较多的醇易溶于水。
4、物理性质
(1)沸点
①相对分子质量接近的饱和一元醇和烷烃或烯烃相比,饱和一
元醇的沸点远远高于烷烃或烯烃。
②饱和一元醇,随分子中碳原子数的增加沸点逐渐升高。
③碳原子数相同时,羟基个数越多,沸点越高。
⑷芳香醇的同分异构体:
5、醇的同分异构现象
⑵位置异构:
⑴碳链异构:
⑶类别异构(醇醚和酚):
CH3CH2CH2CH2OH和
CH3CH2CH2OH和
CH3CH2OH和CH3—O—CH3
(2)由于醇分子中羟基上氧原子的强吸电子作用,使α-H和β-H都较为活
泼。
阅读课本交流研讨栏目,分析醇分子的结构特点,并完成课本问
题。
(1)氧元素的电负性比氢元素和碳元素的电负性都大,醇分子中羟基上的
氧原子对共用电子的吸引能力强,共用电子偏向氧原子,从而使碳氧键和氢氧键都显出极性,容易断裂。
交流 研讨
①②:分子间脱水
断键部位和发生的反应:
①:醇和活泼金属的反应
醇和羧酸的酯化反应
②:和氢卤酸的取代反应
①③:催化氧化反应
②④:消去反应
⑴羟基的反应
⑵羟基中氢的反应
⑶醇的氧化
阅读课本,总结醇的化学性质。
二、醇的化学性质
①醇和氢卤酸的反应
CH3CH2—OH+H—Br CH3CH2Br+H2O
②醇分子间脱水生成醚
练习⑴写出2-丙醇、3-甲基-2-丁醇和氢溴酸反应。
③醇的消去反应
2CH3CH2OH CH3CH2OCH2CH3+H2O
练习⑵写出甲醇和乙醇、2-丙醇和3-甲基-2-丁醇在浓硫酸、140℃条件下的
反应。
1、羟基的反应
练习⑶发生消去反应的醇的结构特点是什么?
⑷写出2-丁醇、3-甲基-2-丁醇分别在浓硫酸、170℃条件下的的反应方程式。
2、羟基中氢的反应
④醇和金属的反应
⑤醇和羧酸的酯化反应
思考:⑸和金属钠与水的反应相比较,乙醇与水的反应现象有何异同?
为什么?
⑹写出2-丙醇、3-甲基-2-丁醇和金属钠的反应。
思考:⑺试写出2-丙醇和甲酸、苯甲酸和苯甲醇反应生成相应的酯的方程式,并分析断键和成键部位;试写出丙三醇和硝酸形成酯的方程式。
练习:⑻发生催化氧化反应的醇的结构特点是什么?
实验现象:红色的铜丝,火焰灼烧变黑,迅速伸入乙醇中,铜丝由黑色变红色,同时产生刺激性气味。
3、醇的氧化
⑥醇的催化氧化
⑼写出1-丙醇、2-丙醇催化氧化的反应方程式。
实验:把铜丝在酒精灯上加热,然后将红热的铜丝插入到乙醇中,反复数次。
4、醇的氧化
乙醇可以被酸性高锰酸钾(KMnO4)溶液氧化为乙酸,因而可以使酸性高锰酸钾溶液褪色。同时乙醇还可以被酸性K2Cr2O7溶液氧化,后者常被用于检查酒驾。
乙醇的燃烧也是氧化反应,所以乙醇可用作燃料。
⑦醇被其他强氧化剂氧化
⑧醇的燃烧反应
醇的转化
⑤
①
②
③
④
⑦
⑥
1、下列物质中既属于芳香化合物又属于醇的是( )
A. B.
C. D.CH3CH2OH
B
2、下列说法正确的是( )
A. 的名称为2-甲基-2-丙醇
B. 的名称为2-甲基-3,6-己二醇
C.
的名称为4-甲基-3,4-己二醇
D. 的名称为3,6-二己基-1-庚醇
A
3、分子式为C5H12O的醇类物质的同分异构体有 ( )
A.6种 B.7种 C.8种 D.9种
C
⑶位置异构:
⑵碳链异构:
⑴类别异构(醇、醚和酚):
1
2
3
4
1
2
3
1
4、乙醇、乙二醇(HOCH2CH2OH)、甘油(丙三醇:HOCH2CHOHCH2OH)分别与
足量金属钠作用,产生等量的氢气,则三种醇的物质的量之比为( )
A.6∶3∶2 B.1∶2∶3 C.3∶2∶1 D.4∶3∶2
A
5、丙烯醇(CH2==CH—CH2OH)可发生的化学反应有( )
①加成 ②氧化 ③燃烧 ④加聚 ⑤取代
A.①②③ B.①②③④
C.①②③④⑤ D.①③④
C
6、下列醇既能被催化氧化生成醛,又能发生消去反应生成烯烃的
是( )
A.CH3OH B.
C. D.
D
7、以下是丁醇的四种同分异构体:
A.CH3CH2CH2CH2—OH B.
C. D.
请根据乙醇在消去反应、催化氧化反应中变化的结构特点,回答以下问题(以下各问只需填写字母):
(1)在消去反应中能够得到两种消去产物的结构有____。
(2)只得到一种消去产物的结构是_________。
(3)能被氧化为含相同碳原子数的醛的结构是_______。
(4)不能被灼热的CuO氧化的醇的结构是____。
B
A、C、D
A、C
D
