高考特训7 常见过渡金属及其化合物(含答案)2026届高三化学一轮大单元复习
文档属性
| 名称 | 高考特训7 常见过渡金属及其化合物(含答案)2026届高三化学一轮大单元复习 |

|
|
| 格式 | DOC | ||
| 文件大小 | 527.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-22 00:00:00 | ||
图片预览


文档简介
高考特训7 常见过渡金属及其化合物
1. (2023·无锡)鞣革废水中含大量的Cr(Ⅵ)对环境有污染,工业上可以用还原法处理。
Ⅰ. 还原沉淀法
(1) Cr(Ⅵ)在水溶液中有H2CrO4、HCrO、CrO和Cr2O四种存在形式(H2CrO4是二元弱酸),HCrO部分转化为Cr2O的离子方程式为_____________________________________________。
(2) 在pH=2的废水中,Cr(Ⅵ)主要以HCrO和Cr2O的形式存在,选用还原剂FeSO4处理此废水,生成Fe3Cr(OH)12沉淀,Fe2+还原Cr2O时,二者物质的量之比为___________。实际投入FeSO4的量需大于上述计算值的可能原因是___________________________________________________________________ ____________________________________________________________________________________________________________________________。
Ⅱ. 还原吸附法
(3) 纳米磁性Fe3O4的制备
以FeSO4和Fe2(SO4)3为原料,在氨水存在的条件下反应可生成纳米磁性Fe3O4,发生反应的化学方程式为________________________________________________________________________________________ ________________________________________________________。
(4) 纳米磁性Fe3O4的修饰
某研究小组经查阅资料,发现纳米磁性Fe3O4颗粒粒径小,比表面积大,但极易发生团聚。在纳米磁性Fe3O4颗粒表面修饰SiO2(记作Fe3O4@SiO2),可优化纳米磁性Fe3O4降解废水中Cr2O的性能,其原因是_________________________________________________________________________________________ ________________________________________________________________________________________________________________。
(5) Fe3O4@SiO2-GO还原吸附
氧化石墨烯(记作GO)表面含有—COOH等含氧官能团,将氧化石墨烯嫁接在Fe3O4@SiO2的表面得到Fe3O4@SiO2-GO,其去除废水中Cr(Ⅵ)的过程如下:
―→―→―→―→―→
“吸附”过程中,氧化石墨烯表面带电微粒与Cr3+之间的静电作用是实现“吸附”的重要因素,溶液中Cr3+去除率随pH变化如图所示。
① pH较小时,Cr3+去除率较低的原因是___________________________________________________ ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
② 实际除Cr3+时,控制pH约为6,而不选择更高pH的原因是___________________________________ ___________________________________________________________________________________________________________________________________________。
2. (2023·淮阴、姜堰、徐州一中联考)锌是一种重要的金属,一种以固体废锌催化剂(主要成分为ZnO,含少量Fe2O3、CuO、SiO2)为原料制备锌的工艺流程如图所示:
已知:① 25 ℃时,Ksp(CuS)=6.4×10-36,Ksp(ZnS)=1.6×10-24;
② 25 ℃时,Zn2++4NH3??[Zn(NH3)4]2+,K=5.0×108;
③深度除铜标准:溶液中铜锌比 ≤2.0×10-6。
(1) “浸取”时,ZnO、 CuO转化为[Zn(NH3)4]2+、[Cu(NH3)4]2+进入溶液。
① ZnO发生反应的离子方程式为____________________________________________________________ ______________________________________________________________________________________________________________________________________________。
② 浸取温度应控制在 30 ℃左右,其原因为_________________________________________________ ____________________________________________。
(2) “深度除铜”时,锌的回收率、除铜效果与(NH4)2S加入量的关系曲线如图所示。
① 当(NH4)2S加入量≥100%时,会发生反应[Zn(NH3)4]2++S2-===ZnS↓+4NH3导致锌的回收率下降,该反应的平衡常数数值为________________________。
② “深度除铜”时,(NH4)2S较为合理的加入量约为120%,理由是___________________________ ___________________________________________________________________________________________________________________________________________________________________________。
(3) 通过“萃取”“反萃取”可以获得酸性ZnSO4溶液,为提高锌的回收率,萃取时可以采取的措施为______________________________________________________。
(4) “电解”时采用Al为阴极,惰性电极为阳极,电解过程中发现当阳极产生1 mol O2时,阴极析出的Zn 小于2 mol,其可能的原因是_____________________。
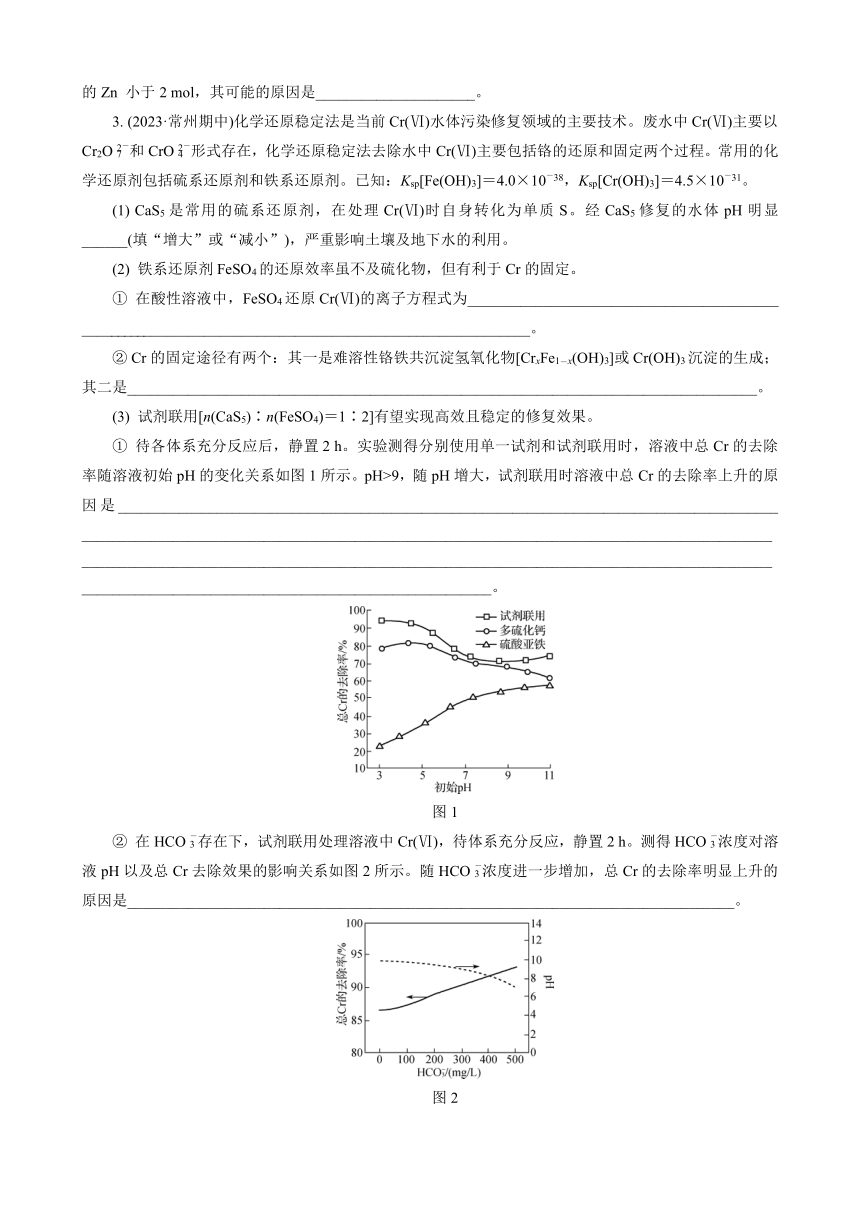
3. (2023·常州期中)化学还原稳定法是当前Cr(Ⅵ)水体污染修复领域的主要技术。废水中Cr(Ⅵ)主要以Cr2O和CrO形式存在,化学还原稳定法去除水中Cr(Ⅵ)主要包括铬的还原和固定两个过程。常用的化学还原剂包括硫系还原剂和铁系还原剂。已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=4.5×10-31。
(1) CaS5是常用的硫系还原剂,在处理Cr(Ⅵ)时自身转化为单质S。经CaS5修复的水体pH明显______(填“增大”或“减小”),严重影响土壤及地下水的利用。
(2) 铁系还原剂FeSO4的还原效率虽不及硫化物,但有利于Cr的固定。
① 在酸性溶液中,FeSO4还原Cr(Ⅵ)的离子方程式为_________________________________________ ____________________________________________________________。
② Cr的固定途径有两个:其一是难溶性铬铁共沉淀氢氧化物[CrxFe1-x(OH)3]或Cr(OH)3沉淀的生成;其二是___________________________________________________________________________________。
(3) 试剂联用[n(CaS5)∶n(FeSO4)=1∶2]有望实现高效且稳定的修复效果。
① 待各体系充分反应后,静置2 h。实验测得分别使用单一试剂和试剂联用时,溶液中总Cr的去除率随溶液初始pH的变化关系如图1所示。pH>9,随pH增大,试剂联用时溶液中总Cr的去除率上升的原因是_______________________________________________________________________________________ ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
图1
② 在HCO存在下,试剂联用处理溶液中Cr(Ⅵ),待体系充分反应,静置2 h。测得HCO浓度对溶液pH以及总Cr去除效果的影响关系如图2所示。随HCO浓度进一步增加,总Cr的去除率明显上升的原因是________________________________________________________________________________。
图2
③ 研究表明,试剂联用效果优于单一试剂主要是由于反应过程中生成了起催化作用的FeS。FeS的生成过程可用化学方程式表示为______________________________________________________________。
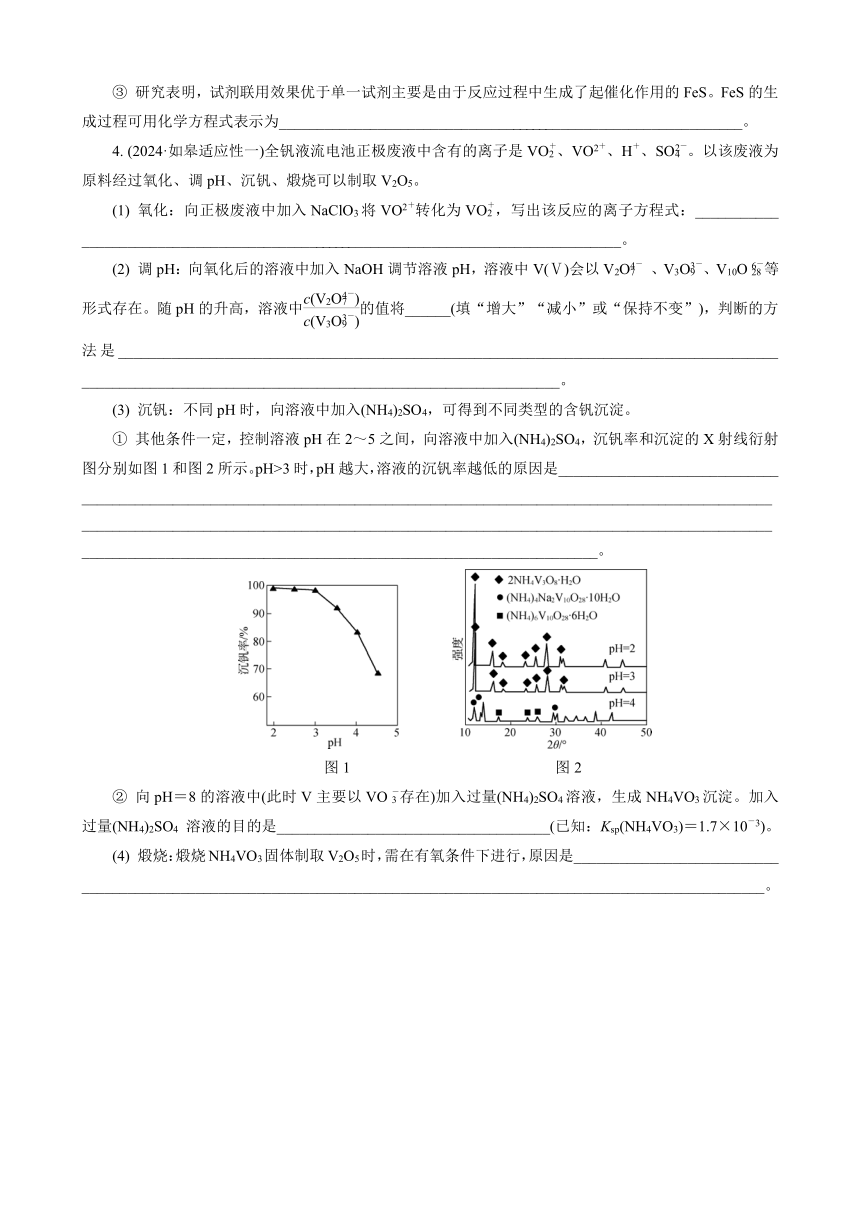
4. (2024·如皋适应性一)全钒液流电池正极废液中含有的离子是VO、VO2+、H+、SO。以该废液为原料经过氧化、调pH、沉钒、煅烧可以制取V2O5。
(1) 氧化:向正极废液中加入NaClO3将VO2+转化为VO,写出该反应的离子方程式:___________ ________________________________________________________________________。
(2) 调pH:向氧化后的溶液中加入NaOH调节溶液pH,溶液中V(Ⅴ)会以V2O 、V3O、V10O等形式存在。随pH的升高,溶液中的值将______(填“增大”“减小”或“保持不变”),判断的方法是_______________________________________________________________________________________ _______________________________________________________________。
(3) 沉钒:不同pH时,向溶液中加入(NH4)2SO4,可得到不同类型的含钒沉淀。
① 其他条件一定,控制溶液pH在2~5之间,向溶液中加入(NH4)2SO4,沉钒率和沉淀的X射线衍射图分别如图1和图2所示。pH>3时,pH越大,溶液的沉钒率越低的原因是_____________________________ __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
图1 图2
② 向pH=8的溶液中(此时V主要以VO存在)加入过量(NH4)2SO4溶液,生成NH4VO3沉淀。加入过量(NH4)2SO4 溶液的目的是____________________________________(已知:Ksp(NH4VO3)=1.7×10-3)。
(4) 煅烧:煅烧NH4VO3固体制取V2O5时,需在有氧条件下进行,原因是___________________________ __________________________________________________________________________________________。
高考特训7 常见过渡金属及其化合物
1. (2023·无锡)鞣革废水中含大量的Cr(Ⅵ)对环境有污染,工业上可以用还原法处理。
Ⅰ. 还原沉淀法
(1) Cr(Ⅵ)在水溶液中有H2CrO4、HCrO、CrO和Cr2O四种存在形式(H2CrO4是二元弱酸),HCrO部分转化为Cr2O的离子方程式为2HCrO??Cr2O+H2O。
(2) 在pH=2的废水中,Cr(Ⅵ)主要以HCrO和Cr2O的形式存在,选用还原剂FeSO4处理此废水,生成Fe3Cr(OH)12沉淀,Fe2+还原Cr2O时,二者物质的量之比为6∶1。实际投入FeSO4的量需大于上述计算值的可能原因是Fe2+被O2氧化;随着Cr2O的消耗,HCrO(或CrO)不断转化为Cr2O(或Fe2+被O2氧化;HCrO也能氧化Fe2+)。
Ⅱ. 还原吸附法
(3) 纳米磁性Fe3O4的制备
以FeSO4和Fe2(SO4)3为原料,在氨水存在的条件下反应可生成纳米磁性Fe3O4,发生反应的化学方程式为FeSO4+Fe2(SO4)3+8NH3·H2O===Fe3O4+4(NH4)2SO4+4H2O。
(4) 纳米磁性Fe3O4的修饰
某研究小组经查阅资料,发现纳米磁性Fe3O4颗粒粒径小,比表面积大,但极易发生团聚。在纳米磁性Fe3O4颗粒表面修饰SiO2(记作Fe3O4@SiO2),可优化纳米磁性Fe3O4降解废水中Cr2O的性能,其原因是纳米Fe3O4有磁性,会聚集在一起不易分散而影响除铬效果,Fe3O4@SiO2中SiO2起到分散作用,使得纳米Fe3O4不易聚集在一起。
(5) Fe3O4@SiO2-GO还原吸附
氧化石墨烯(记作GO)表面含有—COOH等含氧官能团,将氧化石墨烯嫁接在Fe3O4@SiO2的表面得到Fe3O4@SiO2-GO,其去除废水中Cr(Ⅵ)的过程如下:
―→―→―→―→―→
“吸附”过程中,氧化石墨烯表面带电微粒与Cr3+之间的静电作用是实现“吸附”的重要因素,溶液中Cr3+去除率随pH变化如图所示。
① pH较小时,Cr3+去除率较低的原因是pH较小时,氧化石墨烯表面的羧酸根离子易结合H+,Fe3O4@SiO2-GO表面负电荷减少,静电作用减弱,不易吸附Cr3+;H+浓度大也增大了H+与Cr3+之间的竞争,Cr3+吸附量减少。
② 实际除Cr3+时,控制pH约为6,而不选择更高pH的原因是pH大于6,虽然Cr3+去除率增大,但生成的Cr(OH)3沉淀覆盖在Fe3O4@SiO2-GO表面,不利于回收再利用。
【解析】 (2) Fe2+还原Cr2O时,Fe2+被氧化为Fe3+、Cr由+6价降为+3价,根据得失电子守恒可知n(Fe2+)=6n(Cr2O),故二者物质的量之比为6∶1。Fe2+具有还原性,酸性条件下能被溶液中溶解的O2氧化,实际投入FeSO4的量大于理论值;由2HCrO??Cr2O+H2O可知,随着Cr2O的消耗,HCrO(或CrO)不断转化为Cr2O,实际投入FeSO4的量增加。(3) 以FeSO4和Fe2(SO4)3为原料制Fe3O4,不是氧化还原反应,根据质量守恒配平可得FeSO4+Fe2(SO4)3+8NH3·H2O===Fe3O4+4(NH4)2SO4+4H2O。(4) 在纳米磁性Fe3O4颗粒表面修饰SiO2(记作Fe3O4@SiO2),可以将Fe3O4颗粒分散到SiO2中,阻止其团聚,同时还增大了Fe3O4与废水中Cr2O的接触面积。
2. (2023·淮阴、姜堰、徐州一中联考)锌是一种重要的金属,一种以固体废锌催化剂(主要成分为ZnO,含少量Fe2O3、CuO、SiO2)为原料制备锌的工艺流程如图所示:
已知:① 25 ℃时,Ksp(CuS)=6.4×10-36,Ksp(ZnS)=1.6×10-24;
② 25 ℃时,Zn2++4NH3??[Zn(NH3)4]2+,K=5.0×108;
③深度除铜标准:溶液中铜锌比 ≤2.0×10-6。
(1) “浸取”时,ZnO、 CuO转化为[Zn(NH3)4]2+、[Cu(NH3)4]2+进入溶液。
① ZnO发生反应的离子方程式为2NH3·H2O+2NH+ZnO===Zn[(NH3)4]2++3H2O或2NH3+2NH+ZnO===Zn[(NH3)4]2++H2O。
② 浸取温度应控制在 30 ℃左右,其原因为温度过低反应速率慢;温度过高会导致氨挥发量增加且NH4Cl分解。
(2) “深度除铜”时,锌的回收率、除铜效果与(NH4)2S加入量的关系曲线如图所示。
① 当(NH4)2S加入量≥100%时,会发生反应[Zn(NH3)4]2++S2-===ZnS↓+4NH3导致锌的回收率下降,该反应的平衡常数数值为1.25×1015。
② “深度除铜”时,(NH4)2S较为合理的加入量约为120%,理由是(NH4)2S 加入量低于120%时,未达深度除铜标准,当(NH4)2S加入量大于120%时,会导致锌回收率下降且浪费(NH4)2S。
(3) 通过“萃取”“反萃取”可以获得酸性ZnSO4溶液,为提高锌的回收率,萃取时可以采取的措施为采用多次萃取并将有机相合并或充分振荡。
(4) “电解”时采用Al为阴极,惰性电极为阳极,电解过程中发现当阳极产生1 mol O2时,阴极析出的Zn 小于2 mol,其可能的原因是阴极有氢气生成。
【解析】 (1) ② 浸取温度过低反应速率慢;温度过高氨挥发量增加且NH4Cl受热分解。
(2) ①该反应的平衡常数K=====1.25×1015。(4) 电解过程中阳极产生1 mol O2时,阴极析出的Zn小于2 mol,说明阴极还有其他物质得电子,可能原因是阴极有氢气生成。
3. (2023·常州期中)化学还原稳定法是当前Cr(Ⅵ)水体污染修复领域的主要技术。废水中Cr(Ⅵ)主要以Cr2O和CrO形式存在,化学还原稳定法去除水中Cr(Ⅵ)主要包括铬的还原和固定两个过程。常用的化学还原剂包括硫系还原剂和铁系还原剂。已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=4.5×10-31。
(1) CaS5是常用的硫系还原剂,在处理Cr(Ⅵ)时自身转化为单质S。经CaS5修复的水体pH明显增大(填“增大”或“减小”),严重影响土壤及地下水的利用。
(2) 铁系还原剂FeSO4的还原效率虽不及硫化物,但有利于Cr的固定。
① 在酸性溶液中,FeSO4还原Cr(Ⅵ)的离子方程式为6Fe2++Cr2O+14H+===6Fe3++2Cr3++7H2O。
② Cr的固定途径有两个:其一是难溶性铬铁共沉淀氢氧化物[CrxFe1-x(OH)3]或Cr(OH)3沉淀的生成;其二是Fe3+水解产生的Fe(OH)3胶体吸附Cr2O或CrO。
(3) 试剂联用[n(CaS5)∶n(FeSO4)=1∶2]有望实现高效且稳定的修复效果。
① 待各体系充分反应后,静置2 h。实验测得分别使用单一试剂和试剂联用时,溶液中总Cr的去除率随溶液初始pH的变化关系如图1所示。pH>9,随pH增大,试剂联用时溶液中总Cr的去除率上升的原因是pH增大,使用CaS5会抑制Cr(Ⅵ)的还原,降低总Cr去除率;但使用FeSO4有利于Cr(Ⅵ)的固定,提高总Cr去除率;试剂联用时,FeSO4的用量大于CaS5,增大pH,FeSO4对总Cr去除率的影响程度大于CaS5。
图1
② 在HCO存在下,试剂联用处理溶液中Cr(Ⅵ),待体系充分反应,静置2 h。测得HCO浓度对溶液pH以及总Cr去除效果的影响关系如图2所示。随HCO浓度进一步增加,总Cr的去除率明显上升的原因是增大HCO浓度,溶液pH减小,试剂联用时低pH有利于Cr(Ⅵ)的去除。
图2
③ 研究表明,试剂联用效果优于单一试剂主要是由于反应过程中生成了起催化作用的FeS。FeS的生成过程可用化学方程式表示为CaS5+FeSO4===FeS+4S+CaSO4。
【解析】 (1) CaS5修复时发生的反应消耗H+,pH增大。(2) ① Fe2+被氧化为Fe3+,Cr2O被还原为Cr3+。② 溶液中的Fe3+水解生成氢氧化铁胶体,可以吸附含有铬元素的微粒。(3) ① 结合第一问可知,pH增大会抑制CaS5对Cr(Ⅵ)的还原,但FeSO4的使用有利于Cr(Ⅵ)吸附,试剂联用时两种作用相互竞争。
4. (2024·如皋适应性一)全钒液流电池正极废液中含有的离子是VO、VO2+、H+、SO。以该废液为原料经过氧化、调pH、沉钒、煅烧可以制取V2O5。
(1) 氧化:向正极废液中加入NaClO3将VO2+转化为VO,写出该反应的离子方程式:6VO2++ClO+3H2O===6VO+Cl-+6H+。
(2) 调pH:向氧化后的溶液中加入NaOH调节溶液pH,溶液中V(Ⅴ)会以V2O 、V3O、V10O等形式存在。随pH的升高,溶液中的值将增大(填“增大”“减小”或“保持不变”),判断的方法是根据反应3V2O +6H+??2V3O+3H2O可知,pH升高,H+浓度减小,平衡逆向移动,的值增大。
(3) 沉钒:不同pH时,向溶液中加入(NH4)2SO4,可得到不同类型的含钒沉淀。
① 其他条件一定,控制溶液pH在2~5之间,向溶液中加入(NH4)2SO4,沉钒率和沉淀的X射线衍射图分别如图1和图2所示。pH>3时,pH越大,溶液的沉钒率越低的原因是pH>3时,溶液中V3O转化为V10O,(NH4)4Na2V10O28·10H2O或(NH4)6V10O28·6H2O沉淀的溶解度大于2NH4V3O8·H2O沉淀,所以V10O沉淀率减小。
图1 图2
② 向pH=8的溶液中(此时V主要以VO存在)加入过量(NH4)2SO4溶液,生成NH4VO3沉淀。加入过量(NH4)2SO4 溶液的目的是促进NH4VO3充分沉淀(已知:Ksp(NH4VO3)=1.7×10-3)。
(4) 煅烧:煅烧NH4VO3固体制取V2O5时,需在有氧条件下进行,原因是V2O5具有氧化性,会被NH3(或NH)还原,氧气存在时可以防止V2O5被还原。
【解析】 (1) ClO将VO2+氧化为VO,ClO被还原为Cl-。(4) 煅烧NH4VO3生成V2O5、NH3和水,V2O5具有氧化性,会被NH3还原,在有氧的条件下煅烧NH4VO3固体,使NH3被氧气消耗,可以防止V2O5被还原。
1. (2023·无锡)鞣革废水中含大量的Cr(Ⅵ)对环境有污染,工业上可以用还原法处理。
Ⅰ. 还原沉淀法
(1) Cr(Ⅵ)在水溶液中有H2CrO4、HCrO、CrO和Cr2O四种存在形式(H2CrO4是二元弱酸),HCrO部分转化为Cr2O的离子方程式为_____________________________________________。
(2) 在pH=2的废水中,Cr(Ⅵ)主要以HCrO和Cr2O的形式存在,选用还原剂FeSO4处理此废水,生成Fe3Cr(OH)12沉淀,Fe2+还原Cr2O时,二者物质的量之比为___________。实际投入FeSO4的量需大于上述计算值的可能原因是___________________________________________________________________ ____________________________________________________________________________________________________________________________。
Ⅱ. 还原吸附法
(3) 纳米磁性Fe3O4的制备
以FeSO4和Fe2(SO4)3为原料,在氨水存在的条件下反应可生成纳米磁性Fe3O4,发生反应的化学方程式为________________________________________________________________________________________ ________________________________________________________。
(4) 纳米磁性Fe3O4的修饰
某研究小组经查阅资料,发现纳米磁性Fe3O4颗粒粒径小,比表面积大,但极易发生团聚。在纳米磁性Fe3O4颗粒表面修饰SiO2(记作Fe3O4@SiO2),可优化纳米磁性Fe3O4降解废水中Cr2O的性能,其原因是_________________________________________________________________________________________ ________________________________________________________________________________________________________________。
(5) Fe3O4@SiO2-GO还原吸附
氧化石墨烯(记作GO)表面含有—COOH等含氧官能团,将氧化石墨烯嫁接在Fe3O4@SiO2的表面得到Fe3O4@SiO2-GO,其去除废水中Cr(Ⅵ)的过程如下:
―→―→―→―→―→
“吸附”过程中,氧化石墨烯表面带电微粒与Cr3+之间的静电作用是实现“吸附”的重要因素,溶液中Cr3+去除率随pH变化如图所示。
① pH较小时,Cr3+去除率较低的原因是___________________________________________________ ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
② 实际除Cr3+时,控制pH约为6,而不选择更高pH的原因是___________________________________ ___________________________________________________________________________________________________________________________________________。
2. (2023·淮阴、姜堰、徐州一中联考)锌是一种重要的金属,一种以固体废锌催化剂(主要成分为ZnO,含少量Fe2O3、CuO、SiO2)为原料制备锌的工艺流程如图所示:
已知:① 25 ℃时,Ksp(CuS)=6.4×10-36,Ksp(ZnS)=1.6×10-24;
② 25 ℃时,Zn2++4NH3??[Zn(NH3)4]2+,K=5.0×108;
③深度除铜标准:溶液中铜锌比 ≤2.0×10-6。
(1) “浸取”时,ZnO、 CuO转化为[Zn(NH3)4]2+、[Cu(NH3)4]2+进入溶液。
① ZnO发生反应的离子方程式为____________________________________________________________ ______________________________________________________________________________________________________________________________________________。
② 浸取温度应控制在 30 ℃左右,其原因为_________________________________________________ ____________________________________________。
(2) “深度除铜”时,锌的回收率、除铜效果与(NH4)2S加入量的关系曲线如图所示。
① 当(NH4)2S加入量≥100%时,会发生反应[Zn(NH3)4]2++S2-===ZnS↓+4NH3导致锌的回收率下降,该反应的平衡常数数值为________________________。
② “深度除铜”时,(NH4)2S较为合理的加入量约为120%,理由是___________________________ ___________________________________________________________________________________________________________________________________________________________________________。
(3) 通过“萃取”“反萃取”可以获得酸性ZnSO4溶液,为提高锌的回收率,萃取时可以采取的措施为______________________________________________________。
(4) “电解”时采用Al为阴极,惰性电极为阳极,电解过程中发现当阳极产生1 mol O2时,阴极析出的Zn 小于2 mol,其可能的原因是_____________________。
3. (2023·常州期中)化学还原稳定法是当前Cr(Ⅵ)水体污染修复领域的主要技术。废水中Cr(Ⅵ)主要以Cr2O和CrO形式存在,化学还原稳定法去除水中Cr(Ⅵ)主要包括铬的还原和固定两个过程。常用的化学还原剂包括硫系还原剂和铁系还原剂。已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=4.5×10-31。
(1) CaS5是常用的硫系还原剂,在处理Cr(Ⅵ)时自身转化为单质S。经CaS5修复的水体pH明显______(填“增大”或“减小”),严重影响土壤及地下水的利用。
(2) 铁系还原剂FeSO4的还原效率虽不及硫化物,但有利于Cr的固定。
① 在酸性溶液中,FeSO4还原Cr(Ⅵ)的离子方程式为_________________________________________ ____________________________________________________________。
② Cr的固定途径有两个:其一是难溶性铬铁共沉淀氢氧化物[CrxFe1-x(OH)3]或Cr(OH)3沉淀的生成;其二是___________________________________________________________________________________。
(3) 试剂联用[n(CaS5)∶n(FeSO4)=1∶2]有望实现高效且稳定的修复效果。
① 待各体系充分反应后,静置2 h。实验测得分别使用单一试剂和试剂联用时,溶液中总Cr的去除率随溶液初始pH的变化关系如图1所示。pH>9,随pH增大,试剂联用时溶液中总Cr的去除率上升的原因是_______________________________________________________________________________________ ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
图1
② 在HCO存在下,试剂联用处理溶液中Cr(Ⅵ),待体系充分反应,静置2 h。测得HCO浓度对溶液pH以及总Cr去除效果的影响关系如图2所示。随HCO浓度进一步增加,总Cr的去除率明显上升的原因是________________________________________________________________________________。
图2
③ 研究表明,试剂联用效果优于单一试剂主要是由于反应过程中生成了起催化作用的FeS。FeS的生成过程可用化学方程式表示为______________________________________________________________。
4. (2024·如皋适应性一)全钒液流电池正极废液中含有的离子是VO、VO2+、H+、SO。以该废液为原料经过氧化、调pH、沉钒、煅烧可以制取V2O5。
(1) 氧化:向正极废液中加入NaClO3将VO2+转化为VO,写出该反应的离子方程式:___________ ________________________________________________________________________。
(2) 调pH:向氧化后的溶液中加入NaOH调节溶液pH,溶液中V(Ⅴ)会以V2O 、V3O、V10O等形式存在。随pH的升高,溶液中的值将______(填“增大”“减小”或“保持不变”),判断的方法是_______________________________________________________________________________________ _______________________________________________________________。
(3) 沉钒:不同pH时,向溶液中加入(NH4)2SO4,可得到不同类型的含钒沉淀。
① 其他条件一定,控制溶液pH在2~5之间,向溶液中加入(NH4)2SO4,沉钒率和沉淀的X射线衍射图分别如图1和图2所示。pH>3时,pH越大,溶液的沉钒率越低的原因是_____________________________ __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
图1 图2
② 向pH=8的溶液中(此时V主要以VO存在)加入过量(NH4)2SO4溶液,生成NH4VO3沉淀。加入过量(NH4)2SO4 溶液的目的是____________________________________(已知:Ksp(NH4VO3)=1.7×10-3)。
(4) 煅烧:煅烧NH4VO3固体制取V2O5时,需在有氧条件下进行,原因是___________________________ __________________________________________________________________________________________。
高考特训7 常见过渡金属及其化合物
1. (2023·无锡)鞣革废水中含大量的Cr(Ⅵ)对环境有污染,工业上可以用还原法处理。
Ⅰ. 还原沉淀法
(1) Cr(Ⅵ)在水溶液中有H2CrO4、HCrO、CrO和Cr2O四种存在形式(H2CrO4是二元弱酸),HCrO部分转化为Cr2O的离子方程式为2HCrO??Cr2O+H2O。
(2) 在pH=2的废水中,Cr(Ⅵ)主要以HCrO和Cr2O的形式存在,选用还原剂FeSO4处理此废水,生成Fe3Cr(OH)12沉淀,Fe2+还原Cr2O时,二者物质的量之比为6∶1。实际投入FeSO4的量需大于上述计算值的可能原因是Fe2+被O2氧化;随着Cr2O的消耗,HCrO(或CrO)不断转化为Cr2O(或Fe2+被O2氧化;HCrO也能氧化Fe2+)。
Ⅱ. 还原吸附法
(3) 纳米磁性Fe3O4的制备
以FeSO4和Fe2(SO4)3为原料,在氨水存在的条件下反应可生成纳米磁性Fe3O4,发生反应的化学方程式为FeSO4+Fe2(SO4)3+8NH3·H2O===Fe3O4+4(NH4)2SO4+4H2O。
(4) 纳米磁性Fe3O4的修饰
某研究小组经查阅资料,发现纳米磁性Fe3O4颗粒粒径小,比表面积大,但极易发生团聚。在纳米磁性Fe3O4颗粒表面修饰SiO2(记作Fe3O4@SiO2),可优化纳米磁性Fe3O4降解废水中Cr2O的性能,其原因是纳米Fe3O4有磁性,会聚集在一起不易分散而影响除铬效果,Fe3O4@SiO2中SiO2起到分散作用,使得纳米Fe3O4不易聚集在一起。
(5) Fe3O4@SiO2-GO还原吸附
氧化石墨烯(记作GO)表面含有—COOH等含氧官能团,将氧化石墨烯嫁接在Fe3O4@SiO2的表面得到Fe3O4@SiO2-GO,其去除废水中Cr(Ⅵ)的过程如下:
―→―→―→―→―→
“吸附”过程中,氧化石墨烯表面带电微粒与Cr3+之间的静电作用是实现“吸附”的重要因素,溶液中Cr3+去除率随pH变化如图所示。
① pH较小时,Cr3+去除率较低的原因是pH较小时,氧化石墨烯表面的羧酸根离子易结合H+,Fe3O4@SiO2-GO表面负电荷减少,静电作用减弱,不易吸附Cr3+;H+浓度大也增大了H+与Cr3+之间的竞争,Cr3+吸附量减少。
② 实际除Cr3+时,控制pH约为6,而不选择更高pH的原因是pH大于6,虽然Cr3+去除率增大,但生成的Cr(OH)3沉淀覆盖在Fe3O4@SiO2-GO表面,不利于回收再利用。
【解析】 (2) Fe2+还原Cr2O时,Fe2+被氧化为Fe3+、Cr由+6价降为+3价,根据得失电子守恒可知n(Fe2+)=6n(Cr2O),故二者物质的量之比为6∶1。Fe2+具有还原性,酸性条件下能被溶液中溶解的O2氧化,实际投入FeSO4的量大于理论值;由2HCrO??Cr2O+H2O可知,随着Cr2O的消耗,HCrO(或CrO)不断转化为Cr2O,实际投入FeSO4的量增加。(3) 以FeSO4和Fe2(SO4)3为原料制Fe3O4,不是氧化还原反应,根据质量守恒配平可得FeSO4+Fe2(SO4)3+8NH3·H2O===Fe3O4+4(NH4)2SO4+4H2O。(4) 在纳米磁性Fe3O4颗粒表面修饰SiO2(记作Fe3O4@SiO2),可以将Fe3O4颗粒分散到SiO2中,阻止其团聚,同时还增大了Fe3O4与废水中Cr2O的接触面积。
2. (2023·淮阴、姜堰、徐州一中联考)锌是一种重要的金属,一种以固体废锌催化剂(主要成分为ZnO,含少量Fe2O3、CuO、SiO2)为原料制备锌的工艺流程如图所示:
已知:① 25 ℃时,Ksp(CuS)=6.4×10-36,Ksp(ZnS)=1.6×10-24;
② 25 ℃时,Zn2++4NH3??[Zn(NH3)4]2+,K=5.0×108;
③深度除铜标准:溶液中铜锌比 ≤2.0×10-6。
(1) “浸取”时,ZnO、 CuO转化为[Zn(NH3)4]2+、[Cu(NH3)4]2+进入溶液。
① ZnO发生反应的离子方程式为2NH3·H2O+2NH+ZnO===Zn[(NH3)4]2++3H2O或2NH3+2NH+ZnO===Zn[(NH3)4]2++H2O。
② 浸取温度应控制在 30 ℃左右,其原因为温度过低反应速率慢;温度过高会导致氨挥发量增加且NH4Cl分解。
(2) “深度除铜”时,锌的回收率、除铜效果与(NH4)2S加入量的关系曲线如图所示。
① 当(NH4)2S加入量≥100%时,会发生反应[Zn(NH3)4]2++S2-===ZnS↓+4NH3导致锌的回收率下降,该反应的平衡常数数值为1.25×1015。
② “深度除铜”时,(NH4)2S较为合理的加入量约为120%,理由是(NH4)2S 加入量低于120%时,未达深度除铜标准,当(NH4)2S加入量大于120%时,会导致锌回收率下降且浪费(NH4)2S。
(3) 通过“萃取”“反萃取”可以获得酸性ZnSO4溶液,为提高锌的回收率,萃取时可以采取的措施为采用多次萃取并将有机相合并或充分振荡。
(4) “电解”时采用Al为阴极,惰性电极为阳极,电解过程中发现当阳极产生1 mol O2时,阴极析出的Zn 小于2 mol,其可能的原因是阴极有氢气生成。
【解析】 (1) ② 浸取温度过低反应速率慢;温度过高氨挥发量增加且NH4Cl受热分解。
(2) ①该反应的平衡常数K=====1.25×1015。(4) 电解过程中阳极产生1 mol O2时,阴极析出的Zn小于2 mol,说明阴极还有其他物质得电子,可能原因是阴极有氢气生成。
3. (2023·常州期中)化学还原稳定法是当前Cr(Ⅵ)水体污染修复领域的主要技术。废水中Cr(Ⅵ)主要以Cr2O和CrO形式存在,化学还原稳定法去除水中Cr(Ⅵ)主要包括铬的还原和固定两个过程。常用的化学还原剂包括硫系还原剂和铁系还原剂。已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=4.5×10-31。
(1) CaS5是常用的硫系还原剂,在处理Cr(Ⅵ)时自身转化为单质S。经CaS5修复的水体pH明显增大(填“增大”或“减小”),严重影响土壤及地下水的利用。
(2) 铁系还原剂FeSO4的还原效率虽不及硫化物,但有利于Cr的固定。
① 在酸性溶液中,FeSO4还原Cr(Ⅵ)的离子方程式为6Fe2++Cr2O+14H+===6Fe3++2Cr3++7H2O。
② Cr的固定途径有两个:其一是难溶性铬铁共沉淀氢氧化物[CrxFe1-x(OH)3]或Cr(OH)3沉淀的生成;其二是Fe3+水解产生的Fe(OH)3胶体吸附Cr2O或CrO。
(3) 试剂联用[n(CaS5)∶n(FeSO4)=1∶2]有望实现高效且稳定的修复效果。
① 待各体系充分反应后,静置2 h。实验测得分别使用单一试剂和试剂联用时,溶液中总Cr的去除率随溶液初始pH的变化关系如图1所示。pH>9,随pH增大,试剂联用时溶液中总Cr的去除率上升的原因是pH增大,使用CaS5会抑制Cr(Ⅵ)的还原,降低总Cr去除率;但使用FeSO4有利于Cr(Ⅵ)的固定,提高总Cr去除率;试剂联用时,FeSO4的用量大于CaS5,增大pH,FeSO4对总Cr去除率的影响程度大于CaS5。
图1
② 在HCO存在下,试剂联用处理溶液中Cr(Ⅵ),待体系充分反应,静置2 h。测得HCO浓度对溶液pH以及总Cr去除效果的影响关系如图2所示。随HCO浓度进一步增加,总Cr的去除率明显上升的原因是增大HCO浓度,溶液pH减小,试剂联用时低pH有利于Cr(Ⅵ)的去除。
图2
③ 研究表明,试剂联用效果优于单一试剂主要是由于反应过程中生成了起催化作用的FeS。FeS的生成过程可用化学方程式表示为CaS5+FeSO4===FeS+4S+CaSO4。
【解析】 (1) CaS5修复时发生的反应消耗H+,pH增大。(2) ① Fe2+被氧化为Fe3+,Cr2O被还原为Cr3+。② 溶液中的Fe3+水解生成氢氧化铁胶体,可以吸附含有铬元素的微粒。(3) ① 结合第一问可知,pH增大会抑制CaS5对Cr(Ⅵ)的还原,但FeSO4的使用有利于Cr(Ⅵ)吸附,试剂联用时两种作用相互竞争。
4. (2024·如皋适应性一)全钒液流电池正极废液中含有的离子是VO、VO2+、H+、SO。以该废液为原料经过氧化、调pH、沉钒、煅烧可以制取V2O5。
(1) 氧化:向正极废液中加入NaClO3将VO2+转化为VO,写出该反应的离子方程式:6VO2++ClO+3H2O===6VO+Cl-+6H+。
(2) 调pH:向氧化后的溶液中加入NaOH调节溶液pH,溶液中V(Ⅴ)会以V2O 、V3O、V10O等形式存在。随pH的升高,溶液中的值将增大(填“增大”“减小”或“保持不变”),判断的方法是根据反应3V2O +6H+??2V3O+3H2O可知,pH升高,H+浓度减小,平衡逆向移动,的值增大。
(3) 沉钒:不同pH时,向溶液中加入(NH4)2SO4,可得到不同类型的含钒沉淀。
① 其他条件一定,控制溶液pH在2~5之间,向溶液中加入(NH4)2SO4,沉钒率和沉淀的X射线衍射图分别如图1和图2所示。pH>3时,pH越大,溶液的沉钒率越低的原因是pH>3时,溶液中V3O转化为V10O,(NH4)4Na2V10O28·10H2O或(NH4)6V10O28·6H2O沉淀的溶解度大于2NH4V3O8·H2O沉淀,所以V10O沉淀率减小。
图1 图2
② 向pH=8的溶液中(此时V主要以VO存在)加入过量(NH4)2SO4溶液,生成NH4VO3沉淀。加入过量(NH4)2SO4 溶液的目的是促进NH4VO3充分沉淀(已知:Ksp(NH4VO3)=1.7×10-3)。
(4) 煅烧:煅烧NH4VO3固体制取V2O5时,需在有氧条件下进行,原因是V2O5具有氧化性,会被NH3(或NH)还原,氧气存在时可以防止V2O5被还原。
【解析】 (1) ClO将VO2+氧化为VO,ClO被还原为Cl-。(4) 煅烧NH4VO3生成V2O5、NH3和水,V2O5具有氧化性,会被NH3还原,在有氧的条件下煅烧NH4VO3固体,使NH3被氧气消耗,可以防止V2O5被还原。
同课章节目录
