高考特训12 电极反应式书写 (含解析)2026届高三化学一轮大单元复习
文档属性
| 名称 | 高考特训12 电极反应式书写 (含解析)2026届高三化学一轮大单元复习 |  | |
| 格式 | DOC | ||
| 文件大小 | 435.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-23 00:34:46 | ||
图片预览

文档简介
大单元五 综合与应用
高考特训12 电极反应式书写
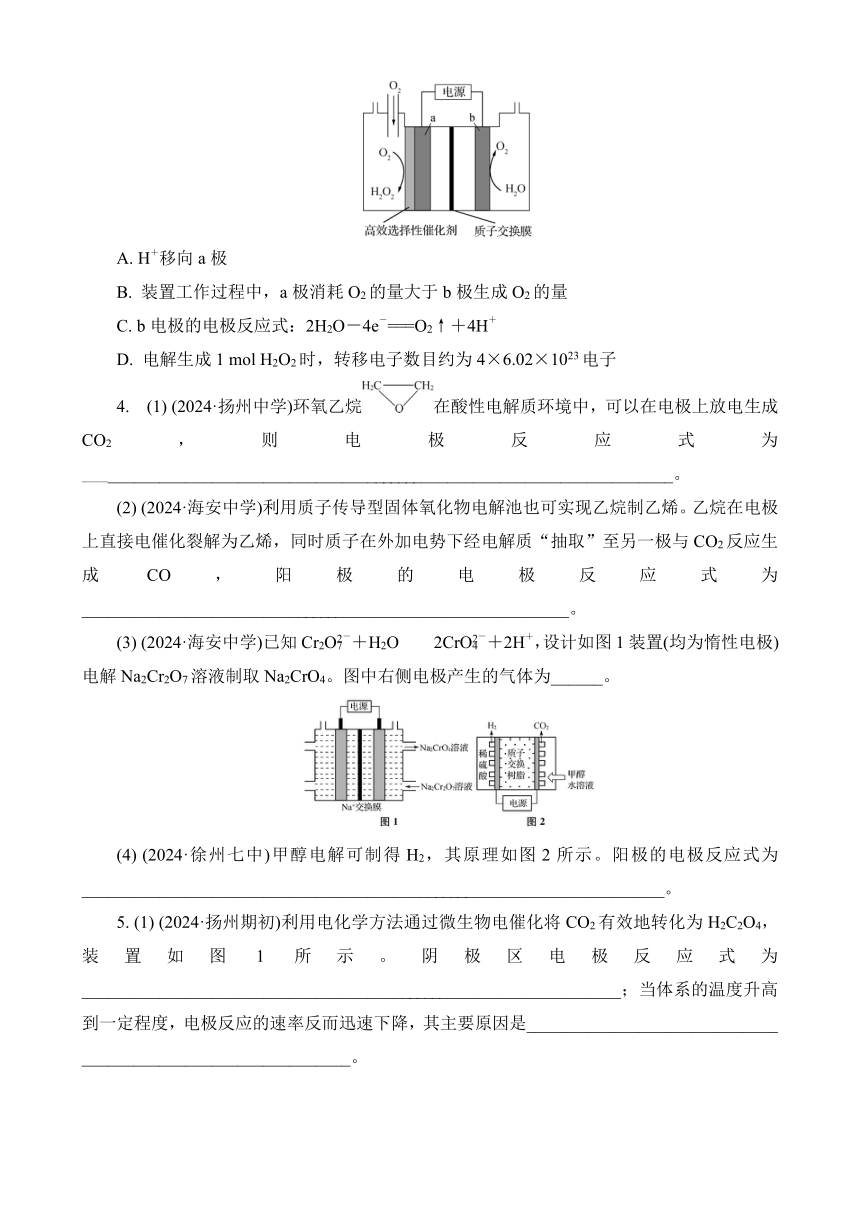
1. (2024·江苏各地模拟)下列说法错误的是( )
A. 用如图所示装置在铁片上镀铜
B. 工业上可通过电解熔融MgCl2制取金属Mg
C. 工业制备NaOH的原理:2NaCl+2H2O2NaOH+Cl2↑+H2↑
D. Al2O3熔点高,故可用于电解冶炼铝
2. (2024·南通二调)一种电解装置如图所示,电解时H+从右室移向左室。通过电解获得的电解液可实现下列说法正确的是( )
A. 左室电解获得的电解液可用于实现“转化Ⅰ”
B. 右室发生的电极反应为Cr2O+14H++6e-===2Cr3++7H2O
C. “转化Ⅱ”发生的反应为
D. “转化Ⅰ”生成1 mol,理论上电路中通过3 mol e-
3. (2022·苏北四市一模)H2O2是常用的绿色氧化剂,可用如图所示装置电解H2O和O2制备H2O2。下列说法不正确的是( )
A. H+移向a极
B. 装置工作过程中,a极消耗O2的量大于b极生成O2的量
C. b电极的电极反应式:2H2O-4e-===O2↑+4H+
D. 电解生成1 mol H2O2时,转移电子数目约为4×6.02×1023电子
4. (1) (2024·扬州中学)环氧乙烷在酸性电解质环境中,可以在电极上放电生成CO2,则电极反应式为_____________________________________________________________________。
(2) (2024·海安中学)利用质子传导型固体氧化物电解池也可实现乙烷制乙烯。乙烷在电极上直接电催化裂解为乙烯,同时质子在外加电势下经电解质“抽取”至另一极与CO2反应生成CO,阳极的电极反应式为_________________________________________________________。
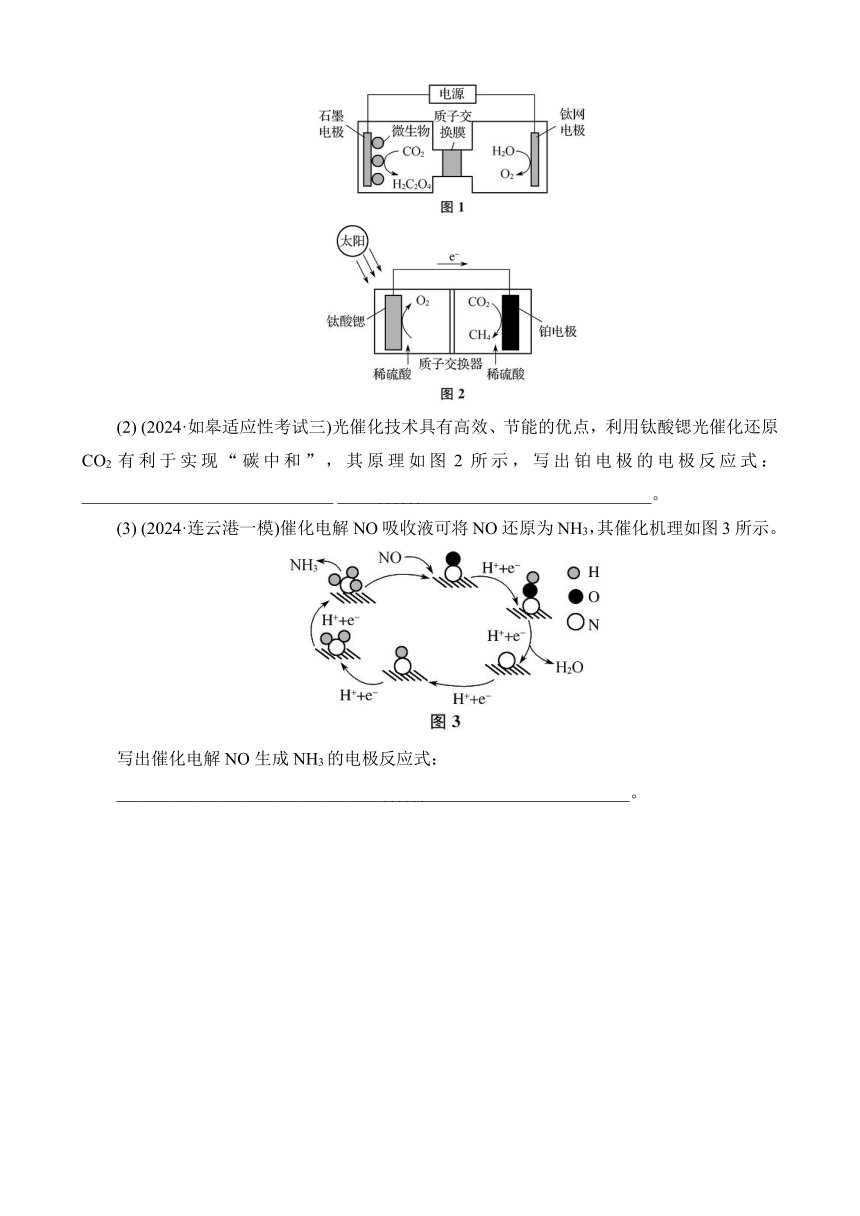
(3) (2024·海安中学)已知Cr2O+H2O??2CrO+2H+,设计如图1装置(均为惰性电极)电解Na2Cr2O7溶液制取Na2CrO4。图中右侧电极产生的气体为______。
(4) (2024·徐州七中)甲醇电解可制得H2,其原理如图2所示。阳极的电极反应式为____________________________________________________________________。
5. (1) (2024·扬州期初)利用电化学方法通过微生物电催化将CO2有效地转化为H2C2O4,装置如图1所示。阴极区电极反应式为_______________________________________________________________;当体系的温度升高到一定程度,电极反应的速率反而迅速下降,其主要原因是_____________________________ _______________________________。
(2) (2024·如皋适应性考试三)光催化技术具有高效、节能的优点,利用钛酸锶光催化还原CO2有利于实现“碳中和”,其原理如图2所示,写出铂电极的电极反应式:_____________________________ _____________________________________。
(3) (2024·连云港一模)催化电解NO吸收液可将NO还原为NH3,其催化机理如图3所示。
写出催化电解NO生成NH3的电极反应式:
____________________________________________________________。
大单元五 综合与应用
高考特训12 电极反应式书写
1. (2024·江苏各地模拟)下列说法错误的是(D)
A. 用如图所示装置在铁片上镀铜
B. 工业上可通过电解熔融MgCl2制取金属Mg
C. 工业制备NaOH的原理:2NaCl+2H2O2NaOH+Cl2↑+H2↑
D. Al2O3熔点高,故可用于电解冶炼铝
【解析】 熔融状态的Al2O3能导电,可用于电解冶炼铝,与其熔点高无关,D错误。
2. (2024·南通二调)一种电解装置如图所示,电解时H+从右室移向左室。通过电解获得的电解液可实现下列说法正确的是(C)
A. 左室电解获得的电解液可用于实现“转化Ⅰ”
B. 右室发生的电极反应为Cr2O+14H++6e-===2Cr3++7H2O
C. “转化Ⅱ”发生的反应为
D. “转化Ⅰ”生成1 mol,理论上电路中通过3 mol e-
【解析】 根据氢离子在电解池中移动方向可知,a电极为阴极,b电极为阳极,阳极反应式为2Cr3+-6e-+7H2O===Cr2O+14H+,阴极反应式为Ti4++e-===Ti3+,阳极生成Cr2O具有强氧化性,阴极生成Ti3+具有还原性,“转化Ⅰ”为氧化反应,应加入右室电解获得的电解液氧化实现,A错误,B错误;“转化Ⅱ”为还原反应,可加入左室电解获得的电解液还原实现,C正确;“转化Ⅰ”为,根据得失电子守恒,每生成1 mol ,需消耗1 mol Cr2O,故理论上电路中通过6 mol e-,D错误。
3. (2022·苏北四市一模)H2O2是常用的绿色氧化剂,可用如图所示装置电解H2O和O2制备H2O2。下列说法不正确的是(D)
A. H+移向a极
B. 装置工作过程中,a极消耗O2的量大于b极生成O2的量
C. b电极的电极反应式:
2H2O-4e-===O2↑+4H+
D. 电解生成1 mol H2O2时,转移电子数目约为
4×6.02×1023电子
【解析】 由图可知,b极上水失电子生成O2和H+,b极为阳极,H+向a极(阴极)移动,A正确;a极电极反应式为O2+2e-+2H+===H2O2,b极电极反应式为2H2O-4e-===O2↑+4H+,当转移4 mol电子时,a极消耗2 mol O2,b极产生1 mol O2,B、C正确;a极电极反应式为O2+2e-+2H+===H2O2,每生成1 mol H2O2时,转移2 mol电子,转移电子的数目约为2×6.02×1023,D错误。
4. (1) (2024·扬州中学)环氧乙烷在酸性电解质环境中,可以在电极上放电生成CO2,则电极反应式为+3H2O-10e-===2CO2+10H+。
(2) (2024·海安中学)利用质子传导型固体氧化物电解池也可实现乙烷制乙烯。乙烷在电极上直接电催化裂解为乙烯,同时质子在外加电势下经电解质“抽取”至另一极与CO2反应生成CO,阳极的电极反应式为C2H6-2e-===C2H4+2H+。
(3) (2024·海安中学)已知Cr2O+H2O??2CrO+2H+,设计如图1装置(均为惰性电极)电解Na2Cr2O7溶液制取Na2CrO4。图中右侧电极产生的气体为H2。
(4) (2024·徐州七中)甲醇电解可制得H2,其原理如图2所示。阳极的电极反应式为CH3OH-6e-+H2O===CO2↑+6H+。
【解析】 (3) 由Na2Cr2O7溶液制取Na2CrO4,右侧需要消耗H+,使平衡Cr2O+H2O??2CrO+2H+右移,故右侧发生的电极反应式为2H++2e-===H2↑,故产生的气体为H2。
5. (1) (2024·扬州期初)利用电化学方法通过微生物电催化将CO2有效地转化为H2C2O4,装置如图1所示。阴极区电极反应式为2CO2+2e-+2H+===H2C2O4;当体系的温度升高到一定程度,电极反应的速率反而迅速下降,其主要原因是温度过高,微生物催化能力降低或催化剂失活。
(2) (2024·如皋适应性考试三)光催化技术具有高效、节能的优点,利用钛酸锶光催化还原CO2有利于实现“碳中和”,其原理如图2所示,写出铂电极的电极反应式:CO2+8e-+8H+===CH4+2H2O。
(3) (2024·连云港一模)催化电解NO吸收液可将NO还原为NH3,其催化机理如图3所示。
写出催化电解NO生成NH3的电极反应式:
NO+5e-+5H+===NH3+H2O。
高考特训12 电极反应式书写
1. (2024·江苏各地模拟)下列说法错误的是( )
A. 用如图所示装置在铁片上镀铜
B. 工业上可通过电解熔融MgCl2制取金属Mg
C. 工业制备NaOH的原理:2NaCl+2H2O2NaOH+Cl2↑+H2↑
D. Al2O3熔点高,故可用于电解冶炼铝
2. (2024·南通二调)一种电解装置如图所示,电解时H+从右室移向左室。通过电解获得的电解液可实现下列说法正确的是( )
A. 左室电解获得的电解液可用于实现“转化Ⅰ”
B. 右室发生的电极反应为Cr2O+14H++6e-===2Cr3++7H2O
C. “转化Ⅱ”发生的反应为
D. “转化Ⅰ”生成1 mol,理论上电路中通过3 mol e-
3. (2022·苏北四市一模)H2O2是常用的绿色氧化剂,可用如图所示装置电解H2O和O2制备H2O2。下列说法不正确的是( )
A. H+移向a极
B. 装置工作过程中,a极消耗O2的量大于b极生成O2的量
C. b电极的电极反应式:2H2O-4e-===O2↑+4H+
D. 电解生成1 mol H2O2时,转移电子数目约为4×6.02×1023电子
4. (1) (2024·扬州中学)环氧乙烷在酸性电解质环境中,可以在电极上放电生成CO2,则电极反应式为_____________________________________________________________________。
(2) (2024·海安中学)利用质子传导型固体氧化物电解池也可实现乙烷制乙烯。乙烷在电极上直接电催化裂解为乙烯,同时质子在外加电势下经电解质“抽取”至另一极与CO2反应生成CO,阳极的电极反应式为_________________________________________________________。
(3) (2024·海安中学)已知Cr2O+H2O??2CrO+2H+,设计如图1装置(均为惰性电极)电解Na2Cr2O7溶液制取Na2CrO4。图中右侧电极产生的气体为______。
(4) (2024·徐州七中)甲醇电解可制得H2,其原理如图2所示。阳极的电极反应式为____________________________________________________________________。
5. (1) (2024·扬州期初)利用电化学方法通过微生物电催化将CO2有效地转化为H2C2O4,装置如图1所示。阴极区电极反应式为_______________________________________________________________;当体系的温度升高到一定程度,电极反应的速率反而迅速下降,其主要原因是_____________________________ _______________________________。
(2) (2024·如皋适应性考试三)光催化技术具有高效、节能的优点,利用钛酸锶光催化还原CO2有利于实现“碳中和”,其原理如图2所示,写出铂电极的电极反应式:_____________________________ _____________________________________。
(3) (2024·连云港一模)催化电解NO吸收液可将NO还原为NH3,其催化机理如图3所示。
写出催化电解NO生成NH3的电极反应式:
____________________________________________________________。
大单元五 综合与应用
高考特训12 电极反应式书写
1. (2024·江苏各地模拟)下列说法错误的是(D)
A. 用如图所示装置在铁片上镀铜
B. 工业上可通过电解熔融MgCl2制取金属Mg
C. 工业制备NaOH的原理:2NaCl+2H2O2NaOH+Cl2↑+H2↑
D. Al2O3熔点高,故可用于电解冶炼铝
【解析】 熔融状态的Al2O3能导电,可用于电解冶炼铝,与其熔点高无关,D错误。
2. (2024·南通二调)一种电解装置如图所示,电解时H+从右室移向左室。通过电解获得的电解液可实现下列说法正确的是(C)
A. 左室电解获得的电解液可用于实现“转化Ⅰ”
B. 右室发生的电极反应为Cr2O+14H++6e-===2Cr3++7H2O
C. “转化Ⅱ”发生的反应为
D. “转化Ⅰ”生成1 mol,理论上电路中通过3 mol e-
【解析】 根据氢离子在电解池中移动方向可知,a电极为阴极,b电极为阳极,阳极反应式为2Cr3+-6e-+7H2O===Cr2O+14H+,阴极反应式为Ti4++e-===Ti3+,阳极生成Cr2O具有强氧化性,阴极生成Ti3+具有还原性,“转化Ⅰ”为氧化反应,应加入右室电解获得的电解液氧化实现,A错误,B错误;“转化Ⅱ”为还原反应,可加入左室电解获得的电解液还原实现,C正确;“转化Ⅰ”为,根据得失电子守恒,每生成1 mol ,需消耗1 mol Cr2O,故理论上电路中通过6 mol e-,D错误。
3. (2022·苏北四市一模)H2O2是常用的绿色氧化剂,可用如图所示装置电解H2O和O2制备H2O2。下列说法不正确的是(D)
A. H+移向a极
B. 装置工作过程中,a极消耗O2的量大于b极生成O2的量
C. b电极的电极反应式:
2H2O-4e-===O2↑+4H+
D. 电解生成1 mol H2O2时,转移电子数目约为
4×6.02×1023电子
【解析】 由图可知,b极上水失电子生成O2和H+,b极为阳极,H+向a极(阴极)移动,A正确;a极电极反应式为O2+2e-+2H+===H2O2,b极电极反应式为2H2O-4e-===O2↑+4H+,当转移4 mol电子时,a极消耗2 mol O2,b极产生1 mol O2,B、C正确;a极电极反应式为O2+2e-+2H+===H2O2,每生成1 mol H2O2时,转移2 mol电子,转移电子的数目约为2×6.02×1023,D错误。
4. (1) (2024·扬州中学)环氧乙烷在酸性电解质环境中,可以在电极上放电生成CO2,则电极反应式为+3H2O-10e-===2CO2+10H+。
(2) (2024·海安中学)利用质子传导型固体氧化物电解池也可实现乙烷制乙烯。乙烷在电极上直接电催化裂解为乙烯,同时质子在外加电势下经电解质“抽取”至另一极与CO2反应生成CO,阳极的电极反应式为C2H6-2e-===C2H4+2H+。
(3) (2024·海安中学)已知Cr2O+H2O??2CrO+2H+,设计如图1装置(均为惰性电极)电解Na2Cr2O7溶液制取Na2CrO4。图中右侧电极产生的气体为H2。
(4) (2024·徐州七中)甲醇电解可制得H2,其原理如图2所示。阳极的电极反应式为CH3OH-6e-+H2O===CO2↑+6H+。
【解析】 (3) 由Na2Cr2O7溶液制取Na2CrO4,右侧需要消耗H+,使平衡Cr2O+H2O??2CrO+2H+右移,故右侧发生的电极反应式为2H++2e-===H2↑,故产生的气体为H2。
5. (1) (2024·扬州期初)利用电化学方法通过微生物电催化将CO2有效地转化为H2C2O4,装置如图1所示。阴极区电极反应式为2CO2+2e-+2H+===H2C2O4;当体系的温度升高到一定程度,电极反应的速率反而迅速下降,其主要原因是温度过高,微生物催化能力降低或催化剂失活。
(2) (2024·如皋适应性考试三)光催化技术具有高效、节能的优点,利用钛酸锶光催化还原CO2有利于实现“碳中和”,其原理如图2所示,写出铂电极的电极反应式:CO2+8e-+8H+===CH4+2H2O。
(3) (2024·连云港一模)催化电解NO吸收液可将NO还原为NH3,其催化机理如图3所示。
写出催化电解NO生成NH3的电极反应式:
NO+5e-+5H+===NH3+H2O。
同课章节目录
