高考特训14 化学反应原理小综合 化学反应机理(含解析)2026届高三化学一轮大单元复习
文档属性
| 名称 | 高考特训14 化学反应原理小综合 化学反应机理(含解析)2026届高三化学一轮大单元复习 |  | |
| 格式 | DOC | ||
| 文件大小 | 712.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-23 10:19:11 | ||
图片预览



文档简介
大单元六 综合与应用
高考特训14 化学反应原理小综合 化学反应机理
1. (2024·常州期末)固载Ru基催化剂催化反应CO2(g)+H2(g)===HCOOH(g)是实现CO2资源化的重要途径。将一定比例的CO2和H2的混合气体以一定流速通过装有催化剂的反应器,在反应器出口处检测到大量CO,其选择性高达90%以上。下列说法错误的是( )
A. HCOOH既有酸性,又有还原性
B. 该反应的平衡常数K=
C. 该反应中每消耗1 mol H2,转移电子的数目约为2×6.02×1023
D. 该反应可能经历了以下过程:①CO2+H2===CO+H2O、②CO+H2O===HCOOH,且反应①的活化能大于反应②
2. (2024·苏锡常镇一模)对于反应2SO2(g)+O2(g)2SO3(g),下列有关说法正确的是( )
A. 该反应的ΔS>0
B. 该反应平衡常数的表达式为K=
C. 反应中每消耗22.4 L O2(标准状况),转移电子数约为2×6.02×1023
D. 温度不变,提高c起始(O2)或增大反应压强,均能提高反应速率和SO2的转化率
3. (2024·南京、盐城一模)反应CH4(g)+2NO2(g)CO2(g)+N2(g)+2H2O(g)可用于尾气脱硝。下列说法正确的是( )
A. 该反应的ΔS<0
B. 该反应达到平衡后,移除部分H2O(g),正反应速率增大
C. 提高n(NO2)∶n(CH4)的比例,可增大NO2的平衡转化率
D. 该反应每消耗1 mol NO2,转移电子的数目约为4×6.02×1023
4. (2024·南通一模)反应2C2H4(g)+6NO(g)+3O2(g)===4CO2(g)+4H2O(g)+3N2(g)可用于去除氮氧化物,Cu+催化该反应的过程如图所示。下列说法正确的是( )
A. 反应过程中,Cu+参与反应,降低了反应的焓变
B. 该反应的平衡常数K=
C. 其他条件不变时,增大,NO的平衡转化率下降
D. 步骤Ⅲ中每消耗1 mol Cu+(NO2),转移电子数目约为4×6.02×1023
5. (2024·无锡期末)电催化是利用催化剂电极进行电解以实现物质转变的前沿方法。使用单原子催化剂电催化将CO2转化为CO的部分机理如图所示。下列说法正确的是( )
A. 该催化过程在电解池的阳极进行
B. 该催化过程CO2发生了氧化反应
C. 甲、乙中的C原子的杂化类型不同
D. 催化剂原子吸附CO2中带负电的部分
6. (2023·淮安期初)炼油、石化等含S2-工业废水可通过催化氧化法进行处理。将MnO2嵌于聚苯胺(高温会分解)表面制成催化剂,碱性条件下,催化氧化废水的机理如图所示。下列有关说法错误的是( )
A. 催化剂因S覆盖表面或进入空位而失效,高温灼烧后也不可继续使用
B. 该反应过程的总反应为O2+2H2O+2S2-4OH-+2S↓
C. 反应过程中只有硫元素被氧化
D. 反应Ⅲ的ΔH >0
7. (2023·如东期初)活性Fe3O4-x催化反应:H2(g)+HCO(aq)===HCOO-(aq)+H2O(l),进而可制得甲酸,反应机理如图所示。下列说法正确的是( )
A. 该反应的ΔH>0
B. 该反应的平衡常数K=
C. 反应前后,碳原子的杂化方式和化合价均没有发生变化
D. 如图所示的反应机理中,步骤Ⅰ可理解为带部分负电荷的氢与HCO中带部分正电荷的碳结合,带部分正电荷的氢与带部分负电荷的羟基氧结合生成水,HCO转化为HCOO-
8. (2024·苏州期末)在压强0.7 MPa、温度370 ℃下,化合物WS2催化反应H2S+CH3OH===H2O+CH3SH可用于制备甲硫醇,其反应过程如图所示。下列说法正确的是( )
A. 该反应的平衡常数K=
B. 过程Ⅰ存在反应物吸附,S—H没有断裂
C. 图中“”代表S原子
D. 若用CH3OD代替CH3OH,则生成CH3SD
9. (2023·苏州期中)利用CO2和H2组成原电池,在Pt电极的催化下可以生成甲烷,总反应为CO2(g)+4H2(g)===CH4(g)+2H2O(g)。装置中正负极之间采用质子交换膜分隔,在电极上CO2先转化为*CO吸附在催化剂表面,随后生成甲烷,部分机理如图所示。下列说法正确的是( )
A. 总反应的平衡常数K=
B. 正极获得CO的电极反应式:2H++CO2-2e-===CO+H2O
C. 气体中CO2的浓度越高,越利于甲烷的生成
D. 在催化剂表面生成CH4的反应为*CO+6H===CH4+H2O
10. (2023·无锡期中)CO2氧化乙苯脱氢制苯乙烯的反应的化学方程式为+CO2(g)+H2O(g)+CO(g),其反应历程如图所示。下列有关说法正确的是( )
A. 该反应的ΔS<0
B. 该反应的平衡常数表达式为K=
C. 催化剂表面酸性越强,苯乙烯的产率越高
D. 过程③可能生成副产物
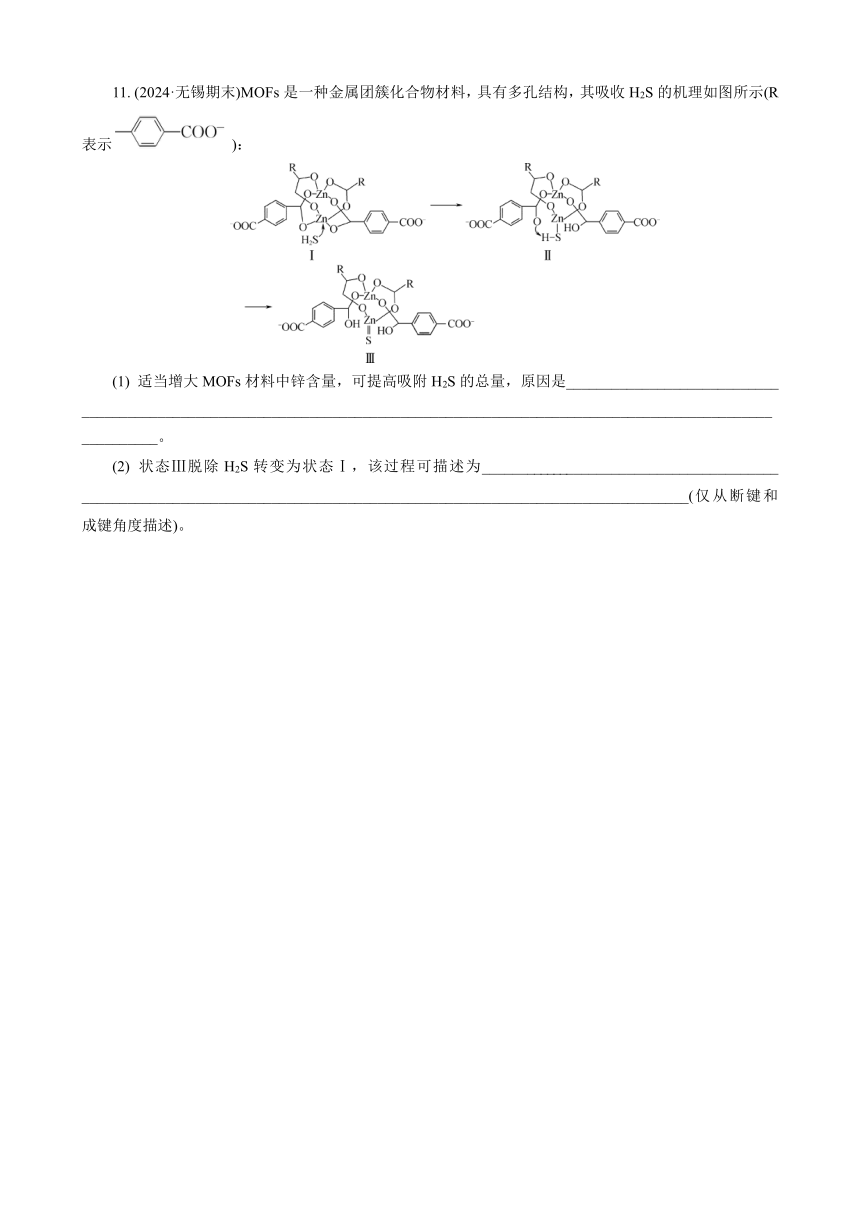
11. (2024·无锡期末)MOFs是一种金属团簇化合物材料,具有多孔结构,其吸收H2S的机理如图所示(R表示):
(1) 适当增大MOFs材料中锌含量,可提高吸附H2S的总量,原因是____________________________ _____________________________________________________________________________________________________。
(2) 状态Ⅲ脱除H2S转变为状态Ⅰ,该过程可描述为________________________________________ ________________________________________________________________________________(仅从断键和成键角度描述)。
大单元六 综合与应用
高考特训14 化学反应原理小综合 化学反应机理
1. (2024·常州期末)固载Ru基催化剂催化反应CO2(g)+H2(g)===HCOOH(g)是实现CO2资源化的重要途径。将一定比例的CO2和H2的混合气体以一定流速通过装有催化剂的反应器,在反应器出口处检测到大量CO,其选择性高达90%以上。下列说法错误的是(D)
A. HCOOH既有酸性,又有还原性
B. 该反应的平衡常数K=
C. 该反应中每消耗1 mol H2,转移电子的数目约为2×6.02×1023
D. 该反应可能经历了以下过程:①CO2+H2===CO+H2O、②CO+H2O===HCOOH,且反应①的活化能大于反应②
【解析】 HCOOH可以继续被氧化为CO2,分子中含有—COOH,故其既有还原性,又有酸性,A正确;反应物和生成物都是气体,均可列入平衡常数表达式中,B正确;由CO2(g)+H2(g)===HCOOH(g)知,每消耗1 mol H2,转移2 mol 电子,则转移电子的数目约为2×6.02×1023,C正确;在反应器出口处检测到大量CO,其选择性高达90%以上,说明反应②的速率较慢,故反应②的活化能大于反应①,D错误。
2. (2024·苏锡常镇一模)对于反应2SO2(g)+O2(g)2SO3(g),下列有关说法正确的是(D)
A. 该反应的ΔS>0
B. 该反应平衡常数的表达式为K=
C. 反应中每消耗22.4 L O2(标准状况),转移电子数约为2×6.02×1023
D. 温度不变,提高c起始(O2)或增大反应压强,均能提高反应速率和SO2的转化率
【解析】 该反应前后气体分子数减少,则ΔS<0,A错误;该反应平衡常数的表达式为K=,B错误;每消耗1 mol氧气时,转移4 mol电子,转移电子数约为4×6.02×1023,C错误。
3. (2024·南京、盐城一模)反应CH4(g)+2NO2(g)CO2(g)+N2(g)+2H2O(g)可用于尾气脱硝。下列说法正确的是(D)
A. 该反应的ΔS<0
B. 该反应达到平衡后,移除部分H2O(g),正反应速率增大
C. 提高n(NO2)∶n(CH4)的比例,可增大NO2的平衡转化率
D. 该反应每消耗1 mol NO2,转移电子的数目约为4×6.02×1023
【解析】 该反应为气体分子数增加的反应,则ΔS>0,A错误;H2O(g)是生成物,在该反应达到平衡后,在移除部分H2O(g)的瞬间,逆反应速率减小而正反应速率不变,化学平衡正向移动,B错误;若提高n(NO2)∶n(CH4)的比例,相当于n(CH4)不变、增大n(NO2),CH4的平衡转化率增大,但NO2的平衡转化率降低,C错误。
4. (2024·南通一模)反应2C2H4(g)+6NO(g)+3O2(g)===4CO2(g)+4H2O(g)+3N2(g)可用于去除氮氧化物,Cu+催化该反应的过程如图所示。下列说法正确的是(D)
A. 反应过程中,Cu+参与反应,降低了反应的焓变
B. 该反应的平衡常数
K=
C. 其他条件不变时,增大,NO的平衡转化率下降
D. 步骤Ⅲ中每消耗1 mol Cu+(NO2),转移电子数目约为4×6.02×1023
【解析】 Cu+是反应的催化剂,对反应的焓变无影响,A错误;水为气态,应列入平衡常数表达式,B错误;增大,NO的平衡转化率上升,C错误;步骤Ⅲ中N元素化合价由+4下降到0,则步骤Ⅲ中每消耗1 mol Cu+(NO2),转移电子数目约为4×6.02×1023,D正确。
5. (2024·无锡期末)电催化是利用催化剂电极进行电解以实现物质转变的前沿方法。使用单原子催化剂电催化将CO2转化为CO的部分机理如图所示。下列说法正确的是(C)
A. 该催化过程在电解池的阳极进行
B. 该催化过程CO2发生了氧化反应
C. 甲、乙中的C原子的杂化类型不同
D. 催化剂原子吸附CO2中带负电的部分
【解析】 CO2转变为CO的过程中需要得到电子,故该过程在电解池的阴极进行,A错误;该催化过程中,C元素的化合价降低,CO2发生了还原反应,B错误;CO2分子中的C原子采取sp杂化,CO2分子得一个电子后,C原子的杂化方式改变,则甲、乙中C原子的杂化类型不同,C正确;催化剂吸附CO2中的C原子,CO2分子中的C原子带正电荷,故催化剂原子吸附CO2中带正电的部分,D错误。
6. (2023·淮安期初)炼油、石化等含S2-工业废水可通过催化氧化法进行处理。将MnO2嵌于聚苯胺(高温会分解)表面制成催化剂,碱性条件下,催化氧化废水的机理如图所示。下列有关说法错误的是(C)
A. 催化剂因S覆盖表面或进入空位而失效,高温灼烧后也不可继续使用
B. 该反应过程的总反应为
O2+2H2O+2S2-4OH-+2S↓
C. 反应过程中只有硫元素被氧化
D. 反应Ⅲ的ΔH >0
【解析】 反应中生成硫单质,生成的S覆盖在催化剂表面或进入催化剂内空位处,阻碍了反应的进行,导致催化剂使用一段时间后催化效率会下降,高温下聚苯胺会分解,故高温灼烧后不可继续使用,A正确;该催化氧化过程是在碱性条件下,硫离子在催化作用下被O2氧化成硫单质:O2+2H2O+2S2-4OH-+2S↓,B正确;由题干图示信息可知,反应过程中锰形成的化学键数目发生改变,化合价升高,C错误;由题干图示信息可知,反应Ⅲ为化学键断裂,为吸热反应,故ΔH >0,D正确。
7. (2023·如东期初)活性Fe3O4-x催化反应:H2(g)+HCO(aq)===HCOO-(aq)+H2O(l),进而可制得甲酸,反应机理如图所示。下列说法正确的是(D)
A. 该反应的ΔH>0
B. 该反应的平衡常数K=
C. 反应前后,碳原子的杂化方式和化合价均没有发生变化
D. 如图所示的反应机理中,步骤Ⅰ可理解为带部分负电荷的氢与HCO中带部分正电荷的碳结合,带部分正电荷的氢与带部分负电荷的羟基氧结合生成水,HCO转化为HCOO-
【解析】 该反应为气体分子数减小的反应,ΔS<0,因该反应能自发进行,即ΔH-TΔS<0,故ΔH<0,A错误;水为纯液体,不列入K,B错误;反应前后,碳元素的化合价由+4变为+2,C错误;氧的电负性大于碳,HCO中碳带正电荷、氧带负电荷,步骤Ⅰ可理解为带部分负电荷的氢与HCO中带部分正电荷的碳结合,带部分正电荷的氢与带部分负电荷的羟基氧结合生成水,HCO转化为HCOO-,D正确。
8. (2024·苏州期末)在压强0.7 MPa、温度370 ℃下,化合物WS2催化反应H2S+CH3OH===H2O+CH3SH可用于制备甲硫醇,其反应过程如图所示。下列说法正确的是(B)
A. 该反应的平衡常数K=
B. 过程Ⅰ存在反应物吸附,S—H没有断裂
C. 图中“”代表S原子
D. 若用CH3OD代替CH3OH,则生成CH3SD
【解析】 0.7 MPa、370 ℃时,H2O为气态,应列入平衡常数表达式中,A错误;由图可知,CH3OH、H2S中略带负电荷的O、S均与大灰球相连,说明大灰球代表的是W原子,C错误;由图中过程Ⅲ可知,在该过程中断裂了C—O,若用CH3OD代替CH3OH,则应生成CH3SH,D错误。
9. (2023·苏州期中)利用CO2和H2组成原电池,在Pt电极的催化下可以生成甲烷,总反应为CO2(g)+4H2(g)===CH4(g)+2H2O(g)。装置中正负极之间采用质子交换膜分隔,在电极上CO2先转化为*CO吸附在催化剂表面,随后生成甲烷,部分机理如图所示。下列说法正确的是(D)
A. 总反应的平衡常数K=
B. 正极获得CO的电极反应式:
2H++CO2-2e-===CO+H2O
C. 气体中CO2的浓度越高,越利于甲烷的生成
D. 在催化剂表面生成CH4的反应为
*CO+6H===CH4+H2O
【解析】 总反应的平衡常数K=,A错误;正极应得到电子,B错误;气体中CO2的浓度过高,可能占据催化剂表面活性位点,甲烷的生成速率不一定快,C错误。
10. (2023·无锡期中)CO2氧化乙苯脱氢制苯乙烯的反应的化学方程式为+CO2(g)+H2O(g)+CO(g),其反应历程如图所示。下列有关说法正确的是(D)
A. 该反应的ΔS<0
B. 该反应的平衡常数表达式为K=
C. 催化剂表面酸性越强,苯乙烯的产率越高
D. 过程③可能生成副产物
【解析】 该反应为气体分子数增大的反应,故ΔS>0,A错误;H2O为气态,应列入K,B错误;酸性越强,的吸附能力减弱,不利乙苯转化率的提高,C错误;过程③ 中和可生成,D正确。
11. (2024·无锡期末)MOFs是一种金属团簇化合物材料,具有多孔结构,其吸收H2S的机理如图所示(R表示):
(1) 适当增大MOFs材料中锌含量,可提高吸附H2S的总量,原因是适当增大MOFs材料中锌含量,提高配位中心(吸附中心)的数量,从而提高吸附H2S的总量。
(2) 状态Ⅲ脱除H2S转变为状态Ⅰ,该过程可描述为Zn===S断裂,H—O断裂;H与S形成H2S分子中S—H,Zn与O形成Zn—O(仅从断键和成键角度描述)。
【解析】 (1) 由图Ⅰ可知,Zn是配位中心,H2S可被Zn吸附,故适当增大MOFs材料中锌含量,可提高配位中心的数量,从而提高吸附H2S的总量。
高考特训14 化学反应原理小综合 化学反应机理
1. (2024·常州期末)固载Ru基催化剂催化反应CO2(g)+H2(g)===HCOOH(g)是实现CO2资源化的重要途径。将一定比例的CO2和H2的混合气体以一定流速通过装有催化剂的反应器,在反应器出口处检测到大量CO,其选择性高达90%以上。下列说法错误的是( )
A. HCOOH既有酸性,又有还原性
B. 该反应的平衡常数K=
C. 该反应中每消耗1 mol H2,转移电子的数目约为2×6.02×1023
D. 该反应可能经历了以下过程:①CO2+H2===CO+H2O、②CO+H2O===HCOOH,且反应①的活化能大于反应②
2. (2024·苏锡常镇一模)对于反应2SO2(g)+O2(g)2SO3(g),下列有关说法正确的是( )
A. 该反应的ΔS>0
B. 该反应平衡常数的表达式为K=
C. 反应中每消耗22.4 L O2(标准状况),转移电子数约为2×6.02×1023
D. 温度不变,提高c起始(O2)或增大反应压强,均能提高反应速率和SO2的转化率
3. (2024·南京、盐城一模)反应CH4(g)+2NO2(g)CO2(g)+N2(g)+2H2O(g)可用于尾气脱硝。下列说法正确的是( )
A. 该反应的ΔS<0
B. 该反应达到平衡后,移除部分H2O(g),正反应速率增大
C. 提高n(NO2)∶n(CH4)的比例,可增大NO2的平衡转化率
D. 该反应每消耗1 mol NO2,转移电子的数目约为4×6.02×1023
4. (2024·南通一模)反应2C2H4(g)+6NO(g)+3O2(g)===4CO2(g)+4H2O(g)+3N2(g)可用于去除氮氧化物,Cu+催化该反应的过程如图所示。下列说法正确的是( )
A. 反应过程中,Cu+参与反应,降低了反应的焓变
B. 该反应的平衡常数K=
C. 其他条件不变时,增大,NO的平衡转化率下降
D. 步骤Ⅲ中每消耗1 mol Cu+(NO2),转移电子数目约为4×6.02×1023
5. (2024·无锡期末)电催化是利用催化剂电极进行电解以实现物质转变的前沿方法。使用单原子催化剂电催化将CO2转化为CO的部分机理如图所示。下列说法正确的是( )
A. 该催化过程在电解池的阳极进行
B. 该催化过程CO2发生了氧化反应
C. 甲、乙中的C原子的杂化类型不同
D. 催化剂原子吸附CO2中带负电的部分
6. (2023·淮安期初)炼油、石化等含S2-工业废水可通过催化氧化法进行处理。将MnO2嵌于聚苯胺(高温会分解)表面制成催化剂,碱性条件下,催化氧化废水的机理如图所示。下列有关说法错误的是( )
A. 催化剂因S覆盖表面或进入空位而失效,高温灼烧后也不可继续使用
B. 该反应过程的总反应为O2+2H2O+2S2-4OH-+2S↓
C. 反应过程中只有硫元素被氧化
D. 反应Ⅲ的ΔH >0
7. (2023·如东期初)活性Fe3O4-x催化反应:H2(g)+HCO(aq)===HCOO-(aq)+H2O(l),进而可制得甲酸,反应机理如图所示。下列说法正确的是( )
A. 该反应的ΔH>0
B. 该反应的平衡常数K=
C. 反应前后,碳原子的杂化方式和化合价均没有发生变化
D. 如图所示的反应机理中,步骤Ⅰ可理解为带部分负电荷的氢与HCO中带部分正电荷的碳结合,带部分正电荷的氢与带部分负电荷的羟基氧结合生成水,HCO转化为HCOO-
8. (2024·苏州期末)在压强0.7 MPa、温度370 ℃下,化合物WS2催化反应H2S+CH3OH===H2O+CH3SH可用于制备甲硫醇,其反应过程如图所示。下列说法正确的是( )
A. 该反应的平衡常数K=
B. 过程Ⅰ存在反应物吸附,S—H没有断裂
C. 图中“”代表S原子
D. 若用CH3OD代替CH3OH,则生成CH3SD
9. (2023·苏州期中)利用CO2和H2组成原电池,在Pt电极的催化下可以生成甲烷,总反应为CO2(g)+4H2(g)===CH4(g)+2H2O(g)。装置中正负极之间采用质子交换膜分隔,在电极上CO2先转化为*CO吸附在催化剂表面,随后生成甲烷,部分机理如图所示。下列说法正确的是( )
A. 总反应的平衡常数K=
B. 正极获得CO的电极反应式:2H++CO2-2e-===CO+H2O
C. 气体中CO2的浓度越高,越利于甲烷的生成
D. 在催化剂表面生成CH4的反应为*CO+6H===CH4+H2O
10. (2023·无锡期中)CO2氧化乙苯脱氢制苯乙烯的反应的化学方程式为+CO2(g)+H2O(g)+CO(g),其反应历程如图所示。下列有关说法正确的是( )
A. 该反应的ΔS<0
B. 该反应的平衡常数表达式为K=
C. 催化剂表面酸性越强,苯乙烯的产率越高
D. 过程③可能生成副产物
11. (2024·无锡期末)MOFs是一种金属团簇化合物材料,具有多孔结构,其吸收H2S的机理如图所示(R表示):
(1) 适当增大MOFs材料中锌含量,可提高吸附H2S的总量,原因是____________________________ _____________________________________________________________________________________________________。
(2) 状态Ⅲ脱除H2S转变为状态Ⅰ,该过程可描述为________________________________________ ________________________________________________________________________________(仅从断键和成键角度描述)。
大单元六 综合与应用
高考特训14 化学反应原理小综合 化学反应机理
1. (2024·常州期末)固载Ru基催化剂催化反应CO2(g)+H2(g)===HCOOH(g)是实现CO2资源化的重要途径。将一定比例的CO2和H2的混合气体以一定流速通过装有催化剂的反应器,在反应器出口处检测到大量CO,其选择性高达90%以上。下列说法错误的是(D)
A. HCOOH既有酸性,又有还原性
B. 该反应的平衡常数K=
C. 该反应中每消耗1 mol H2,转移电子的数目约为2×6.02×1023
D. 该反应可能经历了以下过程:①CO2+H2===CO+H2O、②CO+H2O===HCOOH,且反应①的活化能大于反应②
【解析】 HCOOH可以继续被氧化为CO2,分子中含有—COOH,故其既有还原性,又有酸性,A正确;反应物和生成物都是气体,均可列入平衡常数表达式中,B正确;由CO2(g)+H2(g)===HCOOH(g)知,每消耗1 mol H2,转移2 mol 电子,则转移电子的数目约为2×6.02×1023,C正确;在反应器出口处检测到大量CO,其选择性高达90%以上,说明反应②的速率较慢,故反应②的活化能大于反应①,D错误。
2. (2024·苏锡常镇一模)对于反应2SO2(g)+O2(g)2SO3(g),下列有关说法正确的是(D)
A. 该反应的ΔS>0
B. 该反应平衡常数的表达式为K=
C. 反应中每消耗22.4 L O2(标准状况),转移电子数约为2×6.02×1023
D. 温度不变,提高c起始(O2)或增大反应压强,均能提高反应速率和SO2的转化率
【解析】 该反应前后气体分子数减少,则ΔS<0,A错误;该反应平衡常数的表达式为K=,B错误;每消耗1 mol氧气时,转移4 mol电子,转移电子数约为4×6.02×1023,C错误。
3. (2024·南京、盐城一模)反应CH4(g)+2NO2(g)CO2(g)+N2(g)+2H2O(g)可用于尾气脱硝。下列说法正确的是(D)
A. 该反应的ΔS<0
B. 该反应达到平衡后,移除部分H2O(g),正反应速率增大
C. 提高n(NO2)∶n(CH4)的比例,可增大NO2的平衡转化率
D. 该反应每消耗1 mol NO2,转移电子的数目约为4×6.02×1023
【解析】 该反应为气体分子数增加的反应,则ΔS>0,A错误;H2O(g)是生成物,在该反应达到平衡后,在移除部分H2O(g)的瞬间,逆反应速率减小而正反应速率不变,化学平衡正向移动,B错误;若提高n(NO2)∶n(CH4)的比例,相当于n(CH4)不变、增大n(NO2),CH4的平衡转化率增大,但NO2的平衡转化率降低,C错误。
4. (2024·南通一模)反应2C2H4(g)+6NO(g)+3O2(g)===4CO2(g)+4H2O(g)+3N2(g)可用于去除氮氧化物,Cu+催化该反应的过程如图所示。下列说法正确的是(D)
A. 反应过程中,Cu+参与反应,降低了反应的焓变
B. 该反应的平衡常数
K=
C. 其他条件不变时,增大,NO的平衡转化率下降
D. 步骤Ⅲ中每消耗1 mol Cu+(NO2),转移电子数目约为4×6.02×1023
【解析】 Cu+是反应的催化剂,对反应的焓变无影响,A错误;水为气态,应列入平衡常数表达式,B错误;增大,NO的平衡转化率上升,C错误;步骤Ⅲ中N元素化合价由+4下降到0,则步骤Ⅲ中每消耗1 mol Cu+(NO2),转移电子数目约为4×6.02×1023,D正确。
5. (2024·无锡期末)电催化是利用催化剂电极进行电解以实现物质转变的前沿方法。使用单原子催化剂电催化将CO2转化为CO的部分机理如图所示。下列说法正确的是(C)
A. 该催化过程在电解池的阳极进行
B. 该催化过程CO2发生了氧化反应
C. 甲、乙中的C原子的杂化类型不同
D. 催化剂原子吸附CO2中带负电的部分
【解析】 CO2转变为CO的过程中需要得到电子,故该过程在电解池的阴极进行,A错误;该催化过程中,C元素的化合价降低,CO2发生了还原反应,B错误;CO2分子中的C原子采取sp杂化,CO2分子得一个电子后,C原子的杂化方式改变,则甲、乙中C原子的杂化类型不同,C正确;催化剂吸附CO2中的C原子,CO2分子中的C原子带正电荷,故催化剂原子吸附CO2中带正电的部分,D错误。
6. (2023·淮安期初)炼油、石化等含S2-工业废水可通过催化氧化法进行处理。将MnO2嵌于聚苯胺(高温会分解)表面制成催化剂,碱性条件下,催化氧化废水的机理如图所示。下列有关说法错误的是(C)
A. 催化剂因S覆盖表面或进入空位而失效,高温灼烧后也不可继续使用
B. 该反应过程的总反应为
O2+2H2O+2S2-4OH-+2S↓
C. 反应过程中只有硫元素被氧化
D. 反应Ⅲ的ΔH >0
【解析】 反应中生成硫单质,生成的S覆盖在催化剂表面或进入催化剂内空位处,阻碍了反应的进行,导致催化剂使用一段时间后催化效率会下降,高温下聚苯胺会分解,故高温灼烧后不可继续使用,A正确;该催化氧化过程是在碱性条件下,硫离子在催化作用下被O2氧化成硫单质:O2+2H2O+2S2-4OH-+2S↓,B正确;由题干图示信息可知,反应过程中锰形成的化学键数目发生改变,化合价升高,C错误;由题干图示信息可知,反应Ⅲ为化学键断裂,为吸热反应,故ΔH >0,D正确。
7. (2023·如东期初)活性Fe3O4-x催化反应:H2(g)+HCO(aq)===HCOO-(aq)+H2O(l),进而可制得甲酸,反应机理如图所示。下列说法正确的是(D)
A. 该反应的ΔH>0
B. 该反应的平衡常数K=
C. 反应前后,碳原子的杂化方式和化合价均没有发生变化
D. 如图所示的反应机理中,步骤Ⅰ可理解为带部分负电荷的氢与HCO中带部分正电荷的碳结合,带部分正电荷的氢与带部分负电荷的羟基氧结合生成水,HCO转化为HCOO-
【解析】 该反应为气体分子数减小的反应,ΔS<0,因该反应能自发进行,即ΔH-TΔS<0,故ΔH<0,A错误;水为纯液体,不列入K,B错误;反应前后,碳元素的化合价由+4变为+2,C错误;氧的电负性大于碳,HCO中碳带正电荷、氧带负电荷,步骤Ⅰ可理解为带部分负电荷的氢与HCO中带部分正电荷的碳结合,带部分正电荷的氢与带部分负电荷的羟基氧结合生成水,HCO转化为HCOO-,D正确。
8. (2024·苏州期末)在压强0.7 MPa、温度370 ℃下,化合物WS2催化反应H2S+CH3OH===H2O+CH3SH可用于制备甲硫醇,其反应过程如图所示。下列说法正确的是(B)
A. 该反应的平衡常数K=
B. 过程Ⅰ存在反应物吸附,S—H没有断裂
C. 图中“”代表S原子
D. 若用CH3OD代替CH3OH,则生成CH3SD
【解析】 0.7 MPa、370 ℃时,H2O为气态,应列入平衡常数表达式中,A错误;由图可知,CH3OH、H2S中略带负电荷的O、S均与大灰球相连,说明大灰球代表的是W原子,C错误;由图中过程Ⅲ可知,在该过程中断裂了C—O,若用CH3OD代替CH3OH,则应生成CH3SH,D错误。
9. (2023·苏州期中)利用CO2和H2组成原电池,在Pt电极的催化下可以生成甲烷,总反应为CO2(g)+4H2(g)===CH4(g)+2H2O(g)。装置中正负极之间采用质子交换膜分隔,在电极上CO2先转化为*CO吸附在催化剂表面,随后生成甲烷,部分机理如图所示。下列说法正确的是(D)
A. 总反应的平衡常数K=
B. 正极获得CO的电极反应式:
2H++CO2-2e-===CO+H2O
C. 气体中CO2的浓度越高,越利于甲烷的生成
D. 在催化剂表面生成CH4的反应为
*CO+6H===CH4+H2O
【解析】 总反应的平衡常数K=,A错误;正极应得到电子,B错误;气体中CO2的浓度过高,可能占据催化剂表面活性位点,甲烷的生成速率不一定快,C错误。
10. (2023·无锡期中)CO2氧化乙苯脱氢制苯乙烯的反应的化学方程式为+CO2(g)+H2O(g)+CO(g),其反应历程如图所示。下列有关说法正确的是(D)
A. 该反应的ΔS<0
B. 该反应的平衡常数表达式为K=
C. 催化剂表面酸性越强,苯乙烯的产率越高
D. 过程③可能生成副产物
【解析】 该反应为气体分子数增大的反应,故ΔS>0,A错误;H2O为气态,应列入K,B错误;酸性越强,的吸附能力减弱,不利乙苯转化率的提高,C错误;过程③ 中和可生成,D正确。
11. (2024·无锡期末)MOFs是一种金属团簇化合物材料,具有多孔结构,其吸收H2S的机理如图所示(R表示):
(1) 适当增大MOFs材料中锌含量,可提高吸附H2S的总量,原因是适当增大MOFs材料中锌含量,提高配位中心(吸附中心)的数量,从而提高吸附H2S的总量。
(2) 状态Ⅲ脱除H2S转变为状态Ⅰ,该过程可描述为Zn===S断裂,H—O断裂;H与S形成H2S分子中S—H,Zn与O形成Zn—O(仅从断键和成键角度描述)。
【解析】 (1) 由图Ⅰ可知,Zn是配位中心,H2S可被Zn吸附,故适当增大MOFs材料中锌含量,可提高配位中心的数量,从而提高吸附H2S的总量。
同课章节目录
