高考特训15 化学反应速率与化学平衡综合(含解析)2026届高三化学一轮大单元复习
文档属性
| 名称 | 高考特训15 化学反应速率与化学平衡综合(含解析)2026届高三化学一轮大单元复习 |

|
|
| 格式 | doc | ||
| 文件大小 | 485.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-23 00:00:00 | ||
图片预览

文档简介
高考特训15 化学反应速率与化学平衡综合
1. 某温度下,在一恒容密闭容器中进行如下两个反应并达到平衡状态:
①2X(g)+Y(g)Z(s)+2Q(g) ΔH1<0;
②M(g)+N(g)R(g)+Q(g) ΔH2>0。
下列叙述错误的是( )
A. 加入适量Z,①②平衡均不移动
B. 通入稀有气体Ar,①平衡正向移动
C. 降温时无法判断Q浓度的增减
D. 通入Y,N的浓度增大
2. (2024·泰州一模)二甲醚和水蒸气制氢气可作为燃料电池的氢能源,发生的主要反应如下:
反应Ⅰ. CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH1>0
反应Ⅱ. CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH2>0
反应Ⅲ. CO2(g)+H2(g)===CO(g)+H2O(g) ΔH3>0
在恒压下,将一定比例的二甲醚和水蒸气混合后,以一定流速通过装有催化剂的反应器,反应相同时间测得的CH3OCH3实际转化率、CO2实际选择性与CO2平衡选择性随温度的变化如图所示。CO2的选择性=×100%。下列说法不正确的是( )
A. 曲线a表示CH3OCH3实际转化率随温度的变化
B. 200 ℃时,反应Ⅱ的速率大于反应Ⅲ的速率
C. 适当增加,有利于提高H2的产率
D. 一定温度下,若增大压强,CO的平衡产量不变
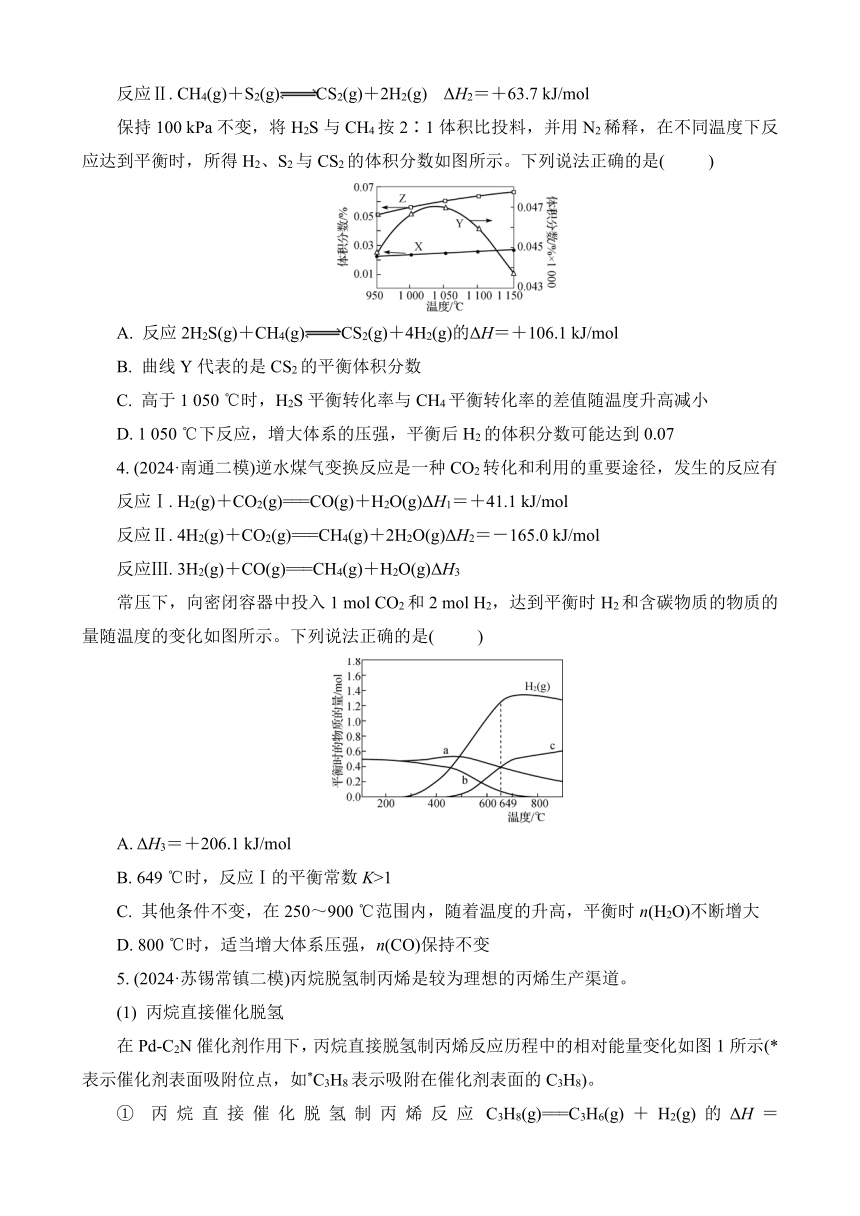
3. (2024·苏锡常镇一模)采用热分解法脱除沼气中的H2S过程中涉及的主要反应如下:
反应Ⅰ. 2H2S(g)2H2(g)+S2(g) ΔH1=+169.8 kJ/mol
反应Ⅱ. CH4(g)+S2(g)CS2(g)+2H2(g) ΔH2=+63.7 kJ/mol
保持100 kPa不变,将H2S与CH4按2∶1体积比投料,并用N2稀释,在不同温度下反应达到平衡时,所得H2、S2与CS2的体积分数如图所示。下列说法正确的是( )
A. 反应2H2S(g)+CH4(g)CS2(g)+4H2(g)的ΔH=+106.1 kJ/mol
B. 曲线Y代表的是CS2的平衡体积分数
C. 高于1 050 ℃时,H2S平衡转化率与CH4平衡转化率的差值随温度升高减小
D. 1 050 ℃下反应,增大体系的压强,平衡后H2的体积分数可能达到0.07
4. (2024·南通二模)逆水煤气变换反应是一种CO2转化和利用的重要途径,发生的反应有
反应Ⅰ. H2(g)+CO2(g)===CO(g)+H2O(g)ΔH1=+41.1 kJ/mol
反应Ⅱ. 4H2(g)+CO2(g)===CH4(g)+2H2O(g)ΔH2=-165.0 kJ/mol
反应Ⅲ. 3H2(g)+CO(g)===CH4(g)+H2O(g)ΔH3
常压下,向密闭容器中投入1 mol CO2和2 mol H2,达到平衡时H2和含碳物质的物质的量随温度的变化如图所示。下列说法正确的是( )
A. ΔH3=+206.1 kJ/mol
B. 649 ℃时,反应Ⅰ的平衡常数K>1
C. 其他条件不变,在250~900 ℃范围内,随着温度的升高,平衡时n(H2O)不断增大
D. 800 ℃时,适当增大体系压强,n(CO)保持不变
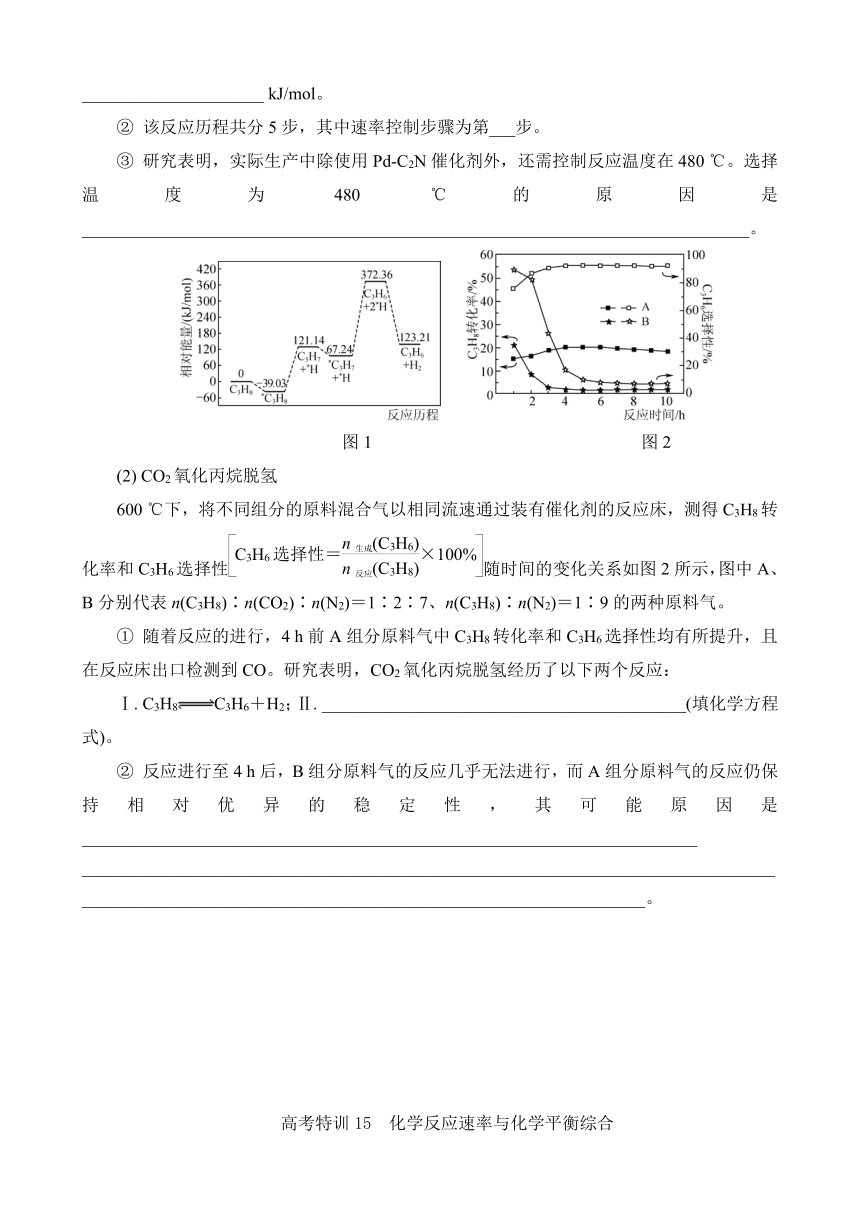
5. (2024·苏锡常镇二模)丙烷脱氢制丙烯是较为理想的丙烯生产渠道。
(1) 丙烷直接催化脱氢
在Pd-C2N催化剂作用下,丙烷直接脱氢制丙烯反应历程中的相对能量变化如图1所示(*表示催化剂表面吸附位点,如*C3H8表示吸附在催化剂表面的C3H8)。
① 丙烷直接催化脱氢制丙烯反应C3H8(g)===C3H6(g)+H2(g)的ΔH=_____________________ kJ/mol。
② 该反应历程共分5步,其中速率控制步骤为第___步。
③ 研究表明,实际生产中除使用Pd-C2N催化剂外,还需控制反应温度在480 ℃。选择温度为480 ℃的原因是_____________________________________________________________________________。
图1 图2
(2) CO2氧化丙烷脱氢
600 ℃下,将不同组分的原料混合气以相同流速通过装有催化剂的反应床,测得C3H8转化率和C3H6选择性随时间的变化关系如图2所示,图中A、B分别代表n(C3H8)∶n(CO2)∶n(N2)=1∶2∶7、n(C3H8)∶n(N2)=1∶9的两种原料气。
① 随着反应的进行,4 h前A组分原料气中C3H8转化率和C3H6选择性均有所提升,且在反应床出口检测到CO。研究表明,CO2氧化丙烷脱氢经历了以下两个反应:
Ⅰ. C3H8C3H6+H2;Ⅱ. __________________________________________(填化学方程式)。
② 反应进行至4 h后,B组分原料气的反应几乎无法进行,而A组分原料气的反应仍保持相对优异的稳定性,其可能原因是_______________________________________________________________________ _________________________________________________________________________________________________________________________________________________。
高考特训15 化学反应速率与化学平衡综合
1. 某温度下,在一恒容密闭容器中进行如下两个反应并达到平衡状态:
①2X(g)+Y(g)Z(s)+2Q(g) ΔH1<0;
②M(g)+N(g)R(g)+Q(g) ΔH2>0。
下列叙述错误的是(B)
A. 加入适量Z,①②平衡均不移动
B. 通入稀有气体Ar,①平衡正向移动
C. 降温时无法判断Q浓度的增减
D. 通入Y,N的浓度增大
【解析】 Z是固体,对平衡移动无影响,A正确;恒容通入Ar,参与反应的各物质浓度不变,平衡不移动,B错误;反应①是放热反应,反应②是吸热反应,降低温度,两个反应的移动方向不同,反应物的起始浓度未知,无法判断Q的浓度增减,C正确;通入Y,反应①正向移动,Q的浓度增大,导致反应②逆向移动,则N的浓度增大,D正确。
2. (2024·泰州一模)二甲醚和水蒸气制氢气可作为燃料电池的氢能源,发生的主要反应如下:
反应Ⅰ. CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH1>0
反应Ⅱ. CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH2>0
反应Ⅲ. CO2(g)+H2(g)===CO(g)+H2O(g) ΔH3>0
在恒压下,将一定比例的二甲醚和水蒸气混合后,以一定流速通过装有催化剂的反应器,反应相同时间测得的CH3OCH3实际转化率、CO2实际选择性与CO2平衡选择性随温度的变化如图所示。CO2的选择性=×100%。下列说法不正确的是(D)
A. 曲线a表示CH3OCH3实际转化率随温度的变化
B. 200 ℃时,反应Ⅱ的速率大于反应Ⅲ的速率
C. 适当增加,有利于提高H2的产率
D. 一定温度下,若增大压强,CO的平衡产量不变
【解析】 CO2实际选择性与CO2平衡选择性随温度的变化的走势变化应该相同,故曲线b为CO2实际选择性,则曲线a为CH3OCH3实际转化率,A正确;在200 ℃时,CO2实际选择性大于平衡选择性,可知此温度下,反应Ⅱ的速率大于反应Ⅲ,B正确;适当增加,CH3OCH3的转化率增大,促进反应Ⅱ平衡正向进行、反应Ⅲ平衡逆向进行,从而提高氢气的产率,C正确;增大压强会导致反应Ⅱ平衡逆向移动,从而导致反应Ⅲ平衡逆向移动,CO的平衡产量会减小,D错误。
3. (2024·苏锡常镇一模)采用热分解法脱除沼气中的H2S过程中涉及的主要反应如下:
反应Ⅰ. 2H2S(g)2H2(g)+S2(g) ΔH1=+169.8 kJ/mol
反应Ⅱ. CH4(g)+S2(g)CS2(g)+2H2(g) ΔH2=+63.7 kJ/mol
保持100 kPa不变,将H2S与CH4按2∶1体积比投料,并用N2稀释,在不同温度下反应达到平衡时,所得H2、S2与CS2的体积分数如图所示。下列说法正确的是(C)
A. 反应2H2S(g)+CH4(g)CS2(g)+4H2(g)的ΔH=+106.1 kJ/mol
B. 曲线Y代表的是CS2的平衡体积分数
C. 高于1 050 ℃时,H2S平衡转化率与CH4平衡转化率的差值随温度升高减小
D. 1 050 ℃下反应,增大体系的压强,平衡后H2的体积分数可能达到0.07
【解析】 根据盖斯定律,反应Ⅰ+反应Ⅱ可得:2H2S(g)+CH4(g)CS2(g)+4H2(g) ΔH=+233.5 kJ/mol,A错误;升高温度,反应Ⅰ、Ⅱ平衡均正向移动,H2和CS2体积分数增大,根据数量关系,曲线Z代表H2,曲线X代表CS2,S2是反应Ⅰ的生成物同时又是反应Ⅱ的反应物,因此曲线Y代表S2,B错误;1 050~1 150 ℃之间,S2与CS2的体积分数差值越来越小,所以H2S平衡转化率与CH4平衡转化率的差值随温度升高减小,C正确;1 050 ℃下反应,反应Ⅰ和反应Ⅱ都是气体体积增大的反应,增大体系的压强,平衡会逆向移动,平衡后H2的体积分数小于0.07,D错误。
4. (2024·南通二模)逆水煤气变换反应是一种CO2转化和利用的重要途径,发生的反应有
反应Ⅰ. H2(g)+CO2(g)===CO(g)+H2O(g)ΔH1=+41.1 kJ/mol
反应Ⅱ. 4H2(g)+CO2(g)===CH4(g)+2H2O(g)ΔH2=-165.0 kJ/mol
反应Ⅲ. 3H2(g)+CO(g)===CH4(g)+H2O(g)ΔH3
常压下,向密闭容器中投入1 mol CO2和2 mol H2,达到平衡时H2和含碳物质的物质的量随温度的变化如图所示。下列说法正确的是(D)
A. ΔH3=+206.1 kJ/mol
B. 649 ℃时,反应Ⅰ的平衡常数K>1
C. 其他条件不变,在250~900 ℃范围内,随着温度的升高,平衡时n(H2O)不断增大
D. 800 ℃时,适当增大体系压强,n(CO)保持不变
【解析】 根据盖斯定律,反应Ⅲ=反应Ⅱ-反应Ⅰ,故ΔH3=ΔH2-ΔH1=[-165.0 -(+41.1)] kJ/mol=-206.1 kJ/mol,A错误;随着温度的升高,反应Ⅰ平衡右移,反应Ⅱ、Ⅲ平衡左移,故n(CO)逐渐升高、n(CH4)逐渐降低,则曲线c代表n(CO),a、b代表n(CH4)和n(CO2),随着温度升高,n(H2)逐渐升高,而n(CO2)逐渐减小,则温度对反应Ⅱ、Ⅲ的影响程度大于对反应Ⅰ的影响程度,故n(CH4)降低的程度大于n(CO2)降低的程度,即曲线a表示n(CO2)、曲线b表示n(CH4);由图可知,649 ℃时n(CO)=n(CO2),此时n(H2)≈1.2 mol,n(CH4)≈0.1 mol,反应消耗的n(H2)=0.8 mol,根据H元素守恒可知n(H2O)=0.6 mol,反应Ⅰ的平衡常数K=<1,B错误;在250~700 ℃范围内,随着温度的升高,n(H2)增大,温度对反应Ⅱ、Ⅲ的影响程度大于对反应Ⅰ的影响程度,则n(H2O)减小,C错误;在800 ℃时的平衡体系中几乎没有CH4,则体系中只进行反应Ⅰ,适当增大体系压强,反应Ⅰ平衡不移动,则n(CO)保持不变,D正确。
5. (2024·苏锡常镇二模)丙烷脱氢制丙烯是较为理想的丙烯生产渠道。
(1) 丙烷直接催化脱氢
在Pd-C2N催化剂作用下,丙烷直接脱氢制丙烯反应历程中的相对能量变化如图1所示(*表示催化剂表面吸附位点,如*C3H8表示吸附在催化剂表面的C3H8)。
① 丙烷直接催化脱氢制丙烯反应C3H8(g)===C3H6(g)+H2(g)的ΔH=+123.21 kJ/mol。
② 该反应历程共分5步,其中速率控制步骤为第4步。
③ 研究表明,实际生产中除使用Pd-C2N催化剂外,还需控制反应温度在480 ℃。选择温度为480 ℃的原因是该温度下催化剂的活性较高,反应速率较快,丙烯的产率较高。
图1 图2
(2) CO2氧化丙烷脱氢
600 ℃下,将不同组分的原料混合气以相同流速通过装有催化剂的反应床,测得C3H8转化率和C3H6选择性随时间的变化关系如图2所示,图中A、B分别代表n(C3H8)∶n(CO2)∶n(N2)=1∶2∶7、n(C3H8)∶n(N2)=1∶9的两种原料气。
① 随着反应的进行,4 h前A组分原料气中C3H8转化率和C3H6选择性均有所提升,且在反应床出口检测到CO。研究表明,CO2氧化丙烷脱氢经历了以下两个反应:
Ⅰ. C3H8C3H6+H2;Ⅱ. CO2+H2CO+H2O(填化学方程式)。
② 反应进行至4 h后,B组分原料气的反应几乎无法进行,而A组分原料气的反应仍保持相对优异的稳定性,其可能原因是丙烷直接脱氢时发生副反应生成积碳覆盖在催化剂表面上,阻碍了反应的进行;而在CO2氧化丙烷脱氢时,CO2能发生反应:CO2+C2CO,及时消除积碳。
【解析】 (1) ① 由图1看出,C3H8的相对能量为0,而产物C3H6和H2的相对能量为123.21 kJ/mol,故该反应为吸热反应,该反应的ΔH=+123.21 kJ/mol。② 由图示中的数据可以看出,第4步反应的活化能最大,反应速率最慢,为整个反应的速率控制步骤。(2) ① 由于原料气中含有CO2,而出口气中含有CO,故第二步反应中CO2被H2还原为CO,反应的化学方程式为CO2+H2CO+H2O。
1. 某温度下,在一恒容密闭容器中进行如下两个反应并达到平衡状态:
①2X(g)+Y(g)Z(s)+2Q(g) ΔH1<0;
②M(g)+N(g)R(g)+Q(g) ΔH2>0。
下列叙述错误的是( )
A. 加入适量Z,①②平衡均不移动
B. 通入稀有气体Ar,①平衡正向移动
C. 降温时无法判断Q浓度的增减
D. 通入Y,N的浓度增大
2. (2024·泰州一模)二甲醚和水蒸气制氢气可作为燃料电池的氢能源,发生的主要反应如下:
反应Ⅰ. CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH1>0
反应Ⅱ. CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH2>0
反应Ⅲ. CO2(g)+H2(g)===CO(g)+H2O(g) ΔH3>0
在恒压下,将一定比例的二甲醚和水蒸气混合后,以一定流速通过装有催化剂的反应器,反应相同时间测得的CH3OCH3实际转化率、CO2实际选择性与CO2平衡选择性随温度的变化如图所示。CO2的选择性=×100%。下列说法不正确的是( )
A. 曲线a表示CH3OCH3实际转化率随温度的变化
B. 200 ℃时,反应Ⅱ的速率大于反应Ⅲ的速率
C. 适当增加,有利于提高H2的产率
D. 一定温度下,若增大压强,CO的平衡产量不变
3. (2024·苏锡常镇一模)采用热分解法脱除沼气中的H2S过程中涉及的主要反应如下:
反应Ⅰ. 2H2S(g)2H2(g)+S2(g) ΔH1=+169.8 kJ/mol
反应Ⅱ. CH4(g)+S2(g)CS2(g)+2H2(g) ΔH2=+63.7 kJ/mol
保持100 kPa不变,将H2S与CH4按2∶1体积比投料,并用N2稀释,在不同温度下反应达到平衡时,所得H2、S2与CS2的体积分数如图所示。下列说法正确的是( )
A. 反应2H2S(g)+CH4(g)CS2(g)+4H2(g)的ΔH=+106.1 kJ/mol
B. 曲线Y代表的是CS2的平衡体积分数
C. 高于1 050 ℃时,H2S平衡转化率与CH4平衡转化率的差值随温度升高减小
D. 1 050 ℃下反应,增大体系的压强,平衡后H2的体积分数可能达到0.07
4. (2024·南通二模)逆水煤气变换反应是一种CO2转化和利用的重要途径,发生的反应有
反应Ⅰ. H2(g)+CO2(g)===CO(g)+H2O(g)ΔH1=+41.1 kJ/mol
反应Ⅱ. 4H2(g)+CO2(g)===CH4(g)+2H2O(g)ΔH2=-165.0 kJ/mol
反应Ⅲ. 3H2(g)+CO(g)===CH4(g)+H2O(g)ΔH3
常压下,向密闭容器中投入1 mol CO2和2 mol H2,达到平衡时H2和含碳物质的物质的量随温度的变化如图所示。下列说法正确的是( )
A. ΔH3=+206.1 kJ/mol
B. 649 ℃时,反应Ⅰ的平衡常数K>1
C. 其他条件不变,在250~900 ℃范围内,随着温度的升高,平衡时n(H2O)不断增大
D. 800 ℃时,适当增大体系压强,n(CO)保持不变
5. (2024·苏锡常镇二模)丙烷脱氢制丙烯是较为理想的丙烯生产渠道。
(1) 丙烷直接催化脱氢
在Pd-C2N催化剂作用下,丙烷直接脱氢制丙烯反应历程中的相对能量变化如图1所示(*表示催化剂表面吸附位点,如*C3H8表示吸附在催化剂表面的C3H8)。
① 丙烷直接催化脱氢制丙烯反应C3H8(g)===C3H6(g)+H2(g)的ΔH=_____________________ kJ/mol。
② 该反应历程共分5步,其中速率控制步骤为第___步。
③ 研究表明,实际生产中除使用Pd-C2N催化剂外,还需控制反应温度在480 ℃。选择温度为480 ℃的原因是_____________________________________________________________________________。
图1 图2
(2) CO2氧化丙烷脱氢
600 ℃下,将不同组分的原料混合气以相同流速通过装有催化剂的反应床,测得C3H8转化率和C3H6选择性随时间的变化关系如图2所示,图中A、B分别代表n(C3H8)∶n(CO2)∶n(N2)=1∶2∶7、n(C3H8)∶n(N2)=1∶9的两种原料气。
① 随着反应的进行,4 h前A组分原料气中C3H8转化率和C3H6选择性均有所提升,且在反应床出口检测到CO。研究表明,CO2氧化丙烷脱氢经历了以下两个反应:
Ⅰ. C3H8C3H6+H2;Ⅱ. __________________________________________(填化学方程式)。
② 反应进行至4 h后,B组分原料气的反应几乎无法进行,而A组分原料气的反应仍保持相对优异的稳定性,其可能原因是_______________________________________________________________________ _________________________________________________________________________________________________________________________________________________。
高考特训15 化学反应速率与化学平衡综合
1. 某温度下,在一恒容密闭容器中进行如下两个反应并达到平衡状态:
①2X(g)+Y(g)Z(s)+2Q(g) ΔH1<0;
②M(g)+N(g)R(g)+Q(g) ΔH2>0。
下列叙述错误的是(B)
A. 加入适量Z,①②平衡均不移动
B. 通入稀有气体Ar,①平衡正向移动
C. 降温时无法判断Q浓度的增减
D. 通入Y,N的浓度增大
【解析】 Z是固体,对平衡移动无影响,A正确;恒容通入Ar,参与反应的各物质浓度不变,平衡不移动,B错误;反应①是放热反应,反应②是吸热反应,降低温度,两个反应的移动方向不同,反应物的起始浓度未知,无法判断Q的浓度增减,C正确;通入Y,反应①正向移动,Q的浓度增大,导致反应②逆向移动,则N的浓度增大,D正确。
2. (2024·泰州一模)二甲醚和水蒸气制氢气可作为燃料电池的氢能源,发生的主要反应如下:
反应Ⅰ. CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH1>0
反应Ⅱ. CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH2>0
反应Ⅲ. CO2(g)+H2(g)===CO(g)+H2O(g) ΔH3>0
在恒压下,将一定比例的二甲醚和水蒸气混合后,以一定流速通过装有催化剂的反应器,反应相同时间测得的CH3OCH3实际转化率、CO2实际选择性与CO2平衡选择性随温度的变化如图所示。CO2的选择性=×100%。下列说法不正确的是(D)
A. 曲线a表示CH3OCH3实际转化率随温度的变化
B. 200 ℃时,反应Ⅱ的速率大于反应Ⅲ的速率
C. 适当增加,有利于提高H2的产率
D. 一定温度下,若增大压强,CO的平衡产量不变
【解析】 CO2实际选择性与CO2平衡选择性随温度的变化的走势变化应该相同,故曲线b为CO2实际选择性,则曲线a为CH3OCH3实际转化率,A正确;在200 ℃时,CO2实际选择性大于平衡选择性,可知此温度下,反应Ⅱ的速率大于反应Ⅲ,B正确;适当增加,CH3OCH3的转化率增大,促进反应Ⅱ平衡正向进行、反应Ⅲ平衡逆向进行,从而提高氢气的产率,C正确;增大压强会导致反应Ⅱ平衡逆向移动,从而导致反应Ⅲ平衡逆向移动,CO的平衡产量会减小,D错误。
3. (2024·苏锡常镇一模)采用热分解法脱除沼气中的H2S过程中涉及的主要反应如下:
反应Ⅰ. 2H2S(g)2H2(g)+S2(g) ΔH1=+169.8 kJ/mol
反应Ⅱ. CH4(g)+S2(g)CS2(g)+2H2(g) ΔH2=+63.7 kJ/mol
保持100 kPa不变,将H2S与CH4按2∶1体积比投料,并用N2稀释,在不同温度下反应达到平衡时,所得H2、S2与CS2的体积分数如图所示。下列说法正确的是(C)
A. 反应2H2S(g)+CH4(g)CS2(g)+4H2(g)的ΔH=+106.1 kJ/mol
B. 曲线Y代表的是CS2的平衡体积分数
C. 高于1 050 ℃时,H2S平衡转化率与CH4平衡转化率的差值随温度升高减小
D. 1 050 ℃下反应,增大体系的压强,平衡后H2的体积分数可能达到0.07
【解析】 根据盖斯定律,反应Ⅰ+反应Ⅱ可得:2H2S(g)+CH4(g)CS2(g)+4H2(g) ΔH=+233.5 kJ/mol,A错误;升高温度,反应Ⅰ、Ⅱ平衡均正向移动,H2和CS2体积分数增大,根据数量关系,曲线Z代表H2,曲线X代表CS2,S2是反应Ⅰ的生成物同时又是反应Ⅱ的反应物,因此曲线Y代表S2,B错误;1 050~1 150 ℃之间,S2与CS2的体积分数差值越来越小,所以H2S平衡转化率与CH4平衡转化率的差值随温度升高减小,C正确;1 050 ℃下反应,反应Ⅰ和反应Ⅱ都是气体体积增大的反应,增大体系的压强,平衡会逆向移动,平衡后H2的体积分数小于0.07,D错误。
4. (2024·南通二模)逆水煤气变换反应是一种CO2转化和利用的重要途径,发生的反应有
反应Ⅰ. H2(g)+CO2(g)===CO(g)+H2O(g)ΔH1=+41.1 kJ/mol
反应Ⅱ. 4H2(g)+CO2(g)===CH4(g)+2H2O(g)ΔH2=-165.0 kJ/mol
反应Ⅲ. 3H2(g)+CO(g)===CH4(g)+H2O(g)ΔH3
常压下,向密闭容器中投入1 mol CO2和2 mol H2,达到平衡时H2和含碳物质的物质的量随温度的变化如图所示。下列说法正确的是(D)
A. ΔH3=+206.1 kJ/mol
B. 649 ℃时,反应Ⅰ的平衡常数K>1
C. 其他条件不变,在250~900 ℃范围内,随着温度的升高,平衡时n(H2O)不断增大
D. 800 ℃时,适当增大体系压强,n(CO)保持不变
【解析】 根据盖斯定律,反应Ⅲ=反应Ⅱ-反应Ⅰ,故ΔH3=ΔH2-ΔH1=[-165.0 -(+41.1)] kJ/mol=-206.1 kJ/mol,A错误;随着温度的升高,反应Ⅰ平衡右移,反应Ⅱ、Ⅲ平衡左移,故n(CO)逐渐升高、n(CH4)逐渐降低,则曲线c代表n(CO),a、b代表n(CH4)和n(CO2),随着温度升高,n(H2)逐渐升高,而n(CO2)逐渐减小,则温度对反应Ⅱ、Ⅲ的影响程度大于对反应Ⅰ的影响程度,故n(CH4)降低的程度大于n(CO2)降低的程度,即曲线a表示n(CO2)、曲线b表示n(CH4);由图可知,649 ℃时n(CO)=n(CO2),此时n(H2)≈1.2 mol,n(CH4)≈0.1 mol,反应消耗的n(H2)=0.8 mol,根据H元素守恒可知n(H2O)=0.6 mol,反应Ⅰ的平衡常数K=<1,B错误;在250~700 ℃范围内,随着温度的升高,n(H2)增大,温度对反应Ⅱ、Ⅲ的影响程度大于对反应Ⅰ的影响程度,则n(H2O)减小,C错误;在800 ℃时的平衡体系中几乎没有CH4,则体系中只进行反应Ⅰ,适当增大体系压强,反应Ⅰ平衡不移动,则n(CO)保持不变,D正确。
5. (2024·苏锡常镇二模)丙烷脱氢制丙烯是较为理想的丙烯生产渠道。
(1) 丙烷直接催化脱氢
在Pd-C2N催化剂作用下,丙烷直接脱氢制丙烯反应历程中的相对能量变化如图1所示(*表示催化剂表面吸附位点,如*C3H8表示吸附在催化剂表面的C3H8)。
① 丙烷直接催化脱氢制丙烯反应C3H8(g)===C3H6(g)+H2(g)的ΔH=+123.21 kJ/mol。
② 该反应历程共分5步,其中速率控制步骤为第4步。
③ 研究表明,实际生产中除使用Pd-C2N催化剂外,还需控制反应温度在480 ℃。选择温度为480 ℃的原因是该温度下催化剂的活性较高,反应速率较快,丙烯的产率较高。
图1 图2
(2) CO2氧化丙烷脱氢
600 ℃下,将不同组分的原料混合气以相同流速通过装有催化剂的反应床,测得C3H8转化率和C3H6选择性随时间的变化关系如图2所示,图中A、B分别代表n(C3H8)∶n(CO2)∶n(N2)=1∶2∶7、n(C3H8)∶n(N2)=1∶9的两种原料气。
① 随着反应的进行,4 h前A组分原料气中C3H8转化率和C3H6选择性均有所提升,且在反应床出口检测到CO。研究表明,CO2氧化丙烷脱氢经历了以下两个反应:
Ⅰ. C3H8C3H6+H2;Ⅱ. CO2+H2CO+H2O(填化学方程式)。
② 反应进行至4 h后,B组分原料气的反应几乎无法进行,而A组分原料气的反应仍保持相对优异的稳定性,其可能原因是丙烷直接脱氢时发生副反应生成积碳覆盖在催化剂表面上,阻碍了反应的进行;而在CO2氧化丙烷脱氢时,CO2能发生反应:CO2+C2CO,及时消除积碳。
【解析】 (1) ① 由图1看出,C3H8的相对能量为0,而产物C3H6和H2的相对能量为123.21 kJ/mol,故该反应为吸热反应,该反应的ΔH=+123.21 kJ/mol。② 由图示中的数据可以看出,第4步反应的活化能最大,反应速率最慢,为整个反应的速率控制步骤。(2) ① 由于原料气中含有CO2,而出口气中含有CO,故第二步反应中CO2被H2还原为CO,反应的化学方程式为CO2+H2CO+H2O。
同课章节目录
