安徽省六安市独山中学2024-2025学年高二下学期4月期中考试 化学试题(含答案)
文档属性
| 名称 | 安徽省六安市独山中学2024-2025学年高二下学期4月期中考试 化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 852.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-22 15:54:29 | ||
图片预览




文档简介
独山中学2024-2025春学期高二期中测试化学卷
学校:___________姓名:___________班级:___________考号:___________
相对原子质量:F 19 Cl 35.5 Ca 40 Cu 64
一、单选题(18 * 3 = 54分)
1.改革开放 40 年,我国取得了很多世界瞩目的科技成果,下列说法不正确的是
A.蛟龙号潜水器用到钛合金,22号钛元素属于过渡元素
B.港珠澳大桥用到的合金材料,具有强度大、密度小、耐腐蚀等性能
C.中国天眼传输信息用的光纤材料是硅
D.国产C 919用到的氮化硅陶瓷是新型无机非金属材料
2.龙是中华民族精神的象征,以下说法正确的是
A.“战国青铜双翼神龙”的主要材质为铜合金,其熔点比纯铜要高
B.“东汉玛瑙龙头雕刻品”的主要成分为硅酸盐材料
C.“月白地云龙纹缂丝单朝袍”所使用丝的主要材质为纤维素
D.巴黎奥运会中国代表团的“冠军龙服”用环保再生纤维打造,可减少碳排放
3.下列说法正确的是
A.基态 Cr 原子有 6 个未成对电子
B.元素 Ga 的核外电子排布式为 ,位于元素周期表中 p 区
C.NH3 中 N—H 间的键角比 CH4 中 C—H 间的键角大
D.XY2 分子为 V 形,则 X 原子一定为 sp2 杂化
4.下列几种有机羧酸中,按酸性由强到弱的顺序排列正确的是
①乙酸()②氯乙酸()③三氯乙酸() ④三氟乙酸()
A.②①④③ B.①②③④ C.④③②① D.③②④①
5.中和胃酸药物“达喜”的有效成分为。下列说法正确的是
A.电离能大小: B.电负性大小:
C.半径大小: D.碱性强弱:
6.M(结构如图)常用作农药中间体、橡胶助剂、合成树脂添加剂以及分析试剂等。X、Y、Z、W为短周期原子序数依次增大的主族元素,其中基态X原子内的电子只有1个运动状态,Y、Z位于X的下一周期,基态W原子s和p能级电子数之比为3:5。下列说法正确的是
A.元素电负性:W>Z>Y B.元素第一电离能:Y>Z>W
C.M分子中Y原子的孤电子对数为0 D.M分子中σ键和π键数目之比为4:1
7.2015年10月,中国科学家屠呦呦因为发现了新型抗疟药——青蒿素,获得诺贝尔生理学或医学奖,下列关于青蒿素分子结构的研究中说法正确的是
A.通过核磁共振氢谱能确定青蒿素分子中有三种氢原子
B.通过质谱法能确定青蒿素的相对分子质量为280
C.通过红外光谱能确定青蒿素分子中含有酯基、羟基
D.通过化学反应证明分子中含有过氧基
8.法匹拉韦是治疗新冠肺炎的一种药物,其结构简式如图所示,下列说法不正确的是
A.该分子属于极性分子 B.该分子可以形成分子内氢键
C.该分子中所有N原子均采取杂化 D.该分子中σ键与π键数目之比为
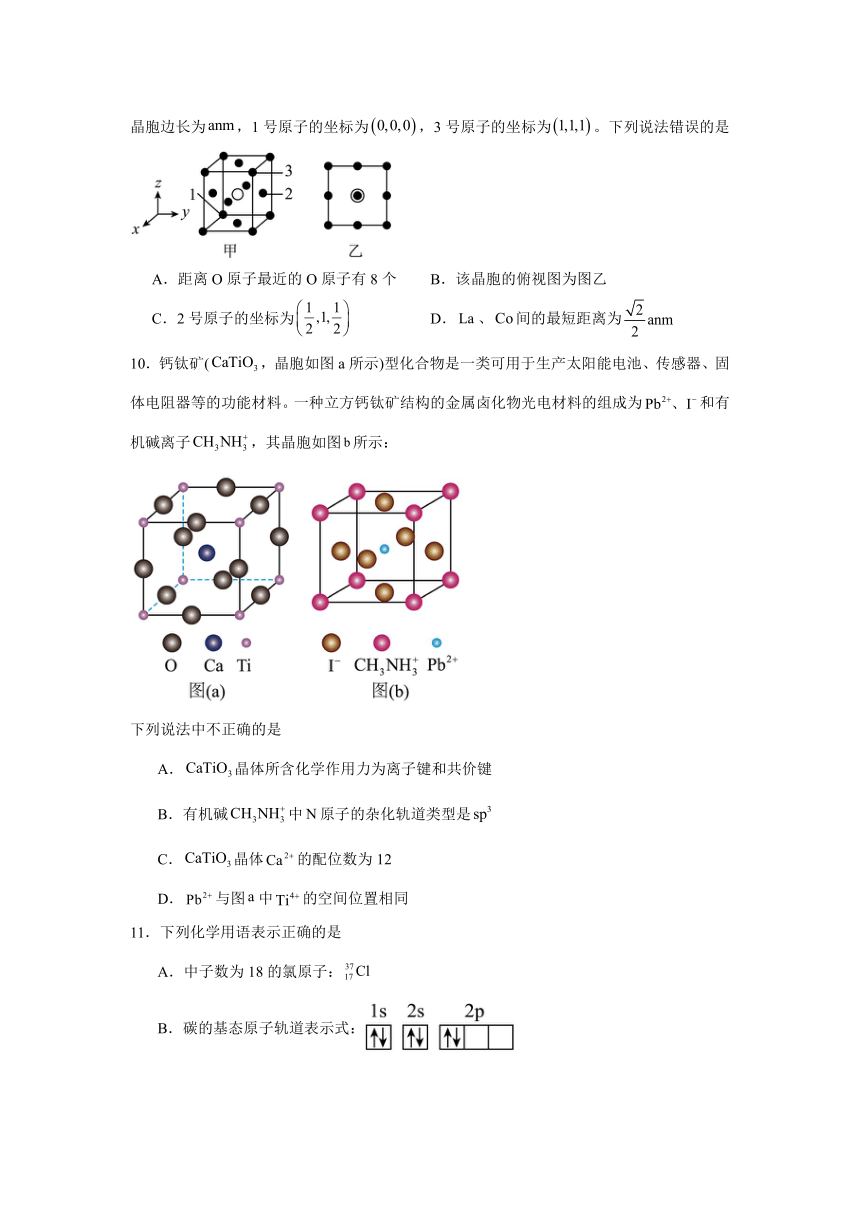
9.钙钛矿型具有优异的化学稳定性和在高温下的良导电性,在催化分解、汽车尾气处理等方面有重要用途,晶胞的结构如图甲所示。设为阿伏加德罗常数的值,晶胞边长为,1号原子的坐标为,3号原子的坐标为。下列说法错误的是
A.距离O原子最近的O原子有8个 B.该晶胞的俯视图为图乙
C.2号原子的坐标为 D.、间的最短距离为
10.钙钛矿(,晶胞如图a所示)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料。一种立方钙钛矿结构的金属卤化物光电材料的组成为和有机碱离子,其晶胞如图所示:
下列说法中不正确的是
A.晶体所含化学作用力为离子键和共价键
B.有机碱中原子的杂化轨道类型是
C.晶体的配位数为12
D.与图中的空间位置相同
11.下列化学用语表示正确的是
A.中子数为18的氯原子:
B.碳的基态原子轨道表示式:
C.的空间结构:(平面三角形)
D.的形成过程:
12.下列说法正确的是
A.CO2、CS2和SiO2的结构相似
B.H—F的键能比H—Cl的键能大,所以HF比HCl稳定,HF的稳定性与HF分子间存在氢键无关
C.干冰易升华,这与分子中C=O键的键能大小有关
D.H2O和H2S的空间构型相似,CaO2和CaH2的化学键类型完全相同
13.关于性质的解释合理的是
选项 性质 解释
A 用蘸有浓盐酸的玻璃棒检验 生成了白雾
B 熔点高于 键的键能比大
C 能与以配位键结合 中氮原子有孤电子对
D 氨水中存在 是离子化合物
A.A B.B C.C D.D
14.下列有机物中,一氯代物有2种的是
①
②
③
④
A.全部 B.①③ C.②④ D.②③
15.下列各组物质性质的比较,结论正确的是
A.在水中的溶解度:
B.沸点:>
C.分子的极性:
D.溶液酸性:CF3COOH16.根据杂化轨道理论和价层电子对互斥模型判断,下列说法不正确的是
选项 粒子 中心原子杂化方式 VSEPR模型 空间结构
A 直线形 直线形
B 四面体形 三角锥形
C 四面体形 平面三角形
D 四面体形 三角锥形
A.A B.B C.C D.D
17.下列对原子结构的描述正确的是
A.Cu原子的价电子排布式为3d94s2
B.Fe的基态原子核外电子共有15种不同空间运动状态
C.S的基态原子的轨道表示式为
D.4f、4s、3d原子轨道的能量关系:E(4f)>E(4s)>E(3d)
18.某种硫的氧化物冷却到289.8 K时凝固得到一种螺旋状单链结构的固体,其结构片段如图所示。
下列有关该物质的说法中正确的是
A.固态物质中S原子的杂化轨道类型是SP2杂化
B.该物质的化学式为SO3
C.从该结构片段分析可知所有的O原子和S原子在同一平面上
D.该结构片段中S-O键之间的夹角约为120
二、解答题
19(14分).主要用作颜料、釉料及磁性材料,利用一种钴矿石(主要成分为,含少量及铝、镁、钙等金属元素的氧化物)制取的工艺流程如图所示。
已知:①浸出液含有的阳离子主要有等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的如下表:
沉淀物
完全沉淀的 3.7 9.6 9.2 5.2
回答下列问题:
(1)“溶浸”过程中,可以加快反应速率和提高原料利用率的方法是 (写出一种即可)。
(2)加入的作用是还原,写出的与反应的离子方程式 。“氧化”过程中被氧化的离子是 。
(3)滤渣2的主要成分为 (写化学式),检验铁元素的离子已被完全沉淀的实验操作及现象:取少量待测液于试管中, 。
(4)已知某温度下。该温度下,沉淀除杂时加入足量的溶液可将沉淀除去,若所得滤液中,则滤液中 。
(5)在空气中充分煅烧,除得到产品外还生成了,写出该反应的化学方程式 。
20(12分).电池在人类生产生活中具有十分重要的作用,单晶硅和铜、锗、镓等的化合物常作为制备太阳能电池的原料。回答下列问题:
(1)基态镓原子的价层电子排布图是 。
(2)硅(Ⅳ)的某化合物结构如图所示,硅原子的杂化方式推断合理的是___________(填标号)。
A. B. C. D.
(3)下列锗卤化物的熔点和沸点,产生该变化规律的原因是 。
熔点/℃ 26 146
沸点/℃ 83.1 186 约400
(4)下图为铜的某种氯化物晶胞示意图,试回答下列问题。
①该物质的化学式是 。原子坐标参数可表示晶胞内部各原子的相对位置,图中各原子标参数分别为;;;则D原子的坐标参数为 。
②晶胞中C、D两原子核间距为,阿伏加德罗常数的值为,则该晶体的密度为 (列出计算式即可)。
21(12分).氟在已知元素中电负性最大、非金属性最强,其单质在1886年才被首次分离出来。
键长/ 121 148
(1)的核外电子排布式为 。
(2)氟氧化物的结构已经确定。
①依据数据推测键的稳定性: (填“>”或“<”)。
②中键角小于中键角,解释原因: 。
(3)是一种有特殊性质的氢化物。
①已知:氢键()中三原子在一条直线上时,作用力最强。测定结果表明,固体中分子排列为锯齿形,画出含3个的结构片段: 。
②溶剂中加入可以解离出和具有正四面体形结构的阴离子,写出该过程的离子方程式: 。
(4)工业上用茧石(主要成分)制备。晶体的一种立方晶胞如图所示。
①晶体中距离最近的有 个。
②晶体中与的最近距离为,阿伏加德罗常数值为。则该晶体的密度 (列出计算式)。
22(8分).青蒿素是烃的含氧衍生物,为无色针状晶体,可溶于乙醇、乙醚,在水中几乎不溶,熔点为156~157℃,是高效的抗疟药。已知:乙醚的沸点为34.5℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。
Ⅰ.实验室用乙醚提取青蒿素的流程如图1所示。
(1)实验前要对青蒿进行粉碎,其目的是 。
(2)操作Ⅱ的名称是 。
(3)操作Ⅲ的主要过程可能是 。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
Ⅱ.用如图2所示的实验装置测定青蒿素实验式的方法如下:将28.2g青蒿素样品放在装置C的硬质玻璃管中,缓缓通入空气数分钟后,使其完全燃烧,精确测定装置D和B实验前后的质量,根据所测数据计算。
(4)装置A中盛放的物质是 ,装置D中盛放的物质是 ,装置B中盛放的物质是 。
(5)该实验装置可能会产生误差,造成测定含氧最偏低,改进方法是 。
(6)用合理改进后的装置进行实验,测得的数据如表所示:
装置 实验前/g 实验后/g
D 22.6 42.4
E 80.2 146.2
则青蒿素的实验式是 。
《独山中学2024-2025春学期高二期中测试化学卷》参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 C D A C A C D C D A
题号 11 12 13 14 15 16 17 18
答案 C B C D B C B B
19(每空2分,共14分).
(1)适当升温、粉碎矿石、适当增加稀硫酸浓度、搅拌等
(2)
(3) 滴入几滴溶液,振荡,溶液不变红
(4)
(5)
20(每空2分,共12分).
(1)
(2)A
(3)锗的氯化物均为分子晶体,随相对分子质量增加,分子间作用力增强,熔沸点升高
(4)
21(前两空每空1分,其它每空2分,共12分).
(1)1s22s22p6
>
F电负性大于氧,故OF2中O周围电子密度相对小于H2O中情形,斥力较小,键角变小
(3) +2HF=[BF4]- + H2F+
(4) 12
22(每空1分,共8分).
(1)增大青蒿与乙醚的接触面积,提高青蒿素的浸漫出速率
(2)蒸馏
(3)B
(4) NaOH溶液 碱石灰
(5)装置E后连接一个防止空气中和进入E的装置
(6)
学校:___________姓名:___________班级:___________考号:___________
相对原子质量:F 19 Cl 35.5 Ca 40 Cu 64
一、单选题(18 * 3 = 54分)
1.改革开放 40 年,我国取得了很多世界瞩目的科技成果,下列说法不正确的是
A.蛟龙号潜水器用到钛合金,22号钛元素属于过渡元素
B.港珠澳大桥用到的合金材料,具有强度大、密度小、耐腐蚀等性能
C.中国天眼传输信息用的光纤材料是硅
D.国产C 919用到的氮化硅陶瓷是新型无机非金属材料
2.龙是中华民族精神的象征,以下说法正确的是
A.“战国青铜双翼神龙”的主要材质为铜合金,其熔点比纯铜要高
B.“东汉玛瑙龙头雕刻品”的主要成分为硅酸盐材料
C.“月白地云龙纹缂丝单朝袍”所使用丝的主要材质为纤维素
D.巴黎奥运会中国代表团的“冠军龙服”用环保再生纤维打造,可减少碳排放
3.下列说法正确的是
A.基态 Cr 原子有 6 个未成对电子
B.元素 Ga 的核外电子排布式为 ,位于元素周期表中 p 区
C.NH3 中 N—H 间的键角比 CH4 中 C—H 间的键角大
D.XY2 分子为 V 形,则 X 原子一定为 sp2 杂化
4.下列几种有机羧酸中,按酸性由强到弱的顺序排列正确的是
①乙酸()②氯乙酸()③三氯乙酸() ④三氟乙酸()
A.②①④③ B.①②③④ C.④③②① D.③②④①
5.中和胃酸药物“达喜”的有效成分为。下列说法正确的是
A.电离能大小: B.电负性大小:
C.半径大小: D.碱性强弱:
6.M(结构如图)常用作农药中间体、橡胶助剂、合成树脂添加剂以及分析试剂等。X、Y、Z、W为短周期原子序数依次增大的主族元素,其中基态X原子内的电子只有1个运动状态,Y、Z位于X的下一周期,基态W原子s和p能级电子数之比为3:5。下列说法正确的是
A.元素电负性:W>Z>Y B.元素第一电离能:Y>Z>W
C.M分子中Y原子的孤电子对数为0 D.M分子中σ键和π键数目之比为4:1
7.2015年10月,中国科学家屠呦呦因为发现了新型抗疟药——青蒿素,获得诺贝尔生理学或医学奖,下列关于青蒿素分子结构的研究中说法正确的是
A.通过核磁共振氢谱能确定青蒿素分子中有三种氢原子
B.通过质谱法能确定青蒿素的相对分子质量为280
C.通过红外光谱能确定青蒿素分子中含有酯基、羟基
D.通过化学反应证明分子中含有过氧基
8.法匹拉韦是治疗新冠肺炎的一种药物,其结构简式如图所示,下列说法不正确的是
A.该分子属于极性分子 B.该分子可以形成分子内氢键
C.该分子中所有N原子均采取杂化 D.该分子中σ键与π键数目之比为
9.钙钛矿型具有优异的化学稳定性和在高温下的良导电性,在催化分解、汽车尾气处理等方面有重要用途,晶胞的结构如图甲所示。设为阿伏加德罗常数的值,晶胞边长为,1号原子的坐标为,3号原子的坐标为。下列说法错误的是
A.距离O原子最近的O原子有8个 B.该晶胞的俯视图为图乙
C.2号原子的坐标为 D.、间的最短距离为
10.钙钛矿(,晶胞如图a所示)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料。一种立方钙钛矿结构的金属卤化物光电材料的组成为和有机碱离子,其晶胞如图所示:
下列说法中不正确的是
A.晶体所含化学作用力为离子键和共价键
B.有机碱中原子的杂化轨道类型是
C.晶体的配位数为12
D.与图中的空间位置相同
11.下列化学用语表示正确的是
A.中子数为18的氯原子:
B.碳的基态原子轨道表示式:
C.的空间结构:(平面三角形)
D.的形成过程:
12.下列说法正确的是
A.CO2、CS2和SiO2的结构相似
B.H—F的键能比H—Cl的键能大,所以HF比HCl稳定,HF的稳定性与HF分子间存在氢键无关
C.干冰易升华,这与分子中C=O键的键能大小有关
D.H2O和H2S的空间构型相似,CaO2和CaH2的化学键类型完全相同
13.关于性质的解释合理的是
选项 性质 解释
A 用蘸有浓盐酸的玻璃棒检验 生成了白雾
B 熔点高于 键的键能比大
C 能与以配位键结合 中氮原子有孤电子对
D 氨水中存在 是离子化合物
A.A B.B C.C D.D
14.下列有机物中,一氯代物有2种的是
①
②
③
④
A.全部 B.①③ C.②④ D.②③
15.下列各组物质性质的比较,结论正确的是
A.在水中的溶解度:
B.沸点:>
C.分子的极性:
D.溶液酸性:CF3COOH
选项 粒子 中心原子杂化方式 VSEPR模型 空间结构
A 直线形 直线形
B 四面体形 三角锥形
C 四面体形 平面三角形
D 四面体形 三角锥形
A.A B.B C.C D.D
17.下列对原子结构的描述正确的是
A.Cu原子的价电子排布式为3d94s2
B.Fe的基态原子核外电子共有15种不同空间运动状态
C.S的基态原子的轨道表示式为
D.4f、4s、3d原子轨道的能量关系:E(4f)>E(4s)>E(3d)
18.某种硫的氧化物冷却到289.8 K时凝固得到一种螺旋状单链结构的固体,其结构片段如图所示。
下列有关该物质的说法中正确的是
A.固态物质中S原子的杂化轨道类型是SP2杂化
B.该物质的化学式为SO3
C.从该结构片段分析可知所有的O原子和S原子在同一平面上
D.该结构片段中S-O键之间的夹角约为120
二、解答题
19(14分).主要用作颜料、釉料及磁性材料,利用一种钴矿石(主要成分为,含少量及铝、镁、钙等金属元素的氧化物)制取的工艺流程如图所示。
已知:①浸出液含有的阳离子主要有等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的如下表:
沉淀物
完全沉淀的 3.7 9.6 9.2 5.2
回答下列问题:
(1)“溶浸”过程中,可以加快反应速率和提高原料利用率的方法是 (写出一种即可)。
(2)加入的作用是还原,写出的与反应的离子方程式 。“氧化”过程中被氧化的离子是 。
(3)滤渣2的主要成分为 (写化学式),检验铁元素的离子已被完全沉淀的实验操作及现象:取少量待测液于试管中, 。
(4)已知某温度下。该温度下,沉淀除杂时加入足量的溶液可将沉淀除去,若所得滤液中,则滤液中 。
(5)在空气中充分煅烧,除得到产品外还生成了,写出该反应的化学方程式 。
20(12分).电池在人类生产生活中具有十分重要的作用,单晶硅和铜、锗、镓等的化合物常作为制备太阳能电池的原料。回答下列问题:
(1)基态镓原子的价层电子排布图是 。
(2)硅(Ⅳ)的某化合物结构如图所示,硅原子的杂化方式推断合理的是___________(填标号)。
A. B. C. D.
(3)下列锗卤化物的熔点和沸点,产生该变化规律的原因是 。
熔点/℃ 26 146
沸点/℃ 83.1 186 约400
(4)下图为铜的某种氯化物晶胞示意图,试回答下列问题。
①该物质的化学式是 。原子坐标参数可表示晶胞内部各原子的相对位置,图中各原子标参数分别为;;;则D原子的坐标参数为 。
②晶胞中C、D两原子核间距为,阿伏加德罗常数的值为,则该晶体的密度为 (列出计算式即可)。
21(12分).氟在已知元素中电负性最大、非金属性最强,其单质在1886年才被首次分离出来。
键长/ 121 148
(1)的核外电子排布式为 。
(2)氟氧化物的结构已经确定。
①依据数据推测键的稳定性: (填“>”或“<”)。
②中键角小于中键角,解释原因: 。
(3)是一种有特殊性质的氢化物。
①已知:氢键()中三原子在一条直线上时,作用力最强。测定结果表明,固体中分子排列为锯齿形,画出含3个的结构片段: 。
②溶剂中加入可以解离出和具有正四面体形结构的阴离子,写出该过程的离子方程式: 。
(4)工业上用茧石(主要成分)制备。晶体的一种立方晶胞如图所示。
①晶体中距离最近的有 个。
②晶体中与的最近距离为,阿伏加德罗常数值为。则该晶体的密度 (列出计算式)。
22(8分).青蒿素是烃的含氧衍生物,为无色针状晶体,可溶于乙醇、乙醚,在水中几乎不溶,熔点为156~157℃,是高效的抗疟药。已知:乙醚的沸点为34.5℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。
Ⅰ.实验室用乙醚提取青蒿素的流程如图1所示。
(1)实验前要对青蒿进行粉碎,其目的是 。
(2)操作Ⅱ的名称是 。
(3)操作Ⅲ的主要过程可能是 。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
Ⅱ.用如图2所示的实验装置测定青蒿素实验式的方法如下:将28.2g青蒿素样品放在装置C的硬质玻璃管中,缓缓通入空气数分钟后,使其完全燃烧,精确测定装置D和B实验前后的质量,根据所测数据计算。
(4)装置A中盛放的物质是 ,装置D中盛放的物质是 ,装置B中盛放的物质是 。
(5)该实验装置可能会产生误差,造成测定含氧最偏低,改进方法是 。
(6)用合理改进后的装置进行实验,测得的数据如表所示:
装置 实验前/g 实验后/g
D 22.6 42.4
E 80.2 146.2
则青蒿素的实验式是 。
《独山中学2024-2025春学期高二期中测试化学卷》参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 C D A C A C D C D A
题号 11 12 13 14 15 16 17 18
答案 C B C D B C B B
19(每空2分,共14分).
(1)适当升温、粉碎矿石、适当增加稀硫酸浓度、搅拌等
(2)
(3) 滴入几滴溶液,振荡,溶液不变红
(4)
(5)
20(每空2分,共12分).
(1)
(2)A
(3)锗的氯化物均为分子晶体,随相对分子质量增加,分子间作用力增强,熔沸点升高
(4)
21(前两空每空1分,其它每空2分,共12分).
(1)1s22s22p6
>
F电负性大于氧,故OF2中O周围电子密度相对小于H2O中情形,斥力较小,键角变小
(3) +2HF=[BF4]- + H2F+
(4) 12
22(每空1分,共8分).
(1)增大青蒿与乙醚的接触面积,提高青蒿素的浸漫出速率
(2)蒸馏
(3)B
(4) NaOH溶液 碱石灰
(5)装置E后连接一个防止空气中和进入E的装置
(6)
同课章节目录
