专题2 第一单元 第2课时 原子核外电子的运动课件(共29张PPT)2024-2025学年高二化学苏教版(2019)选择性必修第二册
文档属性
| 名称 | 专题2 第一单元 第2课时 原子核外电子的运动课件(共29张PPT)2024-2025学年高二化学苏教版(2019)选择性必修第二册 |

|
|
| 格式 | ppt | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-23 00:14:40 | ||
图片预览







文档简介
(共29张PPT)
专题2 原子结构与性质
第一单元 原子核外电子的运动
第2课时 原子核外电子的排布
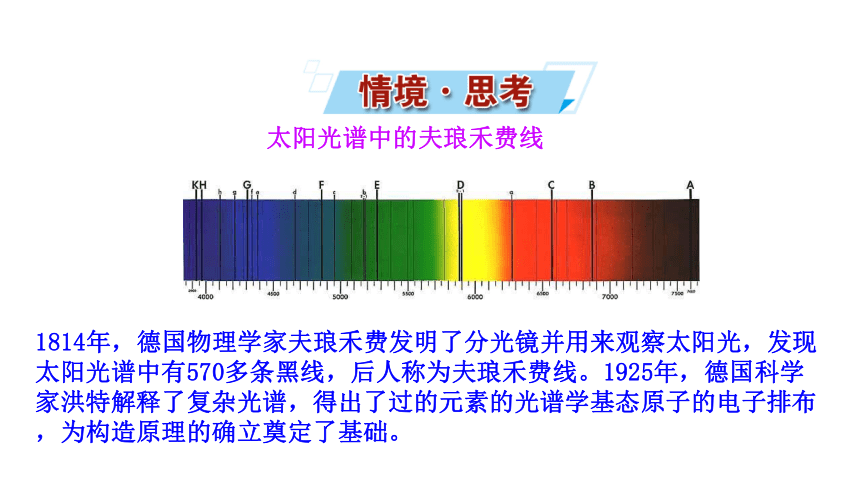
太阳光谱中的夫琅禾费线
1814年,德国物理学家夫琅禾费发明了分光镜并用来观察太阳光,发现太阳光谱中有570多条黑线,后人称为夫琅禾费线。1925年,德国科学家洪特解释了复杂光谱,得出了过的元素的光谱学基态原子的电子排布,为构造原理的确立奠定了基础。
1.知道原子核外电子的能级高低顺序,了解原子核外电子排布的构造原理。
2.知道1~36号元素基态原子核外电子的排布。
1.通过认识原子结构及核外电子排布,辨识微观粒子的运动状态不同于宏观物体的运动状态。(宏观辨识与微观探析)
2.结合原子核外电子排布规律及核外电子排布的原则建立观点、结论和证据之间的逻辑关系。(证据推理与模型认知)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
描述原子核外电子的运动状态涉及电子层、原子轨道和电子自旋。科学家经过研究发现,原子核外电子的排布遵循能量最低原理、泡利不相容原理和洪特规则。
一、原子核外的电子排布
内容:原子核外电子在排布时要先占据能量低的轨道,然后依次进入能量较高的轨道,这样使整个原子处于最低的能量状态。
原子轨道的能量高低顺序:
1s 2s2p 3s3p 4s3d4p 5s4d5p
6s4f5d6p 7s5f6d7p…
1.能量最低原理
2.泡利不相容原理
每个原子轨道上最多只能容纳2个自旋状态不同的电子(用“↓↑”表示)。
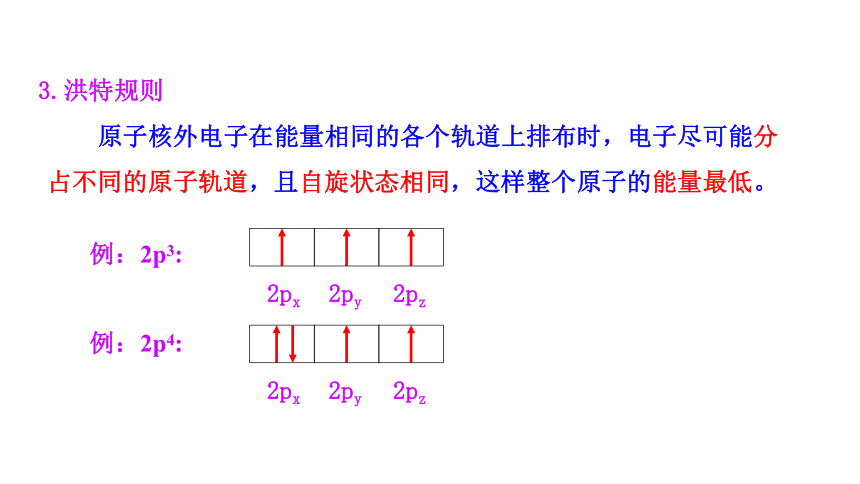
3.洪特规则
原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占不同的原子轨道,且自旋状态相同,这样整个原子的能量最低。
例:2p3:
2px
2py
2pz
例:2p4:
2px
2py
2pz
2.电子排布式
3.轨道表示式
1.原子结构示意图
二、原子核外电子的排布表示方法
1.原子结构示意图
核电荷数
电子层
该电子层上的电子数
原子核
电子层:
原子轨道:
原子轨道数:
容纳的电子数:
1s2
1 2
1s 2s2p
1 1+3
2
2+3
2s22p3
5
2
+7
N
电子排布式:
2.电子排布式
电子排布式的书写思路:
①记住元素序号
②轨道排布顺序:1s 2s 2p 3s 3p 3d 4s
(要先排4s,再排3d)
③每个轨道最多容纳电子数
s——最多2个, p——最多6个,
d——最多10个,f——最多14个
电子排布式的书写格式:
①电子层数(1,2,3,4……);
②轨道类型(s,p,d,f);
③电子个数(右上角)。
Al:1s22s22p63s23p1
Na+:1s22s22p6
C:1s22s22p2
电子层数
轨道类型
例如:
写出下列元素的电子排布式:
Ne:
S:
Mg:
1s22s22p6
1s22s22p63s23p4
1s22s22p63s2
[Ne]3s23p4
[Ne]3s2
【试一试】
[He]2s22p6
洪特规则的特例
整个体系的能量最低,相对稳定的状态。
轨道上的电子全充满(p6,d10,f14)
轨道上的电子全空时(p0,d0,f0)
轨道上的电子半充满(p3,d5,f7)
19K:
24Cr:
1s22s22p63s23p63d54s1
1s22s22p63s23p63d04s1
1s22s22p63s23p64s1
29Cu:
1s22s22p63s23p63d104s1
外围电子排布式为3d54s1
外围电子排布式为3d104s1
写出21~35号的原子实排布式。
21Sc:
[Ar]3d14s2
22Ti:
[Ar]3d24s2
23V:
[Ar]3d34s2
24Cr:
[Ar]3d54s1
25Mn:
[Ar]3d54s2
26Fe:
[Ar]3d64s2
27Co:
[Ar]3d74s2
28Ni:
[Ar]3d84s2
29Cu:
[Ar]3d104s1
30Zn:
[Ar]3d104s2
31Ga:
[Ar]3d104s24p1
32Ge:
[Ar]3d104s24p2
33As:
[Ar] 3d104s24p3
34Se:
[Ar] 3d104s24p4
35Br:
[Ar] 3d104s24p5
主族外围电子排布式(去掉[ ]及d)
【试一试】
电子排布式:
1s2
2s2 2p3
轨道表示式:
1s 2s 2p
每个原子轨道上最多只能容纳两个自旋状态不同的电子。
电子尽量分占不同的原子轨道,且自旋状态相同,这样整个原子的能量最低。
3.轨道表示式
↑↓
↑↓
↑
↑
↑
用一个小方框表示一个原子轨道,在方框中用“↑”或“↓”表示该轨道上排入的电子的式子。
5
2
+7
N
①元素符号;
②轨道及轨道框(一个轨道一个框,能量相同的轨道连在一起) s—1个 p—3个 d—5个 f—7个;
③电子的自旋状态(↑、↓)。
轨道表示式的书写格式:
画出下列元素的轨道表示式:
C:
Na:
写出下列微粒的轨道表示式:
7N:
8O:
S2—:
Na+:
↑↓
↑↓
↑
↑
↑
1s 2s 2p
↑↓
↑↓
1s 2s 2p
3s 3p
↑↓
↑↓
1s 2s 2p
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
1s 2s 2p
↑↓
↑↓
↑↓
↑
↑
【练一练】
氧原子结构的三种表示方法
原子结构示意图
电子排布式
1s2 2s2 2p4
轨道表示式
原子的发射与吸收光谱
低能量轨道电子
吸收能量
高能量轨道电子
原子吸收光谱
低能量轨道电子
释放能量
原子发射光谱
一、原子核外电子排布遵循的原理和规则
二、原子核外电子排布的表示方法
原子核外电子的运动
能量最低原理
泡利不相容原理
洪特规则
电子排布式
轨道表示式
1.下列电子排布式违反了泡利不相容原理的是( )
A.铜原子的电子排布式:1s22s22p63s23p63d94s2
B.碳原子的电子排布式:1s22s22p2
C.钪原子的电子排布式:1s22s22p63s23p64s2
D.硅原子的电子排布式:1s22s22p63s33p1
D
2.以下是一些原子的 2p能级和 3d 能级中电子排布的情况;其中违反了洪特规则的是( )
①
②
③
④
⑤
⑥
D
3.下列由电子排布式所得的结论错误的是( )
选项 电子排布式 结论
A 1s22s22px22py02pz0 违背洪特规则
B 1s22s22p63s23p2 违背能量最低原理
C 1s22s22p63s23p10 违背泡利原理
D 1s22s22p63s23p23d5 违背能量最低原理
B
4.以下现象与核外电子的跃迁有关的是( )
①霓虹灯发出有色光 ②棱镜分光 ③激光器产生激光 ④石油蒸馏 ⑤凸透镜聚光 ⑥燃放的焰火,在夜空中呈现五彩缤纷的礼花 ⑦日光灯通电发光 ⑧冷却结晶
A.①③⑥⑦ B.②④⑤⑧
C.①③⑤⑥⑦ D.①②③⑤⑥⑦
A
5.(1)Cl原子核外电子能量最高的电子所在的能级是_____。
(2)基态Si原子中,核外电子占据最高能层的符号为____,该能层上有___个能级,电子数为____。
3p
M
3
4
6.(1)(2021·山东等级考节选)基态F原子核外电子的运动状态有 种。
(2)(2021·广东选择考节选)基态硫原子价电子排布式
为 。
(3)(2021·湖南选择考节选)基态硅原子最外层的电子排布图
为 。
9
3s23p4
专题2 原子结构与性质
第一单元 原子核外电子的运动
第2课时 原子核外电子的排布
太阳光谱中的夫琅禾费线
1814年,德国物理学家夫琅禾费发明了分光镜并用来观察太阳光,发现太阳光谱中有570多条黑线,后人称为夫琅禾费线。1925年,德国科学家洪特解释了复杂光谱,得出了过的元素的光谱学基态原子的电子排布,为构造原理的确立奠定了基础。
1.知道原子核外电子的能级高低顺序,了解原子核外电子排布的构造原理。
2.知道1~36号元素基态原子核外电子的排布。
1.通过认识原子结构及核外电子排布,辨识微观粒子的运动状态不同于宏观物体的运动状态。(宏观辨识与微观探析)
2.结合原子核外电子排布规律及核外电子排布的原则建立观点、结论和证据之间的逻辑关系。(证据推理与模型认知)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
描述原子核外电子的运动状态涉及电子层、原子轨道和电子自旋。科学家经过研究发现,原子核外电子的排布遵循能量最低原理、泡利不相容原理和洪特规则。
一、原子核外的电子排布
内容:原子核外电子在排布时要先占据能量低的轨道,然后依次进入能量较高的轨道,这样使整个原子处于最低的能量状态。
原子轨道的能量高低顺序:
1s 2s2p 3s3p 4s3d4p 5s4d5p
6s4f5d6p 7s5f6d7p…
1.能量最低原理
2.泡利不相容原理
每个原子轨道上最多只能容纳2个自旋状态不同的电子(用“↓↑”表示)。
3.洪特规则
原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占不同的原子轨道,且自旋状态相同,这样整个原子的能量最低。
例:2p3:
2px
2py
2pz
例:2p4:
2px
2py
2pz
2.电子排布式
3.轨道表示式
1.原子结构示意图
二、原子核外电子的排布表示方法
1.原子结构示意图
核电荷数
电子层
该电子层上的电子数
原子核
电子层:
原子轨道:
原子轨道数:
容纳的电子数:
1s2
1 2
1s 2s2p
1 1+3
2
2+3
2s22p3
5
2
+7
N
电子排布式:
2.电子排布式
电子排布式的书写思路:
①记住元素序号
②轨道排布顺序:1s 2s 2p 3s 3p 3d 4s
(要先排4s,再排3d)
③每个轨道最多容纳电子数
s——最多2个, p——最多6个,
d——最多10个,f——最多14个
电子排布式的书写格式:
①电子层数(1,2,3,4……);
②轨道类型(s,p,d,f);
③电子个数(右上角)。
Al:1s22s22p63s23p1
Na+:1s22s22p6
C:1s22s22p2
电子层数
轨道类型
例如:
写出下列元素的电子排布式:
Ne:
S:
Mg:
1s22s22p6
1s22s22p63s23p4
1s22s22p63s2
[Ne]3s23p4
[Ne]3s2
【试一试】
[He]2s22p6
洪特规则的特例
整个体系的能量最低,相对稳定的状态。
轨道上的电子全充满(p6,d10,f14)
轨道上的电子全空时(p0,d0,f0)
轨道上的电子半充满(p3,d5,f7)
19K:
24Cr:
1s22s22p63s23p63d54s1
1s22s22p63s23p63d04s1
1s22s22p63s23p64s1
29Cu:
1s22s22p63s23p63d104s1
外围电子排布式为3d54s1
外围电子排布式为3d104s1
写出21~35号的原子实排布式。
21Sc:
[Ar]3d14s2
22Ti:
[Ar]3d24s2
23V:
[Ar]3d34s2
24Cr:
[Ar]3d54s1
25Mn:
[Ar]3d54s2
26Fe:
[Ar]3d64s2
27Co:
[Ar]3d74s2
28Ni:
[Ar]3d84s2
29Cu:
[Ar]3d104s1
30Zn:
[Ar]3d104s2
31Ga:
[Ar]3d104s24p1
32Ge:
[Ar]3d104s24p2
33As:
[Ar] 3d104s24p3
34Se:
[Ar] 3d104s24p4
35Br:
[Ar] 3d104s24p5
主族外围电子排布式(去掉[ ]及d)
【试一试】
电子排布式:
1s2
2s2 2p3
轨道表示式:
1s 2s 2p
每个原子轨道上最多只能容纳两个自旋状态不同的电子。
电子尽量分占不同的原子轨道,且自旋状态相同,这样整个原子的能量最低。
3.轨道表示式
↑↓
↑↓
↑
↑
↑
用一个小方框表示一个原子轨道,在方框中用“↑”或“↓”表示该轨道上排入的电子的式子。
5
2
+7
N
①元素符号;
②轨道及轨道框(一个轨道一个框,能量相同的轨道连在一起) s—1个 p—3个 d—5个 f—7个;
③电子的自旋状态(↑、↓)。
轨道表示式的书写格式:
画出下列元素的轨道表示式:
C:
Na:
写出下列微粒的轨道表示式:
7N:
8O:
S2—:
Na+:
↑↓
↑↓
↑
↑
↑
1s 2s 2p
↑↓
↑↓
1s 2s 2p
3s 3p
↑↓
↑↓
1s 2s 2p
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
1s 2s 2p
↑↓
↑↓
↑↓
↑
↑
【练一练】
氧原子结构的三种表示方法
原子结构示意图
电子排布式
1s2 2s2 2p4
轨道表示式
原子的发射与吸收光谱
低能量轨道电子
吸收能量
高能量轨道电子
原子吸收光谱
低能量轨道电子
释放能量
原子发射光谱
一、原子核外电子排布遵循的原理和规则
二、原子核外电子排布的表示方法
原子核外电子的运动
能量最低原理
泡利不相容原理
洪特规则
电子排布式
轨道表示式
1.下列电子排布式违反了泡利不相容原理的是( )
A.铜原子的电子排布式:1s22s22p63s23p63d94s2
B.碳原子的电子排布式:1s22s22p2
C.钪原子的电子排布式:1s22s22p63s23p64s2
D.硅原子的电子排布式:1s22s22p63s33p1
D
2.以下是一些原子的 2p能级和 3d 能级中电子排布的情况;其中违反了洪特规则的是( )
①
②
③
④
⑤
⑥
D
3.下列由电子排布式所得的结论错误的是( )
选项 电子排布式 结论
A 1s22s22px22py02pz0 违背洪特规则
B 1s22s22p63s23p2 违背能量最低原理
C 1s22s22p63s23p10 违背泡利原理
D 1s22s22p63s23p23d5 违背能量最低原理
B
4.以下现象与核外电子的跃迁有关的是( )
①霓虹灯发出有色光 ②棱镜分光 ③激光器产生激光 ④石油蒸馏 ⑤凸透镜聚光 ⑥燃放的焰火,在夜空中呈现五彩缤纷的礼花 ⑦日光灯通电发光 ⑧冷却结晶
A.①③⑥⑦ B.②④⑤⑧
C.①③⑤⑥⑦ D.①②③⑤⑥⑦
A
5.(1)Cl原子核外电子能量最高的电子所在的能级是_____。
(2)基态Si原子中,核外电子占据最高能层的符号为____,该能层上有___个能级,电子数为____。
3p
M
3
4
6.(1)(2021·山东等级考节选)基态F原子核外电子的运动状态有 种。
(2)(2021·广东选择考节选)基态硫原子价电子排布式
为 。
(3)(2021·湖南选择考节选)基态硅原子最外层的电子排布图
为 。
9
3s23p4
