专题3 第一单元 金属键 金属晶体课件 (共37张PPT)2024-2025学年高二化学苏教版(2019)选择性必修第二册
文档属性
| 名称 | 专题3 第一单元 金属键 金属晶体课件 (共37张PPT)2024-2025学年高二化学苏教版(2019)选择性必修第二册 |  | |
| 格式 | ppt | ||
| 文件大小 | 5.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-23 00:15:53 | ||
图片预览







文档简介
(共37张PPT)
专题3 微粒间作用力与物质性质
第一单元 金属键 金属晶体
你能归纳出金属的物理性质吗 你知道金属为什么具有这些物理性质吗?
金属通常都具有金属光泽,有良好的导热性、导电性和延展性。
在金属晶体中,原子间以金属键相互结合。
1.能描述金属晶体中金属键的成键特征,能用金属键理论解释金属的典型性质。
2.能借助模型说明常见金属晶体中晶胞的构成。
3.能举例说明合金的优越性能。
1.运用“宏微结合”的化学观、认识晶体的分类依据、构成粒子及粒子间的相互作用等。(宏观辨识与微观探析)
2.通过建立模型解决金属晶体的相关问题。(证据推理与模型认知)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
金属共同的物理性质
(1)具有金属光泽,一般不透明
(2)具有良好的导电、导热性
(3)具有较好的延展性
一般是银白色。Cu紫红色、Au金黄色
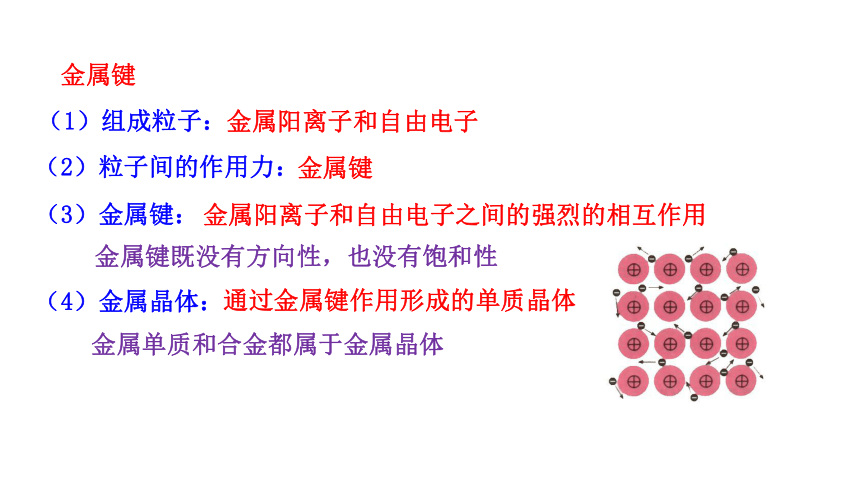
金属键
(1)组成粒子:
金属阳离子和自由电子
(2)粒子间的作用力:
金属阳离子和自由电子之间的强烈的相互作用
(3)金属键:
通过金属键作用形成的单质晶体
金属键
(4)金属晶体:
金属键既没有方向性,也没有饱和性
金属单质和合金都属于金属晶体
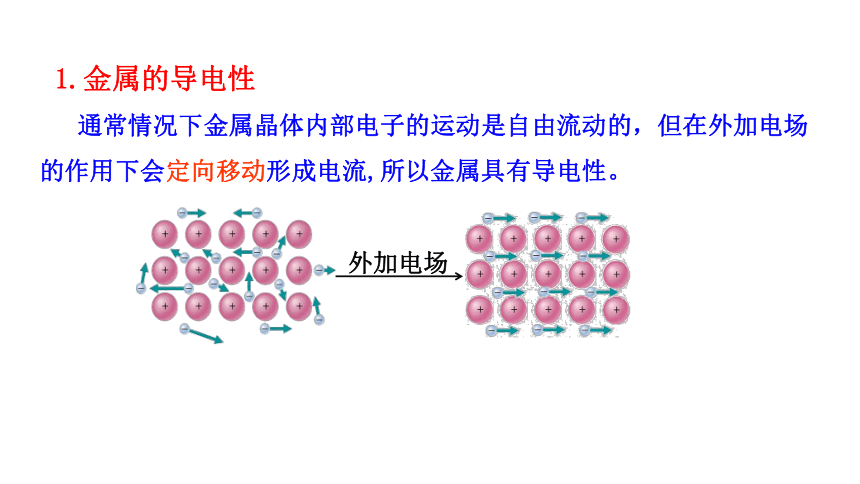
1.金属的导电性
通常情况下金属晶体内部电子的运动是自由流动的,但在外加电场的作用下会定向移动形成电流,所以金属具有导电性。
外加电场
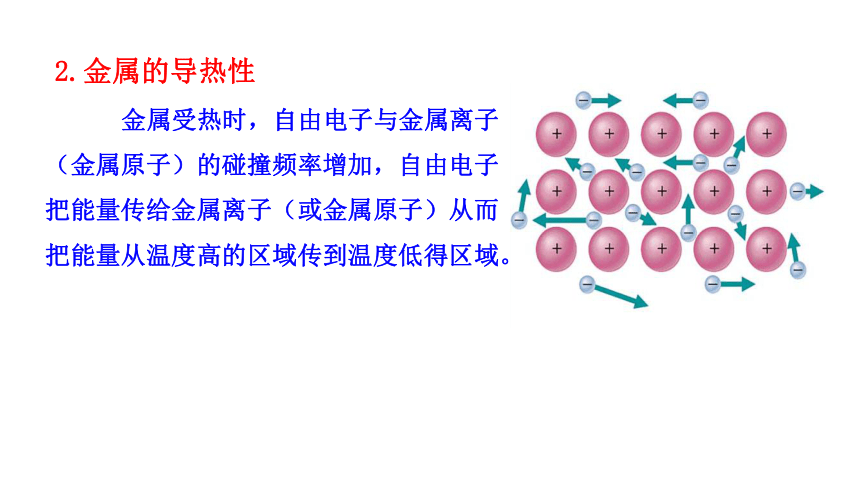
2.金属的导热性
金属受热时,自由电子与金属离子(金属原子)的碰撞频率增加,自由电子把能量传给金属离子(或金属原子)从而把能量从温度高的区域传到温度低得区域。
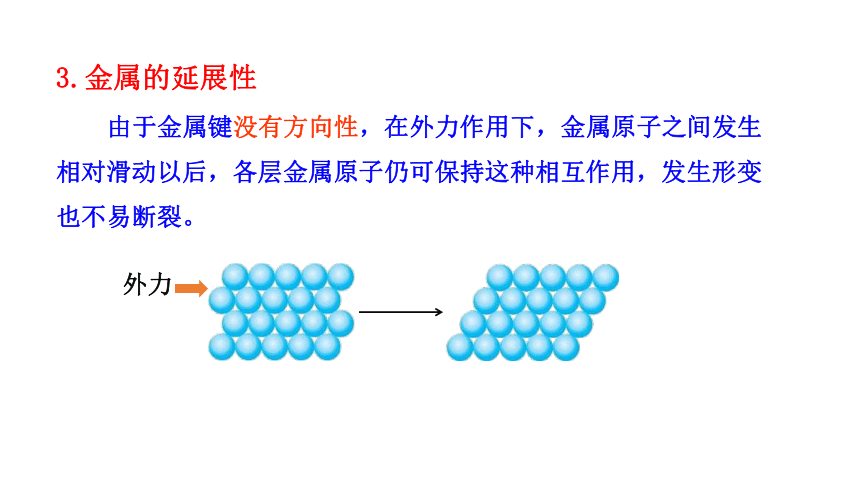
3.金属的延展性
由于金属键没有方向性,在外力作用下,金属原子之间发生相对滑动以后,各层金属原子仍可保持这种相互作用,发生形变也不易断裂。
外力
金属中的自由电子容易可见光的能量跃迁到较高能级,在返回原能级时以光的形式放出能量。铁、镁能吸收各种波长的可见光,吸收后又把它们几乎全部反射出去,所以呈钢灰色或银白色金属光泽。金属对某些波长的光吸收程度较大,该金属就呈现与其对应的某种颜色。
金属晶体具有金属光泽
金属粉末往往没有金属光泽,这是因为在粉末状时,金属的晶面分布在各个方向,非常杂乱,晶格排列不规则,吸收可见光后辐射不出去,所以失去光泽。
【拓展视野】
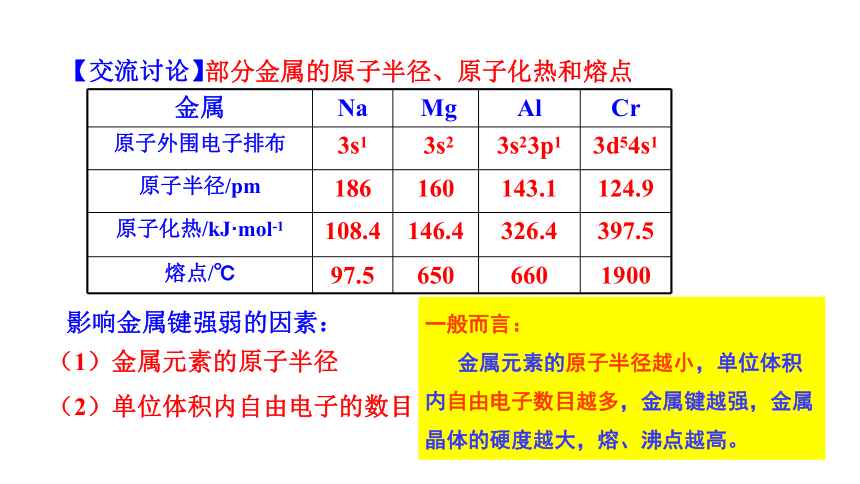
金属 Na Mg Al Cr
原子外围电子排布 3s1 3s2 3s23p1 3d54s1
原子半径/pm 186 160 143.1 124.9
原子化热/kJ·mol-1 108.4 146.4 326.4 397.5
熔点/℃ 97.5 650 660 1900
部分金属的原子半径、原子化热和熔点
(1)金属元素的原子半径
(2)单位体积内自由电子的数目
一般而言:
金属元素的原子半径越小,单位体积内自由电子数目越多,金属键越强,金属晶体的硬度越大,熔、沸点越高。
影响金属键强弱的因素:
【交流讨论】
1.晶体
通过结晶过程形成的具有规则几何外形的固体叫晶体。
通常情况下,大多数金属单质及其合金也是晶体。
2.晶胞
晶体中能够反映晶体结构特征的基本重复单位。
3.配位数:晶体中一个原子周围距离相等且最近的原子数目叫
配位数。
二维平面上金属原子紧密排列的两种方式
非密置层放置
密置层放置
1
1
2
2
3
3
4
4
5
6
配位数:4
配位数:6
金属晶体的原子在三维空间堆积模型
(1)简单立方堆积(只有金属钋Po采用)
非密置层在三维空间的“点对点”堆积
配位数:6
(2)体心立方堆积---钾型(Na、K、Fe)
非密置层在三维空间的“点对穴”堆积
配位数:8
晶胞中平均分配的原子数:2
(1)ABAB…堆积方式
—— 六方最密堆积(Mg、Zn、Ti)
三维空间里密置层的金属原子的堆积方式
1
2
3
4
5
6
7
8
9
10
11
12
12
六方最密堆积配位数:
1
2
3
4
5
6
同层 6,上下层各 3
A B C
(2)ABCABC…堆积方式
—— 面心立方最密堆积(Au、Ag、Cu、Pb)
三维空间里密置层的金属原子的堆积方式
1
2
3
4
5
6
7
8
9
10
11
12
12
面心立方最密堆积配位数:
同层 6,上下层各 3
A B C
1. 晶胞中原子数目的计算(均摊法)
顶角
棱上
面上
内部
顶点占1/8
棱上占1/4
面上占1/2
体内占1
8×1/8 = 1
8×1/8 + 1 = 2
12×1/6+2×1/2 + 3 = 6
8×1/8 + 6×1/2 = 4
2. 晶体空间利用率的计算
晶体空间利用率=
晶胞中微粒总体积
晶胞体积
①简单立方堆积
边长a
半径r
a=2r
空间利用率=
=52.3%
②体心立方堆积
边长a
4r
空间利用率=
体对角线
③六方堆积空间利用率
a
h
a=2r
h=
正六边形的面积s=
6
六方堆积的空间利用率=
=74%
面心立方的空间利用率为
=74%
④面心立方堆积空间利用率
边长a
4r
3. 金属晶体密度的计算
晶体密度的计算步骤:
①先确定一个晶胞中微粒个数N(均摊法)
②再确定一个晶胞中微粒的总质量
③最后求晶胞的密度
简单立方堆积 体心立方堆积 面心立方堆积
晶胞类型
边长a与微粒半径r的关系
晶胞中微粒数 1 2 4
晶胞密度ρ
合金
(1)定义:把两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质叫做合金。
(2)合金的特性
①合金的熔点比其成分中金属低。(介于两种成分金属的熔点之间;)
②具有比各成分金属更好的硬度、强度和机械加工性能。
金属晶体
金属键
组成粒子
粒子间的作用
概念
物理特性
导电性
导热性
延展性
晶体的堆积方式
简单立方堆积
体心立方堆积
六方最密堆积
面心立方最密堆积
合金
1.下列生活中的问题,不能用金属键知识解释的是( )
A. 用铁制品做炊具
B. 用金属铝制成导线
C. 用铂金做首饰
D. 铁易生锈
D
2.下列有关金属键的叙述错误的是 ( )
A.金属键不同于共价键,没有饱和性和方向性
B.金属键中的电子属于整块金属,具有流动性
C.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
D.金属的导电性、导热性和延展性都与金属键有关
C
3.最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该新型超导材料的一个晶胞如图所示,则该晶体的化学式为( )
A.Mg2CNi3 B.MgC2Ni
C.MgCNi2 D.MgCNi3
D
【解析】根据该晶体的结构知该晶胞内Mg原子数为8× =1,C原子数为1,
Ni原子数为6× =3,所以该晶体的化学式为MgCNi3。
4.铜与金可形成两种有序的金属互化物,其晶胞结构如图所示。下列有关说法正确的是( )
A.图Ⅰ、Ⅱ中物质的化学式相同
B.图Ⅱ中物质的化学式为CuAu3
C.图Ⅱ中与每个铜原子紧邻的铜原子有3个
D.设图Ⅰ中晶胞的棱长为acm,则图Ⅰ中合金的密度为 g·cm-3(设NA为阿伏加德罗常数的值)
B
5.在高温超导领域中,有一种化合物叫钙钛矿,其晶体结构中有代表性的最小单位结构如图所示。试回答:
(1)在该晶体中,每个钛离子周围与它最近且距离相等的钛离子有___个。
(2)在该晶体中,氧、钙、钛的离子个数比是________。
3∶1∶1
6
专题3 微粒间作用力与物质性质
第一单元 金属键 金属晶体
你能归纳出金属的物理性质吗 你知道金属为什么具有这些物理性质吗?
金属通常都具有金属光泽,有良好的导热性、导电性和延展性。
在金属晶体中,原子间以金属键相互结合。
1.能描述金属晶体中金属键的成键特征,能用金属键理论解释金属的典型性质。
2.能借助模型说明常见金属晶体中晶胞的构成。
3.能举例说明合金的优越性能。
1.运用“宏微结合”的化学观、认识晶体的分类依据、构成粒子及粒子间的相互作用等。(宏观辨识与微观探析)
2.通过建立模型解决金属晶体的相关问题。(证据推理与模型认知)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
金属共同的物理性质
(1)具有金属光泽,一般不透明
(2)具有良好的导电、导热性
(3)具有较好的延展性
一般是银白色。Cu紫红色、Au金黄色
金属键
(1)组成粒子:
金属阳离子和自由电子
(2)粒子间的作用力:
金属阳离子和自由电子之间的强烈的相互作用
(3)金属键:
通过金属键作用形成的单质晶体
金属键
(4)金属晶体:
金属键既没有方向性,也没有饱和性
金属单质和合金都属于金属晶体
1.金属的导电性
通常情况下金属晶体内部电子的运动是自由流动的,但在外加电场的作用下会定向移动形成电流,所以金属具有导电性。
外加电场
2.金属的导热性
金属受热时,自由电子与金属离子(金属原子)的碰撞频率增加,自由电子把能量传给金属离子(或金属原子)从而把能量从温度高的区域传到温度低得区域。
3.金属的延展性
由于金属键没有方向性,在外力作用下,金属原子之间发生相对滑动以后,各层金属原子仍可保持这种相互作用,发生形变也不易断裂。
外力
金属中的自由电子容易可见光的能量跃迁到较高能级,在返回原能级时以光的形式放出能量。铁、镁能吸收各种波长的可见光,吸收后又把它们几乎全部反射出去,所以呈钢灰色或银白色金属光泽。金属对某些波长的光吸收程度较大,该金属就呈现与其对应的某种颜色。
金属晶体具有金属光泽
金属粉末往往没有金属光泽,这是因为在粉末状时,金属的晶面分布在各个方向,非常杂乱,晶格排列不规则,吸收可见光后辐射不出去,所以失去光泽。
【拓展视野】
金属 Na Mg Al Cr
原子外围电子排布 3s1 3s2 3s23p1 3d54s1
原子半径/pm 186 160 143.1 124.9
原子化热/kJ·mol-1 108.4 146.4 326.4 397.5
熔点/℃ 97.5 650 660 1900
部分金属的原子半径、原子化热和熔点
(1)金属元素的原子半径
(2)单位体积内自由电子的数目
一般而言:
金属元素的原子半径越小,单位体积内自由电子数目越多,金属键越强,金属晶体的硬度越大,熔、沸点越高。
影响金属键强弱的因素:
【交流讨论】
1.晶体
通过结晶过程形成的具有规则几何外形的固体叫晶体。
通常情况下,大多数金属单质及其合金也是晶体。
2.晶胞
晶体中能够反映晶体结构特征的基本重复单位。
3.配位数:晶体中一个原子周围距离相等且最近的原子数目叫
配位数。
二维平面上金属原子紧密排列的两种方式
非密置层放置
密置层放置
1
1
2
2
3
3
4
4
5
6
配位数:4
配位数:6
金属晶体的原子在三维空间堆积模型
(1)简单立方堆积(只有金属钋Po采用)
非密置层在三维空间的“点对点”堆积
配位数:6
(2)体心立方堆积---钾型(Na、K、Fe)
非密置层在三维空间的“点对穴”堆积
配位数:8
晶胞中平均分配的原子数:2
(1)ABAB…堆积方式
—— 六方最密堆积(Mg、Zn、Ti)
三维空间里密置层的金属原子的堆积方式
1
2
3
4
5
6
7
8
9
10
11
12
12
六方最密堆积配位数:
1
2
3
4
5
6
同层 6,上下层各 3
A B C
(2)ABCABC…堆积方式
—— 面心立方最密堆积(Au、Ag、Cu、Pb)
三维空间里密置层的金属原子的堆积方式
1
2
3
4
5
6
7
8
9
10
11
12
12
面心立方最密堆积配位数:
同层 6,上下层各 3
A B C
1. 晶胞中原子数目的计算(均摊法)
顶角
棱上
面上
内部
顶点占1/8
棱上占1/4
面上占1/2
体内占1
8×1/8 = 1
8×1/8 + 1 = 2
12×1/6+2×1/2 + 3 = 6
8×1/8 + 6×1/2 = 4
2. 晶体空间利用率的计算
晶体空间利用率=
晶胞中微粒总体积
晶胞体积
①简单立方堆积
边长a
半径r
a=2r
空间利用率=
=52.3%
②体心立方堆积
边长a
4r
空间利用率=
体对角线
③六方堆积空间利用率
a
h
a=2r
h=
正六边形的面积s=
6
六方堆积的空间利用率=
=74%
面心立方的空间利用率为
=74%
④面心立方堆积空间利用率
边长a
4r
3. 金属晶体密度的计算
晶体密度的计算步骤:
①先确定一个晶胞中微粒个数N(均摊法)
②再确定一个晶胞中微粒的总质量
③最后求晶胞的密度
简单立方堆积 体心立方堆积 面心立方堆积
晶胞类型
边长a与微粒半径r的关系
晶胞中微粒数 1 2 4
晶胞密度ρ
合金
(1)定义:把两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质叫做合金。
(2)合金的特性
①合金的熔点比其成分中金属低。(介于两种成分金属的熔点之间;)
②具有比各成分金属更好的硬度、强度和机械加工性能。
金属晶体
金属键
组成粒子
粒子间的作用
概念
物理特性
导电性
导热性
延展性
晶体的堆积方式
简单立方堆积
体心立方堆积
六方最密堆积
面心立方最密堆积
合金
1.下列生活中的问题,不能用金属键知识解释的是( )
A. 用铁制品做炊具
B. 用金属铝制成导线
C. 用铂金做首饰
D. 铁易生锈
D
2.下列有关金属键的叙述错误的是 ( )
A.金属键不同于共价键,没有饱和性和方向性
B.金属键中的电子属于整块金属,具有流动性
C.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
D.金属的导电性、导热性和延展性都与金属键有关
C
3.最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该新型超导材料的一个晶胞如图所示,则该晶体的化学式为( )
A.Mg2CNi3 B.MgC2Ni
C.MgCNi2 D.MgCNi3
D
【解析】根据该晶体的结构知该晶胞内Mg原子数为8× =1,C原子数为1,
Ni原子数为6× =3,所以该晶体的化学式为MgCNi3。
4.铜与金可形成两种有序的金属互化物,其晶胞结构如图所示。下列有关说法正确的是( )
A.图Ⅰ、Ⅱ中物质的化学式相同
B.图Ⅱ中物质的化学式为CuAu3
C.图Ⅱ中与每个铜原子紧邻的铜原子有3个
D.设图Ⅰ中晶胞的棱长为acm,则图Ⅰ中合金的密度为 g·cm-3(设NA为阿伏加德罗常数的值)
B
5.在高温超导领域中,有一种化合物叫钙钛矿,其晶体结构中有代表性的最小单位结构如图所示。试回答:
(1)在该晶体中,每个钛离子周围与它最近且距离相等的钛离子有___个。
(2)在该晶体中,氧、钙、钛的离子个数比是________。
3∶1∶1
6
