专题1 第一单元 物质结构研究的内容课件(共27张PPT) 2024-2025学年高二化学苏教版(2019)选择性必修第二册
文档属性
| 名称 | 专题1 第一单元 物质结构研究的内容课件(共27张PPT) 2024-2025学年高二化学苏教版(2019)选择性必修第二册 |  | |
| 格式 | ppt | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-23 00:17:15 | ||
图片预览








文档简介
(共27张PPT)
专题1 揭示物质结构的奥秘
第一单元 物质结构研究的内容
上帝创造世界;阴阳五行学说;
德谟克里特:物质由不可再分的粒子构成;
英国科学家道尔顿是科学原子论的创始人。1807年他提出:
“气体、 液体和固体都是由该物质的不可分割的原子组成”
“同种元素的原子,其大小、质量及各种性质都相同”;
1869年门捷列夫发现元素周期律。
历史上关于物质结构的讨论
道尔顿
门捷列夫
1.能结合已有知识描述常见物质的微观结构,分析物质结构与其性质之间的关系;
2.能从物质的微观结构出发解释或预测物质的宏观性质;认识物质结构研究对化学科学发展的重要意义。
1.体会人类探索物质结构的价值和历史,认识在原子、分子层次上研究物质的意义。(科学态度与社会责任)
2.知道物质是由微粒构成的,学会研究物质结构的基本方法。(变化观念与平衡思想)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
一、认识物质的特征结构
(1)为什么已经发现的构成物质的元素只有100多种,而已经发现和人工合成的物质却有几千万种之多?
物质是由一种或者几种元素组成。
不同物质,组成的元素可以不同,也可以相同,如同素异形体,同分异构体、同系物等.....
(2)金刚石是自然界硬度最高的物质,石墨质软且能导电,C60可溶于苯等有机溶剂,碳纳米管具有非同寻常的强度、导电性和热稳定性。这些物质都是由碳元素组成的,但为什么它们的性质和用途却存在很大的差异
结构 性质
决定
反映
(3)物质结构主要包括哪些内容?
物质结构
原子结构
分子结构
晶体结构
原子核
核外电子
原子间作用力- 化学键
原子排列方式
微粒特征
微粒间作用力
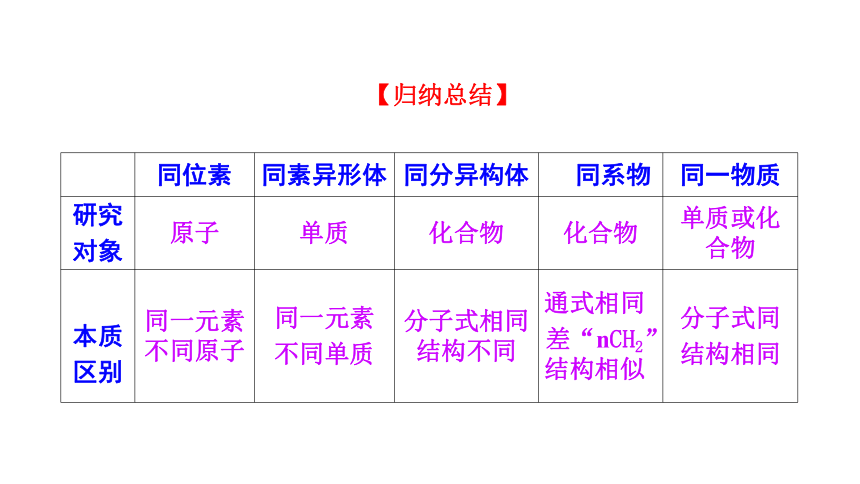
同位素 同素异形体 同分异构体 同系物 同一物质
研究
对象 原子 单质 化合物 化合物 单质或化合物
本质
区别 同一元素不同原子 同一元素
不同单质 分子式相同结构不同 通式相同
差“nCH2”结构相似 分子式同
结构相同
【归纳总结】
研究物质结构的“三注意”
(1)同素异形体的判断关键是要掌握两点。
①它们是结构不同的单质;
②它们由同种元素构成。
(2)结构决定性质,同种元素组成的物质,结构不同,性质有很大差异。
(3)合成新材料须从结构入手,找出性质与结构的关系。
【易错提醒】
(1)为什么N的非金属性比P强,而氮气却不如磷活泼?
(2)为什么碳、氮、氧、氟与氢形成的最简单的化合物(CH4、NH3、H2O、HF)中氢原子的数目不相等
【学以致用】
提示:非金属性:元素的得电子能力,与原子结构有关;活泼性:指单质与其他物质反应的难易程度,与物质结构有关。
提示:C、N、O、F等原子的最外层电子数不同,都需要结合电子才能形成最外层为8个电子的稳定结构。
问题探究:物质结构差异主要表现在哪些方面?
二甲醚
乙醇
1.元素差异:金刚石与晶体硅;
2.原子个数差异:O2与O3;
3.原子连接方式差异:
4.原子空间分布差异:
顺-2-丁烯
反-2-丁烯
链/环
直/支
5.手性差异:
D型
氨基酸
L型
氨基酸
有机物异构可分为碳链异构、位置异构、官能团异构、顺反异构、对映异构等,指出下列各组物质之间异构类型:
异 构 体
异 构 类 型
CH2=CH-CH2OH 与
CH2
CH2
CH-OH
丙烯醇
环丙醇
碳链、官能团异构
CH3-CH2-CH2 与
CH3-CH-CH3
Cl
Cl
位置异构
1-氯丙烷
2-氯丙烷
与
顺-2-氯-2-丁烯
反-2-氯-2-丁烯
顺反异构
对映异构
CH3COOH 与 HOCH2-CHO
羟基乙醛
官能团异构
与
【学以致用】
二、揭示物质结构与性质的关系
问题探究:白磷在潮湿空气中发生缓慢的氧化反应,在40℃左右即可发生自燃;而红磷在300℃左右与氧气反应。两者组成的元素相同,为什么表现出的性质有如此明显的差异?
提示:白磷晶体是由白磷分子(P4)组成的分子晶体,分子呈正四面体结构,分子中P—P键键长是221 pm,键角∠PPP是60°。因其中的P—P键弯曲而具有较大的张力,其键能较小,易断裂,所以白磷在常温、常压下就有很高的反应活性。而红磷的链状结构比较稳定,室温下不与氧气反应。
1.元素原子结构决定其性质。元素周期表中的“位—构—性”关系规律。
2.分子组成相同,结构不同,其性质不同。如:乙醇和甲醚是同分异构体,同分异构体的存在说明物质的结构是决定其性质的重要因素。
3.分子组成不同,若结构相似,则其化学性质或物理性质相似。例如,等电子体的性质相似。
4.构成晶体的微粒不同,微粒的排列方式不同,微粒间的作用力不同,导致各类晶体有不同的性质。
物质结构和性质的关系
1. 为什么分子组成都是C2H6O的乙醇和二甲醚在性质上差异很大?例如,乙醇能与金属钠反应放出氢气而二甲醚却不能,乙醇易溶于水而二甲醚却不溶于水。
乙醇和二甲醚的分子结构模型
【批判性思维】
互为同分异构体,化学性质不同,物理性质有的不同,有的相同。
2. 为什么氨水和硝酸银溶液作用生成的氢氧化银沉淀可溶于过量的氨水中?
3. 许多磷的化合物的结构与P4的正四面体有关,如白磷在空气中燃烧,生成的产物之一是P4O10。试从结构上对该反应进行解释。
形成了配合物
问题1:研究物质结构有哪些意义?
1.揭示结构与性质关系,预测物质性能;
2.合成或从自然界分离出更多新物质;
3.研究、开发和应用新材料;
4.从分子水平探索生命现象的本质推动生命科学;
5.提高环保水平。
【思考·讨论】
问题2:化学科学在创造新物质方面重点科研方向是什么?
1.开发有效利用太阳能新技术;
2.合成智能新材料;
3.合成高效低毒药物;
4.合成高效催化剂等。
【典例】人们对原子结构的认识是一个不断深化的过程。
(1)19世纪初英国物理学家和化学家__________提出了近代原子论。
(2)1897年,汤姆生发现电子并提出类似“西瓜”的原子模型,认为电子就像“西瓜子”一样镶嵌在带正电荷的“西瓜瓤”中,汤姆生原子结构模型的缺陷是__________________________。
(3)卢瑟福核式结构模型是在利用α粒子(带正电荷)轰击金箔实验的基础上提出的。下列能正确反映出他的实验结果的示意图是_______(填“甲”“乙”或“丙”)。
道尔顿
没有发现带正电荷的原子核
乙
(4)从原子结构模型建立的过程中,我们发现__________(选填字母)。
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.玻尔原子模型的建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
A、B、D
物质结构
发展史
研究的意义
结构理论提出与实验
结构理论指导作用
现代科学技术方法
新技术、新材料
生命本质、持续发展
1.我国古代典籍《墨子》中记述了古人对物质的初步认识,其中写道“端,体之无序而最前者也”。下列选项中的哪个化学概念与这里的“端”最为接近 ( )
A.物质 B.化学键 C.原子 D.化学反应
C
【解析】选C。“端,体之无序而最前者也”译成现代语就是不能分为两半的东西是不能砍开的,也就对它不能有所动作,它便是“端”了。其实就是不可分割的意思,这就论证了物质有不可再分割的最原始单位,就相当于原子概念。
2.下列说法正确的是 ( )
A.阿伏加德罗提出了原子学说
B.道尔顿提出了分子学说
C.汤姆生发现了电子
D.卢瑟福是近代原子学说的创始人,被称为“原子之父”
【解析】选C。根据原子学说的发展史可得出正确答案。卢瑟福的确是“原子之父”,但近代原子学说的创始人应是道尔顿。
C
3.人类对原子结构的认识经历了一个不断深入的过程,以下科学家以及他们提出的原子结构学说(或模型)对应关系正确的是 ( )
A.道尔顿——电子轨道理论
B.卢瑟福——量子力学模型
C.玻尔——行星绕太阳模型
D.汤姆生——葡萄干布丁模型
【解析】选D。道尔顿提出原子论,认为原子是实心球体;汤姆生提出的电子在球体中运动的葡萄干布丁原子模型;卢瑟福提出了电子围绕原子核就像行星环绕太阳运转一样的有核模型;玻尔提出电子在原子核外一系列稳定的轨道上绕核做高速运动的原子轨道模型。
D
4.反物质是由反粒子构成的,反质子、正电子都属于反粒子,它们分别与质子、电子的质量、电量相等,但电性相反。那么,根据你的理解,下列关于反氢原子的结构示意图,正确的是 ( )
【解析】选B。首先要明确一个氢原子是由一个电子和一个质子构成的,那么,一个反氢原子就是由一个反电子和一个反质子构成的,反电子带正电,反质子带负电。
B
5.(1)科学家正在设法探寻“反物质”。“反物质”是由“反粒子”构成的,“反粒子”与其对应的正粒子具有相同的质量和相同的电量,但电性相反。若有α粒子(即氦离子)的反粒子,则该粒子的质量数为________,电荷数为__________,反粒子可表示为__________。
(2)固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构。该物质适当加热就分解成两种气体。溶解于水也有气体放出。试回答下列问题:
①固体A属于________化合物,它的电子式为___________。
②A溶于水后,溶液呈__________性(填“酸”“碱”或“中”),
其与水反应的化学方程式是________________________________。
4
-2
He2-
离子
碱
NH5+H2O====NH3·H2O+H2↑
【解析】(1)所谓“反物质”,它的原子核是由反质子和反电子构成的,即质子带负电荷,而电子带正电荷。α粒子(即氦离子)带2个单位正电荷,则α反粒子带2个单位负电荷。
(2)由A的性质可知,A是氢化铵,电子式为 ,是离子化合物,A中的阴离子具有还原性,被水氧化生成H2,故溶于水后与水发生NH5+H2O====NH3·H2O+H2↑,生成溶液显碱性。
专题1 揭示物质结构的奥秘
第一单元 物质结构研究的内容
上帝创造世界;阴阳五行学说;
德谟克里特:物质由不可再分的粒子构成;
英国科学家道尔顿是科学原子论的创始人。1807年他提出:
“气体、 液体和固体都是由该物质的不可分割的原子组成”
“同种元素的原子,其大小、质量及各种性质都相同”;
1869年门捷列夫发现元素周期律。
历史上关于物质结构的讨论
道尔顿
门捷列夫
1.能结合已有知识描述常见物质的微观结构,分析物质结构与其性质之间的关系;
2.能从物质的微观结构出发解释或预测物质的宏观性质;认识物质结构研究对化学科学发展的重要意义。
1.体会人类探索物质结构的价值和历史,认识在原子、分子层次上研究物质的意义。(科学态度与社会责任)
2.知道物质是由微粒构成的,学会研究物质结构的基本方法。(变化观念与平衡思想)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
一、认识物质的特征结构
(1)为什么已经发现的构成物质的元素只有100多种,而已经发现和人工合成的物质却有几千万种之多?
物质是由一种或者几种元素组成。
不同物质,组成的元素可以不同,也可以相同,如同素异形体,同分异构体、同系物等.....
(2)金刚石是自然界硬度最高的物质,石墨质软且能导电,C60可溶于苯等有机溶剂,碳纳米管具有非同寻常的强度、导电性和热稳定性。这些物质都是由碳元素组成的,但为什么它们的性质和用途却存在很大的差异
结构 性质
决定
反映
(3)物质结构主要包括哪些内容?
物质结构
原子结构
分子结构
晶体结构
原子核
核外电子
原子间作用力- 化学键
原子排列方式
微粒特征
微粒间作用力
同位素 同素异形体 同分异构体 同系物 同一物质
研究
对象 原子 单质 化合物 化合物 单质或化合物
本质
区别 同一元素不同原子 同一元素
不同单质 分子式相同结构不同 通式相同
差“nCH2”结构相似 分子式同
结构相同
【归纳总结】
研究物质结构的“三注意”
(1)同素异形体的判断关键是要掌握两点。
①它们是结构不同的单质;
②它们由同种元素构成。
(2)结构决定性质,同种元素组成的物质,结构不同,性质有很大差异。
(3)合成新材料须从结构入手,找出性质与结构的关系。
【易错提醒】
(1)为什么N的非金属性比P强,而氮气却不如磷活泼?
(2)为什么碳、氮、氧、氟与氢形成的最简单的化合物(CH4、NH3、H2O、HF)中氢原子的数目不相等
【学以致用】
提示:非金属性:元素的得电子能力,与原子结构有关;活泼性:指单质与其他物质反应的难易程度,与物质结构有关。
提示:C、N、O、F等原子的最外层电子数不同,都需要结合电子才能形成最外层为8个电子的稳定结构。
问题探究:物质结构差异主要表现在哪些方面?
二甲醚
乙醇
1.元素差异:金刚石与晶体硅;
2.原子个数差异:O2与O3;
3.原子连接方式差异:
4.原子空间分布差异:
顺-2-丁烯
反-2-丁烯
链/环
直/支
5.手性差异:
D型
氨基酸
L型
氨基酸
有机物异构可分为碳链异构、位置异构、官能团异构、顺反异构、对映异构等,指出下列各组物质之间异构类型:
异 构 体
异 构 类 型
CH2=CH-CH2OH 与
CH2
CH2
CH-OH
丙烯醇
环丙醇
碳链、官能团异构
CH3-CH2-CH2 与
CH3-CH-CH3
Cl
Cl
位置异构
1-氯丙烷
2-氯丙烷
与
顺-2-氯-2-丁烯
反-2-氯-2-丁烯
顺反异构
对映异构
CH3COOH 与 HOCH2-CHO
羟基乙醛
官能团异构
与
【学以致用】
二、揭示物质结构与性质的关系
问题探究:白磷在潮湿空气中发生缓慢的氧化反应,在40℃左右即可发生自燃;而红磷在300℃左右与氧气反应。两者组成的元素相同,为什么表现出的性质有如此明显的差异?
提示:白磷晶体是由白磷分子(P4)组成的分子晶体,分子呈正四面体结构,分子中P—P键键长是221 pm,键角∠PPP是60°。因其中的P—P键弯曲而具有较大的张力,其键能较小,易断裂,所以白磷在常温、常压下就有很高的反应活性。而红磷的链状结构比较稳定,室温下不与氧气反应。
1.元素原子结构决定其性质。元素周期表中的“位—构—性”关系规律。
2.分子组成相同,结构不同,其性质不同。如:乙醇和甲醚是同分异构体,同分异构体的存在说明物质的结构是决定其性质的重要因素。
3.分子组成不同,若结构相似,则其化学性质或物理性质相似。例如,等电子体的性质相似。
4.构成晶体的微粒不同,微粒的排列方式不同,微粒间的作用力不同,导致各类晶体有不同的性质。
物质结构和性质的关系
1. 为什么分子组成都是C2H6O的乙醇和二甲醚在性质上差异很大?例如,乙醇能与金属钠反应放出氢气而二甲醚却不能,乙醇易溶于水而二甲醚却不溶于水。
乙醇和二甲醚的分子结构模型
【批判性思维】
互为同分异构体,化学性质不同,物理性质有的不同,有的相同。
2. 为什么氨水和硝酸银溶液作用生成的氢氧化银沉淀可溶于过量的氨水中?
3. 许多磷的化合物的结构与P4的正四面体有关,如白磷在空气中燃烧,生成的产物之一是P4O10。试从结构上对该反应进行解释。
形成了配合物
问题1:研究物质结构有哪些意义?
1.揭示结构与性质关系,预测物质性能;
2.合成或从自然界分离出更多新物质;
3.研究、开发和应用新材料;
4.从分子水平探索生命现象的本质推动生命科学;
5.提高环保水平。
【思考·讨论】
问题2:化学科学在创造新物质方面重点科研方向是什么?
1.开发有效利用太阳能新技术;
2.合成智能新材料;
3.合成高效低毒药物;
4.合成高效催化剂等。
【典例】人们对原子结构的认识是一个不断深化的过程。
(1)19世纪初英国物理学家和化学家__________提出了近代原子论。
(2)1897年,汤姆生发现电子并提出类似“西瓜”的原子模型,认为电子就像“西瓜子”一样镶嵌在带正电荷的“西瓜瓤”中,汤姆生原子结构模型的缺陷是__________________________。
(3)卢瑟福核式结构模型是在利用α粒子(带正电荷)轰击金箔实验的基础上提出的。下列能正确反映出他的实验结果的示意图是_______(填“甲”“乙”或“丙”)。
道尔顿
没有发现带正电荷的原子核
乙
(4)从原子结构模型建立的过程中,我们发现__________(选填字母)。
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.玻尔原子模型的建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
A、B、D
物质结构
发展史
研究的意义
结构理论提出与实验
结构理论指导作用
现代科学技术方法
新技术、新材料
生命本质、持续发展
1.我国古代典籍《墨子》中记述了古人对物质的初步认识,其中写道“端,体之无序而最前者也”。下列选项中的哪个化学概念与这里的“端”最为接近 ( )
A.物质 B.化学键 C.原子 D.化学反应
C
【解析】选C。“端,体之无序而最前者也”译成现代语就是不能分为两半的东西是不能砍开的,也就对它不能有所动作,它便是“端”了。其实就是不可分割的意思,这就论证了物质有不可再分割的最原始单位,就相当于原子概念。
2.下列说法正确的是 ( )
A.阿伏加德罗提出了原子学说
B.道尔顿提出了分子学说
C.汤姆生发现了电子
D.卢瑟福是近代原子学说的创始人,被称为“原子之父”
【解析】选C。根据原子学说的发展史可得出正确答案。卢瑟福的确是“原子之父”,但近代原子学说的创始人应是道尔顿。
C
3.人类对原子结构的认识经历了一个不断深入的过程,以下科学家以及他们提出的原子结构学说(或模型)对应关系正确的是 ( )
A.道尔顿——电子轨道理论
B.卢瑟福——量子力学模型
C.玻尔——行星绕太阳模型
D.汤姆生——葡萄干布丁模型
【解析】选D。道尔顿提出原子论,认为原子是实心球体;汤姆生提出的电子在球体中运动的葡萄干布丁原子模型;卢瑟福提出了电子围绕原子核就像行星环绕太阳运转一样的有核模型;玻尔提出电子在原子核外一系列稳定的轨道上绕核做高速运动的原子轨道模型。
D
4.反物质是由反粒子构成的,反质子、正电子都属于反粒子,它们分别与质子、电子的质量、电量相等,但电性相反。那么,根据你的理解,下列关于反氢原子的结构示意图,正确的是 ( )
【解析】选B。首先要明确一个氢原子是由一个电子和一个质子构成的,那么,一个反氢原子就是由一个反电子和一个反质子构成的,反电子带正电,反质子带负电。
B
5.(1)科学家正在设法探寻“反物质”。“反物质”是由“反粒子”构成的,“反粒子”与其对应的正粒子具有相同的质量和相同的电量,但电性相反。若有α粒子(即氦离子)的反粒子,则该粒子的质量数为________,电荷数为__________,反粒子可表示为__________。
(2)固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构。该物质适当加热就分解成两种气体。溶解于水也有气体放出。试回答下列问题:
①固体A属于________化合物,它的电子式为___________。
②A溶于水后,溶液呈__________性(填“酸”“碱”或“中”),
其与水反应的化学方程式是________________________________。
4
-2
He2-
离子
碱
NH5+H2O====NH3·H2O+H2↑
【解析】(1)所谓“反物质”,它的原子核是由反质子和反电子构成的,即质子带负电荷,而电子带正电荷。α粒子(即氦离子)带2个单位正电荷,则α反粒子带2个单位负电荷。
(2)由A的性质可知,A是氢化铵,电子式为 ,是离子化合物,A中的阴离子具有还原性,被水氧化生成H2,故溶于水后与水发生NH5+H2O====NH3·H2O+H2↑,生成溶液显碱性。
