专题3 第四单元 第2课时 分子晶体课件(共21张PPT) 2024-2025学年高二化学苏教版(2019)选择性必修第二册
文档属性
| 名称 | 专题3 第四单元 第2课时 分子晶体课件(共21张PPT) 2024-2025学年高二化学苏教版(2019)选择性必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-23 00:21:58 | ||
图片预览






文档简介
(共21张PPT)
专题3 微粒间作用力与物质性质
第四单元 分子间作用力 分子晶体
第2课时 分子晶体
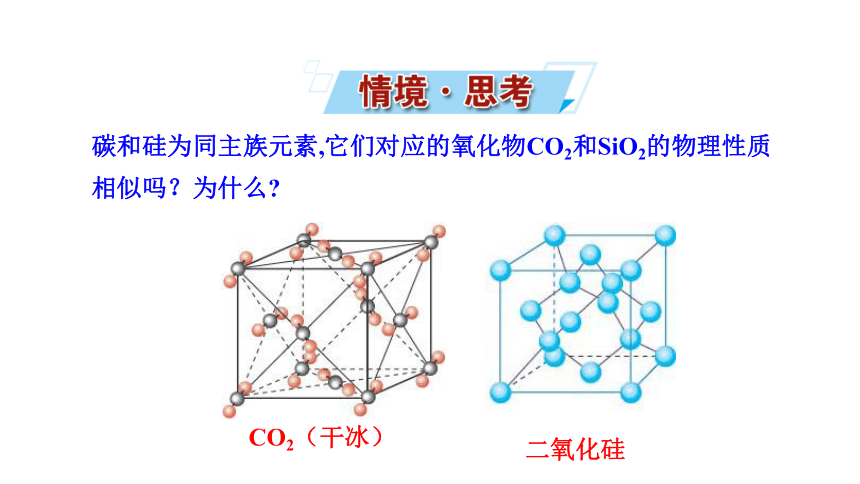
二氧化硅
碳和硅为同主族元素,它们对应的氧化物CO2和SiO2的物理性质相似吗?为什么
CO2(干冰)
1. 能辨识常见的分子晶体,并能从微观角度分析分子晶体中各构成微粒之间的作用和对分子晶体物理性质的影响。(宏观辨识与微观探析)
2. 能利用分子晶体的通性推断常见的分子晶体,理解分子晶体中微粒的堆积模型,并能利用均摊法对晶胞进行分析。(证据推理与模型认知)
1. 知道分子晶体的概念、结构特点及常见的分子晶体。
2. 认识分子晶体中微粒及其微粒间的相互作用。
3.能描述典型分子晶体的特点,区分共价晶体和分子晶体。
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
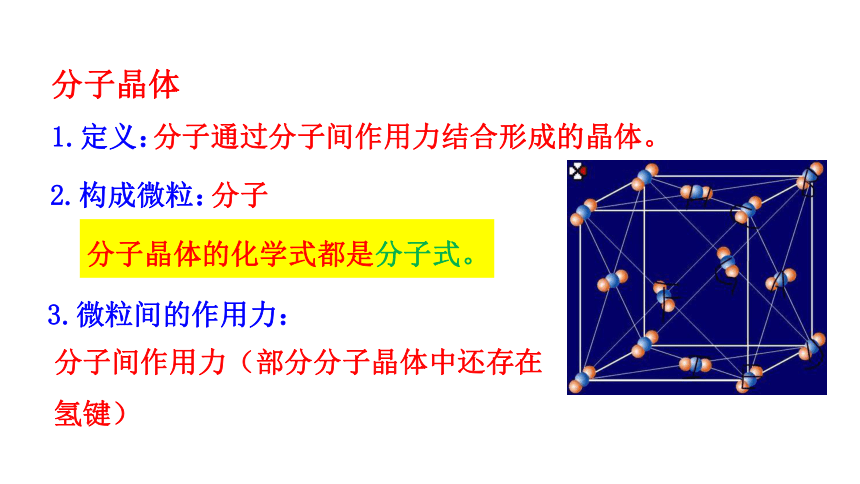
分子晶体
分子通过分子间作用力结合形成的晶体。
分子间作用力(部分分子晶体中还存在氢键)
1.定义:
2.构成微粒:
3.微粒间的作用力:
分子
分子晶体的化学式都是分子式。
4.分子晶体的物理性质
①熔点、沸点低
②硬度小
③固态和熔融状态不导电。
由于分子间作用力较弱,所以分子晶体
(1) 所有非金属氢化物: H2O、H2S、NH3、CH4、HX
(2) 大多数非金属单质: X2、N2、O2、H2、S8、P4、C60
(3) 大多数非金属氧化物: CO2、SO2、N2O4、P4O6、P4O10
(4) 几乎所有的酸: H2SO4、HNO3、H3PO4
(5) 大多数有机物: 乙醇、冰醋酸、蔗糖
5.典型的分子晶体:
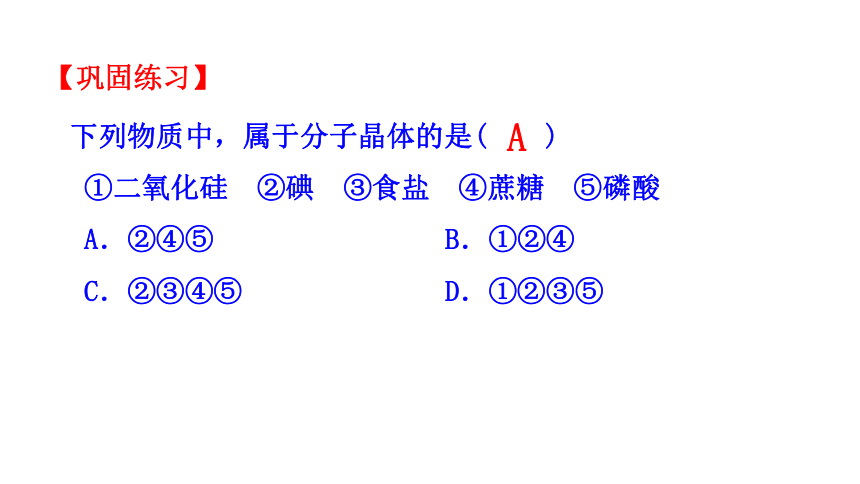
下列物质中,属于分子晶体的是( )
①二氧化硅 ②碘 ③食盐 ④蔗糖 ⑤磷酸
A.②④⑤ B.①②④
C.②③④⑤ D.①②③⑤
A
【巩固练习】
6.分子晶体熔、沸点高低的比较规律:
(1)组成和结构相似的物质
相对分子质量越大,分子间作用力越大,熔沸点越高;若存在氢键(HF、H2O、NH3),会使其熔沸点升高
(2)相对分子质量接近的物质
看分子的极性,对称性差、分子极性强的,熔沸点高一些
【例】在碳原子数相同的烷烃的同分异构体中,一般来说,支链数越多,熔沸点越低。如沸点:正戊烷 > 异戊烷 > 新戊烷。
下列物质,按沸点降低顺序排列的一组是( )
A.HF、HCl、HBr、HI
B.F2、Cl2、Br2、I2
C.H2O、H2S、H2Se、H2Te
D.CI4、CBr4、CCl4、CF4
D
【巩固练习】
与CO2分子距离最近的CO2分子共有 个
——面心立方晶胞
CO2分子处于8个顶点和6个面心
1个干冰晶体晶胞中含有 个CO2分子
干冰的晶体结构
4
12
7.常见分子晶体结构
冰中1个水分子周围有 个水分子
平均每1个水分子实际形成 个氢键
冰的晶体结构
——空间正四面体构型
4
2
C60中有 个六边形, 个五边形,
C60分子中含有碳碳单键 个,
C60分子中含有碳碳双键 个
20
12
60
30
足球烯C60的晶体结构
——笼状结构
【学以致用】二氧化硅和二氧化碳是组成相似的共价化合物,但是它们的物理性质却差别很大,为什么?
SiO2的空间结构
CO2空间结构
SiO2为共价晶体,熔融时破坏共价键,所以熔沸点高
CO2为分子晶体,熔融时破坏分子间作用力,所以熔沸点低
几种类型晶体的结构和性质
晶体类型 金属晶体 离子晶体 原子晶体 分子晶体
结 构 构成微粒 金属阳离子、自由电子 阴、阳离子 原子 分子
微粒间作用力 金属键 离子键 共价键 分子间作用力
性 质 熔、沸点 差异较大 高 很高 低
硬 度 差异较大 硬而脆 很大 小
导电性 导电 熔化或溶于水导电 一般不导电,硅是半导体 固体及熔融状态不导电,有的溶于水能导电。
举 例 金属、 金属合金 离子化合物 金刚石、Si、SiO2、SiC 硫、干冰、冰、
冰醋酸、蔗糖
石墨晶体
(混合晶体)
①石墨晶体为层状结构。层与层之间以
结合。故石墨质软,有滑腻感。
③在同一层内,每个碳原子以C-C键与3个碳原子结合,形成六元环。每个六元环平均 个 C原子。
②在同一层内,碳原子以 彼此结合,故石墨熔点较高。
④1mol石墨晶体中C-C键为 。
1.结构与性质
2
1.5NA
分子间作用力
共价键
⑤在同一平面的碳原子还各剩下一个p轨道,它们相互重叠,形成大π键。这些电子比较自由,相当于金属中的自由电子,所以石墨能导热和导电。
分子晶体
构成粒子:分子
粒子间作用力:分子间作用力
典型的晶体:冰、干冰、I2、S8、稀有气体(固态)、
P4、C60
晶体特征:熔、沸点低,熔融状态不导电,熔融时
不破坏共价键
结构特征:存在分子,分子内原子之间形成共价键,
个别分子晶体中无共价键
D
1.下列关于晶体的说法正确的是( )
A.晶体中只要有阳离子就一定有阴离子
B.氢键属于分子间作用力,不存在于分子内
C.原子晶体的熔点一定比金属晶体的高
D.构成分子晶体的微粒不一定含有共价键
2.下列各组物质中,按熔点由低到高排列的是( )
A.O2、I2、Hg B.CO2、Al2O3、KCl
C.Na、K、Rb D.H2S、H2Se、H2Te
3.下列有关比较正确的是( )
A.熔点:CH4>SiH4>GeH4>SnH4
B.晶格能:NaBr>NaCl>MgO
C.键的极性:N—H键>O—H键>F—H键
D.热稳定性:HF>H2O>NH3
D
D
4.下列物质中,属于分子晶体的是( )
①二氧化硅 ②碘 ③食盐 ④蔗糖 ⑤磷酸
A.②④⑤ B.①②④
C.②③④⑤ D.①②③⑤
A
专题3 微粒间作用力与物质性质
第四单元 分子间作用力 分子晶体
第2课时 分子晶体
二氧化硅
碳和硅为同主族元素,它们对应的氧化物CO2和SiO2的物理性质相似吗?为什么
CO2(干冰)
1. 能辨识常见的分子晶体,并能从微观角度分析分子晶体中各构成微粒之间的作用和对分子晶体物理性质的影响。(宏观辨识与微观探析)
2. 能利用分子晶体的通性推断常见的分子晶体,理解分子晶体中微粒的堆积模型,并能利用均摊法对晶胞进行分析。(证据推理与模型认知)
1. 知道分子晶体的概念、结构特点及常见的分子晶体。
2. 认识分子晶体中微粒及其微粒间的相互作用。
3.能描述典型分子晶体的特点,区分共价晶体和分子晶体。
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
分子晶体
分子通过分子间作用力结合形成的晶体。
分子间作用力(部分分子晶体中还存在氢键)
1.定义:
2.构成微粒:
3.微粒间的作用力:
分子
分子晶体的化学式都是分子式。
4.分子晶体的物理性质
①熔点、沸点低
②硬度小
③固态和熔融状态不导电。
由于分子间作用力较弱,所以分子晶体
(1) 所有非金属氢化物: H2O、H2S、NH3、CH4、HX
(2) 大多数非金属单质: X2、N2、O2、H2、S8、P4、C60
(3) 大多数非金属氧化物: CO2、SO2、N2O4、P4O6、P4O10
(4) 几乎所有的酸: H2SO4、HNO3、H3PO4
(5) 大多数有机物: 乙醇、冰醋酸、蔗糖
5.典型的分子晶体:
下列物质中,属于分子晶体的是( )
①二氧化硅 ②碘 ③食盐 ④蔗糖 ⑤磷酸
A.②④⑤ B.①②④
C.②③④⑤ D.①②③⑤
A
【巩固练习】
6.分子晶体熔、沸点高低的比较规律:
(1)组成和结构相似的物质
相对分子质量越大,分子间作用力越大,熔沸点越高;若存在氢键(HF、H2O、NH3),会使其熔沸点升高
(2)相对分子质量接近的物质
看分子的极性,对称性差、分子极性强的,熔沸点高一些
【例】在碳原子数相同的烷烃的同分异构体中,一般来说,支链数越多,熔沸点越低。如沸点:正戊烷 > 异戊烷 > 新戊烷。
下列物质,按沸点降低顺序排列的一组是( )
A.HF、HCl、HBr、HI
B.F2、Cl2、Br2、I2
C.H2O、H2S、H2Se、H2Te
D.CI4、CBr4、CCl4、CF4
D
【巩固练习】
与CO2分子距离最近的CO2分子共有 个
——面心立方晶胞
CO2分子处于8个顶点和6个面心
1个干冰晶体晶胞中含有 个CO2分子
干冰的晶体结构
4
12
7.常见分子晶体结构
冰中1个水分子周围有 个水分子
平均每1个水分子实际形成 个氢键
冰的晶体结构
——空间正四面体构型
4
2
C60中有 个六边形, 个五边形,
C60分子中含有碳碳单键 个,
C60分子中含有碳碳双键 个
20
12
60
30
足球烯C60的晶体结构
——笼状结构
【学以致用】二氧化硅和二氧化碳是组成相似的共价化合物,但是它们的物理性质却差别很大,为什么?
SiO2的空间结构
CO2空间结构
SiO2为共价晶体,熔融时破坏共价键,所以熔沸点高
CO2为分子晶体,熔融时破坏分子间作用力,所以熔沸点低
几种类型晶体的结构和性质
晶体类型 金属晶体 离子晶体 原子晶体 分子晶体
结 构 构成微粒 金属阳离子、自由电子 阴、阳离子 原子 分子
微粒间作用力 金属键 离子键 共价键 分子间作用力
性 质 熔、沸点 差异较大 高 很高 低
硬 度 差异较大 硬而脆 很大 小
导电性 导电 熔化或溶于水导电 一般不导电,硅是半导体 固体及熔融状态不导电,有的溶于水能导电。
举 例 金属、 金属合金 离子化合物 金刚石、Si、SiO2、SiC 硫、干冰、冰、
冰醋酸、蔗糖
石墨晶体
(混合晶体)
①石墨晶体为层状结构。层与层之间以
结合。故石墨质软,有滑腻感。
③在同一层内,每个碳原子以C-C键与3个碳原子结合,形成六元环。每个六元环平均 个 C原子。
②在同一层内,碳原子以 彼此结合,故石墨熔点较高。
④1mol石墨晶体中C-C键为 。
1.结构与性质
2
1.5NA
分子间作用力
共价键
⑤在同一平面的碳原子还各剩下一个p轨道,它们相互重叠,形成大π键。这些电子比较自由,相当于金属中的自由电子,所以石墨能导热和导电。
分子晶体
构成粒子:分子
粒子间作用力:分子间作用力
典型的晶体:冰、干冰、I2、S8、稀有气体(固态)、
P4、C60
晶体特征:熔、沸点低,熔融状态不导电,熔融时
不破坏共价键
结构特征:存在分子,分子内原子之间形成共价键,
个别分子晶体中无共价键
D
1.下列关于晶体的说法正确的是( )
A.晶体中只要有阳离子就一定有阴离子
B.氢键属于分子间作用力,不存在于分子内
C.原子晶体的熔点一定比金属晶体的高
D.构成分子晶体的微粒不一定含有共价键
2.下列各组物质中,按熔点由低到高排列的是( )
A.O2、I2、Hg B.CO2、Al2O3、KCl
C.Na、K、Rb D.H2S、H2Se、H2Te
3.下列有关比较正确的是( )
A.熔点:CH4>SiH4>GeH4>SnH4
B.晶格能:NaBr>NaCl>MgO
C.键的极性:N—H键>O—H键>F—H键
D.热稳定性:HF>H2O>NH3
D
D
4.下列物质中,属于分子晶体的是( )
①二氧化硅 ②碘 ③食盐 ④蔗糖 ⑤磷酸
A.②④⑤ B.①②④
C.②③④⑤ D.①②③⑤
A
