专题4 第二单元 配合物的形成和应用课件 (共29张PPT)2024-2025学年高二化学苏教版(2019)选择性必修第二册
文档属性
| 名称 | 专题4 第二单元 配合物的形成和应用课件 (共29张PPT)2024-2025学年高二化学苏教版(2019)选择性必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 32.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-23 00:25:25 | ||
图片预览







文档简介
(共29张PPT)
专题4 分子空间结构与物质性质
第二单元 配合物的形成和应用
CuSO4 是白色的,CuSO4·5H2O 晶体却是蓝色的,这是为什么呢?
CuSO4 CuSO4·5H2O
1.认识简单配位化合物的成键特征。
2.能正确运用化学符号描述配合物的组成。
3.学会简单配合物的实验制备。
4.能联系配合物的组成和结构解释相关的实验现象。
5.认识生命体中配位化合物的功能,列举配合物在药物开发和催化剂研制等领域的重要应用。
1.能从微观角度理解配位键的形成条件和表示方法;能判断常见的配合物。
(宏观辨识与微观探析)
2.能利用配合物的性质去推测配合物的组成,从而形成“结构决定性质”的认知模型。(证据推理与模型认知)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
一 配合物的形成
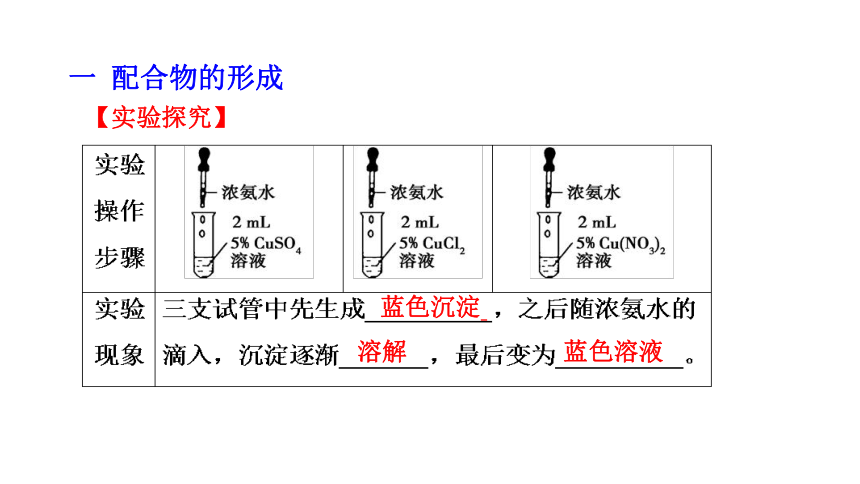
【实验探究】
蓝色沉淀
溶解
蓝色溶液
1.滴加氨水后,试管中首先出现蓝色沉淀。
Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
2.继续滴加氨水,沉淀逐渐溶解,溶液变成深蓝色。
【思考与讨论】沉淀为什么溶解?深蓝色的可溶物质是什么?
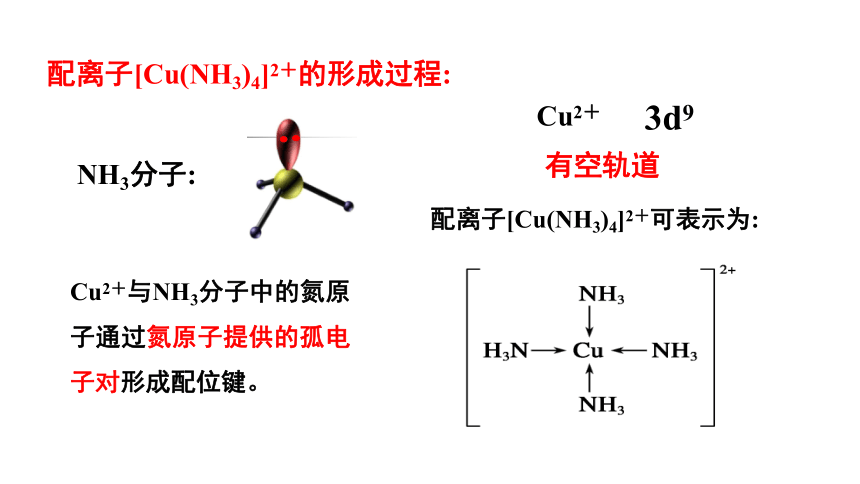
Cu2+与NH3分子中的氮原子通过氮原子提供的孤电子对形成配位键。
配离子[Cu(NH3)4]2+可表示为:
NH3分子:
Cu2+
3d9
有空轨道
配离子[Cu(NH3)4]2+的形成过程:
1.滴加氨水后,试管中首先出现蓝色沉淀。
Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
2.继续滴加氨水,沉淀逐渐溶解,溶液变成深蓝色。
【思考与讨论】沉淀为什么溶解?深蓝色的可溶物质是什么?
Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O
1、概念:
二 配位化合物
【注意】NH4Cl不是配合物。
把金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物称为配位化合物,简称配合物。
如:[Cu(NH3)4]SO4、[Ag(NH3)2]OH等均为配合物
【思考与讨论】为什么无水CuSO4是白色的,而CuSO4·5H2O和CuSO4溶液是蓝色的?
硫酸铜溶液
2、配合物的结构
(内外界之间是完全电离的)
[Co(NH3)6] Cl3
内界
外界
K3[Cr(CN)6]
内界
外界
(1)内界与外界
=[Zn(NH3)4]2++SO42-
[Zn(NH3)4] SO4
內界
↓
外界
↓
例如:
[Zn (NH3) 4 ] SO4
中心
原子
配位体
NH3
配位数
4
(2)内界的结构
配位原子
N
[Co(NH3)6]Cl3
K3[Cr(CN)6]
练习:
1、填空下列配合物的配位数
K[PtCl3(NH3)] 配位数为___
[Co(NH3)4Cl2]Cl 配位数是___
[Co(NH3)5Cl]Cl2 配位数是___
6
【提示】配位体不是同一分子或离子时,配位数要两者相加。
4
6
3+1=4
4+2=6
5+1=6
【巩固练习】
形成条件
一方能提供孤电子对
另一方能提供空轨道
如分子有NH3、H2O、HF、CO等;
离子有Cl-、OH-、CN-、SCN-等。
如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等过渡金属的原子或离子。
【学以致用】
请根据[Zn(NH3)4]SO4中配位键的形成,总结配位键形成的条件。
【学以致用】
2.现有两种配合物晶体[Co(NH3)6]Cl3和[Co(NH3)5Cl]Cl2,一种为橙黄色,另一种为紫红色。请设计实验方案将两种配合物区别开来。
【提示】取相同质量的两种晶体分别配成溶液,向两种溶液中分别滴加硝酸酸化的AgNO3溶液至不再产生沉淀,分别记录滴加的AgNO3溶液的体积。滴加体积多的为[Co(NH3)6]Cl3,滴加体积少的为[Co(NH3)5Cl]Cl2。
【巩固练习】0.01mol氯化铬(CrCl3·6H2O)在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀。此氯化铬最可能是( )
A.[Cr(H2O)6]Cl3
B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl2]Cl·2H2O
D.[Cr(H2O)3Cl3]·3H2O
B
3.配合物的空间结构
一般中心原子的配位数为2、4、6。
配合物的异构现象
含有两种或两种以上配位体的配合物,若配位体在空间的排列方式不同,就能形成不同的几何构型的配合物。
如:Pt(NH3)2Cl2有顺式和反式两种异构体。
极性分子
非极性分子
三、配合物的应用
在实验研究中,常用形成配合物的方法来检验金属离子、分离物质、定量测定物质的组成。
在生产中,配合物被广泛应用于染色、电镀、硬水软化、金属冶炼领域。
在许多尖端领域如激光材料、超导材料、抗癌药物的研究、催化剂的研制等方面,配合物发挥着越来越大的作用。
(1)银氨溶液
银镜反应→检验葡萄糖
配制银氨溶液时,向AgNO3溶液中滴加氨水,先生成白色沉淀,后沉淀逐渐溶解,生成银氨溶液。
Ag++NH3·H2O=AgOH↓+NH4+
AgOH+2NH3·H2O=[Ag(NH3)2]++OH-+2H2O
(2)检验Fe3+离子
Fe3+与SCN-生成[Fe(SCN)n](3-n)+
血红色
(3)做助熔剂
2 Al2O3(熔融)==4 Al+3 O2↑
电解
加冰晶石Na3[AlF6]降低熔点
血红素(Fe2+ )结构示意图
CO中毒原因
人体内血红蛋白是Fe2+卟林配合物, Fe2+与O2结合形成配合物,而CO与血红蛋白中的Fe2+能生成更稳定的配合物。发生CO中毒事故,应首先将病人移至通风处,必要时送医院抢救。
在生命体中、医药、配合物与生物固氮、生产生活等中都有很重要的应用。
配合物
形成
配位键
组成
内界
外界
应用
中心原子
配位体
1.起固定氮作用的化学反应是( )
A、氮气与氢气在一定条件下反应生成氨气
B、一氧化氮与氧气反应生成二氧化氮
C、氨气经催化氧化生成一氧化氮
D、由氨气制碳酸氢铵和硫酸铵
A
2.要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时,最佳顺序为( )
①加入足量氯水 ②加入足量酸性高锰酸钾溶液
③加入少量NH4SCN溶液
A.①③ B.③②
C.③① D.①②③
C
3.下列分子或离子中,能提供孤电子对与某些金属离子形成配位键的是( )
①H2O ②NH3 ③F- ④CN- ⑤CO
A.①② B.①②③④⑤
C.①②③ D.①②④
B
4.向下列配合物的水溶液中加入AgNO3溶液,不能生成AgCl沉淀的是( )
A.[Co(NH3)3Cl3] B.[Co(NH3)6]Cl3
C.[Co(NH3)4Cl2]Cl D.[Co(NH3)5Cl]Cl2
A
专题4 分子空间结构与物质性质
第二单元 配合物的形成和应用
CuSO4 是白色的,CuSO4·5H2O 晶体却是蓝色的,这是为什么呢?
CuSO4 CuSO4·5H2O
1.认识简单配位化合物的成键特征。
2.能正确运用化学符号描述配合物的组成。
3.学会简单配合物的实验制备。
4.能联系配合物的组成和结构解释相关的实验现象。
5.认识生命体中配位化合物的功能,列举配合物在药物开发和催化剂研制等领域的重要应用。
1.能从微观角度理解配位键的形成条件和表示方法;能判断常见的配合物。
(宏观辨识与微观探析)
2.能利用配合物的性质去推测配合物的组成,从而形成“结构决定性质”的认知模型。(证据推理与模型认知)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
一 配合物的形成
【实验探究】
蓝色沉淀
溶解
蓝色溶液
1.滴加氨水后,试管中首先出现蓝色沉淀。
Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
2.继续滴加氨水,沉淀逐渐溶解,溶液变成深蓝色。
【思考与讨论】沉淀为什么溶解?深蓝色的可溶物质是什么?
Cu2+与NH3分子中的氮原子通过氮原子提供的孤电子对形成配位键。
配离子[Cu(NH3)4]2+可表示为:
NH3分子:
Cu2+
3d9
有空轨道
配离子[Cu(NH3)4]2+的形成过程:
1.滴加氨水后,试管中首先出现蓝色沉淀。
Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
2.继续滴加氨水,沉淀逐渐溶解,溶液变成深蓝色。
【思考与讨论】沉淀为什么溶解?深蓝色的可溶物质是什么?
Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O
1、概念:
二 配位化合物
【注意】NH4Cl不是配合物。
把金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物称为配位化合物,简称配合物。
如:[Cu(NH3)4]SO4、[Ag(NH3)2]OH等均为配合物
【思考与讨论】为什么无水CuSO4是白色的,而CuSO4·5H2O和CuSO4溶液是蓝色的?
硫酸铜溶液
2、配合物的结构
(内外界之间是完全电离的)
[Co(NH3)6] Cl3
内界
外界
K3[Cr(CN)6]
内界
外界
(1)内界与外界
=[Zn(NH3)4]2++SO42-
[Zn(NH3)4] SO4
內界
↓
外界
↓
例如:
[Zn (NH3) 4 ] SO4
中心
原子
配位体
NH3
配位数
4
(2)内界的结构
配位原子
N
[Co(NH3)6]Cl3
K3[Cr(CN)6]
练习:
1、填空下列配合物的配位数
K[PtCl3(NH3)] 配位数为___
[Co(NH3)4Cl2]Cl 配位数是___
[Co(NH3)5Cl]Cl2 配位数是___
6
【提示】配位体不是同一分子或离子时,配位数要两者相加。
4
6
3+1=4
4+2=6
5+1=6
【巩固练习】
形成条件
一方能提供孤电子对
另一方能提供空轨道
如分子有NH3、H2O、HF、CO等;
离子有Cl-、OH-、CN-、SCN-等。
如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等过渡金属的原子或离子。
【学以致用】
请根据[Zn(NH3)4]SO4中配位键的形成,总结配位键形成的条件。
【学以致用】
2.现有两种配合物晶体[Co(NH3)6]Cl3和[Co(NH3)5Cl]Cl2,一种为橙黄色,另一种为紫红色。请设计实验方案将两种配合物区别开来。
【提示】取相同质量的两种晶体分别配成溶液,向两种溶液中分别滴加硝酸酸化的AgNO3溶液至不再产生沉淀,分别记录滴加的AgNO3溶液的体积。滴加体积多的为[Co(NH3)6]Cl3,滴加体积少的为[Co(NH3)5Cl]Cl2。
【巩固练习】0.01mol氯化铬(CrCl3·6H2O)在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀。此氯化铬最可能是( )
A.[Cr(H2O)6]Cl3
B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl2]Cl·2H2O
D.[Cr(H2O)3Cl3]·3H2O
B
3.配合物的空间结构
一般中心原子的配位数为2、4、6。
配合物的异构现象
含有两种或两种以上配位体的配合物,若配位体在空间的排列方式不同,就能形成不同的几何构型的配合物。
如:Pt(NH3)2Cl2有顺式和反式两种异构体。
极性分子
非极性分子
三、配合物的应用
在实验研究中,常用形成配合物的方法来检验金属离子、分离物质、定量测定物质的组成。
在生产中,配合物被广泛应用于染色、电镀、硬水软化、金属冶炼领域。
在许多尖端领域如激光材料、超导材料、抗癌药物的研究、催化剂的研制等方面,配合物发挥着越来越大的作用。
(1)银氨溶液
银镜反应→检验葡萄糖
配制银氨溶液时,向AgNO3溶液中滴加氨水,先生成白色沉淀,后沉淀逐渐溶解,生成银氨溶液。
Ag++NH3·H2O=AgOH↓+NH4+
AgOH+2NH3·H2O=[Ag(NH3)2]++OH-+2H2O
(2)检验Fe3+离子
Fe3+与SCN-生成[Fe(SCN)n](3-n)+
血红色
(3)做助熔剂
2 Al2O3(熔融)==4 Al+3 O2↑
电解
加冰晶石Na3[AlF6]降低熔点
血红素(Fe2+ )结构示意图
CO中毒原因
人体内血红蛋白是Fe2+卟林配合物, Fe2+与O2结合形成配合物,而CO与血红蛋白中的Fe2+能生成更稳定的配合物。发生CO中毒事故,应首先将病人移至通风处,必要时送医院抢救。
在生命体中、医药、配合物与生物固氮、生产生活等中都有很重要的应用。
配合物
形成
配位键
组成
内界
外界
应用
中心原子
配位体
1.起固定氮作用的化学反应是( )
A、氮气与氢气在一定条件下反应生成氨气
B、一氧化氮与氧气反应生成二氧化氮
C、氨气经催化氧化生成一氧化氮
D、由氨气制碳酸氢铵和硫酸铵
A
2.要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时,最佳顺序为( )
①加入足量氯水 ②加入足量酸性高锰酸钾溶液
③加入少量NH4SCN溶液
A.①③ B.③②
C.③① D.①②③
C
3.下列分子或离子中,能提供孤电子对与某些金属离子形成配位键的是( )
①H2O ②NH3 ③F- ④CN- ⑤CO
A.①② B.①②③④⑤
C.①②③ D.①②④
B
4.向下列配合物的水溶液中加入AgNO3溶液,不能生成AgCl沉淀的是( )
A.[Co(NH3)3Cl3] B.[Co(NH3)6]Cl3
C.[Co(NH3)4Cl2]Cl D.[Co(NH3)5Cl]Cl2
A
