江苏省盐城市建湖县第二中学2015-2016学年高二5月阶段考试化学试题
文档属性
| 名称 | 江苏省盐城市建湖县第二中学2015-2016学年高二5月阶段考试化学试题 |  | |
| 格式 | zip | ||
| 文件大小 | 256.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
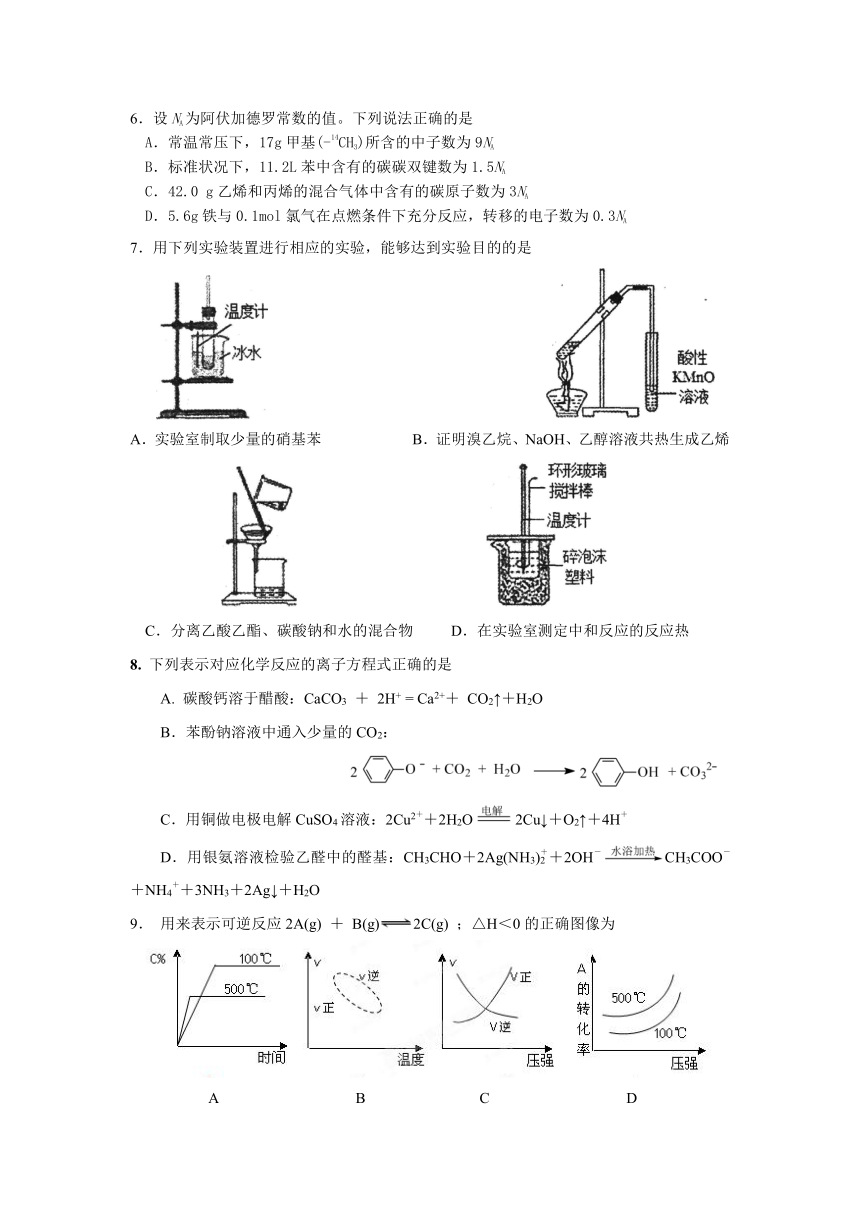
| 科目 | 化学 | ||
| 更新时间 | 2016-05-30 23:02:16 | ||
图片预览




文档简介
建湖二中高二化学
可能用到的相对原子质量:H l C 12 O16 Na23 Fe 56 Cu 64 Na 23 Cr 52 S 32 Cl 35.5 Mg 24
单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意。
1.化学与生产生活、环境保护、资源利用、能源开发等密切相关。下列说法错误的是
A.煤炭经气化、液化和干馏等过程,可以转化为清洁能源
B.利用二氧化碳制造全降解塑料,可以缓解温室效应
C.利用生物方法脱除生活污水中的氮和磷,防止水体富营养化
D.高纯硅广泛应用于太阳能电池、计算机芯片和光导纤维
2.下列有关化学用语表示不正确的是
A. H2F+的电子式:[HH]+
B.铝离子的结构示意图:
C. 质子数为35、中子数为45的溴原子:
D. 丙烷分子的球棍模型:
3. 在pH=1的澄清透明溶液中,不能大量共存的离子组是
A. Na+、K+、NO3-、CO32- B.Cu2+、NH4+、SO42-、Cl-
C.Ba2+、K+、Cl-、Br- D.Zn2+、Na+、NO3-、SO42-
4. 下列有关物质性质的应用正确的是
A.液氨汽化时要吸收大量的热,可用作制冷剂
B.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
C.生石灰能与水反应,可用来干燥氯气
D.氯化铝是一种电解质,可用于电解法制铝
5.在原电池的电极上所发生的反应,下列说法正确的是
A.原电池的正极发生氧化反应
B.原电池的负极发生氧化反应
C.发生原电池反应时,溶液中的阳离子向负极定向移动
D.如右图,可观察到灵敏检流计的指针不偏转;
6.设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,17g甲基(-14CH3)所含的中子数为9NA
B.标准状况下,11.2L苯中含有的碳碳双键数为1.5NA
C.42.0 g乙烯和丙烯的混合气体中含有的碳原子数为3NA
D.5.6g铁与0.1mol氯气在点燃条件下充分反应,转移的电子数为0.3NA
7.用下列实验装置进行相应的实验,能够达到实验目的的是
A.实验室制取少量的硝基苯 B.证明溴乙烷、NaOH、乙醇溶液共热生成乙烯
C.分离乙酸乙酯、碳酸钠和水的混合物 D.在实验室测定中和反应的反应热
8. 下列表示对应化学反应的离子方程式正确的是
A. 碳酸钙溶于醋酸:CaCO3 + 2H+ = Ca2++ CO2↑+H2O
B.苯酚钠溶液中通入少量的CO2:
C.用铜做电极电解CuSO4溶液:2Cu2++2H2O2Cu↓+O2↑+4H+
D.用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2+ +2OH-CH3COO-+NH4++3NH3+2Ag↓+H2O
9. 用来表示可逆反应2A(g) + B(g)2C(g) ;△H<0的正确图像为
10.短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列说法正确的是
A.原子半径的大小顺序: r(Y)>r(Z)>r(W)
B.元素Z、W 的简单离子的电子层结构不同
C.元素Y 的简单气态氢化物的热稳定性比Z 的强
D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物
不定项选择题:本题包括5小题,每小题4分,共计20分。每小题有一个或两个选项符合
题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,
只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11. 下列有关说法正确的是
A.CaCO3(s) =CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0
B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C.N2(g)+3H2(g) =2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2 )和H2的平衡转化率均增大
D.水的离子积常数Kw 随着温度的升高而增大,说明水的电离是吸热反应
12.进行化学实验、观察实验现象,通过分析、推理得出正确的结论是化学学习的方法之一。下列对有关实验事实的解释正确的是
A.将N2和过量的O2在高温或放电的条件下反应得到红棕色的气体,说明NO为红棕色气体
B.在AgNO3溶液中加入锌粉,能置换出银,说明Ag+的还原性比Zn2+强
C.用干净的铂丝蘸取少量溶液在酒精灯外焰上灼烧,发现火焰呈黄色,则溶液中一定不含K+
D.浓硫酸放入蔗糖中,能使蔗糖炭化,说明浓硫酸具有脱水性
13.新鲜水果、蔬菜中富含的维生素C具有抗衰老作用。某学习小组利用碘滴定法测定维生素C的含量,发生的反应如下:
下列说法正确的是
A、该反应为取代反应
B、维生素C易溶于水,易被氧化
C、1 mol有机物甲最多能和2 mol H2反应
D、两种有机物中含有官能团的种类相同
14.已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O3(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A.△H1>0,△H3<0 B.△H2>0,△H4>0
C.△H1=△H2+△H3 D.△H3=△H4+△H5
15.恒温恒容时,向体积为2.0L密闭容器中充入1.0 molPCl5,反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s 0 50 150 250 350
n(PCl3)/ mol 0 0.16 0.19 0.20 0.20
下列说法正确的是
A. 反应在前50 s的平均速率为v(PCl3)=0.0016 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.12 mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3、2.0mol Cl2,达到平衡时,PCl3的转化率小于80%
建湖二中高二化学
班级 姓名 学号
题号 1 2 3 4 5 6 7 8 9 10
答案
题号 11 12 13 14 15
答案
一、二、选择题,将各题正确答案的字母所在的表格内。
三、填空题
16.(12分)今有氧、镁、铝、硫、铬5种元素,试回答下列问题
(1)镁晶体堆积方式为 堆积(选填:“简单立方”、“体心立方”、“面心立方”、“六方”);
(2)用“>”、“<”填写下表
第一电离能 电负性 晶格能 沸点
Mg Al O S MgO MgS H2O H2S
(3)基态铬原子外围电子轨道表示式为 。
17.(15分)化合物D是硅橡胶的稳定剂,其合成路线如下图
(1)B的分子式为 ; C中官能团名称 。
(2)C→D的反应类型为 。
(3)B→C的化学方程式为 。
(4)化合物D可能具有的性质有 (选填序号)。
a.与FeCl3溶液发生显色反应 b.加成反应 c.消去反应 d.酯化反应
(5)化合物B经3步反应可制备,反应类型依次是 (选填序号)。
a.加成 、 取代、 消去 b.消去、加成、取代 c.取代、消去、加成
(6)写出同时满足下列条件的A的一种同分异构体的结构简式 。
①核磁共振氢谱只有一个峰 ②分子中没有碳碳双键也无环状结构
18.(12分) 300℃时,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:
X(g) +Y(g)2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min 2 4 7 9
n(Y)/mol 0.12 0.11 0.10 0.10
回答下列问题:
(1)反应0~2 min Z的平均速率v(Z)=
(2)能判断该反应已经达到平衡状态的是
A.生成X的速率是生成Z的速率的2倍 B.容器内压强保持不变
C.容器内气体的密度保持不变 D.容器内各气体的浓度保持不变
(3)要提高上述反应的转化率,可采取的措施是 (任写一种)。
(4)温度为300℃时,该反应的化学平衡常数K=
(5)若起始时向该容器中充入X、Y、Z各0.20 mol,则反应将向 (填“正”或“逆”)反应方向进行,达平衡时Z的体积分数与上述平衡相比 (填“增大”、“减小”或“不变”)
19.(15分)汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源。
(1)设汽油成分为C8H18,若在气缸中汽油高温裂解产生丁烷和丁烯,写出该反应的化学方程 。
(2)气缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H >0
①汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因是
。
②1mol空气中含有0.8molN2和0.2molO2,1300℃时在含1mol空气的密闭容器内反应达到平衡。测得NO为8×10-4mol。计算该温度下的平衡常数K≈ 。
(3)尾气中的CO主要来自于汽油不完全燃烧。
①有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) △H=+221kJ·mol-1, 简述该设想能否实现的依据: 。
②测量汽车尾气的浓度常用电化学气敏传感器,其中CO传感器可用下图简单表示,则阳极发生的电极反应为 。
(4)在汽车尾气系统中安装催化转换器,可有效减少尾气中的CO、NOx 和碳氢化合物等废气。
已知:N2(g)+O2(g)=2NO(g) △H1=+180kJ/mol
CO(g) +1/2O2(g)= CO2(g) △H2=-283kJ/mol
2NO(g)+ 2CO(g) = 2CO2(g) + N2(g) △H3
则△H3 = kJ·mol-1。
(5)光化学烟雾(含臭氧、醛类、过氧乙酰硝酸酯等)是汽车尾气在紫外线作用下发生光化学反应生成的二次污染物。写出2-丁烯与臭氧按物质的量之比为1:2反应生成乙醛及氧气的化学方程式 。
20.(14分)甲醇是基本有机原料之一,可用于燃料电池、制取MTBE 等有机产品。
(1)一种“直接甲醇燃料电池”结构如题20图—1所示,电解质为强酸溶液,该燃料电池负极的电极反应式为 。
(2)水煤气法制取甲醇的反应其反应的焓变、平衡常数如下:
CH4(g) + 1/2O2(g) = CO(g) + 2H2(g) H1 =-35.4kJ·mol-1 平衡常数K1
CO(g) + 2H2(g) CH3OH (g) H2 =-90.1 kJ·mol-1 平衡常数K2
2CH4(g) + O2(g) 2CH3OH(g) H3 平衡常数K3
H3 = kJ·mol-1 (填数值) ;相同温度下K3= (用含K1、K2代数式表示)。
(3)二氧化碳加氢也可合成甲醇[CO2(g)+3H2(g) CH3OH(g)+H2O(g)],在10.0L的密闭容器中投入1molCO2和2.75molH2,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强变化如题20图—2所示。
①图中二氧化碳合成甲醇正反应为 反应(选填:“放热”或“吸热”)。
②图中压强P1 P2(选填:“>”或“<”)。
③在图中“M”点,平衡常数K= (填数值,保留2位小数)。
(4)甲醇与醇ROH在浓硫酸及加热条件下可制备汽油抗爆震剂 MTBE。已知MTBE的分子式为C5H12O,其核磁共振氢谱如题20图—3所示。
①ROH的名称为 。
②写出制备MTBE的化学方程式: 。
21.(12分)【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域
内作答。若多做,则按A小题评分。
A、[物质结构与性质]
Fe2+、Fe3+与O22—、CN—、F—、有机分子等形成的化合物具有广泛的应用。
(1)C、N、O原子的第一电离能由大到小的顺序是 。
(2)Fe2+基态核外电子排布式为 。
(3)乙酰基二茂铁是常用汽油抗震剂,其结构如题21A图-1所示。
此物质中碳原子的杂化方式是 。
(4)配合物K3Fe(CN)6可用于电子传感器的制作。与配体互为
等电子体的一种分子的化学式为 。已知(CN)2
是直线型分子,并具有对称性,则(CN)2中π键和σ键的
个数比为 。
(5)F—不仅可与Fe3+形成[FeF6]3—,还可以与Mg2+、K+形成
一种立方晶系的离子晶体,此晶体应用于激光领域,结
构如题21A图-2所示。该晶体的化学式为 。
建湖二中高二化学
1D 2C 3A 4A 5B 6C 7D 8D 9A 10D
11BD 12D 13BC 14C 15AC
16.(12分)(1)六方;(2)>;>;>;> (3)(每空2分)
17.(15分)
(1)C6H12O(2分);羰基(2分)
(2)加成反应(2分)
(3)(2分)
(4)bcd (2分)
(5)b (2分)
(6)CH3-C≡C-O-C≡C-CH3(3分)
18.(本题共12分,每空2分)
(1)0.004 mol·L-1·min-1 (2)D (3)降低温度(合理即可)
(4)1.44 (5)正 不变
19.(15分)
(1)C8H18C4H10 + C4H8(2分)
(2)①温度升高,反应速率加快,平衡右移(2分) ②4×10-6(2分)
(3)①该反应是焓增、熵减的反应,任何温度下均不能自发进行(2分)
②CO+H2O-2e-=CO2+2H+(2分)
(4)-746(2分)
(5) CH3CH=CHCH3 +2O32CH3CHO +2O2(3分)
20. (14 分)
(1)CH3OH+H2O-6e-= CO2+6H+(2分)
(2)-251 (2分);K12·K22(2分)
(3)①放热(1分) ②>(1分) ③1.04(2分)
(4)①2-甲基-2-丙醇(或:叔丁醇)(2分)
②CH3OH + (CH3)3COHCH3OC(CH3)3 + H2O(2分)
21. (12 分)(1)N>O>C (2)1s22s22p63s23p6 3d6 或[Ar] 3d6 (3)sp3、sp2
(4)CO或N2 4:3 (5)KMgF3
A B C D
题20图—1
▲
0.06
0.12
0.18
0.24
0.30
0.36
540
530
520
510
500
●
▲
▲
▲
▲
○
○
○
○
○
n(CH3OH) /mol
T /K
M (506,0.25)
P1
P2
MTBE的1HNMR谱
1
2
3
4
5
6
7
8
9
δ/ppm
0
题20图—2 题20图—3
题21A图-1
题21A图-2
K+
Mg2+
F -
可能用到的相对原子质量:H l C 12 O16 Na23 Fe 56 Cu 64 Na 23 Cr 52 S 32 Cl 35.5 Mg 24
单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意。
1.化学与生产生活、环境保护、资源利用、能源开发等密切相关。下列说法错误的是
A.煤炭经气化、液化和干馏等过程,可以转化为清洁能源
B.利用二氧化碳制造全降解塑料,可以缓解温室效应
C.利用生物方法脱除生活污水中的氮和磷,防止水体富营养化
D.高纯硅广泛应用于太阳能电池、计算机芯片和光导纤维
2.下列有关化学用语表示不正确的是
A. H2F+的电子式:[HH]+
B.铝离子的结构示意图:
C. 质子数为35、中子数为45的溴原子:
D. 丙烷分子的球棍模型:
3. 在pH=1的澄清透明溶液中,不能大量共存的离子组是
A. Na+、K+、NO3-、CO32- B.Cu2+、NH4+、SO42-、Cl-
C.Ba2+、K+、Cl-、Br- D.Zn2+、Na+、NO3-、SO42-
4. 下列有关物质性质的应用正确的是
A.液氨汽化时要吸收大量的热,可用作制冷剂
B.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
C.生石灰能与水反应,可用来干燥氯气
D.氯化铝是一种电解质,可用于电解法制铝
5.在原电池的电极上所发生的反应,下列说法正确的是
A.原电池的正极发生氧化反应
B.原电池的负极发生氧化反应
C.发生原电池反应时,溶液中的阳离子向负极定向移动
D.如右图,可观察到灵敏检流计的指针不偏转;
6.设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,17g甲基(-14CH3)所含的中子数为9NA
B.标准状况下,11.2L苯中含有的碳碳双键数为1.5NA
C.42.0 g乙烯和丙烯的混合气体中含有的碳原子数为3NA
D.5.6g铁与0.1mol氯气在点燃条件下充分反应,转移的电子数为0.3NA
7.用下列实验装置进行相应的实验,能够达到实验目的的是
A.实验室制取少量的硝基苯 B.证明溴乙烷、NaOH、乙醇溶液共热生成乙烯
C.分离乙酸乙酯、碳酸钠和水的混合物 D.在实验室测定中和反应的反应热
8. 下列表示对应化学反应的离子方程式正确的是
A. 碳酸钙溶于醋酸:CaCO3 + 2H+ = Ca2++ CO2↑+H2O
B.苯酚钠溶液中通入少量的CO2:
C.用铜做电极电解CuSO4溶液:2Cu2++2H2O2Cu↓+O2↑+4H+
D.用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2+ +2OH-CH3COO-+NH4++3NH3+2Ag↓+H2O
9. 用来表示可逆反应2A(g) + B(g)2C(g) ;△H<0的正确图像为
10.短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列说法正确的是
A.原子半径的大小顺序: r(Y)>r(Z)>r(W)
B.元素Z、W 的简单离子的电子层结构不同
C.元素Y 的简单气态氢化物的热稳定性比Z 的强
D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物
不定项选择题:本题包括5小题,每小题4分,共计20分。每小题有一个或两个选项符合
题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,
只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11. 下列有关说法正确的是
A.CaCO3(s) =CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0
B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C.N2(g)+3H2(g) =2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2 )和H2的平衡转化率均增大
D.水的离子积常数Kw 随着温度的升高而增大,说明水的电离是吸热反应
12.进行化学实验、观察实验现象,通过分析、推理得出正确的结论是化学学习的方法之一。下列对有关实验事实的解释正确的是
A.将N2和过量的O2在高温或放电的条件下反应得到红棕色的气体,说明NO为红棕色气体
B.在AgNO3溶液中加入锌粉,能置换出银,说明Ag+的还原性比Zn2+强
C.用干净的铂丝蘸取少量溶液在酒精灯外焰上灼烧,发现火焰呈黄色,则溶液中一定不含K+
D.浓硫酸放入蔗糖中,能使蔗糖炭化,说明浓硫酸具有脱水性
13.新鲜水果、蔬菜中富含的维生素C具有抗衰老作用。某学习小组利用碘滴定法测定维生素C的含量,发生的反应如下:
下列说法正确的是
A、该反应为取代反应
B、维生素C易溶于水,易被氧化
C、1 mol有机物甲最多能和2 mol H2反应
D、两种有机物中含有官能团的种类相同
14.已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O3(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A.△H1>0,△H3<0 B.△H2>0,△H4>0
C.△H1=△H2+△H3 D.△H3=△H4+△H5
15.恒温恒容时,向体积为2.0L密闭容器中充入1.0 molPCl5,反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s 0 50 150 250 350
n(PCl3)/ mol 0 0.16 0.19 0.20 0.20
下列说法正确的是
A. 反应在前50 s的平均速率为v(PCl3)=0.0016 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.12 mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3、2.0mol Cl2,达到平衡时,PCl3的转化率小于80%
建湖二中高二化学
班级 姓名 学号
题号 1 2 3 4 5 6 7 8 9 10
答案
题号 11 12 13 14 15
答案
一、二、选择题,将各题正确答案的字母所在的表格内。
三、填空题
16.(12分)今有氧、镁、铝、硫、铬5种元素,试回答下列问题
(1)镁晶体堆积方式为 堆积(选填:“简单立方”、“体心立方”、“面心立方”、“六方”);
(2)用“>”、“<”填写下表
第一电离能 电负性 晶格能 沸点
Mg Al O S MgO MgS H2O H2S
(3)基态铬原子外围电子轨道表示式为 。
17.(15分)化合物D是硅橡胶的稳定剂,其合成路线如下图
(1)B的分子式为 ; C中官能团名称 。
(2)C→D的反应类型为 。
(3)B→C的化学方程式为 。
(4)化合物D可能具有的性质有 (选填序号)。
a.与FeCl3溶液发生显色反应 b.加成反应 c.消去反应 d.酯化反应
(5)化合物B经3步反应可制备,反应类型依次是 (选填序号)。
a.加成 、 取代、 消去 b.消去、加成、取代 c.取代、消去、加成
(6)写出同时满足下列条件的A的一种同分异构体的结构简式 。
①核磁共振氢谱只有一个峰 ②分子中没有碳碳双键也无环状结构
18.(12分) 300℃时,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:
X(g) +Y(g)2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min 2 4 7 9
n(Y)/mol 0.12 0.11 0.10 0.10
回答下列问题:
(1)反应0~2 min Z的平均速率v(Z)=
(2)能判断该反应已经达到平衡状态的是
A.生成X的速率是生成Z的速率的2倍 B.容器内压强保持不变
C.容器内气体的密度保持不变 D.容器内各气体的浓度保持不变
(3)要提高上述反应的转化率,可采取的措施是 (任写一种)。
(4)温度为300℃时,该反应的化学平衡常数K=
(5)若起始时向该容器中充入X、Y、Z各0.20 mol,则反应将向 (填“正”或“逆”)反应方向进行,达平衡时Z的体积分数与上述平衡相比 (填“增大”、“减小”或“不变”)
19.(15分)汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源。
(1)设汽油成分为C8H18,若在气缸中汽油高温裂解产生丁烷和丁烯,写出该反应的化学方程 。
(2)气缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H >0
①汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因是
。
②1mol空气中含有0.8molN2和0.2molO2,1300℃时在含1mol空气的密闭容器内反应达到平衡。测得NO为8×10-4mol。计算该温度下的平衡常数K≈ 。
(3)尾气中的CO主要来自于汽油不完全燃烧。
①有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) △H=+221kJ·mol-1, 简述该设想能否实现的依据: 。
②测量汽车尾气的浓度常用电化学气敏传感器,其中CO传感器可用下图简单表示,则阳极发生的电极反应为 。
(4)在汽车尾气系统中安装催化转换器,可有效减少尾气中的CO、NOx 和碳氢化合物等废气。
已知:N2(g)+O2(g)=2NO(g) △H1=+180kJ/mol
CO(g) +1/2O2(g)= CO2(g) △H2=-283kJ/mol
2NO(g)+ 2CO(g) = 2CO2(g) + N2(g) △H3
则△H3 = kJ·mol-1。
(5)光化学烟雾(含臭氧、醛类、过氧乙酰硝酸酯等)是汽车尾气在紫外线作用下发生光化学反应生成的二次污染物。写出2-丁烯与臭氧按物质的量之比为1:2反应生成乙醛及氧气的化学方程式 。
20.(14分)甲醇是基本有机原料之一,可用于燃料电池、制取MTBE 等有机产品。
(1)一种“直接甲醇燃料电池”结构如题20图—1所示,电解质为强酸溶液,该燃料电池负极的电极反应式为 。
(2)水煤气法制取甲醇的反应其反应的焓变、平衡常数如下:
CH4(g) + 1/2O2(g) = CO(g) + 2H2(g) H1 =-35.4kJ·mol-1 平衡常数K1
CO(g) + 2H2(g) CH3OH (g) H2 =-90.1 kJ·mol-1 平衡常数K2
2CH4(g) + O2(g) 2CH3OH(g) H3 平衡常数K3
H3 = kJ·mol-1 (填数值) ;相同温度下K3= (用含K1、K2代数式表示)。
(3)二氧化碳加氢也可合成甲醇[CO2(g)+3H2(g) CH3OH(g)+H2O(g)],在10.0L的密闭容器中投入1molCO2和2.75molH2,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强变化如题20图—2所示。
①图中二氧化碳合成甲醇正反应为 反应(选填:“放热”或“吸热”)。
②图中压强P1 P2(选填:“>”或“<”)。
③在图中“M”点,平衡常数K= (填数值,保留2位小数)。
(4)甲醇与醇ROH在浓硫酸及加热条件下可制备汽油抗爆震剂 MTBE。已知MTBE的分子式为C5H12O,其核磁共振氢谱如题20图—3所示。
①ROH的名称为 。
②写出制备MTBE的化学方程式: 。
21.(12分)【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域
内作答。若多做,则按A小题评分。
A、[物质结构与性质]
Fe2+、Fe3+与O22—、CN—、F—、有机分子等形成的化合物具有广泛的应用。
(1)C、N、O原子的第一电离能由大到小的顺序是 。
(2)Fe2+基态核外电子排布式为 。
(3)乙酰基二茂铁是常用汽油抗震剂,其结构如题21A图-1所示。
此物质中碳原子的杂化方式是 。
(4)配合物K3Fe(CN)6可用于电子传感器的制作。与配体互为
等电子体的一种分子的化学式为 。已知(CN)2
是直线型分子,并具有对称性,则(CN)2中π键和σ键的
个数比为 。
(5)F—不仅可与Fe3+形成[FeF6]3—,还可以与Mg2+、K+形成
一种立方晶系的离子晶体,此晶体应用于激光领域,结
构如题21A图-2所示。该晶体的化学式为 。
建湖二中高二化学
1D 2C 3A 4A 5B 6C 7D 8D 9A 10D
11BD 12D 13BC 14C 15AC
16.(12分)(1)六方;(2)>;>;>;> (3)(每空2分)
17.(15分)
(1)C6H12O(2分);羰基(2分)
(2)加成反应(2分)
(3)(2分)
(4)bcd (2分)
(5)b (2分)
(6)CH3-C≡C-O-C≡C-CH3(3分)
18.(本题共12分,每空2分)
(1)0.004 mol·L-1·min-1 (2)D (3)降低温度(合理即可)
(4)1.44 (5)正 不变
19.(15分)
(1)C8H18C4H10 + C4H8(2分)
(2)①温度升高,反应速率加快,平衡右移(2分) ②4×10-6(2分)
(3)①该反应是焓增、熵减的反应,任何温度下均不能自发进行(2分)
②CO+H2O-2e-=CO2+2H+(2分)
(4)-746(2分)
(5) CH3CH=CHCH3 +2O32CH3CHO +2O2(3分)
20. (14 分)
(1)CH3OH+H2O-6e-= CO2+6H+(2分)
(2)-251 (2分);K12·K22(2分)
(3)①放热(1分) ②>(1分) ③1.04(2分)
(4)①2-甲基-2-丙醇(或:叔丁醇)(2分)
②CH3OH + (CH3)3COHCH3OC(CH3)3 + H2O(2分)
21. (12 分)(1)N>O>C (2)1s22s22p63s23p6 3d6 或[Ar] 3d6 (3)sp3、sp2
(4)CO或N2 4:3 (5)KMgF3
A B C D
题20图—1
▲
0.06
0.12
0.18
0.24
0.30
0.36
540
530
520
510
500
●
▲
▲
▲
▲
○
○
○
○
○
n(CH3OH) /mol
T /K
M (506,0.25)
P1
P2
MTBE的1HNMR谱
1
2
3
4
5
6
7
8
9
δ/ppm
0
题20图—2 题20图—3
题21A图-1
题21A图-2
K+
Mg2+
F -
同课章节目录
