分层作业9 化学键 离子键和共价键--2025鲁科版化学必修第二册同步练习题(含答案)
文档属性
| 名称 | 分层作业9 化学键 离子键和共价键--2025鲁科版化学必修第二册同步练习题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 381.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-24 09:41:45 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025鲁科版化学必修第二册
分层作业9 化学键 离子键和共价键
A级必备知识基础练
以下选择题只有一个选项符合题目要求。
题组1.化学键的概念、化学变化的实质
1.从化学键的角度看,化学反应的实质是“旧化学键断裂和新化学键形成”,下列既有旧化学键的断裂,又有新化学键的形成的变化是( )
A.固体碘的升华
B.生石灰作为干燥剂吸水
C.氯化钠的熔化
D.酒精溶于水
2.下列叙述错误的是( )
A.带相反电荷的离子之间的相互作用称为离子键
B.某主族元素原子最外层只有一个电子,它与卤素原子结合时所形成的化学键不一定是离子键
C.金属元素与非金属元素化合时,不一定形成离子键
D.只由非金属元素形成的化合物中不可能含有离子键
题组2.离子键与共价键的概念、形成及判断
3.(2024宁夏石嘴山高一期末)下列分子的化学键类型、空间结构的说法均正确的有( )
选项 分子 化学键类型 空间结构
A NH3 极性键 正四面体形
B CO2 极性键 直线形
C H2O 非极性键 直线形
D CH4 极性键 角形
4.将等物质的量的硫酸和氢氧化钠反应后所得到的溶液蒸干,可得到NaHSO4固体。下列关于NaHSO4的说法正确的是( )
A.NaHSO4固体中阳离子和阴离子的个数比是1∶2
B.NaHSO4固体中阳离子和阴离子的个数比是2∶1
C.NaHSO4固体熔化时破坏的是离子键和共价键
D.NaHSO4固体溶于水时破坏的是离子键和共价键
5.(2024山东泰安高一期中)寿山石是传统“四大印章石”之一,某地采掘的寿山石化学式为X2Y4Z10(ZF)2。已知F、Z、X、Y均为短周期元素且原子序数依次增大,X元素原子的最外层电子数等于其电子层数,且其单质能与强碱溶液反应生成F2,YF4与F2Z2都是含有18个电子的分子。下列说法错误的是( )
A.Y元素最高价氧化物对应的水化物为弱酸
B.X单质的导电能力强于Y单质
C.Z和F可形成不止一种化合物
D.F2Z2中既含有离子键,又含有共价键
6.(2024福建普通高中学业水平合格考)氯化铵等铵态氮肥与氢氧化钙等碱性物质混合施用,会发生反应释放氨气而降低肥效。反应中涉及的下列四种物质,不含离子键的是( )
A.NH4Cl B.Ca(OH)2
C.CaCl2 D.NH3
7.化学家证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:
下列关于合成氨反应的叙述中不正确的是( )
A.该过程表明在化学反应中存在化学键的断裂与形成
B.在催化剂的作用下,反应物的化学键变得容易断裂
C.过程②需吸收能量,过程③则释放能量
D.常温下该反应难以进行,是因为常温下生成物的化学键难以形成
B级关键能力提升练
以下选择题有一个或两个选项符合题目要求。
8.(2024山东威海二中高一期中)利用热稳定性的差异可实现物质的转化和分离。以镁为例的转化关系如图,其中a、c分别代表Mg(OH)Cl或MgO。下列说法错误的是( )
A.a为Mg(OH)Cl,c为MgO
B.c中所有原子最外层均为8e-稳定结构
C.NH4Cl和Mg(OH)Cl中均既存在离子键又存在共价键
D.上述转化过程中不涉及氧化还原反应
9.(2024山东青岛58中高一期末)由短周期元素X、Y、Z、W组成的单质A、B、C、D能发生如下反应,Z是短周期中原子半径最大的元素,W是地壳中含量最多的金属元素,F是淡黄色固体。下列说法不正确的是( )
A.原子半径大小:Z>W>Y>X
B.最高价氧化物对应水化物的碱性强弱:Z>W
C.F中阴、阳离子个数比为1∶1
D.G中既含有离子键又含有共价键
10.全氮类物质具有高密度、超高能量及爆轰产物无污染等优点。中国科学家成功合成全氮阴离子是全氮类物质的重要中间体。下列说法不正确的是( )
A.全氮类物质属于绿色能源
B.每个中含有36个质子
C.由阴、阳离子构成
D.中只含有离子键
11.下列反应过程中,同时有离子键和共价键的断裂和形成的反应是( )
A.NH4ClNH3↑+HCl↑
B.NH3+CO2+H2ONH4HCO3
C.2NaBr+Cl22NaCl+Br2
D.CuSO4+FeCu+FeSO4
12.有下列几种物质:①P4 ②KOH ③I2 ④MgCl2 ⑤Na2S ⑥氩气 ⑦CaC2
回答下列问题:
(1)不含有化学键的是 。
(2)只含有非极性键的是 。
(3)只含有离子键的是 。
(4)既含有离子键又含有极性键的是 。
(5)既含有离子键又含有非极性键的是 。
C级学科素养拔高练
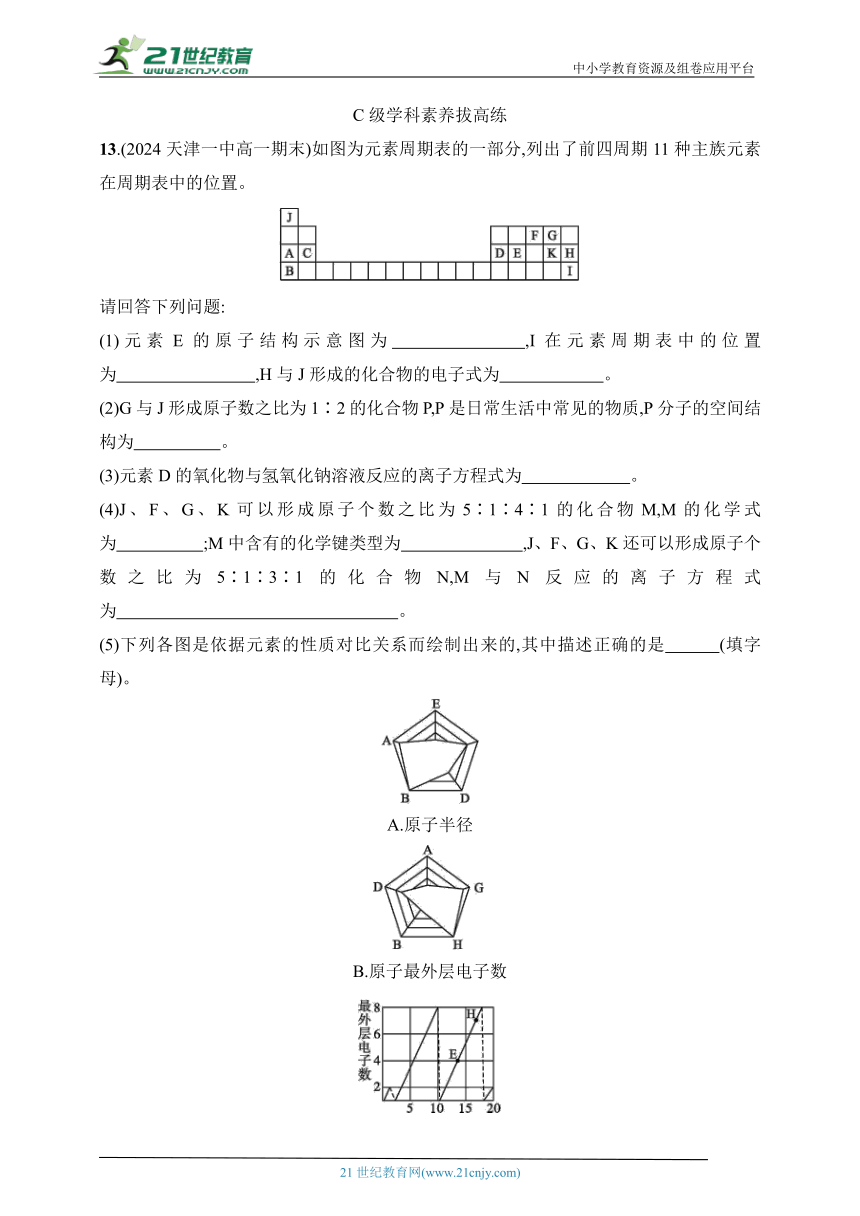
13.(2024天津一中高一期末)如图为元素周期表的一部分,列出了前四周期11种主族元素在周期表中的位置。
请回答下列问题:
(1)元素E的原子结构示意图为 ,I在元素周期表中的位置为 ,H与J形成的化合物的电子式为 。
(2)G与J形成原子数之比为1∶2的化合物P,P是日常生活中常见的物质,P分子的空间结构为 。
(3)元素D的氧化物与氢氧化钠溶液反应的离子方程式为 。
(4)J、F、G、K可以形成原子个数之比为5∶1∶4∶1的化合物M,M的化学式为 ;M中含有的化学键类型为 ,J、F、G、K还可以形成原子个数之比为5∶1∶3∶1的化合物N,M与N反应的离子方程式为 。
(5)下列各图是依据元素的性质对比关系而绘制出来的,其中描述正确的是 (填字母)。
A.原子半径
B.原子最外层电子数
C.原子序数
分层作业9 化学键 离子键和共价键
1.B 解析 A、C、D均为物理变化,B为化学变化。
2.D 解析 A项,带相反电荷的离子就是阴、阳离子,相互作用就是静电作用,正确;B项,主族元素原子最外层只有一个电子,可以是氢原子,它和卤素原子结合,如HF、HCl、HBr、HI等,所形成的化学键为共价键,若主族元素是Li、Na、K等,则和卤素原子结合所形成的化学键为离子键,正确;C项,金属元素与非金属元素化合时可能形成离子键,如NaCl、MgCl2等,也可能形成共价键,如AlCl3等,正确;D项,只由非金属元素形成的化合物中可能含有离子键,如铵盐等,错误。
3.B 解析 NH3含极性键,分子呈三角锥形,故A错误;CO2含极性键,分子呈直线形,故B正确;H2O含极性键,分子呈角形,故C错误;CH4含极性键,分子呈正四面体形,故D错误。
4.D 解析 NaHSO4固体中阳离子(Na+)和阴离子(HS)的个数比是1∶1,A、B项错误;NaHSO4固体熔化时破坏的只有离子键,C项错误;NaHSO4固体溶于水时电离成Na+、H+和S,破坏的是离子键和共价键,D项正确。
5.D 解析 已知F、Z、X、Y均为短周期元素且原子序数依次增大,X元素原子的最外层电子数等于其电子层数,且其单质能与强碱反应生成F2,推测出F为H,X为Al,YF4与F2Z2都是含有18个电子的分子,可推出Y、Z分别是Si、O。Y元素最高价氧化物对应的水化物硅酸为弱酸,A正确;X为铝,铝属于导体,导电性很强,Y单质为硅,硅为半导体,导电性弱于铝,B正确;O和H可以形成H2O2、H2O,C正确;H2O2中只含有共价键,没有离子键,D错误。
6.D 解析 NH4Cl中铵根离子和氯离子之间存在离子键,故A不符合题意;Ca(OH)2中钙离子和氢氧根离子之间存在离子键,故B不符合题意;CaCl2中钙离子和氯离子之间存在离子键,故C不符合题意;NH3中只存在极性共价键,不存在离子键,故D符合题意。
7.D 解析 由题图可知,每3个氢气分子和1个氮气分子断键得到原子,然后原子重新结合生成2个氨分子,A正确;催化剂能改变化学反应的速率,合成氨的反应在催化剂作用下,反应速率加快,意味着反应物化学键的断裂变得更容易,B正确;化学键的断裂需要吸收能量,而化学键的形成则释放能量,从题图可看出②为化学键断裂过程,③为化学键形成过程,C正确;化学键的断裂需要吸收能量,所以该反应在常温下难以进行,D错误。
8.AB 解析 Mg(OH)Cl分解生成MgO和HCl,故a为MgO,c为Mg(OH)Cl,d为HCl,MgO和NH4Cl反应生成Mg(OH)Cl和NH3,故b为NH3。a为MgO,c为Mg(OH)Cl,A错误;c为Mg(OH)Cl,H原子为2电子稳定结构,B错误;NH4Cl中铵根离子和氯离子之间为离子键,铵根离子内N原子和H原子之间为共价键,Mg(OH)Cl中镁离子和氢氧根离子、镁离子与氯离子之间均为离子键,氢氧根内H原子与O原子之间为共价键,C正确;Mg(OH)Cl分解生成MgO和HCl,MgO和NH4Cl反应生成Mg(OH)Cl和NH3,两个过程中均没有元素化合价发生变化,不属于氧化还原反应,D正确。
9.C 解析 由短周期元素X、Y、Z、W组成的单质A、B、C、D能发生如图反应,Z是短周期中原子半径最大的元素,则Z(C)为Na,W是地壳中含量最多的金属元素,则W(D)为Al;F是淡黄色固体,则F为Na2O2。依据图中信息,可得出Y为O,G为NaOH、E为H2O、X为H、H为Na[Al(OH)4],故X、Y、Z、W、A、B、C、D、E、F、G、H分别为H、O、Na、Al、H2、O2、Na、Al、H2O、Na2O2、NaOH、Na[Al(OH)4]。原子半径大小:Na>Al>O>H,A正确;Na的金属性强于Al,则最高价氧化物对应水化物的碱性强弱:NaOH>Al(OH)3,B正确;F为Na2O2,阴、阳离子分别为、Na+,二者的个数比为1∶2,C不正确;G为NaOH,由Na+和OH-构成,阴、阳离子间含有离子键,OH-中的O、H原子间含有共价键,D正确。
10.BD 解析 根据全氮类物质具有的优点可知其属于绿色能源,A正确;每个中含有7×5=35个质子,B错误;结构中含阴、阳离子,C正确;结构中间以离子键结合,以及中N原子间以共价键结合,中既含有离子键又含有共价键,D错误。
11.C 解析 A选项中没有离子键的形成;B选项中没有离子键的断裂;D选项中没有共价键的断裂和形成。
12.答案 (1)⑥ (2)①③ (3)④⑤ (4)② (5)⑦
解析 ①P4是只含有非极性共价键的单质;②KOH中含有离子键和极性共价键;③I2是只含有非极性共价键的非金属单质;④MgCl2只含有离子键;⑤Na2S只含有离子键;⑥氩气为单原子分子,分子中不存在共价键;⑦在CaC2中,Ca2+和之间存在离子键,内部两个碳原子之间存在非极性共价键,故CaC2既含有离子键又含有非极性键。
13.答案 (1) 第4周期ⅦA族
(2)角形
(3)2OH-+Al2O3+3H2O2[Al(OH)4]-
(4)NH4HSO4 离子键、共价键 HS+H+H2O+SO2↑
(5)AC
解析 根据元素在周期表中的位置,可确定A~K依次为Na、K、Mg、Al、Si、N、O、Cl、Br、H、S。
(1)E为Si,原子序数为14,其原子结构示意图为 ;I为Br,位于元素周期表第4周期ⅦA族;Cl与H形成的化合物为HCl,其电子式为。
(2)O与H形成的原子数之比为1∶2的化合物为H2O,H2O的空间结构为角形。
(3)Al的氧化物为Al2O3,Al2O3与氢氧化钠溶液反应的离子方程式为2OH-+Al2O3+3H2O2[Al(OH)4]-。
(4)H、N、O、S形成的原子个数之比为5∶1∶4∶1的化合物M为NH4HSO4,NH4HSO4含有离子键和共价键。H、N、O、S还可以形成原子个数之比为5∶1∶3∶1的化合物N,N为NH4HSO3,M与N反应的离子方程式为HS+H+H2O+SO2↑。
(5)A、B、D、E分别为Na、K、Al、Si,原子半径:K>Na>Al>Si,与图相符,A正确;A、B分别为Na、K,最外层电子数相等,而从图中看出A的最外层电子数比B大,B错误;E为Si,H为Cl,最外层电子数分别为4和7,与图相符,C正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025鲁科版化学必修第二册
分层作业9 化学键 离子键和共价键
A级必备知识基础练
以下选择题只有一个选项符合题目要求。
题组1.化学键的概念、化学变化的实质
1.从化学键的角度看,化学反应的实质是“旧化学键断裂和新化学键形成”,下列既有旧化学键的断裂,又有新化学键的形成的变化是( )
A.固体碘的升华
B.生石灰作为干燥剂吸水
C.氯化钠的熔化
D.酒精溶于水
2.下列叙述错误的是( )
A.带相反电荷的离子之间的相互作用称为离子键
B.某主族元素原子最外层只有一个电子,它与卤素原子结合时所形成的化学键不一定是离子键
C.金属元素与非金属元素化合时,不一定形成离子键
D.只由非金属元素形成的化合物中不可能含有离子键
题组2.离子键与共价键的概念、形成及判断
3.(2024宁夏石嘴山高一期末)下列分子的化学键类型、空间结构的说法均正确的有( )
选项 分子 化学键类型 空间结构
A NH3 极性键 正四面体形
B CO2 极性键 直线形
C H2O 非极性键 直线形
D CH4 极性键 角形
4.将等物质的量的硫酸和氢氧化钠反应后所得到的溶液蒸干,可得到NaHSO4固体。下列关于NaHSO4的说法正确的是( )
A.NaHSO4固体中阳离子和阴离子的个数比是1∶2
B.NaHSO4固体中阳离子和阴离子的个数比是2∶1
C.NaHSO4固体熔化时破坏的是离子键和共价键
D.NaHSO4固体溶于水时破坏的是离子键和共价键
5.(2024山东泰安高一期中)寿山石是传统“四大印章石”之一,某地采掘的寿山石化学式为X2Y4Z10(ZF)2。已知F、Z、X、Y均为短周期元素且原子序数依次增大,X元素原子的最外层电子数等于其电子层数,且其单质能与强碱溶液反应生成F2,YF4与F2Z2都是含有18个电子的分子。下列说法错误的是( )
A.Y元素最高价氧化物对应的水化物为弱酸
B.X单质的导电能力强于Y单质
C.Z和F可形成不止一种化合物
D.F2Z2中既含有离子键,又含有共价键
6.(2024福建普通高中学业水平合格考)氯化铵等铵态氮肥与氢氧化钙等碱性物质混合施用,会发生反应释放氨气而降低肥效。反应中涉及的下列四种物质,不含离子键的是( )
A.NH4Cl B.Ca(OH)2
C.CaCl2 D.NH3
7.化学家证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:
下列关于合成氨反应的叙述中不正确的是( )
A.该过程表明在化学反应中存在化学键的断裂与形成
B.在催化剂的作用下,反应物的化学键变得容易断裂
C.过程②需吸收能量,过程③则释放能量
D.常温下该反应难以进行,是因为常温下生成物的化学键难以形成
B级关键能力提升练
以下选择题有一个或两个选项符合题目要求。
8.(2024山东威海二中高一期中)利用热稳定性的差异可实现物质的转化和分离。以镁为例的转化关系如图,其中a、c分别代表Mg(OH)Cl或MgO。下列说法错误的是( )
A.a为Mg(OH)Cl,c为MgO
B.c中所有原子最外层均为8e-稳定结构
C.NH4Cl和Mg(OH)Cl中均既存在离子键又存在共价键
D.上述转化过程中不涉及氧化还原反应
9.(2024山东青岛58中高一期末)由短周期元素X、Y、Z、W组成的单质A、B、C、D能发生如下反应,Z是短周期中原子半径最大的元素,W是地壳中含量最多的金属元素,F是淡黄色固体。下列说法不正确的是( )
A.原子半径大小:Z>W>Y>X
B.最高价氧化物对应水化物的碱性强弱:Z>W
C.F中阴、阳离子个数比为1∶1
D.G中既含有离子键又含有共价键
10.全氮类物质具有高密度、超高能量及爆轰产物无污染等优点。中国科学家成功合成全氮阴离子是全氮类物质的重要中间体。下列说法不正确的是( )
A.全氮类物质属于绿色能源
B.每个中含有36个质子
C.由阴、阳离子构成
D.中只含有离子键
11.下列反应过程中,同时有离子键和共价键的断裂和形成的反应是( )
A.NH4ClNH3↑+HCl↑
B.NH3+CO2+H2ONH4HCO3
C.2NaBr+Cl22NaCl+Br2
D.CuSO4+FeCu+FeSO4
12.有下列几种物质:①P4 ②KOH ③I2 ④MgCl2 ⑤Na2S ⑥氩气 ⑦CaC2
回答下列问题:
(1)不含有化学键的是 。
(2)只含有非极性键的是 。
(3)只含有离子键的是 。
(4)既含有离子键又含有极性键的是 。
(5)既含有离子键又含有非极性键的是 。
C级学科素养拔高练
13.(2024天津一中高一期末)如图为元素周期表的一部分,列出了前四周期11种主族元素在周期表中的位置。
请回答下列问题:
(1)元素E的原子结构示意图为 ,I在元素周期表中的位置为 ,H与J形成的化合物的电子式为 。
(2)G与J形成原子数之比为1∶2的化合物P,P是日常生活中常见的物质,P分子的空间结构为 。
(3)元素D的氧化物与氢氧化钠溶液反应的离子方程式为 。
(4)J、F、G、K可以形成原子个数之比为5∶1∶4∶1的化合物M,M的化学式为 ;M中含有的化学键类型为 ,J、F、G、K还可以形成原子个数之比为5∶1∶3∶1的化合物N,M与N反应的离子方程式为 。
(5)下列各图是依据元素的性质对比关系而绘制出来的,其中描述正确的是 (填字母)。
A.原子半径
B.原子最外层电子数
C.原子序数
分层作业9 化学键 离子键和共价键
1.B 解析 A、C、D均为物理变化,B为化学变化。
2.D 解析 A项,带相反电荷的离子就是阴、阳离子,相互作用就是静电作用,正确;B项,主族元素原子最外层只有一个电子,可以是氢原子,它和卤素原子结合,如HF、HCl、HBr、HI等,所形成的化学键为共价键,若主族元素是Li、Na、K等,则和卤素原子结合所形成的化学键为离子键,正确;C项,金属元素与非金属元素化合时可能形成离子键,如NaCl、MgCl2等,也可能形成共价键,如AlCl3等,正确;D项,只由非金属元素形成的化合物中可能含有离子键,如铵盐等,错误。
3.B 解析 NH3含极性键,分子呈三角锥形,故A错误;CO2含极性键,分子呈直线形,故B正确;H2O含极性键,分子呈角形,故C错误;CH4含极性键,分子呈正四面体形,故D错误。
4.D 解析 NaHSO4固体中阳离子(Na+)和阴离子(HS)的个数比是1∶1,A、B项错误;NaHSO4固体熔化时破坏的只有离子键,C项错误;NaHSO4固体溶于水时电离成Na+、H+和S,破坏的是离子键和共价键,D项正确。
5.D 解析 已知F、Z、X、Y均为短周期元素且原子序数依次增大,X元素原子的最外层电子数等于其电子层数,且其单质能与强碱反应生成F2,推测出F为H,X为Al,YF4与F2Z2都是含有18个电子的分子,可推出Y、Z分别是Si、O。Y元素最高价氧化物对应的水化物硅酸为弱酸,A正确;X为铝,铝属于导体,导电性很强,Y单质为硅,硅为半导体,导电性弱于铝,B正确;O和H可以形成H2O2、H2O,C正确;H2O2中只含有共价键,没有离子键,D错误。
6.D 解析 NH4Cl中铵根离子和氯离子之间存在离子键,故A不符合题意;Ca(OH)2中钙离子和氢氧根离子之间存在离子键,故B不符合题意;CaCl2中钙离子和氯离子之间存在离子键,故C不符合题意;NH3中只存在极性共价键,不存在离子键,故D符合题意。
7.D 解析 由题图可知,每3个氢气分子和1个氮气分子断键得到原子,然后原子重新结合生成2个氨分子,A正确;催化剂能改变化学反应的速率,合成氨的反应在催化剂作用下,反应速率加快,意味着反应物化学键的断裂变得更容易,B正确;化学键的断裂需要吸收能量,而化学键的形成则释放能量,从题图可看出②为化学键断裂过程,③为化学键形成过程,C正确;化学键的断裂需要吸收能量,所以该反应在常温下难以进行,D错误。
8.AB 解析 Mg(OH)Cl分解生成MgO和HCl,故a为MgO,c为Mg(OH)Cl,d为HCl,MgO和NH4Cl反应生成Mg(OH)Cl和NH3,故b为NH3。a为MgO,c为Mg(OH)Cl,A错误;c为Mg(OH)Cl,H原子为2电子稳定结构,B错误;NH4Cl中铵根离子和氯离子之间为离子键,铵根离子内N原子和H原子之间为共价键,Mg(OH)Cl中镁离子和氢氧根离子、镁离子与氯离子之间均为离子键,氢氧根内H原子与O原子之间为共价键,C正确;Mg(OH)Cl分解生成MgO和HCl,MgO和NH4Cl反应生成Mg(OH)Cl和NH3,两个过程中均没有元素化合价发生变化,不属于氧化还原反应,D正确。
9.C 解析 由短周期元素X、Y、Z、W组成的单质A、B、C、D能发生如图反应,Z是短周期中原子半径最大的元素,则Z(C)为Na,W是地壳中含量最多的金属元素,则W(D)为Al;F是淡黄色固体,则F为Na2O2。依据图中信息,可得出Y为O,G为NaOH、E为H2O、X为H、H为Na[Al(OH)4],故X、Y、Z、W、A、B、C、D、E、F、G、H分别为H、O、Na、Al、H2、O2、Na、Al、H2O、Na2O2、NaOH、Na[Al(OH)4]。原子半径大小:Na>Al>O>H,A正确;Na的金属性强于Al,则最高价氧化物对应水化物的碱性强弱:NaOH>Al(OH)3,B正确;F为Na2O2,阴、阳离子分别为、Na+,二者的个数比为1∶2,C不正确;G为NaOH,由Na+和OH-构成,阴、阳离子间含有离子键,OH-中的O、H原子间含有共价键,D正确。
10.BD 解析 根据全氮类物质具有的优点可知其属于绿色能源,A正确;每个中含有7×5=35个质子,B错误;结构中含阴、阳离子,C正确;结构中间以离子键结合,以及中N原子间以共价键结合,中既含有离子键又含有共价键,D错误。
11.C 解析 A选项中没有离子键的形成;B选项中没有离子键的断裂;D选项中没有共价键的断裂和形成。
12.答案 (1)⑥ (2)①③ (3)④⑤ (4)② (5)⑦
解析 ①P4是只含有非极性共价键的单质;②KOH中含有离子键和极性共价键;③I2是只含有非极性共价键的非金属单质;④MgCl2只含有离子键;⑤Na2S只含有离子键;⑥氩气为单原子分子,分子中不存在共价键;⑦在CaC2中,Ca2+和之间存在离子键,内部两个碳原子之间存在非极性共价键,故CaC2既含有离子键又含有非极性键。
13.答案 (1) 第4周期ⅦA族
(2)角形
(3)2OH-+Al2O3+3H2O2[Al(OH)4]-
(4)NH4HSO4 离子键、共价键 HS+H+H2O+SO2↑
(5)AC
解析 根据元素在周期表中的位置,可确定A~K依次为Na、K、Mg、Al、Si、N、O、Cl、Br、H、S。
(1)E为Si,原子序数为14,其原子结构示意图为 ;I为Br,位于元素周期表第4周期ⅦA族;Cl与H形成的化合物为HCl,其电子式为。
(2)O与H形成的原子数之比为1∶2的化合物为H2O,H2O的空间结构为角形。
(3)Al的氧化物为Al2O3,Al2O3与氢氧化钠溶液反应的离子方程式为2OH-+Al2O3+3H2O2[Al(OH)4]-。
(4)H、N、O、S形成的原子个数之比为5∶1∶4∶1的化合物M为NH4HSO4,NH4HSO4含有离子键和共价键。H、N、O、S还可以形成原子个数之比为5∶1∶3∶1的化合物N,N为NH4HSO3,M与N反应的离子方程式为HS+H+H2O+SO2↑。
(5)A、B、D、E分别为Na、K、Al、Si,原子半径:K>Na>Al>Si,与图相符,A正确;A、B分别为Na、K,最外层电子数相等,而从图中看出A的最外层电子数比B大,B错误;E为Si,H为Cl,最外层电子数分别为4和7,与图相符,C正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
