第6章 化学反应与能量 分层作业8 化学反应与热能--2025人教版化学必修第二册同步练习题(含答案)
文档属性
| 名称 | 第6章 化学反应与能量 分层作业8 化学反应与热能--2025人教版化学必修第二册同步练习题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 593.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-24 09:56:18 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2025人教版化学必修第二册
分层作业8 化学反应与热能
A 级 必备知识基础练
题组1.化学能与热能的转化
1.(2024·北京人大附中高一期中)下列反应属于吸热反应的是( )
A.钠与水的反应
B.乙醇的燃烧
C.碳酸氢钠与柠檬酸的反应
D.氢氧化钾与硫酸的反应
2.(2024·浙江金华十校高一联考)下列反应中,既属于氧化还原反应又属于放热反应的是( )
A.硫酸与KOH溶液反应
B.灼热的炭与二氧化碳反应
C.Ba(OH)2·8H2O晶体与NH4Cl晶体反应
D.金属钾与水反应
3.(2024·重庆璧山高一期末)使用下列装置给液体升温时,将化学能转化为热能的是( )
A.太阳能热水器 B.热水壶 C.天然气燃烧 D.冷水与热水传递热量
4.(2024·湖南长沙雅礼中学月考)下列关于化学能与热能的说法,不正确的是( )
A.放热反应中反应物的总能量高于生成物总能量
B.吸热反应中断裂反应物化学键所吸收的能量大于形成生成物的化学键所放出的能量
C.化学反应既有物质变化,又有能量变化
D.镁条在空气中燃烧是放热反应,反应过程中所释放的能量全部转化为热能
5.(2024·河北衡水高一期中)某化学实验小组设计了如图三套实验装置探究化学能与热能的转化关系(装置中夹持仪器已略去)。回答下列问题:
(1)观察到甲装置中的实验现象是 ,产生该现象的原因是 。
(2)将乙装置中外层具支试管的支管与虚线框内的①连接,实验现象是 ;
支管与②连接,实验现象是 。
钠与水的总能量 (填“大于”或“小于”)生成物的能量。
(3)装置丙中将胶头滴管内的水滴到生石灰上,支管处的白色粉末(无水硫酸铜)变为蓝色,其原因是 。
(4)上述三个实验方案均验证了以上三个反应的反应物化学键断裂吸收的能量 (填“高于”或“低于”)生成物化学键形成放出的能量;物质中的化学能通过 转化成 释放出来。
题组2.化学反应中能量变化的原因
6.(2024·湖南株洲高一期末)将一小段镁带投入盛有稀盐酸的试管中,剧烈反应。一段时间后,用手触摸试管外壁感觉烫手。下列有关该反应的叙述错误的是( )
A.该反应为放热反应
B.该反应为吸热反应
C.反应过程中化学能转化为热能
D.反应物的总能量大于生成物的总能量
7.(2024·江苏扬州高一期中)反应NH3+HClNH4Cl的能量变化如图所示,下列说法正确的是( )
A.该反应是吸热反应
B.反应物的总能量大于生成物的总能量
C.H—Cl键断裂过程释放能量
D.放热反应都需要加热
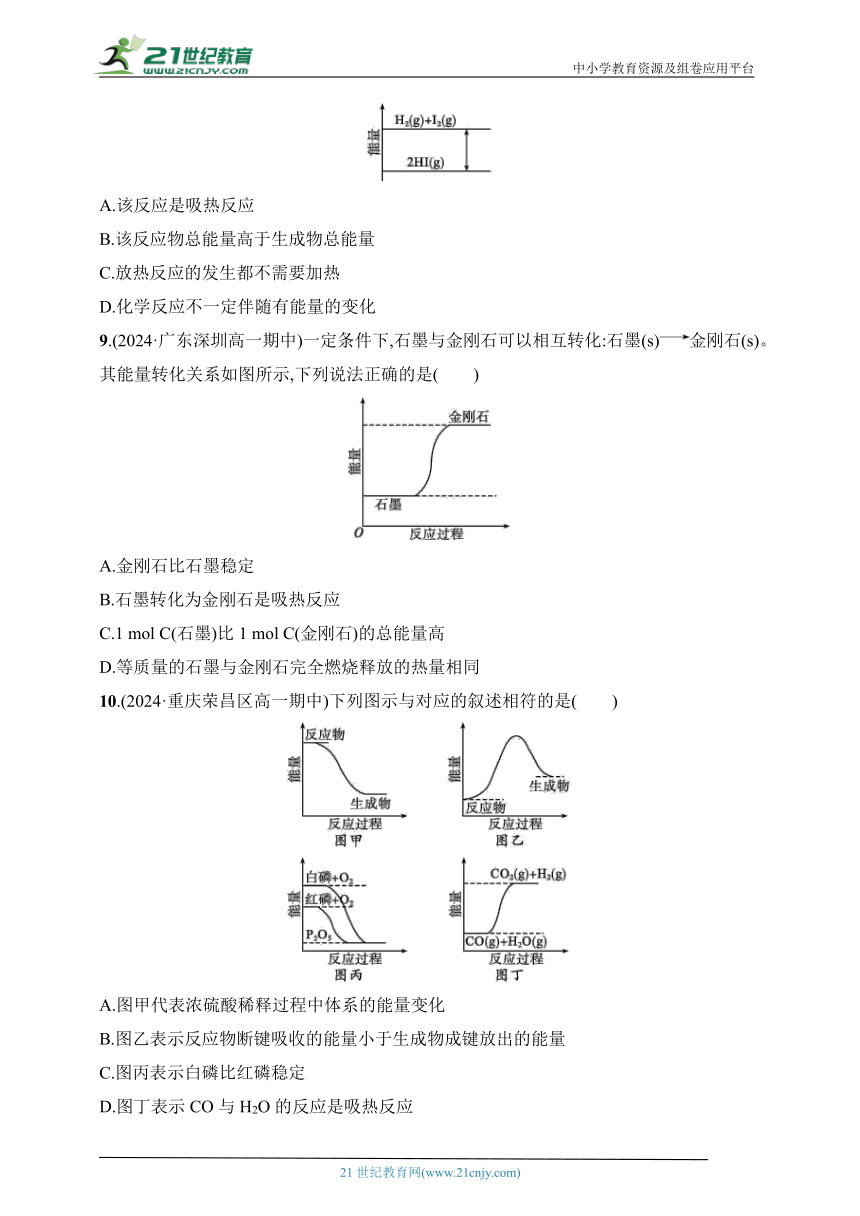
8.(2024·上海浦东新区高一期末)如图是H2(g)与I2(g)反应生成HI(g)的能量示意图。下列说法正确的是( )
A.该反应是吸热反应
B.该反应物总能量高于生成物总能量
C.放热反应的发生都不需要加热
D.化学反应不一定伴随有能量的变化
9.(2024·广东深圳高一期中)一定条件下,石墨与金刚石可以相互转化:石墨(s)金刚石(s)。其能量转化关系如图所示,下列说法正确的是( )
A.金刚石比石墨稳定
B.石墨转化为金刚石是吸热反应
C.1 mol C(石墨)比1 mol C(金刚石)的总能量高
D.等质量的石墨与金刚石完全燃烧释放的热量相同
10.(2024·重庆荣昌区高一期中)下列图示与对应的叙述相符的是( )
A.图甲代表浓硫酸稀释过程中体系的能量变化
B.图乙表示反应物断键吸收的能量小于生成物成键放出的能量
C.图丙表示白磷比红磷稳定
D.图丁表示CO与H2O的反应是吸热反应
B 级 关键能力提升练
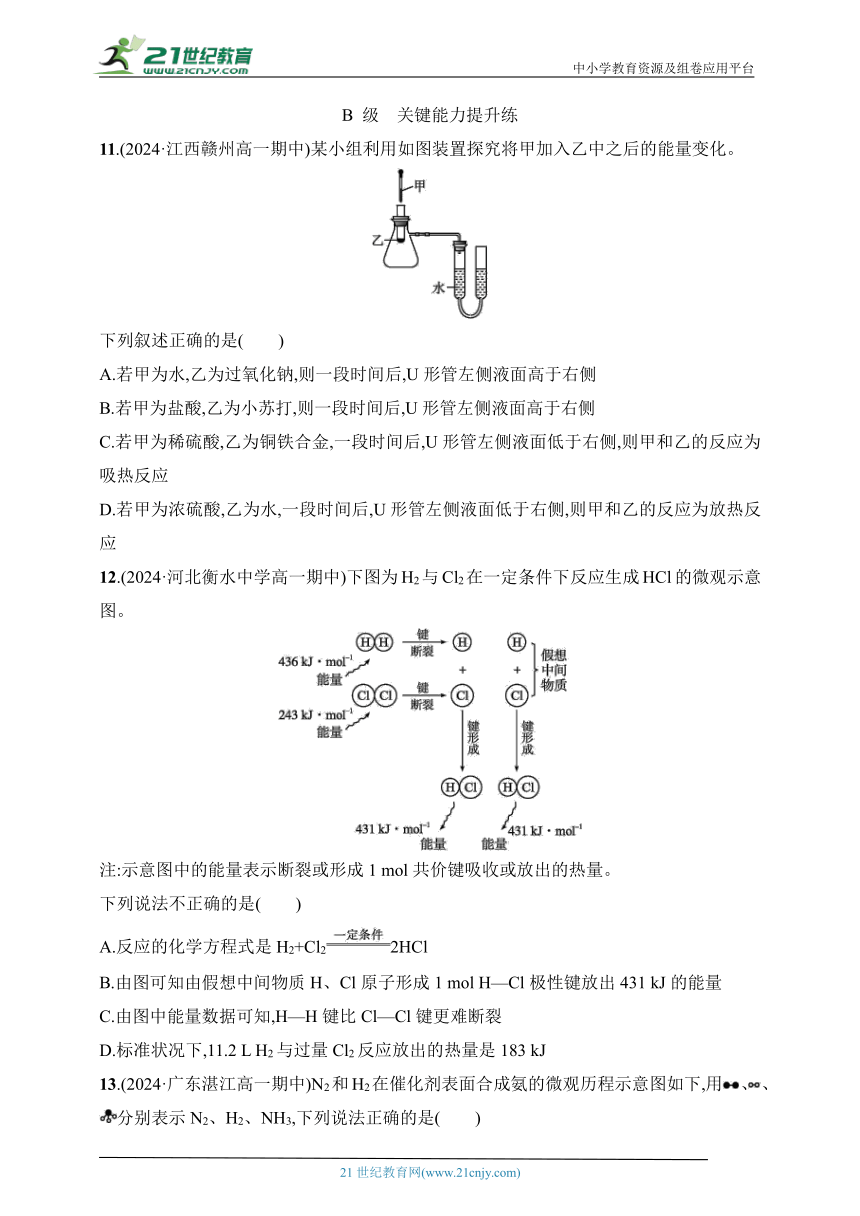
11.(2024·江西赣州高一期中)某小组利用如图装置探究将甲加入乙中之后的能量变化。
下列叙述正确的是( )
A.若甲为水,乙为过氧化钠,则一段时间后,U形管左侧液面高于右侧
B.若甲为盐酸,乙为小苏打,则一段时间后,U形管左侧液面高于右侧
C.若甲为稀硫酸,乙为铜铁合金,一段时间后,U形管左侧液面低于右侧,则甲和乙的反应为吸热反应
D.若甲为浓硫酸,乙为水,一段时间后,U形管左侧液面低于右侧,则甲和乙的反应为放热反应
12.(2024·河北衡水中学高一期中)下图为H2与Cl2在一定条件下反应生成HCl的微观示意图。
注:示意图中的能量表示断裂或形成1 mol共价键吸收或放出的热量。
下列说法不正确的是( )
A.反应的化学方程式是H2+Cl22HCl
B.由图可知由假想中间物质H、Cl原子形成1 mol H—Cl极性键放出431 kJ的能量
C.由图中能量数据可知,H—H键比Cl—Cl键更难断裂
D.标准状况下,11.2 L H2与过量Cl2反应放出的热量是183 kJ
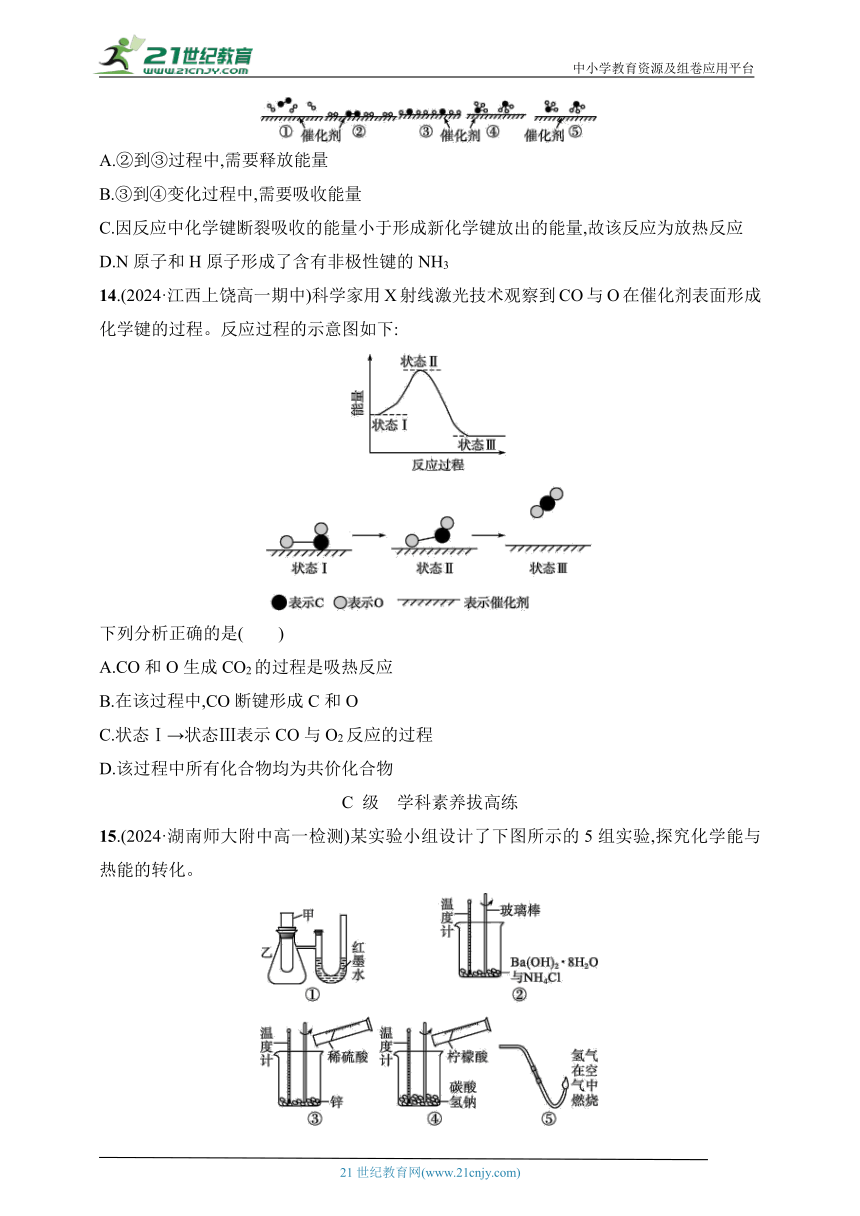
13.(2024·广东湛江高一期中)N2和H2在催化剂表面合成氨的微观历程示意图如下,用、、分别表示N2、H2、NH3,下列说法正确的是( )
A.②到③过程中,需要释放能量
B.③到④变化过程中,需要吸收能量
C.因反应中化学键断裂吸收的能量小于形成新化学键放出的能量,故该反应为放热反应
D.N原子和H原子形成了含有非极性键的NH3
14.(2024·江西上饶高一期中)科学家用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列分析正确的是( )
A.CO和O生成CO2的过程是吸热反应
B.在该过程中,CO断键形成C和O
C.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
D.该过程中所有化合物均为共价化合物
C 级 学科素养拔高练
15.(2024·湖南师大附中高一检测)某实验小组设计了下图所示的5组实验,探究化学能与热能的转化。
(1)实验①在实验前U形管中液面左右相平,在甲试管中加入适量氧化钙和水后,可观察到U形管中的现象是 ,
反应的化学方程式是 。
(2)实验②中反应的能量变化可用下图中的 (填字母)表示。
(3)实验③④⑤中属于吸热反应的是 (填序号)。
(4)从微观角度分析实验⑤化学反应中能量变化的原因:
①和②分别为 、 (填“吸收”或“释放”)。氢气与氧气反应生成1 mol水蒸气时,释放 kJ能量。
(5)当前,很多地区倡导用天然气替代煤作为家用燃料,从尽可能多的角度分析其原因:
。
已知:
燃料 燃烧释放的能量(每1千克)
天然气 55 812 kJ
煤 20 908 kJ
答案:
1.C 解析 钠与水的反应为放热反应,A错误;乙醇的燃烧为放热反应,B错误;碳酸氢钠与柠檬酸的反应为吸热反应,C正确;氢氧化钾与硫酸的反应为放热反应,D错误。
2.D 解析 硫酸与KOH溶液反应是放热反应,但不属于氧化还原反应,A错误;灼热的炭与二氧化碳在高温条件下反应生成一氧化碳,该反应是吸热反应,B错误;Ba(OH)2·8H2O晶体与NH4Cl晶体反应是吸热反应,C错误;金属钾与水反应生成KOH和H2,属于氧化还原反应,且该反应是放热反应,D正确。
3.C 解析 太阳能热水器是将太阳能转化为热能,A错误;电热水壶是将电能转化为热能,B错误;天然气燃烧是将化学能转化为热能,C正确;该过程属于热量的传递,不存在能量转化,D错误。
4.D 解析 D项,由于反应中有耀眼白光,故该反应过程中所释放的能量并未全部转化为热能,有一部分转化为光能,错误。
5.答案 (1)试管内有气泡产生,烧杯内有固体析出 镁与稀盐酸反应产生氢气且是放热反应,氢氧化钙的溶解度随温度的升高而减小,溶质析出
(2)支管连接的导管口处有气泡产生 支管连接的U形管内红墨水的液面左低右高 大于
(3)水与生石灰反应放热,温度升高,水被蒸发,无水硫酸铜白色粉末遇水变蓝
(4)低于 化学反应 热能
解析 (1)镁片和稀盐酸反应:Mg+2HClMgCl2+H2↑,试管内有气泡产生,且该反应放出热量,烧杯中温度升高,Ca(OH)2的溶解度随温度的升高而降低,故烧杯中析出Ca(OH)2固体。
(2)水与钠反应产生氢气,将支管与虚线框内的①连接,实验现象是:钠浮于水面上,并在水面上到处游动,发出“嘶嘶”的响声,熔成闪亮的小球,最后消失,烧杯中的导管口有气泡冒出;支管与②连接,由于压强原因U形管中的红墨水向右管移动;上述实验现象说明具支试管中的空气受热膨胀,则钠与水的反应为放热反应,说明钠与水的总能量大于生成物的总能量。
(3)装置丙中将胶头滴管内的水滴到生石灰上,支管处的白色粉末(无水硫酸铜)变为蓝色,其原因是生石灰和水反应放出的热量使水挥发,无水硫酸铜遇水变蓝。
(4)上述三个实验方案均验证了以上三个反应的反应物化学键断裂吸收的能量低于生成物化学键形成放出的能量;物质中的化学能通过化学反应转化成热能释放出来。
6.B 解析 试管外壁感觉烫手说明为放热反应,A正确、B错误;反应过程中镁和盐酸的部分化学能转化为热能释放,C正确;试管外壁感觉烫手说明为放热反应,放热反应说明反应物的总能量大于生成物的总能量,D正确。
7.B 解析 该反应中反应物总能量高于生成物总能量,故该反应是放热反应,A错误;根据图像可知,反应物的总能量大于生成物的总能量,B正确;H—Cl键断裂过程吸收能量,C错误;放热反应不一定都需要加热,例如中和反应等,D错误。
8.B 解析 由图可知,1 mol氢气和1 mol碘蒸气的总能量大于2 mol碘化氢的总能量,则反应为放热反应,A错误;由图知反应物的总能量比生成物的总能量高,B正确;需要加热才能进行的反应,不一定是吸热反应,C错误;化学反应有两个特征:一是有新物质生成,二是伴随着能量的变化,D错误。
9.B 解析 能量越低越稳定,由图知,等质量的金刚石能量大于石墨,则石墨比金刚石稳定,A错误;金刚石所具有的能量高,石墨转化为金刚石是吸热反应,B正确;结合选项A可知,1 mol C(石墨)比1 mol C(金刚石)的总能量低,C错误;等质量的石墨与金刚石完全燃烧生成稳定的化合物释放的热量不相同,金刚石所具有的能量高,释放的热量多,D错误。
10.D 解析 浓硫酸稀释是物理变化不是化学变化,没有反应物和生成物,A错误;图乙中反应物的能量低于生成物的能量,该反应为吸热反应,说明反应物断键吸收的能量大于生成物成键放出的能量,B错误;从图中可知,相同质量和状态的白磷能量高于红磷,则红磷更加稳定,C错误;CO与H2O反应生成CO2和H2的反应为吸热反应,图中所示能量变化正确,D正确。
11.B 解析 过氧化钠与水的反应是放热反应,热胀冷缩,锥形瓶中气压增大,U形管中水向右移动,即左低右高,A错误;盐酸和碳酸氢钠的反应是吸热反应,锥形瓶内气压减小,U形管中水向左移动,即左高右低,B正确;U形管液面左低右高,说明铜铁合金与稀硫酸反应后温度升高,是放热反应,C错误;浓硫酸的稀释是放热过程,不是放热反应,D错误。
12.D 解析 氢气和氯气反应的化学方程式为H2+Cl22HCl,A正确;由题图可知,H、Cl原子形成1 mol H—Cl极性键放出431 kJ的能量,B正确;由题图中能量数据可知,断裂1 mol H—H键吸收436 kJ能量,断裂1 mol Cl—Cl键吸收243 kJ能量,则H—H键更难断裂,C正确;反应中生成2 mol HCl放出热量183 kJ,D错误。
13.C 解析 ②到③过程为化学键的断裂,则需要吸收能量,A错误;③到④变化过程为化学键的形成,则有能量放出,B错误;反应物化学键断裂吸收的能量小于形成新化学键放出的能量,该反应为放热反应,C正确;N原子和H原子形成了含有极性键的NH3,D错误。
14.D 解析 由题图可知,反应物总能量高于生成物总能量,则为放热反应,A错误;由题图可知,不存在CO的断键过程,B错误;状态Ⅰ→状态Ⅲ表示CO与O反应的过程,而不是CO与O2反应的过程,C错误;该过程中涉及的化合物有CO和CO2,二者都是由非金属原子间通过共用电子对结合而成的,均为共价化合物,D正确。
15.答案 (1)左管液面降低,右管液面升高 CaO+H2OCa(OH)2
(2)B
(3)④
(4)吸收 释放 245
(5)相同质量的甲烷和煤相比,甲烷燃烧放出热量更高,甲烷燃烧充分,燃料利用率高,且污染小,甲烷中不含硫等杂质,不会造成酸雨等环境问题,因此甲烷是国家大力推广的清洁能源
解析 (1)CaO固体与水反应的方程式为CaO+H2OCa(OH)2,反应为放热反应,则锥形瓶中气体受热膨胀,导致U形管左端液柱降低,右端液柱升高。
(2)Ba(OH)2·8H2O晶体与NH4Cl晶体的反应属于吸热反应,即反应物具有的能量小于生成物具有的能量,其能量变化可用图中的B表示。
(3)③为Zn和稀硫酸反应,为放热反应;④为柠檬酸和碳酸氢钠反应,为吸热反应;⑤为氢气燃烧,为放热反应。
(4)①为断键,断键吸收能量,②为形成化学键,形成化学键放出能量;断裂1 mol H2和 mol O2中的化学键吸收的总能量为(436+249) kJ=685 kJ,形成1 mol H2O中的化学键释放的能量为930 kJ,因此生成1 mol H2O时放出热量为930 kJ-685 kJ=245 kJ。
(5)天然气的主要成分是甲烷,由表中数据可知,相同质量的甲烷和煤相比,甲烷燃烧放出热量更高;而且甲烷是含氢量最高的烃,燃烧充分,燃料利用率高,且污染小;甲烷中不含硫等杂质,不会造成酸雨等环境问题,因此甲烷是国家大力推广的清洁能源。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025人教版化学必修第二册
分层作业8 化学反应与热能
A 级 必备知识基础练
题组1.化学能与热能的转化
1.(2024·北京人大附中高一期中)下列反应属于吸热反应的是( )
A.钠与水的反应
B.乙醇的燃烧
C.碳酸氢钠与柠檬酸的反应
D.氢氧化钾与硫酸的反应
2.(2024·浙江金华十校高一联考)下列反应中,既属于氧化还原反应又属于放热反应的是( )
A.硫酸与KOH溶液反应
B.灼热的炭与二氧化碳反应
C.Ba(OH)2·8H2O晶体与NH4Cl晶体反应
D.金属钾与水反应
3.(2024·重庆璧山高一期末)使用下列装置给液体升温时,将化学能转化为热能的是( )
A.太阳能热水器 B.热水壶 C.天然气燃烧 D.冷水与热水传递热量
4.(2024·湖南长沙雅礼中学月考)下列关于化学能与热能的说法,不正确的是( )
A.放热反应中反应物的总能量高于生成物总能量
B.吸热反应中断裂反应物化学键所吸收的能量大于形成生成物的化学键所放出的能量
C.化学反应既有物质变化,又有能量变化
D.镁条在空气中燃烧是放热反应,反应过程中所释放的能量全部转化为热能
5.(2024·河北衡水高一期中)某化学实验小组设计了如图三套实验装置探究化学能与热能的转化关系(装置中夹持仪器已略去)。回答下列问题:
(1)观察到甲装置中的实验现象是 ,产生该现象的原因是 。
(2)将乙装置中外层具支试管的支管与虚线框内的①连接,实验现象是 ;
支管与②连接,实验现象是 。
钠与水的总能量 (填“大于”或“小于”)生成物的能量。
(3)装置丙中将胶头滴管内的水滴到生石灰上,支管处的白色粉末(无水硫酸铜)变为蓝色,其原因是 。
(4)上述三个实验方案均验证了以上三个反应的反应物化学键断裂吸收的能量 (填“高于”或“低于”)生成物化学键形成放出的能量;物质中的化学能通过 转化成 释放出来。
题组2.化学反应中能量变化的原因
6.(2024·湖南株洲高一期末)将一小段镁带投入盛有稀盐酸的试管中,剧烈反应。一段时间后,用手触摸试管外壁感觉烫手。下列有关该反应的叙述错误的是( )
A.该反应为放热反应
B.该反应为吸热反应
C.反应过程中化学能转化为热能
D.反应物的总能量大于生成物的总能量
7.(2024·江苏扬州高一期中)反应NH3+HClNH4Cl的能量变化如图所示,下列说法正确的是( )
A.该反应是吸热反应
B.反应物的总能量大于生成物的总能量
C.H—Cl键断裂过程释放能量
D.放热反应都需要加热
8.(2024·上海浦东新区高一期末)如图是H2(g)与I2(g)反应生成HI(g)的能量示意图。下列说法正确的是( )
A.该反应是吸热反应
B.该反应物总能量高于生成物总能量
C.放热反应的发生都不需要加热
D.化学反应不一定伴随有能量的变化
9.(2024·广东深圳高一期中)一定条件下,石墨与金刚石可以相互转化:石墨(s)金刚石(s)。其能量转化关系如图所示,下列说法正确的是( )
A.金刚石比石墨稳定
B.石墨转化为金刚石是吸热反应
C.1 mol C(石墨)比1 mol C(金刚石)的总能量高
D.等质量的石墨与金刚石完全燃烧释放的热量相同
10.(2024·重庆荣昌区高一期中)下列图示与对应的叙述相符的是( )
A.图甲代表浓硫酸稀释过程中体系的能量变化
B.图乙表示反应物断键吸收的能量小于生成物成键放出的能量
C.图丙表示白磷比红磷稳定
D.图丁表示CO与H2O的反应是吸热反应
B 级 关键能力提升练
11.(2024·江西赣州高一期中)某小组利用如图装置探究将甲加入乙中之后的能量变化。
下列叙述正确的是( )
A.若甲为水,乙为过氧化钠,则一段时间后,U形管左侧液面高于右侧
B.若甲为盐酸,乙为小苏打,则一段时间后,U形管左侧液面高于右侧
C.若甲为稀硫酸,乙为铜铁合金,一段时间后,U形管左侧液面低于右侧,则甲和乙的反应为吸热反应
D.若甲为浓硫酸,乙为水,一段时间后,U形管左侧液面低于右侧,则甲和乙的反应为放热反应
12.(2024·河北衡水中学高一期中)下图为H2与Cl2在一定条件下反应生成HCl的微观示意图。
注:示意图中的能量表示断裂或形成1 mol共价键吸收或放出的热量。
下列说法不正确的是( )
A.反应的化学方程式是H2+Cl22HCl
B.由图可知由假想中间物质H、Cl原子形成1 mol H—Cl极性键放出431 kJ的能量
C.由图中能量数据可知,H—H键比Cl—Cl键更难断裂
D.标准状况下,11.2 L H2与过量Cl2反应放出的热量是183 kJ
13.(2024·广东湛江高一期中)N2和H2在催化剂表面合成氨的微观历程示意图如下,用、、分别表示N2、H2、NH3,下列说法正确的是( )
A.②到③过程中,需要释放能量
B.③到④变化过程中,需要吸收能量
C.因反应中化学键断裂吸收的能量小于形成新化学键放出的能量,故该反应为放热反应
D.N原子和H原子形成了含有非极性键的NH3
14.(2024·江西上饶高一期中)科学家用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列分析正确的是( )
A.CO和O生成CO2的过程是吸热反应
B.在该过程中,CO断键形成C和O
C.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
D.该过程中所有化合物均为共价化合物
C 级 学科素养拔高练
15.(2024·湖南师大附中高一检测)某实验小组设计了下图所示的5组实验,探究化学能与热能的转化。
(1)实验①在实验前U形管中液面左右相平,在甲试管中加入适量氧化钙和水后,可观察到U形管中的现象是 ,
反应的化学方程式是 。
(2)实验②中反应的能量变化可用下图中的 (填字母)表示。
(3)实验③④⑤中属于吸热反应的是 (填序号)。
(4)从微观角度分析实验⑤化学反应中能量变化的原因:
①和②分别为 、 (填“吸收”或“释放”)。氢气与氧气反应生成1 mol水蒸气时,释放 kJ能量。
(5)当前,很多地区倡导用天然气替代煤作为家用燃料,从尽可能多的角度分析其原因:
。
已知:
燃料 燃烧释放的能量(每1千克)
天然气 55 812 kJ
煤 20 908 kJ
答案:
1.C 解析 钠与水的反应为放热反应,A错误;乙醇的燃烧为放热反应,B错误;碳酸氢钠与柠檬酸的反应为吸热反应,C正确;氢氧化钾与硫酸的反应为放热反应,D错误。
2.D 解析 硫酸与KOH溶液反应是放热反应,但不属于氧化还原反应,A错误;灼热的炭与二氧化碳在高温条件下反应生成一氧化碳,该反应是吸热反应,B错误;Ba(OH)2·8H2O晶体与NH4Cl晶体反应是吸热反应,C错误;金属钾与水反应生成KOH和H2,属于氧化还原反应,且该反应是放热反应,D正确。
3.C 解析 太阳能热水器是将太阳能转化为热能,A错误;电热水壶是将电能转化为热能,B错误;天然气燃烧是将化学能转化为热能,C正确;该过程属于热量的传递,不存在能量转化,D错误。
4.D 解析 D项,由于反应中有耀眼白光,故该反应过程中所释放的能量并未全部转化为热能,有一部分转化为光能,错误。
5.答案 (1)试管内有气泡产生,烧杯内有固体析出 镁与稀盐酸反应产生氢气且是放热反应,氢氧化钙的溶解度随温度的升高而减小,溶质析出
(2)支管连接的导管口处有气泡产生 支管连接的U形管内红墨水的液面左低右高 大于
(3)水与生石灰反应放热,温度升高,水被蒸发,无水硫酸铜白色粉末遇水变蓝
(4)低于 化学反应 热能
解析 (1)镁片和稀盐酸反应:Mg+2HClMgCl2+H2↑,试管内有气泡产生,且该反应放出热量,烧杯中温度升高,Ca(OH)2的溶解度随温度的升高而降低,故烧杯中析出Ca(OH)2固体。
(2)水与钠反应产生氢气,将支管与虚线框内的①连接,实验现象是:钠浮于水面上,并在水面上到处游动,发出“嘶嘶”的响声,熔成闪亮的小球,最后消失,烧杯中的导管口有气泡冒出;支管与②连接,由于压强原因U形管中的红墨水向右管移动;上述实验现象说明具支试管中的空气受热膨胀,则钠与水的反应为放热反应,说明钠与水的总能量大于生成物的总能量。
(3)装置丙中将胶头滴管内的水滴到生石灰上,支管处的白色粉末(无水硫酸铜)变为蓝色,其原因是生石灰和水反应放出的热量使水挥发,无水硫酸铜遇水变蓝。
(4)上述三个实验方案均验证了以上三个反应的反应物化学键断裂吸收的能量低于生成物化学键形成放出的能量;物质中的化学能通过化学反应转化成热能释放出来。
6.B 解析 试管外壁感觉烫手说明为放热反应,A正确、B错误;反应过程中镁和盐酸的部分化学能转化为热能释放,C正确;试管外壁感觉烫手说明为放热反应,放热反应说明反应物的总能量大于生成物的总能量,D正确。
7.B 解析 该反应中反应物总能量高于生成物总能量,故该反应是放热反应,A错误;根据图像可知,反应物的总能量大于生成物的总能量,B正确;H—Cl键断裂过程吸收能量,C错误;放热反应不一定都需要加热,例如中和反应等,D错误。
8.B 解析 由图可知,1 mol氢气和1 mol碘蒸气的总能量大于2 mol碘化氢的总能量,则反应为放热反应,A错误;由图知反应物的总能量比生成物的总能量高,B正确;需要加热才能进行的反应,不一定是吸热反应,C错误;化学反应有两个特征:一是有新物质生成,二是伴随着能量的变化,D错误。
9.B 解析 能量越低越稳定,由图知,等质量的金刚石能量大于石墨,则石墨比金刚石稳定,A错误;金刚石所具有的能量高,石墨转化为金刚石是吸热反应,B正确;结合选项A可知,1 mol C(石墨)比1 mol C(金刚石)的总能量低,C错误;等质量的石墨与金刚石完全燃烧生成稳定的化合物释放的热量不相同,金刚石所具有的能量高,释放的热量多,D错误。
10.D 解析 浓硫酸稀释是物理变化不是化学变化,没有反应物和生成物,A错误;图乙中反应物的能量低于生成物的能量,该反应为吸热反应,说明反应物断键吸收的能量大于生成物成键放出的能量,B错误;从图中可知,相同质量和状态的白磷能量高于红磷,则红磷更加稳定,C错误;CO与H2O反应生成CO2和H2的反应为吸热反应,图中所示能量变化正确,D正确。
11.B 解析 过氧化钠与水的反应是放热反应,热胀冷缩,锥形瓶中气压增大,U形管中水向右移动,即左低右高,A错误;盐酸和碳酸氢钠的反应是吸热反应,锥形瓶内气压减小,U形管中水向左移动,即左高右低,B正确;U形管液面左低右高,说明铜铁合金与稀硫酸反应后温度升高,是放热反应,C错误;浓硫酸的稀释是放热过程,不是放热反应,D错误。
12.D 解析 氢气和氯气反应的化学方程式为H2+Cl22HCl,A正确;由题图可知,H、Cl原子形成1 mol H—Cl极性键放出431 kJ的能量,B正确;由题图中能量数据可知,断裂1 mol H—H键吸收436 kJ能量,断裂1 mol Cl—Cl键吸收243 kJ能量,则H—H键更难断裂,C正确;反应中生成2 mol HCl放出热量183 kJ,D错误。
13.C 解析 ②到③过程为化学键的断裂,则需要吸收能量,A错误;③到④变化过程为化学键的形成,则有能量放出,B错误;反应物化学键断裂吸收的能量小于形成新化学键放出的能量,该反应为放热反应,C正确;N原子和H原子形成了含有极性键的NH3,D错误。
14.D 解析 由题图可知,反应物总能量高于生成物总能量,则为放热反应,A错误;由题图可知,不存在CO的断键过程,B错误;状态Ⅰ→状态Ⅲ表示CO与O反应的过程,而不是CO与O2反应的过程,C错误;该过程中涉及的化合物有CO和CO2,二者都是由非金属原子间通过共用电子对结合而成的,均为共价化合物,D正确。
15.答案 (1)左管液面降低,右管液面升高 CaO+H2OCa(OH)2
(2)B
(3)④
(4)吸收 释放 245
(5)相同质量的甲烷和煤相比,甲烷燃烧放出热量更高,甲烷燃烧充分,燃料利用率高,且污染小,甲烷中不含硫等杂质,不会造成酸雨等环境问题,因此甲烷是国家大力推广的清洁能源
解析 (1)CaO固体与水反应的方程式为CaO+H2OCa(OH)2,反应为放热反应,则锥形瓶中气体受热膨胀,导致U形管左端液柱降低,右端液柱升高。
(2)Ba(OH)2·8H2O晶体与NH4Cl晶体的反应属于吸热反应,即反应物具有的能量小于生成物具有的能量,其能量变化可用图中的B表示。
(3)③为Zn和稀硫酸反应,为放热反应;④为柠檬酸和碳酸氢钠反应,为吸热反应;⑤为氢气燃烧,为放热反应。
(4)①为断键,断键吸收能量,②为形成化学键,形成化学键放出能量;断裂1 mol H2和 mol O2中的化学键吸收的总能量为(436+249) kJ=685 kJ,形成1 mol H2O中的化学键释放的能量为930 kJ,因此生成1 mol H2O时放出热量为930 kJ-685 kJ=245 kJ。
(5)天然气的主要成分是甲烷,由表中数据可知,相同质量的甲烷和煤相比,甲烷燃烧放出热量更高;而且甲烷是含氢量最高的烃,燃烧充分,燃料利用率高,且污染小;甲烷中不含硫等杂质,不会造成酸雨等环境问题,因此甲烷是国家大力推广的清洁能源。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
