专题2 研究物质的基本方法 分层作业10 物质的量浓度--2025苏教版化学必修第一册同步练习题(含答案)
文档属性
| 名称 | 专题2 研究物质的基本方法 分层作业10 物质的量浓度--2025苏教版化学必修第一册同步练习题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 375.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-24 14:13:28 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2025苏教版化学必修第一册
分层作业10 物质的量浓度
A级必备知识基础练
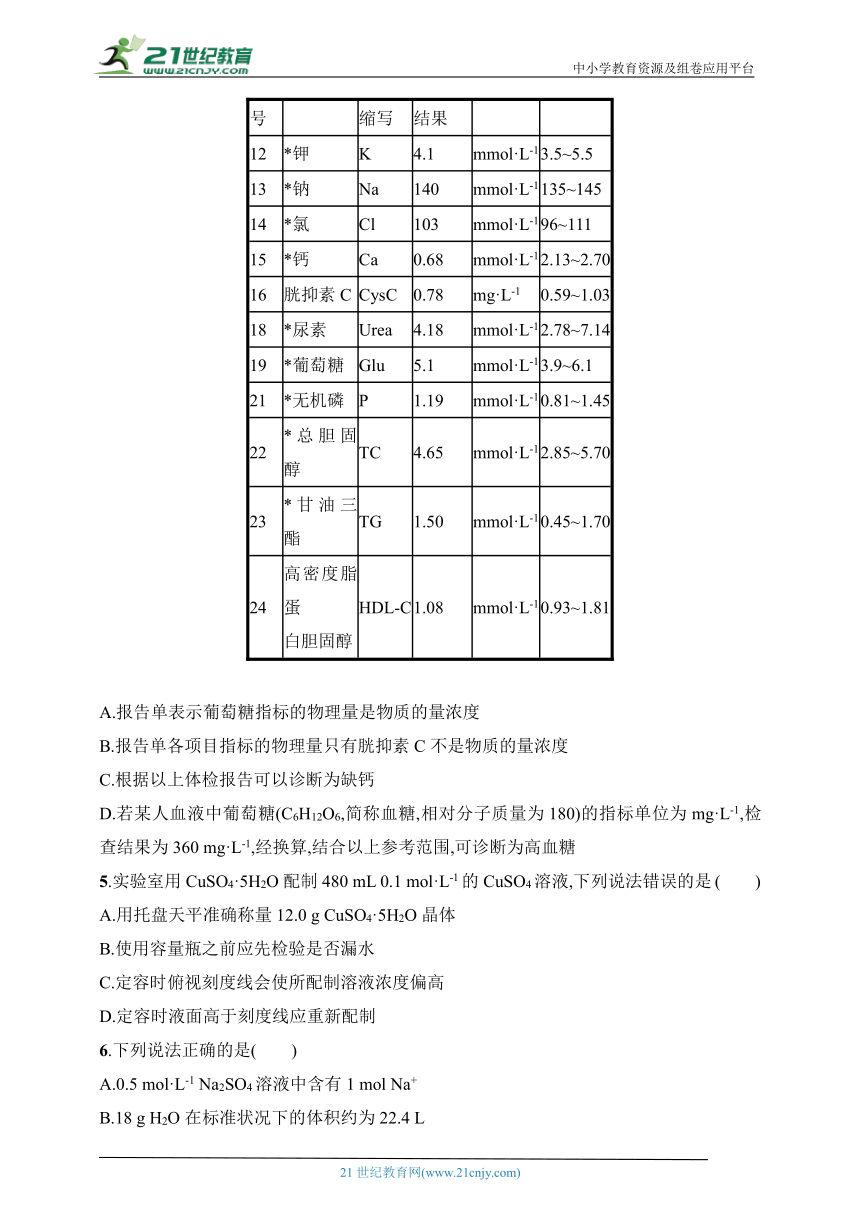
1.化学实验是化学科学赖以形成和发展的基础。下图实验装置正确,且能达到实验目的的是( )
A.利用图1装置模拟石油的分馏
B.利用图2装置进行CCl4萃取碘水中的碘并分液
C.利用图3装置蒸发结晶得到氯化钠晶体
D.利用图4装置配制100 mL一定物质的量浓度的硫酸溶液
2.1 mol·L-1 NaCl溶液的含义是( )
A.含有1 mol NaCl
B.1 L H2O中溶有1 mol NaCl
C.含有58.5 g NaCl
D.1 L NaCl溶液中含有1 mol NaCl
3.下列溶液中,与100 mL 0.5 mol·L-1 CuCl2溶液所含的Cl-物质的量浓度相同的是( )
A.100 mL 0.5 mol·L-1 KCl溶液
B.200 mL 0.25 mol·L-1 AlCl3溶液
C.50 mL 1 mol·L-1 NaCl溶液
D.50 mL 0.5 mol·L-1HCl溶液
4.阅读并分析体检报告(1 mmol=1×10-3 mol,1 mg=1×10-3 g),下列说法不正确的是( )
序 号 项目名称 英文 缩写 检查 结果 单位 参考范围
12 *钾 K 4.1 mmol·L-1 3.5~5.5
13 *钠 Na 140 mmol·L-1 135~145
14 *氯 Cl 103 mmol·L-1 96~111
15 *钙 Ca 0.68 mmol·L-1 2.13~2.70
16 胱抑素C CysC 0.78 mg·L-1 0.59~1.03
18 *尿素 Urea 4.18 mmol·L-1 2.78~7.14
19 *葡萄糖 Glu 5.1 mmol·L-1 3.9~6.1
21 *无机磷 P 1.19 mmol·L-1 0.81~1.45
22 *总胆固醇 TC 4.65 mmol·L-1 2.85~5.70
23 *甘油三酯 TG 1.50 mmol·L-1 0.45~1.70
24 高密度脂蛋 白胆固醇 HDL-C 1.08 mmol·L-1 0.93~1.81
A.报告单表示葡萄糖指标的物理量是物质的量浓度
B.报告单各项目指标的物理量只有胱抑素C不是物质的量浓度
C.根据以上体检报告可以诊断为缺钙
D.若某人血液中葡萄糖(C6H12O6,简称血糖,相对分子质量为180)的指标单位为mg·L-1,检查结果为360 mg·L-1,经换算,结合以上参考范围,可诊断为高血糖
5.实验室用CuSO4·5H2O配制480 mL 0.1 mol·L-1的CuSO4溶液,下列说法错误的是 ( )
A.用托盘天平准确称量12.0 g CuSO4·5H2O晶体
B.使用容量瓶之前应先检验是否漏水
C.定容时俯视刻度线会使所配制溶液浓度偏高
D.定容时液面高于刻度线应重新配制
6.下列说法正确的是( )
A.0.5 mol·L-1 Na2SO4溶液中含有1 mol Na+
B.18 g H2O在标准状况下的体积约为22.4 L
C.同温同压下,20 mL NH3和60 mL O2所含分子个数比为1∶3
D.80 g NaOH溶解在1 L水中,所得溶液中溶质的物质的量浓度为2 mol·L-1
7.若20 g密度为1 g·cm-3的Ca(NO3)2溶液中含有2 g Ca2+,则溶液中N的物质的量浓度为( )
A.5 mol·L-1
B.2.5 mol·L-1
C. mol·L-1
D. mol·L-1
8.实验室需要0.2 mol·L-1 CuSO4溶液250 mL,实验室除蒸馏水外还提供蓝色胆矾晶体(CuSO4·5H2O)和4 mol·L-1 CuSO4溶液两种试剂以配制该溶液。
(1)无论采用何种试剂进行配制,实验必须用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,至少还需要的一种仪器是 。
(2)若用胆矾晶体进行配制,需要托盘天平称取CuSO4·5H2O的质量为 g;如果用4 mol·L-1的CuSO4溶液配制,需用量筒量取 mL 4 mol·L-1 CuSO4溶液。
(3)用4 mol·L-1的CuSO4溶液配制溶液所需的实验步骤有:
a.往烧杯中加入约100 mL水进行初步稀释,冷却至室温
b.用量筒量取一定体积4 mol·L-1的CuSO4溶液于一烧杯中
c.计算所需4 mol·L-1的CuSO4溶液的体积
d.盖好瓶塞,反复上下颠倒摇匀后,将溶液转存于试剂瓶中
e.加水至液面离容量瓶刻度线1~2 cm处,改用胶头滴管进行定容
f.洗涤烧杯和玻璃棒2~3次并将洗涤液注入容量瓶,轻轻摇动容量瓶,使溶液混合均匀
g.将溶液转移入容量瓶
其中正确的操作顺序为 (填字母)。
(4)指出配制过程中的以下情形对所得溶液浓度的影响(填“偏大”“偏小”或“无影响”)。
①d步骤摇匀后发现液面低于刻度线,再加蒸馏水至刻度线: 。
②g步骤前,容量瓶未干燥,有少量蒸馏水: 。
B级关键能力提升练
9.下列溶液中溶质的物质的量浓度为0.1 mol·L-1的是( )
A.含4 g NaOH的溶液1 L
B.含21.2 g Na2CO3的溶液1 L
C.含0.2 mol H2SO4的溶液0.5 L
D.将98 g H2SO4加入1 L水中
10.将1 L Na2CO3溶液加水稀释,稀释过程中c(Na+)随溶液体积的变化曲线如图,下列说法正确的是( )
A.将Na2CO3溶液稀释需用到烧杯、玻璃棒、漏斗等仪器
B.图中x=9
C.将该Na2CO3溶液与足量盐酸反应最多收集100.8 L CO2
D.Na2CO3溶液的初始浓度为4.5 mol·L-1
11.将标准状况下的a L氯化氢气体溶于1 000 g水中,所得到盐酸的密度为b g·cm-3,则该盐酸的物质的量浓度是( )
A. mol·L-1
B. mol·L-1
C. mol·L-1
D. mol·L-1
12.欲使1 L 0.5 mol·L-1 NaOH溶液的物质的量浓度变为1 mol·L-1,可采取的合理措施是( )
A.加入20 g固体NaOH,搅拌、溶解
B.加热蒸发至溶液质量变为原来的一半
C.加入1 L 1.5 mol·L-1的NaOH溶液混合均匀
D.加入10 mol·L-1的NaOH溶液0.1 L,再稀释至1.5 L
13.已知98%的硫酸物质的量浓度为18.4 mol·L-1,密度为1.84 g·cm-3,则49%的硫酸物质的量浓度是( )
A.小于9.2 mol·L-1
B.等于9.2 mol·L-1
C.大于9.2 mol·L-1
D.不能确定
14.物质的量浓度是一种常用的溶液浓度表示方法,利用其进行定量分析计算比较方便。
Ⅰ.实验需要475 mL 0.8 mol·L-1 NaOH溶液和500 mL 0.4 mol·L-1硫酸溶液。根据这两种溶液的配制情况回答下列问题:
(1)若用质量分数为98%、密度为1.84 g·mL-1的浓硫酸来配制500 mL 0.4 mol·L-1硫酸溶液,需用量筒量取体积为 mL的浓硫酸来稀释。
(2)为配制上述稀硫酸,除了量筒、烧杯、玻璃棒外,还缺少的玻璃仪器是 、 。
(3)在配制过程中,下列实验操作可能导致配制的硫酸溶液浓度偏高的是 (填字母,下同)。
A.定容时俯视观察
B.定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水
C.浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移
D.容量瓶未干燥即用来配制溶液
E.往容量瓶转移时,有少量液体溅出
F.未洗涤稀释浓硫酸的烧杯
(4)欲用NaOH固体配制475 mL 0.8 mol·L-1 NaOH溶液。下列说法正确的是 。
A.如图所示的仪器中,有3种是不需要的,还需要1种玻璃仪器
B.容量瓶使用前应检漏
C.需要称量NaOH固体的质量为15.2 g
D.称量NaOH固体时将NaOH放在纸上称量
Ⅱ.在0.2 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如下图所示(不考虑溶液中H+和OH-浓度)。请回答下列问题:
(5)该混合液中CaCl2的物质的量为 mol。
C级学科素养创新练
15.已知某“84”消毒液瓶体部分标签如图所示,该“84”消毒液通常稀释100倍(体积之比)后使用。请回答下列问题:
“84”消毒液
(有效成分) NaClO
(规格) 1 000 mL
(质量分数) 25%
(密度) 1.19 g·cm-3
(1)该“84”消毒液的物质的量浓度约为 mol·L-1。
(2)取用任意体积的该溶液时,下列物理量中会随所取体积的多少而变化的是 (填字母)。
A.溶液中NaClO的物质的量
B.溶液的浓度
C.溶液中NaClO的摩尔质量
D.溶液的密度
(3)该同学参阅该“84”消毒液的配方,欲用NaClO固体配制400 mL含NaClO质量分数为25%的消毒液,需要称量NaClO固体的质量为 g。
(4)“84”消毒液与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制200 mL 2.3 mol·L-1的稀硫酸用于增强“84”消毒液的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为 mol·L-1。
②需用浓硫酸的体积为 mL。
③若所配制的稀硫酸浓度偏小,则下列可能的原因分析中正确的是 (填字母)。
A.配制前,容量瓶中有少量蒸馏水
B.量取浓硫酸时,仰视观察
C.未冷却,立即转移至容量瓶定容
D.定容时,仰视观察
分层作业10 物质的量浓度
A级 必备知识基础练
1.B 解析 分馏装置中,温度计水银球应置于蒸馏烧瓶的支管口处,故A错误;碘易溶于CCl4,用萃取、分液操作提取碘水中的碘,故B正确;在蒸发皿中蒸发氯化钠溶液,结晶得到氯化钠晶体,故C错误;配制100 mL一定物质的量浓度的硫酸溶液,不能直接把浓硫酸倒入容量瓶,故D错误。
2.D 解析 溶质的物质的量浓度的概念为单位体积溶液中含有溶质的物质的量,1 mol·L-1 NaCl溶液的含义是1 L NaCl溶液中含有溶质NaCl的物质的量为1 mol。没有指出溶液的体积,无法计算NaCl的物质的量,A错误;1 mol·L-1 NaCl溶液是1 L溶液中含有1 mol NaCl,不是1 L水中溶有1 mol NaCl,B错误;没有说明溶液的体积,无法计算溶质的质量,1 L 1 mol·L-1 NaCl溶液中才含有58.5 g NaCl,C错误;1 mol·L-1 NaCl溶液的含义是1 L NaCl溶液中含有溶质NaCl的物质的量为1 mol,D正确。
3.C 解析 100 mL 0.5 mol·L-1 CuCl2溶液中Cl-物质的量浓度为1 mol·L-1,100 mL 0.5 mol·L-1 KCl溶液中氯离子的物质的量浓度为0.5 mol·L-1,A错误;200 mL 0.25 mol·L-1 AlCl3溶液中氯离子的物质的量浓度为0.25 mol·L-1×3=0.75 mol·L-1,B错误;50 mL 1 mol·L-1NaCl溶液中氯离子的物质的量浓度为1 mol·L-1,C正确;50 mL 0.5 mol·L-1HCl溶液中氯离子的物质的量浓度为0.5 mol·L-1,D错误。
4.D 解析 报告单表示葡萄糖指标的物理量单位是mmol·L-1,指的是物质的量浓度,A正确;报告单各项目指标中,只有胱抑素C单位是mg·L-1表示的是密度,其他指标的单位都是mmol·L-1,表示的是物质的量浓度,B正确;根据体检报告可以看出:该人的检测结果中只有Ca元素的含量比最低值还少,其他各个物理量都在正常范围内,因此可诊断该人钙元素含量偏低,缺钙,C正确;若某人血液中葡萄糖指标单位为mg·L-1,检查结果为360 mg·L-1,则用物质的量浓度表示为=2×10-3 mol·L-1=2 mmol·L-1<3.9 mmol·L-1,可诊断为低血糖,D错误。
5.A 解析 用CuSO4·5H2O配制480 mL 0.1 mol·L-1的CuSO4溶液,选用500 mL容量瓶,用托盘天平称量CuSO4·5H2O晶体的质量为0.5 L×0.1 mol·L-1×250 g·mol-1=12.5 g,故A错误;配制溶液,需颠倒摇匀,所以使用容量瓶之前应先检验是否漏水,故B正确;定容时俯视刻度线,溶液体积偏小,会使所配制溶液浓度偏高,故C正确;定容时液面高于刻度线应重新配制,故D正确。
6.C 解析 溶液的体积未知时,无法计算一定物质的量浓度溶液中离子的物质的量,A错误;水在标准状况下不是气体,B错误;同温同压下气体的分子数目之比等于其体积之比,故同温同压下,20 mL NH3和60 mL O2所含分子个数比为1∶3,C正确;80 g NaOH溶解在1 L水中之后,溶液的体积不再是1 L,此时密度未知,无法计算其物质的量浓度,D错误。
7.A 解析 2 g Ca2+的物质的量为=0.05 mol,溶液中n(N)=2n(Ca2+)=0.05 mol×2=0.1 mol,溶液体积为=20 mL=0.02 L,所以该溶液中N的物质的量浓度为=5 mol·L-1。
8.答案 (1)250 mL容量瓶
(2)12.5 12.5
(3)cbagfed
(4)①偏小 ②无影响
B级 关键能力提升练
9.A 解析 4 g氢氧化钠的物质的量为=0.1 mol,溶液体积为1 L,物质的量浓度为0.1 mol·L-1,A正确;n(Na2CO3)==0.2 mol,B错误;含0.2 mol H2SO4的溶液0.5 L,其物质的量浓度为=0.4 mol·L-1,C错误;98 g H2SO4的物质的量为1 mol,加入1 L水中,溶液的体积并不是1 L,无法计算物质的量浓度,D错误。
10.D 解析 溶液稀释用不到漏斗,A项错误;溶液稀释过程中,溶质的物质的量不变,则2x=5×1.8,x=4.5,B项错误;没有指明是标准状况,无法计算气体体积,C项错误;c(Na2CO3)=c(Na+)==4.5 mol·L-1,D项正确。
11.D 解析 标准状况下,氯化氢的物质的量n= mol,氯化氢的质量m=n×M= mol×36.5 g·mol-1= g,溶液的体积V=×10-3 L·cm-3=×10-3 L,则c= mol·L-1,D项正确。
12.D 解析 加入20 g固体NaOH,搅拌、溶解,由于溶解过程中溶液体积会发生变化,氢氧化钠的物质的量为1 mol,但是溶液的体积不是1 L,所以浓度不是1 mol·L-1,A错误;加热蒸发至溶液质量变为原来的一半,但蒸发后溶液的体积不一定是原来的一半,不能确定其物质的量浓度,故B错误;加入1 L 1.5 mol·L-1的NaOH溶液混合均匀,混合液的体积不是2 L,所得溶液的浓度也不是1 mol·L-1,C错误;加入10 mol·L-1的NaOH溶液0.1 L,再稀释至1.5 L,此时溶液中氢氧化钠物质的量浓度为c(NaOH)=
=1 mol·L-1,D项正确。
13.A 解析 浓硫酸中溶质物质的量浓度c1=,稀释后H2SO4物质的量浓度c2=,二者之比;最后由于硫酸溶液的密度比水大,且浓度越大,密度也越大,则,c2<9.2 mol·L-1,A正确。
14.答案 (1)10.9 (2)500 mL容量瓶 胶头滴管 (3)AC (4)B (5)0.1
解析 (1)溶液稀释前后溶质质量不变,可据此进行计算。
若用质量分数为98%、密度为1.84 g·mL-1的浓硫酸来配制500 mL 0.4 mol·L-1硫酸溶液,需用量筒量取体积为≈10.9 mL的浓硫酸来稀释。(2)为配制上述稀硫酸,除了量筒、烧杯、玻璃棒外,还缺少的玻璃仪器是500 mL容量瓶、胶头滴管。(3)定容时俯视观察,导致溶液体积偏小,浓度偏高,A正确;定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水,导致水的体积偏大,浓度偏低,B错误;浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移,导致冷却后溶液体积偏小,浓度偏高,C正确;容量瓶未干燥即用来配制溶液,不影响溶液浓度,D错误;往容量瓶转移时,有少量液体溅出,导致溶质质量减小,浓度偏低,E错误;未洗涤稀释浓硫酸的烧杯,导致溶质质量减小,浓度偏低,F错误;故选AC。
(4)配制NaOH溶液时,需用的仪器有:胶头滴管、烧杯、药匙、玻璃棒、500 mL容量瓶、托盘天平;如图所示的仪器中,圆底烧瓶和分液漏斗是不需要的,还需要2种玻璃仪器,分别为玻璃棒和胶头滴管,A错误;容量瓶使用前应检漏,防止漏液,B正确;配制475 mL 0.8 mol·L-1 NaOH溶液,需要使用500 mL容量瓶,则需要称量NaOH固体的质量为0.8 mol·L-1×0.5 L×40 g·mol-1=16 g,C错误;称量NaOH固体时将NaOH放在烧杯中称量,D错误。
(5)根据电荷守恒可知,该混合液中CaCl2的浓度为=0.5 mol·L-1,则物质的量为0.5 mol·L-1×0.2 L=0.1 mol。
C级 学科素养创新练
15.答案 (1)4.0
(2)A
(3)148.8
(4)①4.6 ②25.0 ③D
解析 (1)该“84”消毒液的物质的量浓度约为≈4.0 mol·L-1。(2)溶液中NaClO的物质的量和溶液体积有关,溶液体积越大,NaClO的物质的量越多;溶液是均一稳定的,其浓度和体积无关;NaClO的摩尔质量是74.5 g·mol-1,和溶液体积无关;溶液是均一稳定的,溶液的密度和体积无关。(3)配制400 mL含NaClO质量分数为25%的消毒液,由于实验室没有400 mL的容量瓶,所以要用500 mL的容量瓶配制500 mL的溶液,需要称量NaClO固体的质量为500 mL×1.19 g·cm-3×25%≈148.8 g。(4)①2.3 mol·L-1的稀硫酸中,H+的物质的量浓度为2.3 mol·L-1×2=4.6 mol·L-1。②浓硫酸的物质的量浓度为 mol·L-1=18.4 mol·L-1,根据稀释前后溶质的物质的量不变,可计算配制200 mL 2.3 mol·L-1的稀硫酸需要浓硫酸的体积,=0.025 L=25.0 mL。③配制前,容量瓶中有少量蒸馏水,不影响溶质的物质的量,也不影响溶液的体积,所以对所配溶液的浓度无影响;量取浓硫酸时,仰视观察,会导致所取的浓硫酸偏多,配制的稀硫酸的浓度偏高;未冷却,立即转移至容量瓶定容会导致溶液体积偏小,配制的稀硫酸的浓度偏高;定容时,仰视观察,会导致溶液体积偏大,使所配制的稀硫酸的浓度偏低。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025苏教版化学必修第一册
分层作业10 物质的量浓度
A级必备知识基础练
1.化学实验是化学科学赖以形成和发展的基础。下图实验装置正确,且能达到实验目的的是( )
A.利用图1装置模拟石油的分馏
B.利用图2装置进行CCl4萃取碘水中的碘并分液
C.利用图3装置蒸发结晶得到氯化钠晶体
D.利用图4装置配制100 mL一定物质的量浓度的硫酸溶液
2.1 mol·L-1 NaCl溶液的含义是( )
A.含有1 mol NaCl
B.1 L H2O中溶有1 mol NaCl
C.含有58.5 g NaCl
D.1 L NaCl溶液中含有1 mol NaCl
3.下列溶液中,与100 mL 0.5 mol·L-1 CuCl2溶液所含的Cl-物质的量浓度相同的是( )
A.100 mL 0.5 mol·L-1 KCl溶液
B.200 mL 0.25 mol·L-1 AlCl3溶液
C.50 mL 1 mol·L-1 NaCl溶液
D.50 mL 0.5 mol·L-1HCl溶液
4.阅读并分析体检报告(1 mmol=1×10-3 mol,1 mg=1×10-3 g),下列说法不正确的是( )
序 号 项目名称 英文 缩写 检查 结果 单位 参考范围
12 *钾 K 4.1 mmol·L-1 3.5~5.5
13 *钠 Na 140 mmol·L-1 135~145
14 *氯 Cl 103 mmol·L-1 96~111
15 *钙 Ca 0.68 mmol·L-1 2.13~2.70
16 胱抑素C CysC 0.78 mg·L-1 0.59~1.03
18 *尿素 Urea 4.18 mmol·L-1 2.78~7.14
19 *葡萄糖 Glu 5.1 mmol·L-1 3.9~6.1
21 *无机磷 P 1.19 mmol·L-1 0.81~1.45
22 *总胆固醇 TC 4.65 mmol·L-1 2.85~5.70
23 *甘油三酯 TG 1.50 mmol·L-1 0.45~1.70
24 高密度脂蛋 白胆固醇 HDL-C 1.08 mmol·L-1 0.93~1.81
A.报告单表示葡萄糖指标的物理量是物质的量浓度
B.报告单各项目指标的物理量只有胱抑素C不是物质的量浓度
C.根据以上体检报告可以诊断为缺钙
D.若某人血液中葡萄糖(C6H12O6,简称血糖,相对分子质量为180)的指标单位为mg·L-1,检查结果为360 mg·L-1,经换算,结合以上参考范围,可诊断为高血糖
5.实验室用CuSO4·5H2O配制480 mL 0.1 mol·L-1的CuSO4溶液,下列说法错误的是 ( )
A.用托盘天平准确称量12.0 g CuSO4·5H2O晶体
B.使用容量瓶之前应先检验是否漏水
C.定容时俯视刻度线会使所配制溶液浓度偏高
D.定容时液面高于刻度线应重新配制
6.下列说法正确的是( )
A.0.5 mol·L-1 Na2SO4溶液中含有1 mol Na+
B.18 g H2O在标准状况下的体积约为22.4 L
C.同温同压下,20 mL NH3和60 mL O2所含分子个数比为1∶3
D.80 g NaOH溶解在1 L水中,所得溶液中溶质的物质的量浓度为2 mol·L-1
7.若20 g密度为1 g·cm-3的Ca(NO3)2溶液中含有2 g Ca2+,则溶液中N的物质的量浓度为( )
A.5 mol·L-1
B.2.5 mol·L-1
C. mol·L-1
D. mol·L-1
8.实验室需要0.2 mol·L-1 CuSO4溶液250 mL,实验室除蒸馏水外还提供蓝色胆矾晶体(CuSO4·5H2O)和4 mol·L-1 CuSO4溶液两种试剂以配制该溶液。
(1)无论采用何种试剂进行配制,实验必须用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,至少还需要的一种仪器是 。
(2)若用胆矾晶体进行配制,需要托盘天平称取CuSO4·5H2O的质量为 g;如果用4 mol·L-1的CuSO4溶液配制,需用量筒量取 mL 4 mol·L-1 CuSO4溶液。
(3)用4 mol·L-1的CuSO4溶液配制溶液所需的实验步骤有:
a.往烧杯中加入约100 mL水进行初步稀释,冷却至室温
b.用量筒量取一定体积4 mol·L-1的CuSO4溶液于一烧杯中
c.计算所需4 mol·L-1的CuSO4溶液的体积
d.盖好瓶塞,反复上下颠倒摇匀后,将溶液转存于试剂瓶中
e.加水至液面离容量瓶刻度线1~2 cm处,改用胶头滴管进行定容
f.洗涤烧杯和玻璃棒2~3次并将洗涤液注入容量瓶,轻轻摇动容量瓶,使溶液混合均匀
g.将溶液转移入容量瓶
其中正确的操作顺序为 (填字母)。
(4)指出配制过程中的以下情形对所得溶液浓度的影响(填“偏大”“偏小”或“无影响”)。
①d步骤摇匀后发现液面低于刻度线,再加蒸馏水至刻度线: 。
②g步骤前,容量瓶未干燥,有少量蒸馏水: 。
B级关键能力提升练
9.下列溶液中溶质的物质的量浓度为0.1 mol·L-1的是( )
A.含4 g NaOH的溶液1 L
B.含21.2 g Na2CO3的溶液1 L
C.含0.2 mol H2SO4的溶液0.5 L
D.将98 g H2SO4加入1 L水中
10.将1 L Na2CO3溶液加水稀释,稀释过程中c(Na+)随溶液体积的变化曲线如图,下列说法正确的是( )
A.将Na2CO3溶液稀释需用到烧杯、玻璃棒、漏斗等仪器
B.图中x=9
C.将该Na2CO3溶液与足量盐酸反应最多收集100.8 L CO2
D.Na2CO3溶液的初始浓度为4.5 mol·L-1
11.将标准状况下的a L氯化氢气体溶于1 000 g水中,所得到盐酸的密度为b g·cm-3,则该盐酸的物质的量浓度是( )
A. mol·L-1
B. mol·L-1
C. mol·L-1
D. mol·L-1
12.欲使1 L 0.5 mol·L-1 NaOH溶液的物质的量浓度变为1 mol·L-1,可采取的合理措施是( )
A.加入20 g固体NaOH,搅拌、溶解
B.加热蒸发至溶液质量变为原来的一半
C.加入1 L 1.5 mol·L-1的NaOH溶液混合均匀
D.加入10 mol·L-1的NaOH溶液0.1 L,再稀释至1.5 L
13.已知98%的硫酸物质的量浓度为18.4 mol·L-1,密度为1.84 g·cm-3,则49%的硫酸物质的量浓度是( )
A.小于9.2 mol·L-1
B.等于9.2 mol·L-1
C.大于9.2 mol·L-1
D.不能确定
14.物质的量浓度是一种常用的溶液浓度表示方法,利用其进行定量分析计算比较方便。
Ⅰ.实验需要475 mL 0.8 mol·L-1 NaOH溶液和500 mL 0.4 mol·L-1硫酸溶液。根据这两种溶液的配制情况回答下列问题:
(1)若用质量分数为98%、密度为1.84 g·mL-1的浓硫酸来配制500 mL 0.4 mol·L-1硫酸溶液,需用量筒量取体积为 mL的浓硫酸来稀释。
(2)为配制上述稀硫酸,除了量筒、烧杯、玻璃棒外,还缺少的玻璃仪器是 、 。
(3)在配制过程中,下列实验操作可能导致配制的硫酸溶液浓度偏高的是 (填字母,下同)。
A.定容时俯视观察
B.定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水
C.浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移
D.容量瓶未干燥即用来配制溶液
E.往容量瓶转移时,有少量液体溅出
F.未洗涤稀释浓硫酸的烧杯
(4)欲用NaOH固体配制475 mL 0.8 mol·L-1 NaOH溶液。下列说法正确的是 。
A.如图所示的仪器中,有3种是不需要的,还需要1种玻璃仪器
B.容量瓶使用前应检漏
C.需要称量NaOH固体的质量为15.2 g
D.称量NaOH固体时将NaOH放在纸上称量
Ⅱ.在0.2 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如下图所示(不考虑溶液中H+和OH-浓度)。请回答下列问题:
(5)该混合液中CaCl2的物质的量为 mol。
C级学科素养创新练
15.已知某“84”消毒液瓶体部分标签如图所示,该“84”消毒液通常稀释100倍(体积之比)后使用。请回答下列问题:
“84”消毒液
(有效成分) NaClO
(规格) 1 000 mL
(质量分数) 25%
(密度) 1.19 g·cm-3
(1)该“84”消毒液的物质的量浓度约为 mol·L-1。
(2)取用任意体积的该溶液时,下列物理量中会随所取体积的多少而变化的是 (填字母)。
A.溶液中NaClO的物质的量
B.溶液的浓度
C.溶液中NaClO的摩尔质量
D.溶液的密度
(3)该同学参阅该“84”消毒液的配方,欲用NaClO固体配制400 mL含NaClO质量分数为25%的消毒液,需要称量NaClO固体的质量为 g。
(4)“84”消毒液与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制200 mL 2.3 mol·L-1的稀硫酸用于增强“84”消毒液的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为 mol·L-1。
②需用浓硫酸的体积为 mL。
③若所配制的稀硫酸浓度偏小,则下列可能的原因分析中正确的是 (填字母)。
A.配制前,容量瓶中有少量蒸馏水
B.量取浓硫酸时,仰视观察
C.未冷却,立即转移至容量瓶定容
D.定容时,仰视观察
分层作业10 物质的量浓度
A级 必备知识基础练
1.B 解析 分馏装置中,温度计水银球应置于蒸馏烧瓶的支管口处,故A错误;碘易溶于CCl4,用萃取、分液操作提取碘水中的碘,故B正确;在蒸发皿中蒸发氯化钠溶液,结晶得到氯化钠晶体,故C错误;配制100 mL一定物质的量浓度的硫酸溶液,不能直接把浓硫酸倒入容量瓶,故D错误。
2.D 解析 溶质的物质的量浓度的概念为单位体积溶液中含有溶质的物质的量,1 mol·L-1 NaCl溶液的含义是1 L NaCl溶液中含有溶质NaCl的物质的量为1 mol。没有指出溶液的体积,无法计算NaCl的物质的量,A错误;1 mol·L-1 NaCl溶液是1 L溶液中含有1 mol NaCl,不是1 L水中溶有1 mol NaCl,B错误;没有说明溶液的体积,无法计算溶质的质量,1 L 1 mol·L-1 NaCl溶液中才含有58.5 g NaCl,C错误;1 mol·L-1 NaCl溶液的含义是1 L NaCl溶液中含有溶质NaCl的物质的量为1 mol,D正确。
3.C 解析 100 mL 0.5 mol·L-1 CuCl2溶液中Cl-物质的量浓度为1 mol·L-1,100 mL 0.5 mol·L-1 KCl溶液中氯离子的物质的量浓度为0.5 mol·L-1,A错误;200 mL 0.25 mol·L-1 AlCl3溶液中氯离子的物质的量浓度为0.25 mol·L-1×3=0.75 mol·L-1,B错误;50 mL 1 mol·L-1NaCl溶液中氯离子的物质的量浓度为1 mol·L-1,C正确;50 mL 0.5 mol·L-1HCl溶液中氯离子的物质的量浓度为0.5 mol·L-1,D错误。
4.D 解析 报告单表示葡萄糖指标的物理量单位是mmol·L-1,指的是物质的量浓度,A正确;报告单各项目指标中,只有胱抑素C单位是mg·L-1表示的是密度,其他指标的单位都是mmol·L-1,表示的是物质的量浓度,B正确;根据体检报告可以看出:该人的检测结果中只有Ca元素的含量比最低值还少,其他各个物理量都在正常范围内,因此可诊断该人钙元素含量偏低,缺钙,C正确;若某人血液中葡萄糖指标单位为mg·L-1,检查结果为360 mg·L-1,则用物质的量浓度表示为=2×10-3 mol·L-1=2 mmol·L-1<3.9 mmol·L-1,可诊断为低血糖,D错误。
5.A 解析 用CuSO4·5H2O配制480 mL 0.1 mol·L-1的CuSO4溶液,选用500 mL容量瓶,用托盘天平称量CuSO4·5H2O晶体的质量为0.5 L×0.1 mol·L-1×250 g·mol-1=12.5 g,故A错误;配制溶液,需颠倒摇匀,所以使用容量瓶之前应先检验是否漏水,故B正确;定容时俯视刻度线,溶液体积偏小,会使所配制溶液浓度偏高,故C正确;定容时液面高于刻度线应重新配制,故D正确。
6.C 解析 溶液的体积未知时,无法计算一定物质的量浓度溶液中离子的物质的量,A错误;水在标准状况下不是气体,B错误;同温同压下气体的分子数目之比等于其体积之比,故同温同压下,20 mL NH3和60 mL O2所含分子个数比为1∶3,C正确;80 g NaOH溶解在1 L水中之后,溶液的体积不再是1 L,此时密度未知,无法计算其物质的量浓度,D错误。
7.A 解析 2 g Ca2+的物质的量为=0.05 mol,溶液中n(N)=2n(Ca2+)=0.05 mol×2=0.1 mol,溶液体积为=20 mL=0.02 L,所以该溶液中N的物质的量浓度为=5 mol·L-1。
8.答案 (1)250 mL容量瓶
(2)12.5 12.5
(3)cbagfed
(4)①偏小 ②无影响
B级 关键能力提升练
9.A 解析 4 g氢氧化钠的物质的量为=0.1 mol,溶液体积为1 L,物质的量浓度为0.1 mol·L-1,A正确;n(Na2CO3)==0.2 mol,B错误;含0.2 mol H2SO4的溶液0.5 L,其物质的量浓度为=0.4 mol·L-1,C错误;98 g H2SO4的物质的量为1 mol,加入1 L水中,溶液的体积并不是1 L,无法计算物质的量浓度,D错误。
10.D 解析 溶液稀释用不到漏斗,A项错误;溶液稀释过程中,溶质的物质的量不变,则2x=5×1.8,x=4.5,B项错误;没有指明是标准状况,无法计算气体体积,C项错误;c(Na2CO3)=c(Na+)==4.5 mol·L-1,D项正确。
11.D 解析 标准状况下,氯化氢的物质的量n= mol,氯化氢的质量m=n×M= mol×36.5 g·mol-1= g,溶液的体积V=×10-3 L·cm-3=×10-3 L,则c= mol·L-1,D项正确。
12.D 解析 加入20 g固体NaOH,搅拌、溶解,由于溶解过程中溶液体积会发生变化,氢氧化钠的物质的量为1 mol,但是溶液的体积不是1 L,所以浓度不是1 mol·L-1,A错误;加热蒸发至溶液质量变为原来的一半,但蒸发后溶液的体积不一定是原来的一半,不能确定其物质的量浓度,故B错误;加入1 L 1.5 mol·L-1的NaOH溶液混合均匀,混合液的体积不是2 L,所得溶液的浓度也不是1 mol·L-1,C错误;加入10 mol·L-1的NaOH溶液0.1 L,再稀释至1.5 L,此时溶液中氢氧化钠物质的量浓度为c(NaOH)=
=1 mol·L-1,D项正确。
13.A 解析 浓硫酸中溶质物质的量浓度c1=,稀释后H2SO4物质的量浓度c2=,二者之比;最后由于硫酸溶液的密度比水大,且浓度越大,密度也越大,则,c2<9.2 mol·L-1,A正确。
14.答案 (1)10.9 (2)500 mL容量瓶 胶头滴管 (3)AC (4)B (5)0.1
解析 (1)溶液稀释前后溶质质量不变,可据此进行计算。
若用质量分数为98%、密度为1.84 g·mL-1的浓硫酸来配制500 mL 0.4 mol·L-1硫酸溶液,需用量筒量取体积为≈10.9 mL的浓硫酸来稀释。(2)为配制上述稀硫酸,除了量筒、烧杯、玻璃棒外,还缺少的玻璃仪器是500 mL容量瓶、胶头滴管。(3)定容时俯视观察,导致溶液体积偏小,浓度偏高,A正确;定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水,导致水的体积偏大,浓度偏低,B错误;浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移,导致冷却后溶液体积偏小,浓度偏高,C正确;容量瓶未干燥即用来配制溶液,不影响溶液浓度,D错误;往容量瓶转移时,有少量液体溅出,导致溶质质量减小,浓度偏低,E错误;未洗涤稀释浓硫酸的烧杯,导致溶质质量减小,浓度偏低,F错误;故选AC。
(4)配制NaOH溶液时,需用的仪器有:胶头滴管、烧杯、药匙、玻璃棒、500 mL容量瓶、托盘天平;如图所示的仪器中,圆底烧瓶和分液漏斗是不需要的,还需要2种玻璃仪器,分别为玻璃棒和胶头滴管,A错误;容量瓶使用前应检漏,防止漏液,B正确;配制475 mL 0.8 mol·L-1 NaOH溶液,需要使用500 mL容量瓶,则需要称量NaOH固体的质量为0.8 mol·L-1×0.5 L×40 g·mol-1=16 g,C错误;称量NaOH固体时将NaOH放在烧杯中称量,D错误。
(5)根据电荷守恒可知,该混合液中CaCl2的浓度为=0.5 mol·L-1,则物质的量为0.5 mol·L-1×0.2 L=0.1 mol。
C级 学科素养创新练
15.答案 (1)4.0
(2)A
(3)148.8
(4)①4.6 ②25.0 ③D
解析 (1)该“84”消毒液的物质的量浓度约为≈4.0 mol·L-1。(2)溶液中NaClO的物质的量和溶液体积有关,溶液体积越大,NaClO的物质的量越多;溶液是均一稳定的,其浓度和体积无关;NaClO的摩尔质量是74.5 g·mol-1,和溶液体积无关;溶液是均一稳定的,溶液的密度和体积无关。(3)配制400 mL含NaClO质量分数为25%的消毒液,由于实验室没有400 mL的容量瓶,所以要用500 mL的容量瓶配制500 mL的溶液,需要称量NaClO固体的质量为500 mL×1.19 g·cm-3×25%≈148.8 g。(4)①2.3 mol·L-1的稀硫酸中,H+的物质的量浓度为2.3 mol·L-1×2=4.6 mol·L-1。②浓硫酸的物质的量浓度为 mol·L-1=18.4 mol·L-1,根据稀释前后溶质的物质的量不变,可计算配制200 mL 2.3 mol·L-1的稀硫酸需要浓硫酸的体积,=0.025 L=25.0 mL。③配制前,容量瓶中有少量蒸馏水,不影响溶质的物质的量,也不影响溶液的体积,所以对所配溶液的浓度无影响;量取浓硫酸时,仰视观察,会导致所取的浓硫酸偏多,配制的稀硫酸的浓度偏高;未冷却,立即转移至容量瓶定容会导致溶液体积偏小,配制的稀硫酸的浓度偏高;定容时,仰视观察,会导致溶液体积偏大,使所配制的稀硫酸的浓度偏低。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
