专题3 从海水中获得的化学物质 分层作业20 粗盐提纯 从海水中提取溴--2025苏教版化学必修第一册同步练习题(含答案)
文档属性
| 名称 | 专题3 从海水中获得的化学物质 分层作业20 粗盐提纯 从海水中提取溴--2025苏教版化学必修第一册同步练习题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 516.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-24 14:17:47 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
分层作业20 粗盐提纯 从海水中提取溴
A级必备知识基础练
1.欲除去粗盐水中的Mg2+、Ca2+、S,设计工艺流程如图所示:
粗盐水溶液精制盐水
下列说法中不正确的是( )
A.NaOH的作用是除去Mg2+
B.试剂a为Na2CO3,试剂b为BaCl2
C.流程图中,操作x为过滤
D.试剂c为盐酸
2.从某含Br-的废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。
已知:Br2极易溶于四氯化碳和正十二烷
物质 Br2 CCl4 正十二烷
密度/(g·cm-3) 3.119 1.595 0.753
沸点/℃ 58.76 76.8 215~217
在水中溶解性 微溶 难溶 难溶
下列说法不正确的是( )
A.甲装置中Br-发生的反应为2Br-+Cl2Br2+2Cl-
B.甲装置中NaOH溶液每吸收1 mol Cl2,转移1 mol e-
C.用乙装置进行萃取,溶解Br2的有机层一定在下层
D.用丙装置进行蒸馏,先收集到的是Br2
3.为了除去氯化钾中的少量硫酸镁和氯化钙杂质,需进行下列六项操作,先后次序正确的是( )
①加水溶解 ②加热蒸发得到晶体 ③加入过量的氯化钡溶液 ④加入适量的盐酸 ⑤加入过量碳酸钾和氢氧化钾 ⑥过滤
A.①④③⑤⑥②
B.①⑤③④⑥②
C.①③④⑥⑤②
D.①③⑤⑥④②
4.矿盐主要成分是NaCl,还含有S等其他可溶性杂质的离子。下列有关说法正确的是( )
A.由矿盐获得精制食盐,除去S最合适的试剂是Ba(NO3)2
B.工业上通过电解氯化钠溶液制备金属钠和氯气
C.食盐的溶解度随温度升高而减小
D.用酚酞溶液可鉴别饱和食盐水和饱和纯碱溶液
5.粗盐提纯中,未发生的化学反应是( )
A.NaOH+HCl===NaCl+H2O
B.2KOH+MgCl2===2KCl+Mg(OH)2↓
C.C+2H+===CO2↑+H2O
D.BaCl2+Na2SO4===BaSO4↓+2NaCl
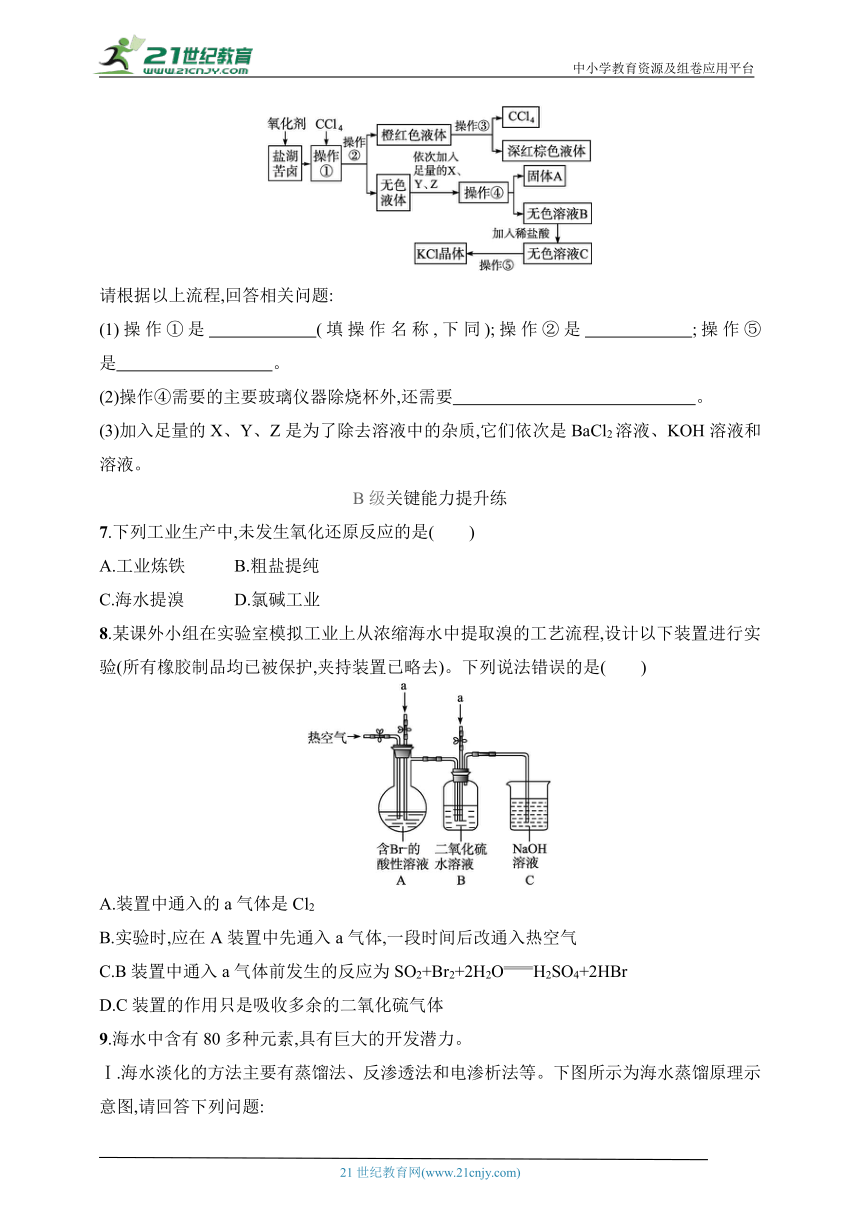
6.某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、S、Cl-等)来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:
请根据以上流程,回答相关问题:
(1)操作①是 (填操作名称,下同);操作②是 ;操作⑤是 。
(2)操作④需要的主要玻璃仪器除烧杯外,还需要 。
(3)加入足量的X、Y、Z是为了除去溶液中的杂质,它们依次是BaCl2溶液、KOH溶液和 溶液。
B级关键能力提升练
7.下列工业生产中,未发生氧化还原反应的是( )
A.工业炼铁 B.粗盐提纯
C.海水提溴 D.氯碱工业
8.某课外小组在实验室模拟工业上从浓缩海水中提取溴的工艺流程,设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)。下列说法错误的是( )
A.装置中通入的a气体是Cl2
B.实验时,应在A装置中先通入a气体,一段时间后改通入热空气
C.B装置中通入a气体前发生的反应为SO2+Br2+2H2OH2SO4+2HBr
D.C装置的作用只是吸收多余的二氧化硫气体
9.海水中含有80多种元素,具有巨大的开发潜力。
Ⅰ.海水淡化的方法主要有蒸馏法、反渗透法和电渗析法等。下图所示为海水蒸馏原理示意图,请回答下列问题:
(1)冷却水的出水口是 (填“a”或“b”)。
(2)碎瓷片的作用是 。
Ⅱ.目前,从海水中提取的溴占世界溴年产量的三分之一左右,空气吹出法是工业大规模海水提溴的常用方法。其中一种工艺流程为:
①海水浓缩,酸化;
②通入Cl2,使Br-转化为Br2;
③通入空气、水蒸气,将Br2吹入吸收塔,与吸收剂SO2反应转化为HBr;
④通入Cl2,再经过一系列处理得到产品Br2。
请回答下列问题:
(1)步骤②③的目的是 (填“富集溴”或“萃取溴”)。
(2)在步骤③中,反应生成HBr的化学方程式为 。
(3)在步骤②中,若通入44.8 L Cl2(标准状况),理论上可得到Br2 g。
10.钠和钠的化合物有许多重要的用途。
(1)碳酸钠可用于从海水中提取溴,涉及的反应如下:3Br2+6Na2CO3+3H2O5NaBr+NaBrO3+6NaHCO3,该反应中还原剂与氧化剂的物质的量之比是 。
(2)粗盐含有少量杂质(主要为CaCl2、MgCl2、Na2SO4等)。用粗盐制取“化学纯”级的NaCl,步骤为①溶解 ②加过量a ③加过量NaOH ④加过量b ⑤过滤 ⑥加适量盐酸 ⑦蒸发结晶,最后得到“化学纯”级的NaCl固体。试剂a、b分别是 (填字母)。
A.Na2CO3、BaCl2
B.BaCl2、Na2CO3
C.BaCl2、Na2SO4
(3)如果需要0.3 mol·L-1的NaOH溶液450 mL,配制时需要称量NaOH固体 g,在该溶液的配制过程中,用到的玻璃仪器: 、胶头滴管、烧杯、玻璃棒。如果在定容时仰视,所配结果将 (填“偏大”“偏小”或“不变”)。
11.溴及其衍生物是制药业和制取阻燃剂、钻井液等的重要原料,空气吹出法是海水提溴的常用方法,其工艺流程如图所示。回答下列问题:
(1)在实验室若想达到步骤①的目的,需要的仪器有酒精灯、三脚架、 、 。
(2)步骤②为工业上电解饱和食盐水制备Cl2的方法,该过程还同时生成 (填化学式)。
(3)步骤④通入热空气吹出Br2,利用了溴的 (填字母,下同);步骤⑤中SO2为吸收剂,利用了SO2的 。
A.氧化性 B.还原性
C.挥发性 D.酸性氧化物
(4)步骤⑦蒸馏过程中,蒸气冷凝后得到下层为液溴、上层为溴水的混合物,继续分离它们的操作名称是 。
(5)提取溴单质,采用蒸馏“溴水混合物Ⅱ”而不是蒸馏“溴水混合物Ⅰ”,请说明原因: 。
12.下图是中学化学常用于混合物分离和提纯的装置,请根据装置回答问题:
(1)从氯化钾溶液中得到氯化钾固体,选择装置 (填代表装置图的字母,下同)。
(2)A装置中插有温度计的玻璃仪器名称为 。
(3)从碘水中分离出I2的装置为 ,分离方法的名称为 、 。
(4)装置B在分液时为使液体顺利滴下,除打开旋塞外,还应进行的具体操作是 。
C级学科素养创新练
13.海洋中有丰富的矿产、能源、水产等资源,部分化学资源获取途径如下:
请回答下列问题:
(1)下列有关实验室模拟步骤①的说法正确的是 。
a.溶解粗盐时,尽量使溶液稀些,以保证食盐完全溶解
b.滤去不溶性杂质后,将滤液移到坩埚内加热浓缩
c.当蒸发到剩有少量液体时停止加热,利用余热蒸干
d.制得的晶体转移到新过滤器中,需用大量水进行洗涤
(2)“氯碱工业”通过电解饱和食盐水可制得NaOH溶液、Cl2和另一种无色无味的单质气体,该气体的化学式为 。“氯碱工业”的产品Cl2用于步骤②中溴的提取,该步反应的离子方程式是 。检验步骤③中的氧化产物,可向反应后的溶液中加入 (填化学式)。
(3)下列有关说法正确的是 (填字母)。
a.“氯碱工业”中氯元素被还原
b.用澄清石灰水可鉴别NaHCO3溶液和Na2CO3溶液
c.除去粗盐中Ca2+、Mg2+、S加入试剂的先后顺序为NaOH、BaCl2、Na2CO3
(4)溴水中加入碳酸钠溶液,溴水褪色,有HBrO和NaHCO3生成,反应的化学方程式为 。
分层作业20 粗盐提纯 从海水中提取溴
A级 必备知识基础练
1.B 解析 向粗盐水中加入过量NaOH溶液可以使Mg2+转化为Mg(OH)2沉淀;然后加入过量BaCl2溶液,使S转化为BaSO4沉淀;再加入过量Na2CO3溶液,使原溶液中的Ca2+及加入的Ba2+转化为CaCO3、BaCO3沉淀,经过滤将上述沉淀除去,所得滤液中含有过量NaOH、Na2CO3,再向其中加入足量盐酸,二者反应转化为NaCl。当不再产生气泡时停止滴加,就得到精制盐水。
反应过程中加入NaOH的作用是使溶液中的Mg2+转化为Mg(OH)2沉淀而除去,A正确;根据上述分析可知:试剂a为BaCl2,试剂b为Na2CO3,B错误;流程图中,操作x为分离难溶性固体与可溶性液体混合物的操作,名称为过滤,C正确;根据上述分析可知:试剂c为盐酸,作用是除去过量的NaOH、Na2CO3,D正确。
2.C 解析 氯气的氧化性强于溴,甲装置中Br-发生的反应为2Br-+Cl2Br2+2Cl-,A正确;根据Cl2+2NaOHNaCl+NaClO+H2O可知,甲装置中NaOH溶液每吸收1 mol Cl2,转移1 mol e-,B正确;如果用正十二烷萃取溴,由于正十二烷密度小于水,所以溶解Br2的有机层在上层,C错误;根据表中数据可知溴的沸点最低,所以用丙装置进行蒸馏,先收集到的是Br2,D正确。
3.D 解析 碳酸钾必须在氯化钡溶液之后加入,这样才能除去过量的氯化钡;加入盐酸必须在过滤之后,以防止沉淀在加盐酸时又溶解。
4.D 解析 用Ba(NO3)2会引入N,应选择BaCl2,A错误;电解氯化钠溶液得到氯气、氢氧化钠和氢气,B错误;食盐的溶解度随温度升高略有增大,C错误;食盐水显中性,不能使酚酞变色,碳酸钠溶液显碱性,可使酚酞溶液变红色,D正确。
5.B 解析 粗盐提纯中,使用KOH溶液会引入新杂质,本题选B。
6.答案 (1)萃取 分液 蒸发结晶(或蒸发)
(2)漏斗、玻璃棒 (3)K2CO3(或碳酸钾)
解析 苦卤中加入的氧化剂应为氯气,通入氯气发生反应Cl2+2Br-===2Cl-+Br2,溴易溶于CCl4,可用萃取、分液的方法分离。由于溴和CCl4的沸点不同,可用蒸馏的方法分离;要除去无色溶液中的S、Mg2+,应分别加入过量的BaCl2溶液、KOH溶液、K2CO3溶液,加入过量BaCl2溶液可除去S,加入过量KOH溶液可除去Mg2+,最后加入K2CO3溶液可除去过量的BaCl2;溶液B是碳酸钾和氢氧化钾的混合溶液,加入盐酸可以得到氯化钾溶液,蒸发结晶可以得到氯化钾晶体。
B级 关键能力提升练
7.B 解析 粗盐提纯中未发生氧化还原反应,所以选B。
8.D 解析 装置中通入的a气体是Cl2,目的是氧化A中溴离子,A正确;实验时,应在A装置中先通入a气体,一段时间后改通入热空气,用热空气将溴单质吹出,B正确;B装置中通入a气体前发生的反应为SO2+Br2+2H2OH2SO4+2HBr,C正确;C装置的作用为吸收尾气中的溴蒸气、氯气、二氧化硫等,D错误。
9.答案 Ⅰ.(1)b (2)防止暴沸
Ⅱ.(1)富集溴 (2)SO2+Br2+2H2OH2SO4+2HBr (3)320
10.答案 (1)1∶5 (2)B (3)6.0 500 mL容量瓶 偏小
解析 (1)在反应3Br2+6Na2CO3+3H2O5NaBr+NaBrO3+6NaHCO3中,溴元素的化合价由Br2中的0价分别变为NaBr中的-1价和NaBrO3中的+5价,溴单质既是氧化剂又是还原剂,氧化产物是溴酸钠,还原产物是溴化钠,根据电子得失数目相等,可知还原剂和氧化剂的物质的量之比为1∶5。(2)粗盐含有少量杂质(主要为CaCl2、MgCl2、Na2SO4等),用粗盐制取“化学纯”级的NaCl,步骤为溶解、加过量氯化钡溶液除去杂质硫酸钠、加过量NaOH溶液除去氯化镁杂质、加过量碳酸钠溶液除去杂质氯化钙及加入的过量氯化钡溶液,将形成的沉淀过滤除去,再加适量盐酸除去过量的氢氧化钠和碳酸钠,最后蒸发、结晶,就可得到“化学纯”级的NaCl固体,因此试剂a、b分别是BaCl2、Na2CO3。(3)准确配制一定体积、一定物质的量浓度的溶液需要使用容量瓶,由于实验室没有450 mL的容量瓶,根据选择仪器的标准“大而近”的原则,要使用500 mL的容量瓶。则配制0.3 mol·L-1的NaOH溶液500 mL,需要称量NaOH固体的物质的量为n(NaOH)=c·V=0.3 mol·L-1×0.5 L=0.15 mol,其质量为m(NaOH)=0.15 mol×40 g·mol-1=6.0 g。如果在定容时仰视,则溶液的体积偏大,根据c=可知所配溶液的浓度偏小。
11.答案 (1)蒸发皿 玻璃棒
(2)NaOH、H2 (3)C B
(4)分液
(5)将“溴水混合物Ⅰ”转变为“溴水混合物Ⅱ”是Br2的浓缩过程,可提高效率、减少能耗、降低成本
解析 (1)在实验室想达到步骤①的目的,应通过蒸发操作,用到的仪器有酒精灯、三脚架、蒸发皿、玻璃棒。
(2)步骤②为氯碱工业,即电解饱和食盐水:2NaCl+2H2O2NaOH+H2↑+Cl2↑,制备氯气的同时还生成NaOH和H2。
(3)步骤④通入热空气可以吹出Br2,利用了溴的挥发性;步骤⑤中SO2为吸收剂,吸收Br2过程中发生反应Br2+SO2+2H2O2HBr+H2SO4,该反应中SO2为还原剂,体现还原性。
(4)步骤⑦蒸馏过程中,蒸气冷凝后得到下层为液溴、上层为溴水的混合物,继续分离它们的操作名称是分液。
(5)将“溴水混合物Ⅰ”转变为“溴水混合物Ⅱ”是Br2的浓缩过程,所以提取溴单质采用蒸馏“溴水混合物Ⅱ”而不是蒸馏“溴水混合物Ⅰ”,可提高效率、减少能耗、降低成本。
12.答案 (1)D (2)蒸馏烧瓶 (3)B 萃取 分液
(4)先打开分液漏斗上部的塞子(或者使分液漏斗塞子上的凹槽对准分液漏斗口上的小孔)
C级 学科素养创新练
13.答案 (1)c
(2)H2 Cl2+2Br-===Br2+2Cl- BaCl2
(3)c
(4)Br2+Na2CO3+H2O===HBrO+NaBr+NaHCO3
解析 (1)溶解时,若加入太多水,则蒸发时需要大量时间,a错误;滤去不溶性杂质后,将滤液移到蒸发皿内加热浓缩,b错误;当蒸发到剩有少量液体时停止加热,利用余热蒸干得到晶体,c正确;晶体应用少量水洗涤,否则会导致晶体溶于水损失,d错误。
(2)“氯碱工业”通过电解饱和食盐水可制得NaOH溶液、Cl2和另一种无色无味的气体为氢气,化学式为H2。Cl2与Br-反应的离子方程式是Cl2+2Br-===Br2+2Cl-。步骤③中,SO2是还原剂,其氧化产物是S,可用BaCl2溶液检验。
(3)“氯碱工业”中氯元素被氧化,a错误;NaHCO3溶液和Na2CO3溶液都可与石灰水反应生成白色碳酸钙沉淀,因此不能用石灰水鉴别两种溶液,b错误;除去粗盐中的Ca2+、Mg2+、S,可以先加入过量NaOH溶液除去Mg2+,再加过量的BaCl2溶液除去S,然后用Na2CO3溶液去除Ca2+和过量的Ba2+,经过滤后,向滤液中加入过量盐酸,除去过量的NaOH和Na2CO3,c正确。
(4)Br2与Na2CO3反应有HBrO和NaHCO3生成,根据溴元素的化合价变化可知,反应还生成NaBr,根据得失电子守恒和元素守恒可写出反应的化学方程式。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
分层作业20 粗盐提纯 从海水中提取溴
A级必备知识基础练
1.欲除去粗盐水中的Mg2+、Ca2+、S,设计工艺流程如图所示:
粗盐水溶液精制盐水
下列说法中不正确的是( )
A.NaOH的作用是除去Mg2+
B.试剂a为Na2CO3,试剂b为BaCl2
C.流程图中,操作x为过滤
D.试剂c为盐酸
2.从某含Br-的废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。
已知:Br2极易溶于四氯化碳和正十二烷
物质 Br2 CCl4 正十二烷
密度/(g·cm-3) 3.119 1.595 0.753
沸点/℃ 58.76 76.8 215~217
在水中溶解性 微溶 难溶 难溶
下列说法不正确的是( )
A.甲装置中Br-发生的反应为2Br-+Cl2Br2+2Cl-
B.甲装置中NaOH溶液每吸收1 mol Cl2,转移1 mol e-
C.用乙装置进行萃取,溶解Br2的有机层一定在下层
D.用丙装置进行蒸馏,先收集到的是Br2
3.为了除去氯化钾中的少量硫酸镁和氯化钙杂质,需进行下列六项操作,先后次序正确的是( )
①加水溶解 ②加热蒸发得到晶体 ③加入过量的氯化钡溶液 ④加入适量的盐酸 ⑤加入过量碳酸钾和氢氧化钾 ⑥过滤
A.①④③⑤⑥②
B.①⑤③④⑥②
C.①③④⑥⑤②
D.①③⑤⑥④②
4.矿盐主要成分是NaCl,还含有S等其他可溶性杂质的离子。下列有关说法正确的是( )
A.由矿盐获得精制食盐,除去S最合适的试剂是Ba(NO3)2
B.工业上通过电解氯化钠溶液制备金属钠和氯气
C.食盐的溶解度随温度升高而减小
D.用酚酞溶液可鉴别饱和食盐水和饱和纯碱溶液
5.粗盐提纯中,未发生的化学反应是( )
A.NaOH+HCl===NaCl+H2O
B.2KOH+MgCl2===2KCl+Mg(OH)2↓
C.C+2H+===CO2↑+H2O
D.BaCl2+Na2SO4===BaSO4↓+2NaCl
6.某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、S、Cl-等)来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:
请根据以上流程,回答相关问题:
(1)操作①是 (填操作名称,下同);操作②是 ;操作⑤是 。
(2)操作④需要的主要玻璃仪器除烧杯外,还需要 。
(3)加入足量的X、Y、Z是为了除去溶液中的杂质,它们依次是BaCl2溶液、KOH溶液和 溶液。
B级关键能力提升练
7.下列工业生产中,未发生氧化还原反应的是( )
A.工业炼铁 B.粗盐提纯
C.海水提溴 D.氯碱工业
8.某课外小组在实验室模拟工业上从浓缩海水中提取溴的工艺流程,设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)。下列说法错误的是( )
A.装置中通入的a气体是Cl2
B.实验时,应在A装置中先通入a气体,一段时间后改通入热空气
C.B装置中通入a气体前发生的反应为SO2+Br2+2H2OH2SO4+2HBr
D.C装置的作用只是吸收多余的二氧化硫气体
9.海水中含有80多种元素,具有巨大的开发潜力。
Ⅰ.海水淡化的方法主要有蒸馏法、反渗透法和电渗析法等。下图所示为海水蒸馏原理示意图,请回答下列问题:
(1)冷却水的出水口是 (填“a”或“b”)。
(2)碎瓷片的作用是 。
Ⅱ.目前,从海水中提取的溴占世界溴年产量的三分之一左右,空气吹出法是工业大规模海水提溴的常用方法。其中一种工艺流程为:
①海水浓缩,酸化;
②通入Cl2,使Br-转化为Br2;
③通入空气、水蒸气,将Br2吹入吸收塔,与吸收剂SO2反应转化为HBr;
④通入Cl2,再经过一系列处理得到产品Br2。
请回答下列问题:
(1)步骤②③的目的是 (填“富集溴”或“萃取溴”)。
(2)在步骤③中,反应生成HBr的化学方程式为 。
(3)在步骤②中,若通入44.8 L Cl2(标准状况),理论上可得到Br2 g。
10.钠和钠的化合物有许多重要的用途。
(1)碳酸钠可用于从海水中提取溴,涉及的反应如下:3Br2+6Na2CO3+3H2O5NaBr+NaBrO3+6NaHCO3,该反应中还原剂与氧化剂的物质的量之比是 。
(2)粗盐含有少量杂质(主要为CaCl2、MgCl2、Na2SO4等)。用粗盐制取“化学纯”级的NaCl,步骤为①溶解 ②加过量a ③加过量NaOH ④加过量b ⑤过滤 ⑥加适量盐酸 ⑦蒸发结晶,最后得到“化学纯”级的NaCl固体。试剂a、b分别是 (填字母)。
A.Na2CO3、BaCl2
B.BaCl2、Na2CO3
C.BaCl2、Na2SO4
(3)如果需要0.3 mol·L-1的NaOH溶液450 mL,配制时需要称量NaOH固体 g,在该溶液的配制过程中,用到的玻璃仪器: 、胶头滴管、烧杯、玻璃棒。如果在定容时仰视,所配结果将 (填“偏大”“偏小”或“不变”)。
11.溴及其衍生物是制药业和制取阻燃剂、钻井液等的重要原料,空气吹出法是海水提溴的常用方法,其工艺流程如图所示。回答下列问题:
(1)在实验室若想达到步骤①的目的,需要的仪器有酒精灯、三脚架、 、 。
(2)步骤②为工业上电解饱和食盐水制备Cl2的方法,该过程还同时生成 (填化学式)。
(3)步骤④通入热空气吹出Br2,利用了溴的 (填字母,下同);步骤⑤中SO2为吸收剂,利用了SO2的 。
A.氧化性 B.还原性
C.挥发性 D.酸性氧化物
(4)步骤⑦蒸馏过程中,蒸气冷凝后得到下层为液溴、上层为溴水的混合物,继续分离它们的操作名称是 。
(5)提取溴单质,采用蒸馏“溴水混合物Ⅱ”而不是蒸馏“溴水混合物Ⅰ”,请说明原因: 。
12.下图是中学化学常用于混合物分离和提纯的装置,请根据装置回答问题:
(1)从氯化钾溶液中得到氯化钾固体,选择装置 (填代表装置图的字母,下同)。
(2)A装置中插有温度计的玻璃仪器名称为 。
(3)从碘水中分离出I2的装置为 ,分离方法的名称为 、 。
(4)装置B在分液时为使液体顺利滴下,除打开旋塞外,还应进行的具体操作是 。
C级学科素养创新练
13.海洋中有丰富的矿产、能源、水产等资源,部分化学资源获取途径如下:
请回答下列问题:
(1)下列有关实验室模拟步骤①的说法正确的是 。
a.溶解粗盐时,尽量使溶液稀些,以保证食盐完全溶解
b.滤去不溶性杂质后,将滤液移到坩埚内加热浓缩
c.当蒸发到剩有少量液体时停止加热,利用余热蒸干
d.制得的晶体转移到新过滤器中,需用大量水进行洗涤
(2)“氯碱工业”通过电解饱和食盐水可制得NaOH溶液、Cl2和另一种无色无味的单质气体,该气体的化学式为 。“氯碱工业”的产品Cl2用于步骤②中溴的提取,该步反应的离子方程式是 。检验步骤③中的氧化产物,可向反应后的溶液中加入 (填化学式)。
(3)下列有关说法正确的是 (填字母)。
a.“氯碱工业”中氯元素被还原
b.用澄清石灰水可鉴别NaHCO3溶液和Na2CO3溶液
c.除去粗盐中Ca2+、Mg2+、S加入试剂的先后顺序为NaOH、BaCl2、Na2CO3
(4)溴水中加入碳酸钠溶液,溴水褪色,有HBrO和NaHCO3生成,反应的化学方程式为 。
分层作业20 粗盐提纯 从海水中提取溴
A级 必备知识基础练
1.B 解析 向粗盐水中加入过量NaOH溶液可以使Mg2+转化为Mg(OH)2沉淀;然后加入过量BaCl2溶液,使S转化为BaSO4沉淀;再加入过量Na2CO3溶液,使原溶液中的Ca2+及加入的Ba2+转化为CaCO3、BaCO3沉淀,经过滤将上述沉淀除去,所得滤液中含有过量NaOH、Na2CO3,再向其中加入足量盐酸,二者反应转化为NaCl。当不再产生气泡时停止滴加,就得到精制盐水。
反应过程中加入NaOH的作用是使溶液中的Mg2+转化为Mg(OH)2沉淀而除去,A正确;根据上述分析可知:试剂a为BaCl2,试剂b为Na2CO3,B错误;流程图中,操作x为分离难溶性固体与可溶性液体混合物的操作,名称为过滤,C正确;根据上述分析可知:试剂c为盐酸,作用是除去过量的NaOH、Na2CO3,D正确。
2.C 解析 氯气的氧化性强于溴,甲装置中Br-发生的反应为2Br-+Cl2Br2+2Cl-,A正确;根据Cl2+2NaOHNaCl+NaClO+H2O可知,甲装置中NaOH溶液每吸收1 mol Cl2,转移1 mol e-,B正确;如果用正十二烷萃取溴,由于正十二烷密度小于水,所以溶解Br2的有机层在上层,C错误;根据表中数据可知溴的沸点最低,所以用丙装置进行蒸馏,先收集到的是Br2,D正确。
3.D 解析 碳酸钾必须在氯化钡溶液之后加入,这样才能除去过量的氯化钡;加入盐酸必须在过滤之后,以防止沉淀在加盐酸时又溶解。
4.D 解析 用Ba(NO3)2会引入N,应选择BaCl2,A错误;电解氯化钠溶液得到氯气、氢氧化钠和氢气,B错误;食盐的溶解度随温度升高略有增大,C错误;食盐水显中性,不能使酚酞变色,碳酸钠溶液显碱性,可使酚酞溶液变红色,D正确。
5.B 解析 粗盐提纯中,使用KOH溶液会引入新杂质,本题选B。
6.答案 (1)萃取 分液 蒸发结晶(或蒸发)
(2)漏斗、玻璃棒 (3)K2CO3(或碳酸钾)
解析 苦卤中加入的氧化剂应为氯气,通入氯气发生反应Cl2+2Br-===2Cl-+Br2,溴易溶于CCl4,可用萃取、分液的方法分离。由于溴和CCl4的沸点不同,可用蒸馏的方法分离;要除去无色溶液中的S、Mg2+,应分别加入过量的BaCl2溶液、KOH溶液、K2CO3溶液,加入过量BaCl2溶液可除去S,加入过量KOH溶液可除去Mg2+,最后加入K2CO3溶液可除去过量的BaCl2;溶液B是碳酸钾和氢氧化钾的混合溶液,加入盐酸可以得到氯化钾溶液,蒸发结晶可以得到氯化钾晶体。
B级 关键能力提升练
7.B 解析 粗盐提纯中未发生氧化还原反应,所以选B。
8.D 解析 装置中通入的a气体是Cl2,目的是氧化A中溴离子,A正确;实验时,应在A装置中先通入a气体,一段时间后改通入热空气,用热空气将溴单质吹出,B正确;B装置中通入a气体前发生的反应为SO2+Br2+2H2OH2SO4+2HBr,C正确;C装置的作用为吸收尾气中的溴蒸气、氯气、二氧化硫等,D错误。
9.答案 Ⅰ.(1)b (2)防止暴沸
Ⅱ.(1)富集溴 (2)SO2+Br2+2H2OH2SO4+2HBr (3)320
10.答案 (1)1∶5 (2)B (3)6.0 500 mL容量瓶 偏小
解析 (1)在反应3Br2+6Na2CO3+3H2O5NaBr+NaBrO3+6NaHCO3中,溴元素的化合价由Br2中的0价分别变为NaBr中的-1价和NaBrO3中的+5价,溴单质既是氧化剂又是还原剂,氧化产物是溴酸钠,还原产物是溴化钠,根据电子得失数目相等,可知还原剂和氧化剂的物质的量之比为1∶5。(2)粗盐含有少量杂质(主要为CaCl2、MgCl2、Na2SO4等),用粗盐制取“化学纯”级的NaCl,步骤为溶解、加过量氯化钡溶液除去杂质硫酸钠、加过量NaOH溶液除去氯化镁杂质、加过量碳酸钠溶液除去杂质氯化钙及加入的过量氯化钡溶液,将形成的沉淀过滤除去,再加适量盐酸除去过量的氢氧化钠和碳酸钠,最后蒸发、结晶,就可得到“化学纯”级的NaCl固体,因此试剂a、b分别是BaCl2、Na2CO3。(3)准确配制一定体积、一定物质的量浓度的溶液需要使用容量瓶,由于实验室没有450 mL的容量瓶,根据选择仪器的标准“大而近”的原则,要使用500 mL的容量瓶。则配制0.3 mol·L-1的NaOH溶液500 mL,需要称量NaOH固体的物质的量为n(NaOH)=c·V=0.3 mol·L-1×0.5 L=0.15 mol,其质量为m(NaOH)=0.15 mol×40 g·mol-1=6.0 g。如果在定容时仰视,则溶液的体积偏大,根据c=可知所配溶液的浓度偏小。
11.答案 (1)蒸发皿 玻璃棒
(2)NaOH、H2 (3)C B
(4)分液
(5)将“溴水混合物Ⅰ”转变为“溴水混合物Ⅱ”是Br2的浓缩过程,可提高效率、减少能耗、降低成本
解析 (1)在实验室想达到步骤①的目的,应通过蒸发操作,用到的仪器有酒精灯、三脚架、蒸发皿、玻璃棒。
(2)步骤②为氯碱工业,即电解饱和食盐水:2NaCl+2H2O2NaOH+H2↑+Cl2↑,制备氯气的同时还生成NaOH和H2。
(3)步骤④通入热空气可以吹出Br2,利用了溴的挥发性;步骤⑤中SO2为吸收剂,吸收Br2过程中发生反应Br2+SO2+2H2O2HBr+H2SO4,该反应中SO2为还原剂,体现还原性。
(4)步骤⑦蒸馏过程中,蒸气冷凝后得到下层为液溴、上层为溴水的混合物,继续分离它们的操作名称是分液。
(5)将“溴水混合物Ⅰ”转变为“溴水混合物Ⅱ”是Br2的浓缩过程,所以提取溴单质采用蒸馏“溴水混合物Ⅱ”而不是蒸馏“溴水混合物Ⅰ”,可提高效率、减少能耗、降低成本。
12.答案 (1)D (2)蒸馏烧瓶 (3)B 萃取 分液
(4)先打开分液漏斗上部的塞子(或者使分液漏斗塞子上的凹槽对准分液漏斗口上的小孔)
C级 学科素养创新练
13.答案 (1)c
(2)H2 Cl2+2Br-===Br2+2Cl- BaCl2
(3)c
(4)Br2+Na2CO3+H2O===HBrO+NaBr+NaHCO3
解析 (1)溶解时,若加入太多水,则蒸发时需要大量时间,a错误;滤去不溶性杂质后,将滤液移到蒸发皿内加热浓缩,b错误;当蒸发到剩有少量液体时停止加热,利用余热蒸干得到晶体,c正确;晶体应用少量水洗涤,否则会导致晶体溶于水损失,d错误。
(2)“氯碱工业”通过电解饱和食盐水可制得NaOH溶液、Cl2和另一种无色无味的气体为氢气,化学式为H2。Cl2与Br-反应的离子方程式是Cl2+2Br-===Br2+2Cl-。步骤③中,SO2是还原剂,其氧化产物是S,可用BaCl2溶液检验。
(3)“氯碱工业”中氯元素被氧化,a错误;NaHCO3溶液和Na2CO3溶液都可与石灰水反应生成白色碳酸钙沉淀,因此不能用石灰水鉴别两种溶液,b错误;除去粗盐中的Ca2+、Mg2+、S,可以先加入过量NaOH溶液除去Mg2+,再加过量的BaCl2溶液除去S,然后用Na2CO3溶液去除Ca2+和过量的Ba2+,经过滤后,向滤液中加入过量盐酸,除去过量的NaOH和Na2CO3,c正确。
(4)Br2与Na2CO3反应有HBrO和NaHCO3生成,根据溴元素的化合价变化可知,反应还生成NaBr,根据得失电子守恒和元素守恒可写出反应的化学方程式。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
