专题4 硫与环境保护 分层作业23 硫酸的工业制备 浓硫酸的性质--2025苏教版化学必修第一册同步练习题(含答案)
文档属性
| 名称 | 专题4 硫与环境保护 分层作业23 硫酸的工业制备 浓硫酸的性质--2025苏教版化学必修第一册同步练习题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 467.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-24 14:18:54 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2025苏教版化学必修第一册
分层作业23 硫酸的工业制备 浓硫酸的性质
A级必备知识基础练
1.下列关于物质的性质与用途具有对应关系的是( )
A.SO2具有氧化性,可用于漂白织物
B.NaCl易溶于水,可用于电解制备金属钠
C.浓硫酸具有吸水性,可用于干燥氢气
D.NaHCO3受热易分解,可用于治疗胃酸过多
2.硫酸厂有一辆存放过浓硫酸的铁槽车。某工人违反规程,边吸烟边用水冲洗铁槽车,结果发生了爆炸。下列对引起爆炸的原因说法正确的是( )
A.浓硫酸遇明火爆炸
B.浓硫酸遇水发热爆炸
C.铁与水(常温下)反应产生的氧化物爆炸
D.稀释后的硫酸与铁反应产生的氢气在空气中遇明火而爆炸
3.下列关于浓硫酸和稀硫酸的叙述正确的是( )
A.常温时都能与铝发生反应,放出气体
B.加热时都能与铜发生反应
C.都能作为气体干燥剂
D.硫元素的化合价都是+6价
4.下列反应中,浓硫酸既表现强氧化性又表现酸性的是( )
A.2NaCl+H2SO4(浓)Na2SO4+2HCl↑
B.Na2SO3+H2SO4(浓)Na2SO4+SO2↑+H2O
C.C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
D.Cu2O+3H2SO4(浓)2CuSO4+SO2↑+3H2O
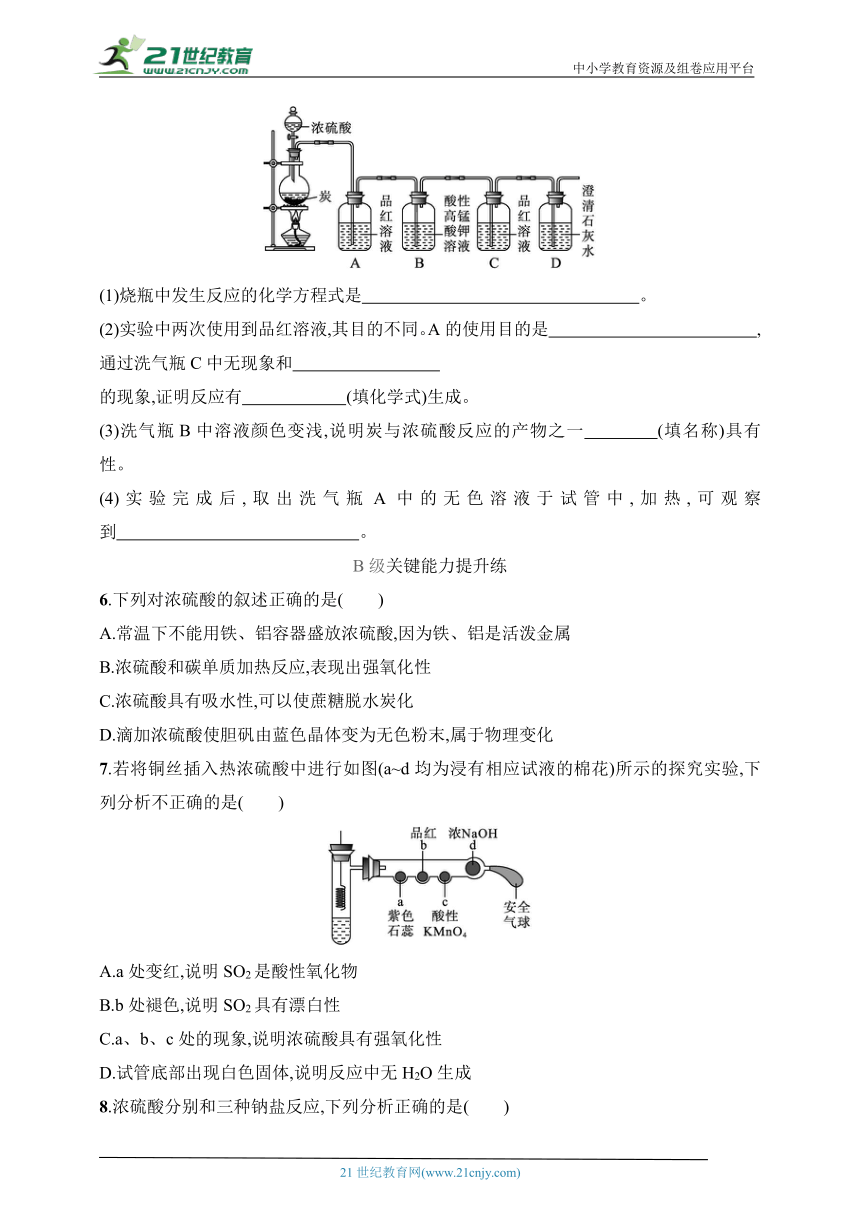
5.某同学欲验证炭与浓硫酸反应产物的性质。现已将装置如图连接,请回答下列问题。
(1)烧瓶中发生反应的化学方程式是 。
(2)实验中两次使用到品红溶液,其目的不同。A的使用目的是 ,通过洗气瓶C中无现象和
的现象,证明反应有 (填化学式)生成。
(3)洗气瓶B中溶液颜色变浅,说明炭与浓硫酸反应的产物之一 (填名称)具有 性。
(4)实验完成后,取出洗气瓶A中的无色溶液于试管中,加热,可观察到 。
B级关键能力提升练
6.下列对浓硫酸的叙述正确的是( )
A.常温下不能用铁、铝容器盛放浓硫酸,因为铁、铝是活泼金属
B.浓硫酸和碳单质加热反应,表现出强氧化性
C.浓硫酸具有吸水性,可以使蔗糖脱水炭化
D.滴加浓硫酸使胆矾由蓝色晶体变为无色粉末,属于物理变化
7.若将铜丝插入热浓硫酸中进行如图(a~d均为浸有相应试液的棉花)所示的探究实验,下列分析不正确的是( )
A.a处变红,说明SO2是酸性氧化物
B.b处褪色,说明SO2具有漂白性
C.a、b、c处的现象,说明浓硫酸具有强氧化性
D.试管底部出现白色固体,说明反应中无H2O生成
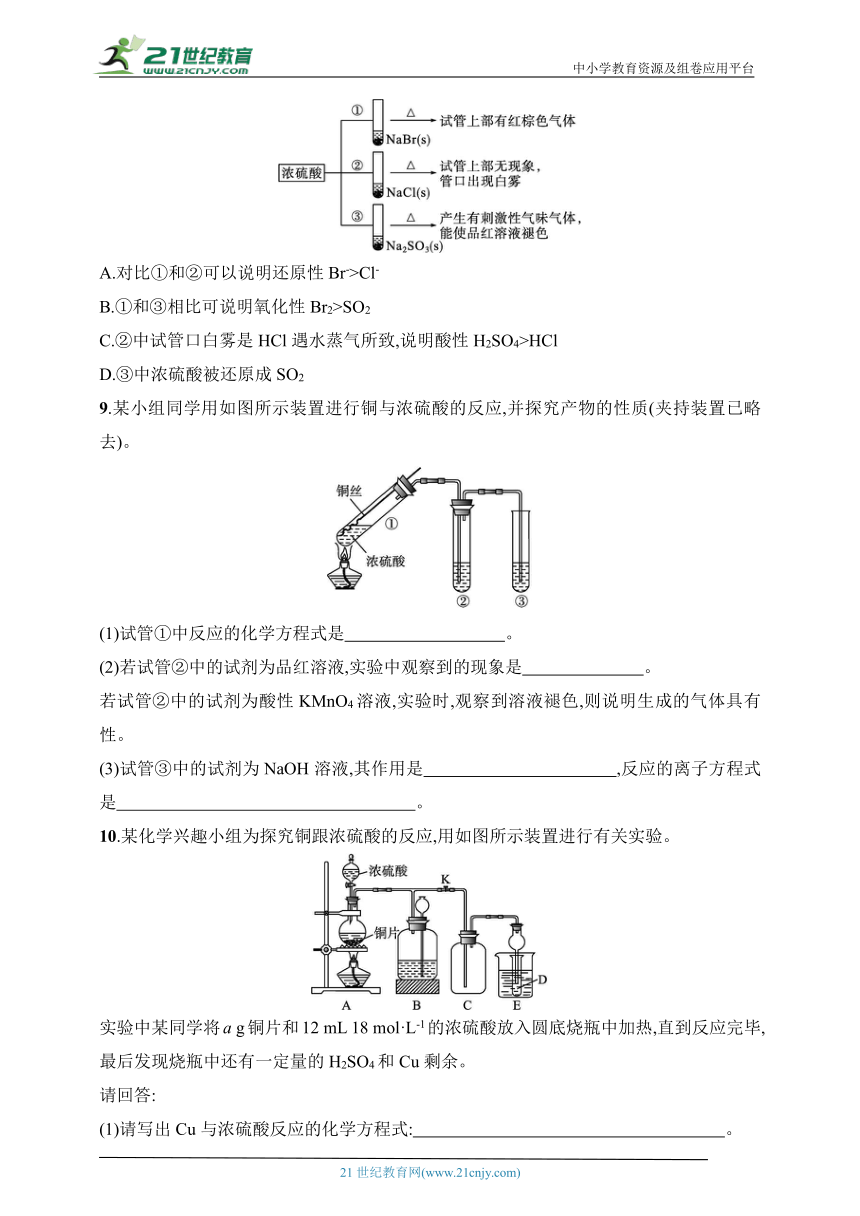
8.浓硫酸分别和三种钠盐反应,下列分析正确的是( )
A.对比①和②可以说明还原性Br->Cl-
B.①和③相比可说明氧化性Br2>SO2
C.②中试管口白雾是HCl遇水蒸气所致,说明酸性H2SO4>HCl
D.③中浓硫酸被还原成SO2
9.某小组同学用如图所示装置进行铜与浓硫酸的反应,并探究产物的性质(夹持装置已略去)。
(1)试管①中反应的化学方程式是 。
(2)若试管②中的试剂为品红溶液,实验中观察到的现象是 。
若试管②中的试剂为酸性KMnO4溶液,实验时,观察到溶液褪色,则说明生成的气体具有 性。
(3)试管③中的试剂为NaOH溶液,其作用是 ,反应的离子方程式是 。
10.某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。
实验中某同学将a g铜片和12 mL 18 mol·L-1的浓硫酸放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余。
请回答:
(1)请写出Cu与浓硫酸反应的化学方程式: 。
(2)装置E中试管D内盛品红溶液,当C中气体收集满后,D中有可能观察到的现象是 。
实验装置E中D有可能造成环境污染,试用最简单方法加以解决(实验用品自选): 。
装置B的作用是储存多余的气体。当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是 。
B中应放置的液体是 (填字母)。
A.饱和Na2SO3溶液
B.酸性KMnO4溶液
C.浓溴水
D.饱和NaHSO3溶液
(3)浓硫酸的强氧化性有多种表现,如FeO放入浓硫酸中加热生成Fe2(SO4)3,反应的化学方程式是 。
C级学科素养创新练
11.实验室中需要22.4 L(标准状况)SO2气体。化学小组同学依据化学方程式Zn+2H2SO4(浓)ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓硫酸(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
(1)化学小组所制得的气体中混有的主要杂质气体可能是 (填分子式)。产生这种结果的主要原因是
(用化学方程式和必要的文字加以说明)。
(2)为证实相关分析,化学小组的同学设计了实验,组装了如下装置,对所制取的气体进行探究。
①装置B中加入的试剂是 ,反应的离子方程式为 。
②装置D加入的试剂及作用: ,装置F加入的试剂及作用: 。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有某杂质气体的实验现象是 。
④U形管G的作用为 。
分层作业23 硫酸的工业制备 浓硫酸的性质
A级 必备知识基础练
1.C 解析 SO2用于漂白纸浆,体现的是漂白性,A不正确;NaCl在熔融态能电离,可用于工业电解制备金属钠,B不正确;浓硫酸用于干燥氢气,体现的是吸水性,C正确;NaHCO3与胃酸发生反应,可用于治疗胃酸过多,D不正确。
2.D 解析 存放过浓硫酸的铁槽车,用水冲洗,稀释后的硫酸与铁反应产生氢气,氢气与空气混合,达到爆炸极限,遇到明火发生爆炸,D项正确。
3.D 解析 常温下,铝与稀硫酸反应生成硫酸铝和氢气,而在常温下,铝在浓硫酸中发生钝化,不产生气体,A项错误;加热时,浓硫酸能与铜反应,而稀硫酸与铜不反应,B项错误;浓硫酸具有吸水性,能作为气体干燥剂,而稀硫酸不能,C项错误;无论浓硫酸还是稀硫酸,硫元素的化合价都是+6价,D项正确。
4.D 解析 A项和B项中硫元素的化合价不变,均生成硫酸盐,故浓硫酸只表现出酸性;C项中硫元素的化合价全部降低,未生成硫酸盐,故浓硫酸只表现出强氧化性;D项中有一部分硫元素的化合价降低,一部分硫元素的化合价不变,生成了SO2和硫酸盐,所以浓硫酸在该反应中既表现强氧化性又表现酸性。
5.答案 (1)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
(2)检验反应中有SO2气体生成 澄清石灰水变浑浊 CO2
(3)二氧化硫 还原
(4)无色溶液又恢复红色
解析 (1)浓硫酸具有强氧化性,在加热的条件下,能与炭反应生成CO2、SO2和水,反应的化学方程式为C+2H2SO4(浓)CO2↑+2SO2↑+2H2O。(2)A中品红褪色,可检验反应中有SO2气体生成;经过B装置中酸性高锰酸钾溶液除去SO2后,可通过洗气瓶C中品红溶液不褪色和D中澄清石灰水变浑浊,证明反应有CO2生成。(3)洗气瓶B中酸性高锰酸钾溶液颜色变浅,说明炭与浓硫酸反应的产物之一SO2具有还原性。(4)因SO2与品红生成了不稳定的无色物质,则A中品红溶液褪色后,再加热,溶液又恢复红色。
B级 关键能力提升练
6.B 解析 常温下铁、铝在浓硫酸中钝化,能用铁、铝容器盛放浓硫酸,A错误;浓硫酸和碳单质加热反应生成二氧化碳、二氧化硫和水,浓硫酸表现出强氧化性,B正确;浓硫酸具有脱水性,可以使蔗糖脱水炭化,C错误;滴加浓硫酸使胆矾由蓝色晶体变为无色粉末,胆矾变为无水硫酸铜,有新物质生成,属于化学变化,D错误。
7.D 解析 a处的紫色石蕊试液变红,原因是SO2溶于水生成了酸,说明SO2是酸性氧化物,A正确;b处品红溶液褪色,说明SO2具有漂白性,B正确;a、b、c处的现象,说明有SO2生成,从而说明浓硫酸具有强氧化性,C正确;浓硫酸具有吸水性,将反应生成的H2O吸收,导致试管底部出现无水CuSO4白色固体,反应中有H2O生成,D错误。
8.A 解析 反应①出现红棕色气体,说明产生Br2(g),Br-被氧化,反应②管口出现白雾,白雾是HCl的小液滴,Cl-没有被氧化,说明Br-的还原性强于Cl-,A项正确;反应③产生的气体为SO2,反应③发生Na2SO3+H2SO4(浓)Na2SO4+SO2↑+H2O,不属于氧化还原反应,不能说明Br2的氧化性强于SO2,B项错误;浓硫酸为高沸点酸,HCl易挥发,反应②利用高沸点酸制取低沸点酸,C项错误;③中反应不属于氧化还原反应,D项错误。
9.答案 (1)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
(2)品红溶液褪色 还原
(3)吸收尾气,防止污染空气 SO2+2OH-S+H2O
解析 (1)铜与浓硫酸在加热条件下发生反应生成硫酸铜、二氧化硫和水,反应的化学方程式为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。(2)SO2气体具有漂白性,能使品红溶液褪色,所以试管②品红溶液褪色;SO2气体具有还原性,可以被强氧化剂氧化为硫酸,若试管②中的试剂为酸性KMnO4溶液,实验时,观察到溶液褪色,是由于二氧化硫与酸性高锰酸钾溶液发生氧化还原反应而褪色,体现二氧化硫的还原性。(3)SO2是有毒气体,不能直接排放到空气中,由于SO2属于酸性氧化物,所以可用NaOH溶液进行尾气处理,反应的离子方程式为SO2+2OH-S+H2O。
10.答案 (1)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
(2)品红溶液褪色 用浸有NaOH溶液的棉花团塞在试管口 试剂瓶中液面下降,长颈漏斗中液面上升 D
(3)2FeO+4H2SO4(浓)Fe2(SO4)3+SO2↑+4H2O
解析 (1)Cu与浓硫酸反应需加热。(2)SO2能使品红溶液褪色,为防止环境污染,可用的简单方法是用浸有NaOH溶液的棉花团塞在试管口,即SO2+2NaOHNa2SO3+H2O。关闭K,装置内气体压强增大,B广口瓶内液面下降,长颈漏斗内液面上升。B中的液体应不能与SO2反应,而且要防止SO2的溶解。A项,Na2SO3+H2O+SO22NaHSO3;B项,酸性KMnO4溶液氧化SO2;C项,Br2+SO2+2H2O2HBr+H2SO4;D项,SO2难溶于饱和NaHSO3溶液。应选D。(3)依据得失电子守恒、元素守恒可写出反应的化学方程式。
C级 学科素养创新练
11.答案 (1)H2 随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2,Zn+H2SO4ZnSO4+H2↑
(2)①NaOH溶液(或其他合理答案) SO2+2OH-S+H2O ②浓硫酸,除去水蒸气 无水硫酸铜粉末,检验生成物中有水 ③装置E中玻璃管中黑色CuO粉末变红色,干燥管F中无水硫酸铜变蓝色 ④防止空气中的H2O进入干燥管而影响杂质气体的检验
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025苏教版化学必修第一册
分层作业23 硫酸的工业制备 浓硫酸的性质
A级必备知识基础练
1.下列关于物质的性质与用途具有对应关系的是( )
A.SO2具有氧化性,可用于漂白织物
B.NaCl易溶于水,可用于电解制备金属钠
C.浓硫酸具有吸水性,可用于干燥氢气
D.NaHCO3受热易分解,可用于治疗胃酸过多
2.硫酸厂有一辆存放过浓硫酸的铁槽车。某工人违反规程,边吸烟边用水冲洗铁槽车,结果发生了爆炸。下列对引起爆炸的原因说法正确的是( )
A.浓硫酸遇明火爆炸
B.浓硫酸遇水发热爆炸
C.铁与水(常温下)反应产生的氧化物爆炸
D.稀释后的硫酸与铁反应产生的氢气在空气中遇明火而爆炸
3.下列关于浓硫酸和稀硫酸的叙述正确的是( )
A.常温时都能与铝发生反应,放出气体
B.加热时都能与铜发生反应
C.都能作为气体干燥剂
D.硫元素的化合价都是+6价
4.下列反应中,浓硫酸既表现强氧化性又表现酸性的是( )
A.2NaCl+H2SO4(浓)Na2SO4+2HCl↑
B.Na2SO3+H2SO4(浓)Na2SO4+SO2↑+H2O
C.C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
D.Cu2O+3H2SO4(浓)2CuSO4+SO2↑+3H2O
5.某同学欲验证炭与浓硫酸反应产物的性质。现已将装置如图连接,请回答下列问题。
(1)烧瓶中发生反应的化学方程式是 。
(2)实验中两次使用到品红溶液,其目的不同。A的使用目的是 ,通过洗气瓶C中无现象和
的现象,证明反应有 (填化学式)生成。
(3)洗气瓶B中溶液颜色变浅,说明炭与浓硫酸反应的产物之一 (填名称)具有 性。
(4)实验完成后,取出洗气瓶A中的无色溶液于试管中,加热,可观察到 。
B级关键能力提升练
6.下列对浓硫酸的叙述正确的是( )
A.常温下不能用铁、铝容器盛放浓硫酸,因为铁、铝是活泼金属
B.浓硫酸和碳单质加热反应,表现出强氧化性
C.浓硫酸具有吸水性,可以使蔗糖脱水炭化
D.滴加浓硫酸使胆矾由蓝色晶体变为无色粉末,属于物理变化
7.若将铜丝插入热浓硫酸中进行如图(a~d均为浸有相应试液的棉花)所示的探究实验,下列分析不正确的是( )
A.a处变红,说明SO2是酸性氧化物
B.b处褪色,说明SO2具有漂白性
C.a、b、c处的现象,说明浓硫酸具有强氧化性
D.试管底部出现白色固体,说明反应中无H2O生成
8.浓硫酸分别和三种钠盐反应,下列分析正确的是( )
A.对比①和②可以说明还原性Br->Cl-
B.①和③相比可说明氧化性Br2>SO2
C.②中试管口白雾是HCl遇水蒸气所致,说明酸性H2SO4>HCl
D.③中浓硫酸被还原成SO2
9.某小组同学用如图所示装置进行铜与浓硫酸的反应,并探究产物的性质(夹持装置已略去)。
(1)试管①中反应的化学方程式是 。
(2)若试管②中的试剂为品红溶液,实验中观察到的现象是 。
若试管②中的试剂为酸性KMnO4溶液,实验时,观察到溶液褪色,则说明生成的气体具有 性。
(3)试管③中的试剂为NaOH溶液,其作用是 ,反应的离子方程式是 。
10.某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。
实验中某同学将a g铜片和12 mL 18 mol·L-1的浓硫酸放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余。
请回答:
(1)请写出Cu与浓硫酸反应的化学方程式: 。
(2)装置E中试管D内盛品红溶液,当C中气体收集满后,D中有可能观察到的现象是 。
实验装置E中D有可能造成环境污染,试用最简单方法加以解决(实验用品自选): 。
装置B的作用是储存多余的气体。当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是 。
B中应放置的液体是 (填字母)。
A.饱和Na2SO3溶液
B.酸性KMnO4溶液
C.浓溴水
D.饱和NaHSO3溶液
(3)浓硫酸的强氧化性有多种表现,如FeO放入浓硫酸中加热生成Fe2(SO4)3,反应的化学方程式是 。
C级学科素养创新练
11.实验室中需要22.4 L(标准状况)SO2气体。化学小组同学依据化学方程式Zn+2H2SO4(浓)ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓硫酸(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
(1)化学小组所制得的气体中混有的主要杂质气体可能是 (填分子式)。产生这种结果的主要原因是
(用化学方程式和必要的文字加以说明)。
(2)为证实相关分析,化学小组的同学设计了实验,组装了如下装置,对所制取的气体进行探究。
①装置B中加入的试剂是 ,反应的离子方程式为 。
②装置D加入的试剂及作用: ,装置F加入的试剂及作用: 。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有某杂质气体的实验现象是 。
④U形管G的作用为 。
分层作业23 硫酸的工业制备 浓硫酸的性质
A级 必备知识基础练
1.C 解析 SO2用于漂白纸浆,体现的是漂白性,A不正确;NaCl在熔融态能电离,可用于工业电解制备金属钠,B不正确;浓硫酸用于干燥氢气,体现的是吸水性,C正确;NaHCO3与胃酸发生反应,可用于治疗胃酸过多,D不正确。
2.D 解析 存放过浓硫酸的铁槽车,用水冲洗,稀释后的硫酸与铁反应产生氢气,氢气与空气混合,达到爆炸极限,遇到明火发生爆炸,D项正确。
3.D 解析 常温下,铝与稀硫酸反应生成硫酸铝和氢气,而在常温下,铝在浓硫酸中发生钝化,不产生气体,A项错误;加热时,浓硫酸能与铜反应,而稀硫酸与铜不反应,B项错误;浓硫酸具有吸水性,能作为气体干燥剂,而稀硫酸不能,C项错误;无论浓硫酸还是稀硫酸,硫元素的化合价都是+6价,D项正确。
4.D 解析 A项和B项中硫元素的化合价不变,均生成硫酸盐,故浓硫酸只表现出酸性;C项中硫元素的化合价全部降低,未生成硫酸盐,故浓硫酸只表现出强氧化性;D项中有一部分硫元素的化合价降低,一部分硫元素的化合价不变,生成了SO2和硫酸盐,所以浓硫酸在该反应中既表现强氧化性又表现酸性。
5.答案 (1)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
(2)检验反应中有SO2气体生成 澄清石灰水变浑浊 CO2
(3)二氧化硫 还原
(4)无色溶液又恢复红色
解析 (1)浓硫酸具有强氧化性,在加热的条件下,能与炭反应生成CO2、SO2和水,反应的化学方程式为C+2H2SO4(浓)CO2↑+2SO2↑+2H2O。(2)A中品红褪色,可检验反应中有SO2气体生成;经过B装置中酸性高锰酸钾溶液除去SO2后,可通过洗气瓶C中品红溶液不褪色和D中澄清石灰水变浑浊,证明反应有CO2生成。(3)洗气瓶B中酸性高锰酸钾溶液颜色变浅,说明炭与浓硫酸反应的产物之一SO2具有还原性。(4)因SO2与品红生成了不稳定的无色物质,则A中品红溶液褪色后,再加热,溶液又恢复红色。
B级 关键能力提升练
6.B 解析 常温下铁、铝在浓硫酸中钝化,能用铁、铝容器盛放浓硫酸,A错误;浓硫酸和碳单质加热反应生成二氧化碳、二氧化硫和水,浓硫酸表现出强氧化性,B正确;浓硫酸具有脱水性,可以使蔗糖脱水炭化,C错误;滴加浓硫酸使胆矾由蓝色晶体变为无色粉末,胆矾变为无水硫酸铜,有新物质生成,属于化学变化,D错误。
7.D 解析 a处的紫色石蕊试液变红,原因是SO2溶于水生成了酸,说明SO2是酸性氧化物,A正确;b处品红溶液褪色,说明SO2具有漂白性,B正确;a、b、c处的现象,说明有SO2生成,从而说明浓硫酸具有强氧化性,C正确;浓硫酸具有吸水性,将反应生成的H2O吸收,导致试管底部出现无水CuSO4白色固体,反应中有H2O生成,D错误。
8.A 解析 反应①出现红棕色气体,说明产生Br2(g),Br-被氧化,反应②管口出现白雾,白雾是HCl的小液滴,Cl-没有被氧化,说明Br-的还原性强于Cl-,A项正确;反应③产生的气体为SO2,反应③发生Na2SO3+H2SO4(浓)Na2SO4+SO2↑+H2O,不属于氧化还原反应,不能说明Br2的氧化性强于SO2,B项错误;浓硫酸为高沸点酸,HCl易挥发,反应②利用高沸点酸制取低沸点酸,C项错误;③中反应不属于氧化还原反应,D项错误。
9.答案 (1)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
(2)品红溶液褪色 还原
(3)吸收尾气,防止污染空气 SO2+2OH-S+H2O
解析 (1)铜与浓硫酸在加热条件下发生反应生成硫酸铜、二氧化硫和水,反应的化学方程式为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。(2)SO2气体具有漂白性,能使品红溶液褪色,所以试管②品红溶液褪色;SO2气体具有还原性,可以被强氧化剂氧化为硫酸,若试管②中的试剂为酸性KMnO4溶液,实验时,观察到溶液褪色,是由于二氧化硫与酸性高锰酸钾溶液发生氧化还原反应而褪色,体现二氧化硫的还原性。(3)SO2是有毒气体,不能直接排放到空气中,由于SO2属于酸性氧化物,所以可用NaOH溶液进行尾气处理,反应的离子方程式为SO2+2OH-S+H2O。
10.答案 (1)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
(2)品红溶液褪色 用浸有NaOH溶液的棉花团塞在试管口 试剂瓶中液面下降,长颈漏斗中液面上升 D
(3)2FeO+4H2SO4(浓)Fe2(SO4)3+SO2↑+4H2O
解析 (1)Cu与浓硫酸反应需加热。(2)SO2能使品红溶液褪色,为防止环境污染,可用的简单方法是用浸有NaOH溶液的棉花团塞在试管口,即SO2+2NaOHNa2SO3+H2O。关闭K,装置内气体压强增大,B广口瓶内液面下降,长颈漏斗内液面上升。B中的液体应不能与SO2反应,而且要防止SO2的溶解。A项,Na2SO3+H2O+SO22NaHSO3;B项,酸性KMnO4溶液氧化SO2;C项,Br2+SO2+2H2O2HBr+H2SO4;D项,SO2难溶于饱和NaHSO3溶液。应选D。(3)依据得失电子守恒、元素守恒可写出反应的化学方程式。
C级 学科素养创新练
11.答案 (1)H2 随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2,Zn+H2SO4ZnSO4+H2↑
(2)①NaOH溶液(或其他合理答案) SO2+2OH-S+H2O ②浓硫酸,除去水蒸气 无水硫酸铜粉末,检验生成物中有水 ③装置E中玻璃管中黑色CuO粉末变红色,干燥管F中无水硫酸铜变蓝色 ④防止空气中的H2O进入干燥管而影响杂质气体的检验
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
