鲁教版九年级化学下册8.2.3粗盐的提纯课件
文档属性
| 名称 | 鲁教版九年级化学下册8.2.3粗盐的提纯课件 |  | |
| 格式 | ppt | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-24 18:18:12 | ||
图片预览






文档简介
(共26张PPT)
第八章 海洋化学资源的利用
8.2.3 粗盐的提纯
情 境 导 入
8.2.3粗盐的提纯
海水“晒盐”得到的粗盐,往往含有可溶性杂质(如氯化镁、氯化钙等)和不溶性杂质(如泥沙等),必须对其进行分离和提纯,才能用于工业生产和人们的日常生活。
新 课 探 究
第一节
化学是一门以实验为基础的科学
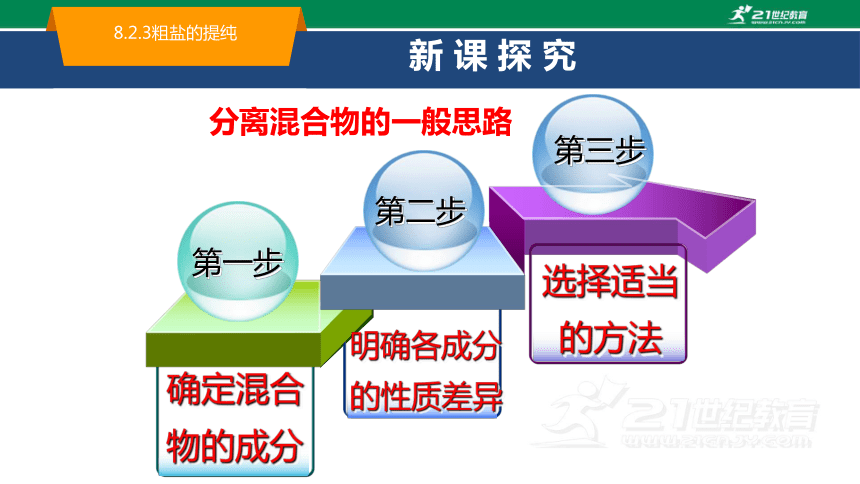
第一步
第二步
第三步
确定混合物的成分
明确各成分的性质差异
选择适当的方法
分离混合物的一般思路
8.2.3粗盐的提纯
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
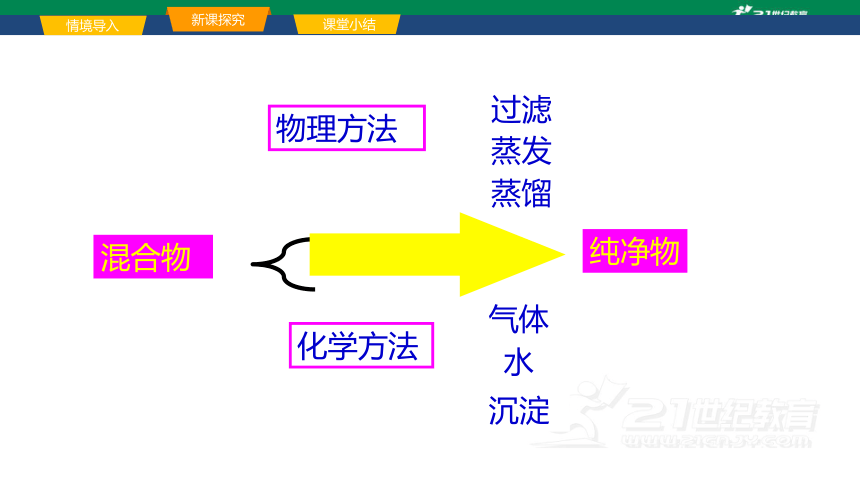
气体
化学方法
水
沉淀
物理方法
过滤
蒸发
蒸馏
纯净物
混合物
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
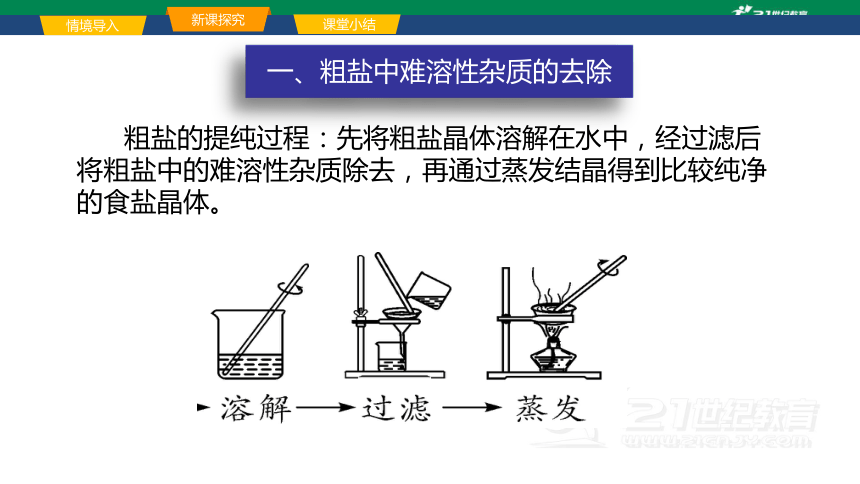
一、粗盐中难溶性杂质的去除
粗盐的提纯过程:先将粗盐晶体溶解在水中,经过滤后将粗盐中的难溶性杂质除去,再通过蒸发结晶得到比较纯净的食盐晶体。
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
1.玻璃棒的作用
溶解
过滤
蒸发
搅拌,加速溶解
引流
搅拌,防止因局部温度过高,造成液滴飞溅
2.蒸发时__________________________时停止加热。
目的:防止_____飞溅
3.停止加热后,用 取下蒸发皿,放在陶土网上
坩埚钳
待蒸发皿中出现较多固体时
晶体
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
4.可否用降温结晶的方法达到实验目的?
5.得到的精盐是否是纯净物
不可以,NaCl的溶解度随温度变化不大。
不是,溶解只去除了不溶性杂质,粗盐中还有可溶性杂质未去除。
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
二、粗盐中可溶性杂质的去除
除去不溶性杂质的食盐晶体中仍含有较多的可溶性杂质,可利用化学方法将它们除去。
优质大粒盐
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
除杂试剂的选择
NaCl(MgCl2、CaCl2、Na2SO4)
通过观察,我们可以看出的NaCl中离子是_____、_____.
所以我们要保留的就是钠离子和氯离子,其他离子就是杂质离子。
那么对于NaCl来说,MgCl2 杂质离子是______,
CaCl2 杂质离子是 ___________,
Na2SO4 杂质离子是 ___________,
因此,在不引入新杂质的前提下,我们一般
1.用_________除去 MgCl2;
2.用_________除去 CaCl2;
3.用_________除去Na2SO4。
NaOH
Na2CO3
BaCl2
Mg2+
Ca2+
SO4 2-
Na+
Cl-
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
CO32-
稀盐酸
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
试剂添加的顺序
向粗盐溶液中加入试剂的顺序:
(1)BaCl2——Na2CO3——NaOH——HCl
(2)BaCl2——NaOH——Na2CO3——HCl
(3)NaOH——BaCl2——Na2CO3——HCl
注意:
①Na2CO3一定要在BaCl2之后加入。
②稀盐酸一定要最后加入
③加盐酸之前要进行过滤。
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
除去难溶性杂质后的食盐水中还含有 SO42-、Ca2+ 和 Mg2+ 等杂质离子。为了除去这些杂质离子,应向食盐水中加入过量的氯化钡(BaCl2)、氢氧化钠(NaOH)和碳酸钠(Na2CO3)等物质,将杂质离子转化为沉淀。过滤除去沉淀后,再加入适量的盐酸,将溶液的 pH 调为 7,除去多余的 CO32- 和 OH-,得到精盐水,最后经蒸发结晶即得到较为纯净的氯化钠晶体。
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
方法 依据原理 举例
分离不溶性固体和液体
分离可溶性固体和液体
分离沸点不同的液体
将可溶性离子转化为沉淀
除去粗盐中的泥沙
净化黄泥水
海水晒盐
蒸馏海水
分离液态空气
石油分馏
海水富集镁
除去粗盐中可溶性杂质
分离溶解度受温度影响较大的可溶性物质
从硝酸钾溶液中获取硝酸钾
从食盐水中得到食盐
过滤
蒸发
蒸馏
化学
沉淀法
降温
结晶
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
三、从海水中提炼金属镁
海水“晒盐”后剩下的苦卤也是宝贵的化学资源,其中主要是由氯、钠、镁、硫、钙、钾、溴等元素组成的盐。向其中加入熟石灰,将苦卤中的氯化镁转化为氢氧化镁沉淀,向氢氧化镁中加入盐酸,可将氢氧化镁转化为氯化镁。在熔融状态的氯化镁中通入直流电,即可得到金属镁。
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
人们提取海水中的化学元素,来制备有多种用途的物质。如广泛用于火箭、导弹和飞机制造业的金属镁,就是利用从海水中提取的镁盐制取的。
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
海水 或卤水 MgCl2
氢氧 化镁 Mg(OH)2
氯化镁 MgCl2
镁 Mg
①石灰乳
②盐酸
③通电
通常将 加入海水或卤水中,沉淀出 ,该物质再与 反应生成 ,电解 状态的 ,就能制得金属镁。
石灰乳
氢氧化镁
盐酸
氯化镁
海水制镁的基本过程:
氯化镁
熔融
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
写出上述流程图中的化学方程式:
①______________
②______________
③______________
Mg(OH)2+2HCl=MgCl2+2H2O
通电
思考:
1. 海水提镁的过程中,为什么要将苦卤中的氯化镁先转化为氢氧化镁,再将氢氧化镁重新转化为氯化镁?
①除去其它杂质 ②将MgCl2富集起来
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
食盐是人体进行正常新陈代谢的必需品,是重要的调味品和食品添加剂。食盐还是制造烧碱、氯气、盐酸和纯碱等的基本原料,被广泛用于制造化学肥料、塑料、合成橡胶和染料等。
氯化钠
NaCl
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
食盐是人体进行正常新陈代谢的必需品,是重要的调味品和食品添加剂。
食盐还是制造烧碱、氯气、盐酸和纯碱等的基本原料,被广泛用于制造化学肥料、塑料、合成橡胶和染料等。
课 堂 小 结
一、粗盐中难溶性杂质的去除
二、粗盐中可溶性杂质的去除
三、从海水中提炼金属镁
8.2.3粗盐的提纯
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
1.下列有关“粗盐中难溶性杂质去除的实验”说法中正确的是( )
A.溶解:向水中逐渐加入粗盐时不断用玻璃棒搅拌
B.过滤:过滤时,有滤液贱出,会使精盐产率偏高
C.蒸发:蒸发时刚有固体开始析出,立即停止加热
D.量取:量取10mL水时为了方便选择100mL量筒
A
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
2.下列有关“粗盐中难溶性杂质去除的实验”说法中正确的是( )
A.取用粗盐 B.溶解粗盐
C.过滤 D.移走蒸发皿
B
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
3.通过溶解、过滤、蒸发等操作,可将下列固体混合物分离的是( )
A.硝酸钠和氢氧化钠
B.二氧化锰和氧化铜
C.氯化钾和二氧化锰
D.碳酸钾和氯化钙
C
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
4.下图是除去粗盐中难溶性杂质实验的三步操作。
①三步操作的正确顺序是________(填字母序号)。
②A中,用璃棒不断搅拌的目是___________ 。
B中,用璃棒不断搅拌的目是___________ 。
C中,用璃棒的目是___________。
ACB
防止因局部温度过高造成液滴飞溅
加速溶解
引流
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
5.(多选)为了除去粗盐中的氯化钙、硫酸镁及泥沙.可将粗盐溶于水,然后进行下列五项操作:①过滤,②加过量氢氧化钠溶液,③加适量盐酸,④加过量碳酸钠溶液 ⑤加过量氯化钡溶液.正确的操作顺序是( )
A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.⑤②④①③
点拨:
碳酸钠的目的是:除去粗盐中的氯化钙和所加过量的氯化钡,因此碳酸钠要加在氯化钡的后面;盐酸要加在过滤之后
C、D
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
6.若要除去粗盐中可溶性的杂质(MgCl2、CaCl2、Na2SO4),常用下面的流程来进一步提纯,下列说法正确的是( )
A.加入试剂a的顺序可以是过量的NaOH溶液、Na2CO3溶液、BaCl2溶液
B.加入盐酸时,若滤液中不再产生气泡,证明加入的盐酸适量
C.加入试剂a后将溶液 I过滤可得3种沉淀
D.操作b的名称为过滤
B
第八章 海洋化学资源的利用
8.2.3 粗盐的提纯
情 境 导 入
8.2.3粗盐的提纯
海水“晒盐”得到的粗盐,往往含有可溶性杂质(如氯化镁、氯化钙等)和不溶性杂质(如泥沙等),必须对其进行分离和提纯,才能用于工业生产和人们的日常生活。
新 课 探 究
第一节
化学是一门以实验为基础的科学
第一步
第二步
第三步
确定混合物的成分
明确各成分的性质差异
选择适当的方法
分离混合物的一般思路
8.2.3粗盐的提纯
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
气体
化学方法
水
沉淀
物理方法
过滤
蒸发
蒸馏
纯净物
混合物
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
一、粗盐中难溶性杂质的去除
粗盐的提纯过程:先将粗盐晶体溶解在水中,经过滤后将粗盐中的难溶性杂质除去,再通过蒸发结晶得到比较纯净的食盐晶体。
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
1.玻璃棒的作用
溶解
过滤
蒸发
搅拌,加速溶解
引流
搅拌,防止因局部温度过高,造成液滴飞溅
2.蒸发时__________________________时停止加热。
目的:防止_____飞溅
3.停止加热后,用 取下蒸发皿,放在陶土网上
坩埚钳
待蒸发皿中出现较多固体时
晶体
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
4.可否用降温结晶的方法达到实验目的?
5.得到的精盐是否是纯净物
不可以,NaCl的溶解度随温度变化不大。
不是,溶解只去除了不溶性杂质,粗盐中还有可溶性杂质未去除。
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
二、粗盐中可溶性杂质的去除
除去不溶性杂质的食盐晶体中仍含有较多的可溶性杂质,可利用化学方法将它们除去。
优质大粒盐
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
除杂试剂的选择
NaCl(MgCl2、CaCl2、Na2SO4)
通过观察,我们可以看出的NaCl中离子是_____、_____.
所以我们要保留的就是钠离子和氯离子,其他离子就是杂质离子。
那么对于NaCl来说,MgCl2 杂质离子是______,
CaCl2 杂质离子是 ___________,
Na2SO4 杂质离子是 ___________,
因此,在不引入新杂质的前提下,我们一般
1.用_________除去 MgCl2;
2.用_________除去 CaCl2;
3.用_________除去Na2SO4。
NaOH
Na2CO3
BaCl2
Mg2+
Ca2+
SO4 2-
Na+
Cl-
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
CO32-
稀盐酸
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
试剂添加的顺序
向粗盐溶液中加入试剂的顺序:
(1)BaCl2——Na2CO3——NaOH——HCl
(2)BaCl2——NaOH——Na2CO3——HCl
(3)NaOH——BaCl2——Na2CO3——HCl
注意:
①Na2CO3一定要在BaCl2之后加入。
②稀盐酸一定要最后加入
③加盐酸之前要进行过滤。
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
除去难溶性杂质后的食盐水中还含有 SO42-、Ca2+ 和 Mg2+ 等杂质离子。为了除去这些杂质离子,应向食盐水中加入过量的氯化钡(BaCl2)、氢氧化钠(NaOH)和碳酸钠(Na2CO3)等物质,将杂质离子转化为沉淀。过滤除去沉淀后,再加入适量的盐酸,将溶液的 pH 调为 7,除去多余的 CO32- 和 OH-,得到精盐水,最后经蒸发结晶即得到较为纯净的氯化钠晶体。
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
方法 依据原理 举例
分离不溶性固体和液体
分离可溶性固体和液体
分离沸点不同的液体
将可溶性离子转化为沉淀
除去粗盐中的泥沙
净化黄泥水
海水晒盐
蒸馏海水
分离液态空气
石油分馏
海水富集镁
除去粗盐中可溶性杂质
分离溶解度受温度影响较大的可溶性物质
从硝酸钾溶液中获取硝酸钾
从食盐水中得到食盐
过滤
蒸发
蒸馏
化学
沉淀法
降温
结晶
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
三、从海水中提炼金属镁
海水“晒盐”后剩下的苦卤也是宝贵的化学资源,其中主要是由氯、钠、镁、硫、钙、钾、溴等元素组成的盐。向其中加入熟石灰,将苦卤中的氯化镁转化为氢氧化镁沉淀,向氢氧化镁中加入盐酸,可将氢氧化镁转化为氯化镁。在熔融状态的氯化镁中通入直流电,即可得到金属镁。
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
人们提取海水中的化学元素,来制备有多种用途的物质。如广泛用于火箭、导弹和飞机制造业的金属镁,就是利用从海水中提取的镁盐制取的。
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
海水 或卤水 MgCl2
氢氧 化镁 Mg(OH)2
氯化镁 MgCl2
镁 Mg
①石灰乳
②盐酸
③通电
通常将 加入海水或卤水中,沉淀出 ,该物质再与 反应生成 ,电解 状态的 ,就能制得金属镁。
石灰乳
氢氧化镁
盐酸
氯化镁
海水制镁的基本过程:
氯化镁
熔融
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
写出上述流程图中的化学方程式:
①______________
②______________
③______________
Mg(OH)2+2HCl=MgCl2+2H2O
通电
思考:
1. 海水提镁的过程中,为什么要将苦卤中的氯化镁先转化为氢氧化镁,再将氢氧化镁重新转化为氯化镁?
①除去其它杂质 ②将MgCl2富集起来
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
食盐是人体进行正常新陈代谢的必需品,是重要的调味品和食品添加剂。食盐还是制造烧碱、氯气、盐酸和纯碱等的基本原料,被广泛用于制造化学肥料、塑料、合成橡胶和染料等。
氯化钠
NaCl
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
食盐是人体进行正常新陈代谢的必需品,是重要的调味品和食品添加剂。
食盐还是制造烧碱、氯气、盐酸和纯碱等的基本原料,被广泛用于制造化学肥料、塑料、合成橡胶和染料等。
课 堂 小 结
一、粗盐中难溶性杂质的去除
二、粗盐中可溶性杂质的去除
三、从海水中提炼金属镁
8.2.3粗盐的提纯
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
1.下列有关“粗盐中难溶性杂质去除的实验”说法中正确的是( )
A.溶解:向水中逐渐加入粗盐时不断用玻璃棒搅拌
B.过滤:过滤时,有滤液贱出,会使精盐产率偏高
C.蒸发:蒸发时刚有固体开始析出,立即停止加热
D.量取:量取10mL水时为了方便选择100mL量筒
A
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
2.下列有关“粗盐中难溶性杂质去除的实验”说法中正确的是( )
A.取用粗盐 B.溶解粗盐
C.过滤 D.移走蒸发皿
B
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
3.通过溶解、过滤、蒸发等操作,可将下列固体混合物分离的是( )
A.硝酸钠和氢氧化钠
B.二氧化锰和氧化铜
C.氯化钾和二氧化锰
D.碳酸钾和氯化钙
C
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
4.下图是除去粗盐中难溶性杂质实验的三步操作。
①三步操作的正确顺序是________(填字母序号)。
②A中,用璃棒不断搅拌的目是___________ 。
B中,用璃棒不断搅拌的目是___________ 。
C中,用璃棒的目是___________。
ACB
防止因局部温度过高造成液滴飞溅
加速溶解
引流
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
5.(多选)为了除去粗盐中的氯化钙、硫酸镁及泥沙.可将粗盐溶于水,然后进行下列五项操作:①过滤,②加过量氢氧化钠溶液,③加适量盐酸,④加过量碳酸钠溶液 ⑤加过量氯化钡溶液.正确的操作顺序是( )
A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.⑤②④①③
点拨:
碳酸钠的目的是:除去粗盐中的氯化钙和所加过量的氯化钡,因此碳酸钠要加在氯化钡的后面;盐酸要加在过滤之后
C、D
单击此处添加标题文本内容
新课探究
情境导入
课堂小结
6.若要除去粗盐中可溶性的杂质(MgCl2、CaCl2、Na2SO4),常用下面的流程来进一步提纯,下列说法正确的是( )
A.加入试剂a的顺序可以是过量的NaOH溶液、Na2CO3溶液、BaCl2溶液
B.加入盐酸时,若滤液中不再产生气泡,证明加入的盐酸适量
C.加入试剂a后将溶液 I过滤可得3种沉淀
D.操作b的名称为过滤
B
同课章节目录
