浙江卷__2025届高考化学仿真猜题卷(含解析)
文档属性
| 名称 | 浙江卷__2025届高考化学仿真猜题卷(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-24 01:08:49 | ||
图片预览



文档简介
2025届高考化学仿真猜题卷
化学(浙江专版) 分值:100分 时间:75分钟
一、选择题:本题共16小题,每小题3分,共48分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列说法正确的是( )
A.有较强的还原性,能用作葡萄酒的抗氧化剂
B.含的盐有挥发性,工业上常用“吹出法”从海水中提溴
C.具有强氧化性,故可用作呼吸面具的供氧剂
D.属于共价晶体,硬度大,可用作切削刀具
2.下列表示不正确的是( )
A.甘油的分子式:
B.的VSEPR模型:
C.用电子式表示HCl的形成过程:
D.乙二酸二乙酯的键线式:
3.下列说法不正确的是( )
A.具有吸水性,可用作食品干燥剂
B.NaClO具有强氧化性,其水溶液可用于消毒杀菌
C.SiC硬度大且化学性质稳定,可用于制作磨具
D.NaOH极易潮解,应密封保存
4.X、Y、Z、M、Q为五种短周期主族元素且原子序数依次增大。基态X原子中电子只有一种自旋方向;基态Y原子核外电子有5种空间运动状态,Y与Z同周期且相邻;Z与M均满足核外电子中s能级和p能级电子数相等;Q与Z形成的晶体具有手性。下列说法不正确的是( )
A.热稳定性:
B.电负性:Z>Y>X>M
C.X与Z无法形成非极性分子
D.第一电离能:M>Q
5.下列实验操作能达到实验目的的是( )
选项 实验操作 实验目的
A 向粗盐溶液中依次加入过量的溶液,过滤,再用盐酸中和滤液 除去粗盐中的
B 向盛装过澄清石灰水的空试剂瓶中加入稀硫酸,再用水清洗 清除试剂瓶内壁上的
C 将新制备的氯气依次通入浓硫酸、饱和食盐水 除杂并收集干燥的
D 将电石和水反应产生的气体通入酸性溶液中 证明具有还原性
A.A B.B C.C D.D
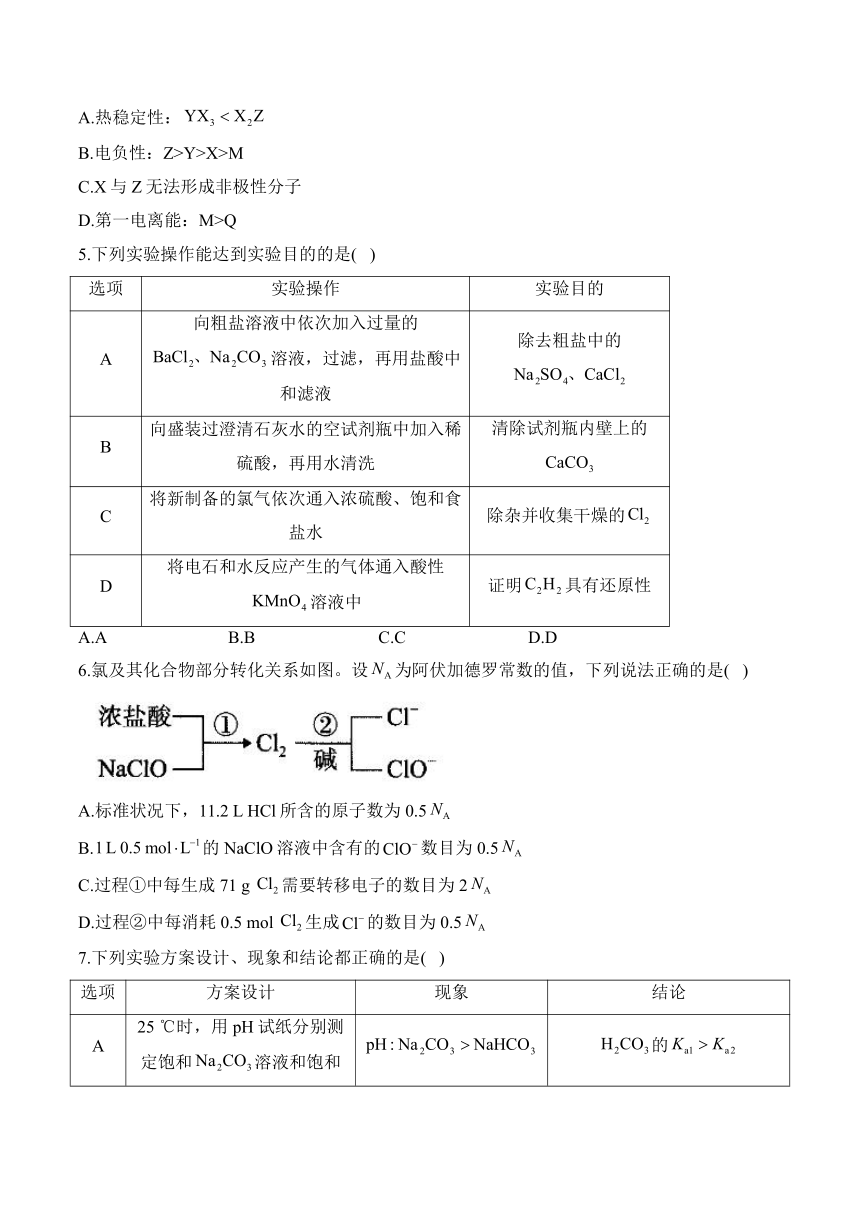
6.氯及其化合物部分转化关系如图。设为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2 L HCl所含的原子数为0.5
B.的NaClO溶液中含有的数目为0.5
C.过程①中每生成71 g 需要转移电子的数目为2
D.过程②中每消耗0.5 mol 生成的数目为0.5
7.下列实验方案设计、现象和结论都正确的是( )
选项 方案设计 现象 结论
A 25 ℃时,用pH试纸分别测定饱和溶液和饱和溶液的pH 的
B 将灼热的木炭投入浓硝酸中 有红棕色气体产生 浓硝酸能氧化木炭
C 向白葡萄酒中滴加几滴酸性 溶液紫色褪去 葡萄酒中含
D 向溶液中滴加2~4滴溶液,继续滴加4滴溶液 先出现白色沉淀,之后转化为红褐色
A.A B.B C.C D.D
8.下列化学方程式或离子方程式正确的是( )
A.实验室配制银氨溶液:
B.铅酸蓄电池充电时的阳极反应:
C.向溶液中通入过量的
D.向水杨酸溶液中加入少量碳酸钠:
9.某药物中间体的合成路径片段如图所示。下列说法正确的是( )
A.X、Y所含的官能团数目不同
B.Y分子中共面的原子数目最多为13
C.1 mol Y最多消耗7 mol NaOH
D.Y可发生消去、取代、加成、氧化反应
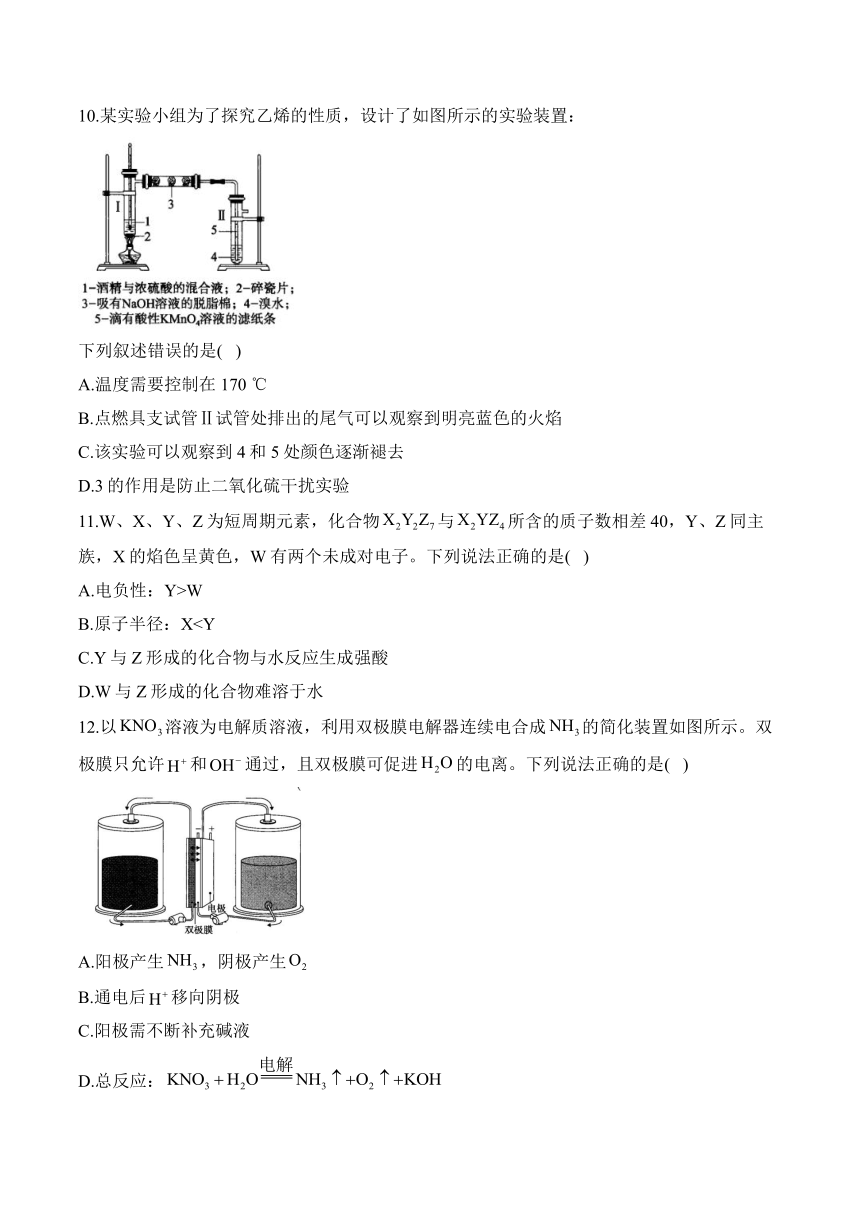
10.某实验小组为了探究乙烯的性质,设计了如图所示的实验装置:
下列叙述错误的是( )
A.温度需要控制在170 ℃
B.点燃具支试管Ⅱ试管处排出的尾气可以观察到明亮蓝色的火焰
C.该实验可以观察到4和5处颜色逐渐褪去
D.3的作用是防止二氧化硫干扰实验
11.W、X、Y、Z为短周期元素,化合物与所含的质子数相差40,Y、Z同主族,X的焰色呈黄色,W有两个未成对电子。下列说法正确的是( )
A.电负性:Y>W
B.原子半径:XC.Y与Z形成的化合物与水反应生成强酸
D.W与Z形成的化合物难溶于水
12.以溶液为电解质溶液,利用双极膜电解器连续电合成的简化装置如图所示。双极膜只允许和通过,且双极膜可促进的电离。下列说法正确的是( )
A.阳极产生,阴极产生
B.通电后移向阴极
C.阳极需不断补充碱液
D.总反应:
13.金铜合金Cu -Au,在低于395 ℃时形成图a所示的晶胞结构,在低于380 ℃时形成图b所示的晶胞结构,晶胞参数均为a nm,设为阿伏加德罗常数的值。下列说法正确的是( )
A.图a中x=0.75
B.图b所示晶胞对应合金的化学式为
C.图a、b中与Cu距离最近且相等的Au的数目均为4
D.图b晶体的密度为
14.某学习小组在研究二元弱酸与盐溶液反应时,进行了如下几组实验。
实验1:常温下,向饱和溶液中通入足量。
实验2:常温下,向的溶液中通入足量的。
已知:①常温下饱和溶液的浓度为;饱和溶液的浓度为,pH约为3.92;的。②的。
下列说法不正确的是( )
A.实验1中无白色沉淀生成
B.实验2中能观察到白色浑浊,且白色浑浊物中含有
C.实验2中
D.往实验2所得溶液中再滴加过量的H O 溶液,振荡出现大量白色沉淀,是因为
15.常温下,均可以与形成配位化合物,反应方程式为;。两种配合物中,更稳定。溶液中,与的关系如图所示。下列说法错误的是( )
A.
B.
C.中,提供孤电子对、提供空轨道,形成配位键
D.向等浓度的溶液中分别加入HCN,转化率相同时,溶液中更小
16.以菱锶矿(含80%~90% ,少量等)制备高纯碳酸锶的工艺流程如图:
已知:①和焦炭在高温下反应有CO生成。
②氢氧化锶在水中的溶解度随温度升高而增大。
下列叙述错误的是( )
A.“焙烧”过程中,与焦炭反应的化学方程式为
B.将热水更换成冰水混合物效果更好
C.滤渣中含有钙、镁化合物和焦炭
D.“沉锶”过程中不能通过加热到过高温度来加快反应速率
二、非选择题:本大题共4小题,共52分。
17.I.铜及其化合物在生产生活中有着重要的作用。请回答:
(1)如图是铜与氯形成的一种化合物的晶胞结构示意图,氯原子的配位数(距其最近且等距离的异种原子数)为________,该化合物的化学式为__________。将该物质溶于氨水并放置在空气中,会得到一种深蓝色溶液,请写出总反应的离子方程式_________。
(2)CuX(X代表Cl、Br、I)在水中的溶解度由CuCl到CuI逐渐减小,试从结构的角度进行解释________。
(3)与均可形成配位数为4的配离子,如等,为平面结构。下列说法正确的是_____。
A.加热时先失去结晶水
B.中Cu为杂化
C.含有键
D.配位键的稳定性:
(4)研究表明:当物质中含有未成对电子时,将该物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。和CuCl中具有顺磁性的物质是_____,理由是___
Ⅱ.黄铜矿主要成分是,还含有,以该黄铜矿为原料制备胆矾的流程如下:
(1)“滤渣Ⅱ”的主要成分为_______(填化学式)。
(2)设计实验方案检验滤液Ⅱ中是否含_________。
(3)方案___更符合环保要求,原因是_________。
18.脂肪胺是一类重要的基本有机化工原料,甲胺、二甲胺、三甲胺分别为,其合成路线如下:
反应I:
反应Ⅱ:
反应Ⅲ:
回答下列问题:
(1)写出以和为原料制备的热化学方程式:_________。
(2)298 K、101 kPa下,反应I、Ⅱ、Ⅲ均可自发进行的主要判断依据是___________。
(3)为提高反应I中CH OH的平衡转化率,可采取的措施有_________(填字母)。
A.增大压强
B.升高温度
C.增大投料比
D.恒温恒容充入Ar气
(4)已知,体系总压为,甲醇的平衡转化率为,只发生反应I(各组分均为气体),其平衡常数=________(为各物质分压代替浓度计算的平衡常数,用R、、表示)。
(5)400 ℃、3 MPa条件下改变R值,测得的物质的量分数如图所示,其中最有利于反应_________(填“I""Ⅱ”或“Ⅲ”,下同)的发生;提高R,可以提高反应________的选择性。
(6)不同反应温度与R下的绝热温升(放热反应中反应物完全转化时所放出的热量可以使物料升高的温度)如表所示,降低绝热温升的方法是升高温度、___________;请解释升高温度,绝热温升降低的原因:___________。
反应温度/C 进料R 反应压力/MPa 转化率/% 出料温度/℃ 绝热温升/℃
200 2.8 3 100 343.82 143.82
300 2.8 3 100 435.23 135.23
400 2.8 3 100 527.65 127.65
400 2.4 3 100 540.49 140.49
19.有机物I是治疗肠道疾病的一种药物,其合成路线如下:
已知:①
②(X代表卤素原子,下同)
③
请回答:
(1)化合物I中含氧官能团的名称为_________。
(2)化合物E的结构简式为____________。
(3)下列说法不正确的是_____。
A.化合物B应保存在无水的环境下
B.化合物C含1个手性碳原子
C.化合物H中的N与亚硝酸(HO—NO)中N的杂化方式相同
D.1 mol F最多可与1 mol NaOH反应
(4)写出C→D的化学方程式___________。
(5)设计以、甲醇和乙二醇为原料,合成的路线_________。(用流程图表示,无机试剂任选)
(6)写出5种同时符合下列要求的D的同分异构体的结构简式_________。
①含苯环,但不含其他环状结构
②核磁共振氢谱有3组峰
20.醋酸亚铬水合物(摩尔质量为)是常用的氧气吸收剂,为深红色晶体,沸点为117.1 ℃,难溶于冷水和乙醚,微溶于乙醇。实验室制备醋酸亚铬水合物的装置如图所示。
涉及的部分反应方程式如下:
I.
Ⅱ.
Ⅲ.
实验步骤:
①配制实验所需溶液,按照上图连接好仪器,检查装置气密性;
②在装置1中加入试剂a,装置2中加入过量锌丝和试剂b,装置3中加入溶液,装置4中加入水;
③……
④过滤、洗涤和干燥,获得。
请回答:
(1)仪器X的名称为________;试剂a是_______(填“盐酸”或“溶液”)。
(2)实验中须控制锌丝过量,其目的是________。
(3)下列说法不正确的是___________。
A.装置3中醋酸钠应过量,以保证产物的产率
B.用锌粉代替锌丝,增大固体接触面,实验效果更好
C.洗涤产品时,先用冷水洗涤,再用乙醚洗涤
D.装置4可用装有碱石灰的干燥管代替
(4)步骤③中,涉及的操作如下,请按操作的先后顺序进行排序:
步骤②→_________→反应一段时间,打开装置1的旋塞,向装置2中加入试剂a,充分反应→_______→装置3反应一段时间→________→装置3中有红色晶体析出。
a.止水夹A开,B开
b.止水夹A开,B关
c.止水夹A关,B开
d.止水夹A关,B关
e.将装置3置于冰水浴中冷却
f.往装置3中缓慢加入无水乙醇
(5)为测定产品纯度,取4.000 g样品在坩埚(空坩埚的质量为31.230 g)中灼烧成,在干燥器中冷却至恒重,最终测得坩埚总质量为32.750 g,已知灼烧过程中,杂质全部分解,则产品中的质量分数是________。
(6)隔绝低温干燥脱水可得,已知两个Cr原子化学环境相同,且之间存在共价键,结构中含有四个完全一样的五元环结构,则可推测中存在的化学键包括______(填序号)。
a.极性共价键 b.非极性共价键
c.离子键 d.金属键
e.配位键
答案以及解析
1.答案:D
解析:有极其难闻的气味,且是一种有剧毒气体,对人体健康有害,不能用作葡萄酒的抗氧化剂,A错误;被氧化为,具有挥发性,可用热空气吹出,B错误;能作呼吸面具的供氧剂是因为其能和或反应生成,C错误;是共价晶体,硬度大,故可用作切削刀具,D正确。
2.答案:C
解析:甘油(丙三醇)的分子式为,A正确;中中心原子N的价层电子对数为,孤电子对数为1,VSEPR模型为平面三角形,B正确;HCl为共价化合物,C错误;依据酯的命名及键线式书写规则,D正确。
3.答案:A
解析:有毒,与水反应会放出大量的热,并生成酸性较强的磷酸,故不能作食品干燥剂,A错误;NaClO具有强氧化性,可以使蛋白质变性,其水溶液可用于消毒杀菌,B正确;SiC是共价晶体,熔点高,硬度大,且化学性质稳定,可用于制作磨具,C正确;NaOH易吸水潮解,应密封保存,D正确。
4.答案:D
解析:第一步,根据题给信息推断各元素名称。
基态X原子中电子只有一种自旋方向→X为H
Q与Z(O)形成的晶体具有手性,在Al、Si、P、S、Cl的氧化物中,只有低温石英()以链状形式存在,有左旋和右旋两种结构,具有手性,则Q为Si。第二步,逐项分析。元素的非金属性越强,其简单氢化物的热稳定性越强,0的非金属性大于N,热稳定性,A正确;电负性O>N>H>Mg,B正确;H和O形成的和都是极性分子,C正确;Mg的第一电离能比Al大,但比Si小,D错误。
5.答案:A
解析:向粗盐溶液中先加入过量溶液除去硫酸根离子,再加入过量溶液除去钡离子和钙离子,然后加入盐酸除去碳酸根离子,A符合题意;硫酸钙微溶于水,生成的硫酸钙会覆盖在碳酸钙的表面,阻止反应继续发生,故不能完全清除,B不符合题意;新制备的氯气中含有氯化氢,可先用饱和食盐水除去氯化氢,再用浓硫酸干燥,最后收集,C不符合题意;电石中含CaS等杂质,与水反应生成还原性气体等,它们都能使酸性溶液褪色,不能确认具有还原性,D不符合题意。
6.答案:D
解析:标准状况下,HCl为气态,则11.2 L HCl的物质的量为0.5 mol,所含原子数为,A错误。NaClO溶液中的会水解,则溶液中含有的数目小于0.5,B错误。过程①发生反应的化学方程式为,可得关系:,则生成时,转移电子的数目为,C错误。过程②发生的反应为,可得关系:,则每消耗0.5 mol 时,生成的数目为0.5,D正确。
7.答案:D
解析:25 ℃时,的溶解度大于的溶解度,则二者饱和溶液中物质的量浓度不同,因此无法比较与的水解能力,A错误;将灼热的木炭投入浓硝酸中,有红棕色气体产生,浓硝酸受热分解也能产生,该现象不能证明浓硝酸能氧化木炭,B错误;白葡萄酒中的乙醇也能使酸性高锰酸钾溶液褪色,该实验不能证明葡萄酒中含,C错误;向溶液中滴加2~4滴溶液,继续滴加4滴溶液,白色沉淀转化为红褐色沉淀,说明的溶度积小于,D正确。
8.答案:C
解析:实验室配制银氨溶液时是向溶液中逐滴滴加氨水至沉淀恰好溶解,离子方程式为,A错误;铅酸蓄电池充电时,阳极的反应物是难溶的,离子方程式为,B错误;向溶液中通入过量的,离子方程式为,C正确;向水杨酸溶液中加入少量碳酸钠,水杨酸过量,—COOH优先与碳酸钠反应,离子方程式为,D错误。
9.答案:D
解析:X、Y中均含有5个官能团,A错误;Y分子中共面的原子数目最多为15(如图所示),B错误;1 mol Y分子中含有1 mol氯原子,可与1 mol氢氧化钠反应,1 mol Y分子中含有2 mol氟原子,氟原子与苯环直接相连,1 mol氟原子可以与2 mol氢氧化钠反应,则1 mol Y最多消耗5mol NaOH,C错误;Y中—OH可发生消去、取代、氧化反应,苯环可以发生加成反应,D正确。
10.答案:B
解析:温度过低会生成副产物乙醚,A叙述正确;尾气为未反应的乙烯,乙烯在空气中燃烧,火焰明亮且伴有黑烟,B叙述错误;乙烯可以与溴水发生加成反应、与酸性高锰酸钾溶液发生氧化反应而使二者颜色逐渐褪去,C叙述正确;酒精易与浓硫酸发生氧化还原反应,从而产生二氧化硫干扰乙烯性质的检验,3中的氢氧化钠溶液可以吸收乙烯中混有的二氧化硫气体,D叙述正确。
11.答案:A
解析:由综合推断可知,X为Na,Y为S,Z为O,W为C或Si,则电负性Y>W,原子半径X>Y,A正确,B错误;Y与Z形成的化合物可以是二氧化硫,二氧化硫与水反应生成,为弱酸,C错误;W与Z形成的化合物为CO、或,能溶于水,CO、均难溶于水,D错误。
12.答案:B
解析:由N元素化合价的变化可知,阴极电极反应式为,阳极电极反应式为,总反应为,阳极产生,阴极产生,A、D错误;在电解池中,通电后(阳离子)移向阴极,B正确;由阳极电极反应式可知,阳极不需要补充碱液,C错误。
13.答案:D
解析:根据“均摊法”可知,题图a晶胞中含有的Au原子的数目为,Cu原子的数目为,则题图a中晶胞的化学式为,根据,可得x=0.25,A错误;题图b晶胞中含有的Au原子的数目为,Cu原子的数目为,原子个数之比为Au:Cu=1:1,则题图b晶胞的化学式为CuAu,B错误;题图a中与Cu距离最近且相等的Au的数目为4,题图b中与Cu距离最近且相等的Au的数目为8,C错误;题图b晶体的密度,D正确。
14.答案:D
解析:第一步,提取关键信息。常温下饱和溶液的浓度为;饱和溶液的浓度为,pH约为3.92;的,,的,。第二步,结合关键信息,逐项分析和判断。根据已知信息①,第二步电离微弱,,结合表达式可以估算出,依据饱和溶液中的浓度,得出,可判断实验1中不能产生白色沉淀,A正确;同理可得出体系中,此时,可判断实验2中观察到的白色浑浊为,B正确;实验2中,根据电荷守恒得,因为足量,故溶液呈酸性,,且,代入上式可得,C正确;往实验2所得溶液中再滴加过量溶液,产生大量白色沉淀,可知发生反应,D错误。
15.答案:D
解析:由解题突破可知,,A说法正确;,B说法正确;为过渡金属阳离子,可以提供空轨道,中含孤电子对,二者可形成配位键,C说法正确;向等浓度的溶液中分别加入HCN,转化率相同时,根据元素质量守恒关系判断,,代入表达式可知,溶液中,浓度更大,D说法错误。
16.答案:B
解析:由题给已知①可知和焦炭反应有CO生成,故反应先发生的分解反应,生成的二氧化碳在高温下再与焦炭反应生成CO,总化学方程式为,A叙述正确;氢氧化钙在水中的溶解度随温度升高而降低,氢氧化锶在水中的溶解度随温度升高而增大,换成冰水混合物会有氢氧化钙杂质掺杂在晶体中,B叙述错误;碳酸钙受热分解生成氧化钙,氧化钙与水反应生成氢氧化钙,氢氧化钙微溶于水,碳酸镁受热分解生成氧化镁,氧化镁与热水反应较微弱,焦炭不与水反应,则滤渣中含有钙、镁化合物和焦炭,C叙述正确;碳酸氢铵受热易分解,温度过高,反应物浓度会减小,反应速率会减慢,D叙述正确。
17.答案:I.(1)4;CuCl;
(2)随着卤素的电负性依次减小,Cu与X形成的化学键的离子性依次减弱,共价性依次增强,在水中的溶解度依次减小
(3)AD
(4);的价层电子排布式为,含有5个未成对电子;的价层电子排布式为,不含未成对电子
Ⅱ.(1)和S
(2)取少量溶液于试管中,滴加铁氰化钾溶液,有蓝色沉淀生成,说明含有
(3)Ⅱ;方案I在空气中“煅烧”时会产生,方案Ⅱ未产生气体
解析:I.(1)第一步,分析晶胞结构中各粒子的位置。观察所给晶胞结构可知,氯原子位于晶胞的顶点和面心,铜原子位于晶胞体内。第二步,根据均摊法分析晶胞中粒子的个数。根据均摊法,每个晶胞中含有氯原子的个数为,含有铜原子的个数为4。第三步,根据粒子个数比得出晶体的化学式。该化合物的化学式为CuCl。每个氯原子的周围最近且距离相等的铜原子有4个,故氯原子的配位数为4。CuCl溶于氨水生成,在空气中不稳定,被氧化为,根据原子守恒、得失电子守恒和电荷守恒,反应的离子方程式为。
(2)随着卤素的电负性依次减小,Cu与X形成的化学键的离子性依次减弱,共价性依次增强,导致在水中的溶解度依次减小。
(3)中水分子以氢键形式结合,氨分子以配位键结合,配位键的强度强于氢键,故该晶体加热时先失去水分子,A正确;为平面结构,故Cu不是杂化,B错误;中H—O键为σ键,每个分子和中心也存在1个配位键(σ键),故含有12 mol σ键,C错误;O的电负性大于N,不易给出电子,说明结合会生成更稳定的配位键,配位键的稳定性:,D正确。
(4)的价层电子排布式为,含有5个未成对电子,具有顺磁性;的价层电子排布式为,不含未成对电子,不具有顺磁性。
Ⅱ.(1)方案Ⅱ“浸取”中发生反应,因此滤渣Ⅱ中含和S。
(2)滤液Ⅱ中含有,不可用氯水和KSCN溶液检验,可用铁氰化钾溶液检验。
(3)方案I在空气中“煅烧”时产生,不符合环保要求,方案Ⅱ未产生气体。
18.答案:(1)
(2)均为放热反应,有利于反应自发进行
(3)C
(4)
(5)Ⅲ;I
(6)增大R;升高温度,平衡逆向移动,逆反应为吸热反应,使体系温度降低
解析:(1)由盖斯定律可得热化学方程式。
(2)根据反应可自发进行判断反应的自发情况,几乎为0,因此<0有利于反应自发进行。
(3)反应前后气体化学计量数之和相同,增大压强,平衡不移动,A不符合题意;<0,升高温度,平衡逆向移动,B不符合题意;增大投料比,相当于增大的投入量,平衡正向移动,转化率提高,C符合题意;恒温恒容充入Ar气,平衡不移动,D不符合题意。
(4)根据,体系总压为,可得起始时的分压,的分压,已知甲醇的平衡转化率为,只发生反应I(各组分均为气体),列“三段式”得:
。
(5)由题图可知,的物质的量分数最大,最有利于反应Ⅲ的发生;提高R,的物质的量分数增大,故可以提高反应I的选择性。
(6)由题表中后2组数据可知,增大R,绝热温升减小;升高温度,平衡逆向移动,逆反应为吸热反应,使体系温度降低。
19.答案:(1)酰胺基、羟基
(2)
(3)BD
(4)
(5)
(6)
解析:(1)I中含氧官能团为酰胺基、羟基。
(2)结合F的分子式,F与反应得到G,可以推断G中的—COCl在F中应为—COOH,结合F的结构简式和E的分子式,可推出E的结构简式为。
(3)根据已知信息②知格氏试剂的C—Mg键非常活泼,极易和发生反应,所以化合物B应保存在无水的环境下,A正确;化合物C中没有手性碳原子,B错误;亚硝酸HO—NO中的N为杂化,化合物H中的N带1个单位的正电荷,形成了3个σ键,1个π键,无孤对电子,因此也为杂化,C正确;1 mol—COOH可消耗1 mol NaOH,1 mol—Br可消耗1 mol NaOH,故1 mol F最多消耗2 mol NaOH,D错误。
(5)分析目标产物的碳骨架可知,两个五元环来自,根据已知信息②可将转化为,六元环来自,通过将中的—CHO转化为—CHO,再利用转化为—,根据已知信息③,—再与格氏试剂反应、酸化可得到目标产物。但根据题给B→C反应可知,格氏试剂会和CO反应,所以在与格氏试剂反应前先需要对中的羰基进行保护,按照上述思路,逐步梳理即可写出合成路线。
(6)第一步,根据题给条件写出该同分异构体的分子式和不饱和度。D的分子式为,不饱和度为5。第二步,根据题给条件确定同分异构体中可能含有的结构。该同分异构体含有苯环,且不含其他环状结构,则还剩余1个不饱和度,可能存在或或核磁共振氢谱只有3组峰说明该分子结构高度对称。第三步,写出符合条件的同分异构体的结构简式。符合条件的同分异构体的结构简式有等。
20.答案:(1)恒压滴液漏斗;溶液
(2)Zn与HCl反应产生足够多的,将溶液压入装置3与溶液反应;与充分反应得到CrCl
(3)BD
(4)c;b;e
(5)94%
(6)abe
解析:(1)仪器X为恒压滴液漏斗;试剂a是溶液,因为先要使Zn和盐酸充分反应生成,将装置中的空气排尽后,再进行Zn和溶液的反应,以免生成的被氧气氧化。
(2)Zn过量,一方面是Zn和溶液反应,另一方面是保证能生成足够多的,后续将装置2中的液体压入装置3中。
(3)需过量,因为从装置2中压入装置3的溶液中可能含有未反应的盐酸,会消耗醋酸钠,A正确;实验操作中,需要利用气体压强将装置2中的反应液压入装置3中,如果改用Zn粉,则液体流动时,可能会将Zn粉一并压入装置3中,影响产品的纯度,B错误;根据题干信息可知,产物难溶于冷水和乙醚,先用冷水洗去无机盐杂质,再用易挥发的乙醚洗涤,能将产物表面的水分带走,利于产品的干燥,C正确;装置4中水的作用是液封,防止空气中的氧气进入,而碱石灰并不能吸收氧气,D错误。
(4)Zn与盐酸产生氢气,应该是止水夹A关,B开,让H 能从B处通往后面的装置,排尽装置内空气,待Zn和溶液反应后,止水夹A开,B关,随着装置2中压强逐渐增大,装置2中溶液被压入装置3中,待装置3中反应结束后,将装置3置于冰水浴中冷却结晶。
(5)第一步,根据题给条件分析产品中的质量。根据题给数据,灼烧后获得的质量为(32.750-31.230) g,其物质的量为,根据元素守恒,产物的质量为。第二步,计算产品中的质量分数。产品中的质量分数为。
(6)根据题给信息,Cr原子之间为非极性共价键而非金属键,与Cr原子之间形成配位键,中有非极性共价键。
化学(浙江专版) 分值:100分 时间:75分钟
一、选择题:本题共16小题,每小题3分,共48分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列说法正确的是( )
A.有较强的还原性,能用作葡萄酒的抗氧化剂
B.含的盐有挥发性,工业上常用“吹出法”从海水中提溴
C.具有强氧化性,故可用作呼吸面具的供氧剂
D.属于共价晶体,硬度大,可用作切削刀具
2.下列表示不正确的是( )
A.甘油的分子式:
B.的VSEPR模型:
C.用电子式表示HCl的形成过程:
D.乙二酸二乙酯的键线式:
3.下列说法不正确的是( )
A.具有吸水性,可用作食品干燥剂
B.NaClO具有强氧化性,其水溶液可用于消毒杀菌
C.SiC硬度大且化学性质稳定,可用于制作磨具
D.NaOH极易潮解,应密封保存
4.X、Y、Z、M、Q为五种短周期主族元素且原子序数依次增大。基态X原子中电子只有一种自旋方向;基态Y原子核外电子有5种空间运动状态,Y与Z同周期且相邻;Z与M均满足核外电子中s能级和p能级电子数相等;Q与Z形成的晶体具有手性。下列说法不正确的是( )
A.热稳定性:
B.电负性:Z>Y>X>M
C.X与Z无法形成非极性分子
D.第一电离能:M>Q
5.下列实验操作能达到实验目的的是( )
选项 实验操作 实验目的
A 向粗盐溶液中依次加入过量的溶液,过滤,再用盐酸中和滤液 除去粗盐中的
B 向盛装过澄清石灰水的空试剂瓶中加入稀硫酸,再用水清洗 清除试剂瓶内壁上的
C 将新制备的氯气依次通入浓硫酸、饱和食盐水 除杂并收集干燥的
D 将电石和水反应产生的气体通入酸性溶液中 证明具有还原性
A.A B.B C.C D.D
6.氯及其化合物部分转化关系如图。设为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2 L HCl所含的原子数为0.5
B.的NaClO溶液中含有的数目为0.5
C.过程①中每生成71 g 需要转移电子的数目为2
D.过程②中每消耗0.5 mol 生成的数目为0.5
7.下列实验方案设计、现象和结论都正确的是( )
选项 方案设计 现象 结论
A 25 ℃时,用pH试纸分别测定饱和溶液和饱和溶液的pH 的
B 将灼热的木炭投入浓硝酸中 有红棕色气体产生 浓硝酸能氧化木炭
C 向白葡萄酒中滴加几滴酸性 溶液紫色褪去 葡萄酒中含
D 向溶液中滴加2~4滴溶液,继续滴加4滴溶液 先出现白色沉淀,之后转化为红褐色
A.A B.B C.C D.D
8.下列化学方程式或离子方程式正确的是( )
A.实验室配制银氨溶液:
B.铅酸蓄电池充电时的阳极反应:
C.向溶液中通入过量的
D.向水杨酸溶液中加入少量碳酸钠:
9.某药物中间体的合成路径片段如图所示。下列说法正确的是( )
A.X、Y所含的官能团数目不同
B.Y分子中共面的原子数目最多为13
C.1 mol Y最多消耗7 mol NaOH
D.Y可发生消去、取代、加成、氧化反应
10.某实验小组为了探究乙烯的性质,设计了如图所示的实验装置:
下列叙述错误的是( )
A.温度需要控制在170 ℃
B.点燃具支试管Ⅱ试管处排出的尾气可以观察到明亮蓝色的火焰
C.该实验可以观察到4和5处颜色逐渐褪去
D.3的作用是防止二氧化硫干扰实验
11.W、X、Y、Z为短周期元素,化合物与所含的质子数相差40,Y、Z同主族,X的焰色呈黄色,W有两个未成对电子。下列说法正确的是( )
A.电负性:Y>W
B.原子半径:X
D.W与Z形成的化合物难溶于水
12.以溶液为电解质溶液,利用双极膜电解器连续电合成的简化装置如图所示。双极膜只允许和通过,且双极膜可促进的电离。下列说法正确的是( )
A.阳极产生,阴极产生
B.通电后移向阴极
C.阳极需不断补充碱液
D.总反应:
13.金铜合金Cu -Au,在低于395 ℃时形成图a所示的晶胞结构,在低于380 ℃时形成图b所示的晶胞结构,晶胞参数均为a nm,设为阿伏加德罗常数的值。下列说法正确的是( )
A.图a中x=0.75
B.图b所示晶胞对应合金的化学式为
C.图a、b中与Cu距离最近且相等的Au的数目均为4
D.图b晶体的密度为
14.某学习小组在研究二元弱酸与盐溶液反应时,进行了如下几组实验。
实验1:常温下,向饱和溶液中通入足量。
实验2:常温下,向的溶液中通入足量的。
已知:①常温下饱和溶液的浓度为;饱和溶液的浓度为,pH约为3.92;的。②的。
下列说法不正确的是( )
A.实验1中无白色沉淀生成
B.实验2中能观察到白色浑浊,且白色浑浊物中含有
C.实验2中
D.往实验2所得溶液中再滴加过量的H O 溶液,振荡出现大量白色沉淀,是因为
15.常温下,均可以与形成配位化合物,反应方程式为;。两种配合物中,更稳定。溶液中,与的关系如图所示。下列说法错误的是( )
A.
B.
C.中,提供孤电子对、提供空轨道,形成配位键
D.向等浓度的溶液中分别加入HCN,转化率相同时,溶液中更小
16.以菱锶矿(含80%~90% ,少量等)制备高纯碳酸锶的工艺流程如图:
已知:①和焦炭在高温下反应有CO生成。
②氢氧化锶在水中的溶解度随温度升高而增大。
下列叙述错误的是( )
A.“焙烧”过程中,与焦炭反应的化学方程式为
B.将热水更换成冰水混合物效果更好
C.滤渣中含有钙、镁化合物和焦炭
D.“沉锶”过程中不能通过加热到过高温度来加快反应速率
二、非选择题:本大题共4小题,共52分。
17.I.铜及其化合物在生产生活中有着重要的作用。请回答:
(1)如图是铜与氯形成的一种化合物的晶胞结构示意图,氯原子的配位数(距其最近且等距离的异种原子数)为________,该化合物的化学式为__________。将该物质溶于氨水并放置在空气中,会得到一种深蓝色溶液,请写出总反应的离子方程式_________。
(2)CuX(X代表Cl、Br、I)在水中的溶解度由CuCl到CuI逐渐减小,试从结构的角度进行解释________。
(3)与均可形成配位数为4的配离子,如等,为平面结构。下列说法正确的是_____。
A.加热时先失去结晶水
B.中Cu为杂化
C.含有键
D.配位键的稳定性:
(4)研究表明:当物质中含有未成对电子时,将该物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。和CuCl中具有顺磁性的物质是_____,理由是___
Ⅱ.黄铜矿主要成分是,还含有,以该黄铜矿为原料制备胆矾的流程如下:
(1)“滤渣Ⅱ”的主要成分为_______(填化学式)。
(2)设计实验方案检验滤液Ⅱ中是否含_________。
(3)方案___更符合环保要求,原因是_________。
18.脂肪胺是一类重要的基本有机化工原料,甲胺、二甲胺、三甲胺分别为,其合成路线如下:
反应I:
反应Ⅱ:
反应Ⅲ:
回答下列问题:
(1)写出以和为原料制备的热化学方程式:_________。
(2)298 K、101 kPa下,反应I、Ⅱ、Ⅲ均可自发进行的主要判断依据是___________。
(3)为提高反应I中CH OH的平衡转化率,可采取的措施有_________(填字母)。
A.增大压强
B.升高温度
C.增大投料比
D.恒温恒容充入Ar气
(4)已知,体系总压为,甲醇的平衡转化率为,只发生反应I(各组分均为气体),其平衡常数=________(为各物质分压代替浓度计算的平衡常数,用R、、表示)。
(5)400 ℃、3 MPa条件下改变R值,测得的物质的量分数如图所示,其中最有利于反应_________(填“I""Ⅱ”或“Ⅲ”,下同)的发生;提高R,可以提高反应________的选择性。
(6)不同反应温度与R下的绝热温升(放热反应中反应物完全转化时所放出的热量可以使物料升高的温度)如表所示,降低绝热温升的方法是升高温度、___________;请解释升高温度,绝热温升降低的原因:___________。
反应温度/C 进料R 反应压力/MPa 转化率/% 出料温度/℃ 绝热温升/℃
200 2.8 3 100 343.82 143.82
300 2.8 3 100 435.23 135.23
400 2.8 3 100 527.65 127.65
400 2.4 3 100 540.49 140.49
19.有机物I是治疗肠道疾病的一种药物,其合成路线如下:
已知:①
②(X代表卤素原子,下同)
③
请回答:
(1)化合物I中含氧官能团的名称为_________。
(2)化合物E的结构简式为____________。
(3)下列说法不正确的是_____。
A.化合物B应保存在无水的环境下
B.化合物C含1个手性碳原子
C.化合物H中的N与亚硝酸(HO—NO)中N的杂化方式相同
D.1 mol F最多可与1 mol NaOH反应
(4)写出C→D的化学方程式___________。
(5)设计以、甲醇和乙二醇为原料,合成的路线_________。(用流程图表示,无机试剂任选)
(6)写出5种同时符合下列要求的D的同分异构体的结构简式_________。
①含苯环,但不含其他环状结构
②核磁共振氢谱有3组峰
20.醋酸亚铬水合物(摩尔质量为)是常用的氧气吸收剂,为深红色晶体,沸点为117.1 ℃,难溶于冷水和乙醚,微溶于乙醇。实验室制备醋酸亚铬水合物的装置如图所示。
涉及的部分反应方程式如下:
I.
Ⅱ.
Ⅲ.
实验步骤:
①配制实验所需溶液,按照上图连接好仪器,检查装置气密性;
②在装置1中加入试剂a,装置2中加入过量锌丝和试剂b,装置3中加入溶液,装置4中加入水;
③……
④过滤、洗涤和干燥,获得。
请回答:
(1)仪器X的名称为________;试剂a是_______(填“盐酸”或“溶液”)。
(2)实验中须控制锌丝过量,其目的是________。
(3)下列说法不正确的是___________。
A.装置3中醋酸钠应过量,以保证产物的产率
B.用锌粉代替锌丝,增大固体接触面,实验效果更好
C.洗涤产品时,先用冷水洗涤,再用乙醚洗涤
D.装置4可用装有碱石灰的干燥管代替
(4)步骤③中,涉及的操作如下,请按操作的先后顺序进行排序:
步骤②→_________→反应一段时间,打开装置1的旋塞,向装置2中加入试剂a,充分反应→_______→装置3反应一段时间→________→装置3中有红色晶体析出。
a.止水夹A开,B开
b.止水夹A开,B关
c.止水夹A关,B开
d.止水夹A关,B关
e.将装置3置于冰水浴中冷却
f.往装置3中缓慢加入无水乙醇
(5)为测定产品纯度,取4.000 g样品在坩埚(空坩埚的质量为31.230 g)中灼烧成,在干燥器中冷却至恒重,最终测得坩埚总质量为32.750 g,已知灼烧过程中,杂质全部分解,则产品中的质量分数是________。
(6)隔绝低温干燥脱水可得,已知两个Cr原子化学环境相同,且之间存在共价键,结构中含有四个完全一样的五元环结构,则可推测中存在的化学键包括______(填序号)。
a.极性共价键 b.非极性共价键
c.离子键 d.金属键
e.配位键
答案以及解析
1.答案:D
解析:有极其难闻的气味,且是一种有剧毒气体,对人体健康有害,不能用作葡萄酒的抗氧化剂,A错误;被氧化为,具有挥发性,可用热空气吹出,B错误;能作呼吸面具的供氧剂是因为其能和或反应生成,C错误;是共价晶体,硬度大,故可用作切削刀具,D正确。
2.答案:C
解析:甘油(丙三醇)的分子式为,A正确;中中心原子N的价层电子对数为,孤电子对数为1,VSEPR模型为平面三角形,B正确;HCl为共价化合物,C错误;依据酯的命名及键线式书写规则,D正确。
3.答案:A
解析:有毒,与水反应会放出大量的热,并生成酸性较强的磷酸,故不能作食品干燥剂,A错误;NaClO具有强氧化性,可以使蛋白质变性,其水溶液可用于消毒杀菌,B正确;SiC是共价晶体,熔点高,硬度大,且化学性质稳定,可用于制作磨具,C正确;NaOH易吸水潮解,应密封保存,D正确。
4.答案:D
解析:第一步,根据题给信息推断各元素名称。
基态X原子中电子只有一种自旋方向→X为H
Q与Z(O)形成的晶体具有手性,在Al、Si、P、S、Cl的氧化物中,只有低温石英()以链状形式存在,有左旋和右旋两种结构,具有手性,则Q为Si。第二步,逐项分析。元素的非金属性越强,其简单氢化物的热稳定性越强,0的非金属性大于N,热稳定性,A正确;电负性O>N>H>Mg,B正确;H和O形成的和都是极性分子,C正确;Mg的第一电离能比Al大,但比Si小,D错误。
5.答案:A
解析:向粗盐溶液中先加入过量溶液除去硫酸根离子,再加入过量溶液除去钡离子和钙离子,然后加入盐酸除去碳酸根离子,A符合题意;硫酸钙微溶于水,生成的硫酸钙会覆盖在碳酸钙的表面,阻止反应继续发生,故不能完全清除,B不符合题意;新制备的氯气中含有氯化氢,可先用饱和食盐水除去氯化氢,再用浓硫酸干燥,最后收集,C不符合题意;电石中含CaS等杂质,与水反应生成还原性气体等,它们都能使酸性溶液褪色,不能确认具有还原性,D不符合题意。
6.答案:D
解析:标准状况下,HCl为气态,则11.2 L HCl的物质的量为0.5 mol,所含原子数为,A错误。NaClO溶液中的会水解,则溶液中含有的数目小于0.5,B错误。过程①发生反应的化学方程式为,可得关系:,则生成时,转移电子的数目为,C错误。过程②发生的反应为,可得关系:,则每消耗0.5 mol 时,生成的数目为0.5,D正确。
7.答案:D
解析:25 ℃时,的溶解度大于的溶解度,则二者饱和溶液中物质的量浓度不同,因此无法比较与的水解能力,A错误;将灼热的木炭投入浓硝酸中,有红棕色气体产生,浓硝酸受热分解也能产生,该现象不能证明浓硝酸能氧化木炭,B错误;白葡萄酒中的乙醇也能使酸性高锰酸钾溶液褪色,该实验不能证明葡萄酒中含,C错误;向溶液中滴加2~4滴溶液,继续滴加4滴溶液,白色沉淀转化为红褐色沉淀,说明的溶度积小于,D正确。
8.答案:C
解析:实验室配制银氨溶液时是向溶液中逐滴滴加氨水至沉淀恰好溶解,离子方程式为,A错误;铅酸蓄电池充电时,阳极的反应物是难溶的,离子方程式为,B错误;向溶液中通入过量的,离子方程式为,C正确;向水杨酸溶液中加入少量碳酸钠,水杨酸过量,—COOH优先与碳酸钠反应,离子方程式为,D错误。
9.答案:D
解析:X、Y中均含有5个官能团,A错误;Y分子中共面的原子数目最多为15(如图所示),B错误;1 mol Y分子中含有1 mol氯原子,可与1 mol氢氧化钠反应,1 mol Y分子中含有2 mol氟原子,氟原子与苯环直接相连,1 mol氟原子可以与2 mol氢氧化钠反应,则1 mol Y最多消耗5mol NaOH,C错误;Y中—OH可发生消去、取代、氧化反应,苯环可以发生加成反应,D正确。
10.答案:B
解析:温度过低会生成副产物乙醚,A叙述正确;尾气为未反应的乙烯,乙烯在空气中燃烧,火焰明亮且伴有黑烟,B叙述错误;乙烯可以与溴水发生加成反应、与酸性高锰酸钾溶液发生氧化反应而使二者颜色逐渐褪去,C叙述正确;酒精易与浓硫酸发生氧化还原反应,从而产生二氧化硫干扰乙烯性质的检验,3中的氢氧化钠溶液可以吸收乙烯中混有的二氧化硫气体,D叙述正确。
11.答案:A
解析:由综合推断可知,X为Na,Y为S,Z为O,W为C或Si,则电负性Y>W,原子半径X>Y,A正确,B错误;Y与Z形成的化合物可以是二氧化硫,二氧化硫与水反应生成,为弱酸,C错误;W与Z形成的化合物为CO、或,能溶于水,CO、均难溶于水,D错误。
12.答案:B
解析:由N元素化合价的变化可知,阴极电极反应式为,阳极电极反应式为,总反应为,阳极产生,阴极产生,A、D错误;在电解池中,通电后(阳离子)移向阴极,B正确;由阳极电极反应式可知,阳极不需要补充碱液,C错误。
13.答案:D
解析:根据“均摊法”可知,题图a晶胞中含有的Au原子的数目为,Cu原子的数目为,则题图a中晶胞的化学式为,根据,可得x=0.25,A错误;题图b晶胞中含有的Au原子的数目为,Cu原子的数目为,原子个数之比为Au:Cu=1:1,则题图b晶胞的化学式为CuAu,B错误;题图a中与Cu距离最近且相等的Au的数目为4,题图b中与Cu距离最近且相等的Au的数目为8,C错误;题图b晶体的密度,D正确。
14.答案:D
解析:第一步,提取关键信息。常温下饱和溶液的浓度为;饱和溶液的浓度为,pH约为3.92;的,,的,。第二步,结合关键信息,逐项分析和判断。根据已知信息①,第二步电离微弱,,结合表达式可以估算出,依据饱和溶液中的浓度,得出,可判断实验1中不能产生白色沉淀,A正确;同理可得出体系中,此时,可判断实验2中观察到的白色浑浊为,B正确;实验2中,根据电荷守恒得,因为足量,故溶液呈酸性,,且,代入上式可得,C正确;往实验2所得溶液中再滴加过量溶液,产生大量白色沉淀,可知发生反应,D错误。
15.答案:D
解析:由解题突破可知,,A说法正确;,B说法正确;为过渡金属阳离子,可以提供空轨道,中含孤电子对,二者可形成配位键,C说法正确;向等浓度的溶液中分别加入HCN,转化率相同时,根据元素质量守恒关系判断,,代入表达式可知,溶液中,浓度更大,D说法错误。
16.答案:B
解析:由题给已知①可知和焦炭反应有CO生成,故反应先发生的分解反应,生成的二氧化碳在高温下再与焦炭反应生成CO,总化学方程式为,A叙述正确;氢氧化钙在水中的溶解度随温度升高而降低,氢氧化锶在水中的溶解度随温度升高而增大,换成冰水混合物会有氢氧化钙杂质掺杂在晶体中,B叙述错误;碳酸钙受热分解生成氧化钙,氧化钙与水反应生成氢氧化钙,氢氧化钙微溶于水,碳酸镁受热分解生成氧化镁,氧化镁与热水反应较微弱,焦炭不与水反应,则滤渣中含有钙、镁化合物和焦炭,C叙述正确;碳酸氢铵受热易分解,温度过高,反应物浓度会减小,反应速率会减慢,D叙述正确。
17.答案:I.(1)4;CuCl;
(2)随着卤素的电负性依次减小,Cu与X形成的化学键的离子性依次减弱,共价性依次增强,在水中的溶解度依次减小
(3)AD
(4);的价层电子排布式为,含有5个未成对电子;的价层电子排布式为,不含未成对电子
Ⅱ.(1)和S
(2)取少量溶液于试管中,滴加铁氰化钾溶液,有蓝色沉淀生成,说明含有
(3)Ⅱ;方案I在空气中“煅烧”时会产生,方案Ⅱ未产生气体
解析:I.(1)第一步,分析晶胞结构中各粒子的位置。观察所给晶胞结构可知,氯原子位于晶胞的顶点和面心,铜原子位于晶胞体内。第二步,根据均摊法分析晶胞中粒子的个数。根据均摊法,每个晶胞中含有氯原子的个数为,含有铜原子的个数为4。第三步,根据粒子个数比得出晶体的化学式。该化合物的化学式为CuCl。每个氯原子的周围最近且距离相等的铜原子有4个,故氯原子的配位数为4。CuCl溶于氨水生成,在空气中不稳定,被氧化为,根据原子守恒、得失电子守恒和电荷守恒,反应的离子方程式为。
(2)随着卤素的电负性依次减小,Cu与X形成的化学键的离子性依次减弱,共价性依次增强,导致在水中的溶解度依次减小。
(3)中水分子以氢键形式结合,氨分子以配位键结合,配位键的强度强于氢键,故该晶体加热时先失去水分子,A正确;为平面结构,故Cu不是杂化,B错误;中H—O键为σ键,每个分子和中心也存在1个配位键(σ键),故含有12 mol σ键,C错误;O的电负性大于N,不易给出电子,说明结合会生成更稳定的配位键,配位键的稳定性:,D正确。
(4)的价层电子排布式为,含有5个未成对电子,具有顺磁性;的价层电子排布式为,不含未成对电子,不具有顺磁性。
Ⅱ.(1)方案Ⅱ“浸取”中发生反应,因此滤渣Ⅱ中含和S。
(2)滤液Ⅱ中含有,不可用氯水和KSCN溶液检验,可用铁氰化钾溶液检验。
(3)方案I在空气中“煅烧”时产生,不符合环保要求,方案Ⅱ未产生气体。
18.答案:(1)
(2)均为放热反应,有利于反应自发进行
(3)C
(4)
(5)Ⅲ;I
(6)增大R;升高温度,平衡逆向移动,逆反应为吸热反应,使体系温度降低
解析:(1)由盖斯定律可得热化学方程式。
(2)根据反应可自发进行判断反应的自发情况,几乎为0,因此<0有利于反应自发进行。
(3)反应前后气体化学计量数之和相同,增大压强,平衡不移动,A不符合题意;<0,升高温度,平衡逆向移动,B不符合题意;增大投料比,相当于增大的投入量,平衡正向移动,转化率提高,C符合题意;恒温恒容充入Ar气,平衡不移动,D不符合题意。
(4)根据,体系总压为,可得起始时的分压,的分压,已知甲醇的平衡转化率为,只发生反应I(各组分均为气体),列“三段式”得:
。
(5)由题图可知,的物质的量分数最大,最有利于反应Ⅲ的发生;提高R,的物质的量分数增大,故可以提高反应I的选择性。
(6)由题表中后2组数据可知,增大R,绝热温升减小;升高温度,平衡逆向移动,逆反应为吸热反应,使体系温度降低。
19.答案:(1)酰胺基、羟基
(2)
(3)BD
(4)
(5)
(6)
解析:(1)I中含氧官能团为酰胺基、羟基。
(2)结合F的分子式,F与反应得到G,可以推断G中的—COCl在F中应为—COOH,结合F的结构简式和E的分子式,可推出E的结构简式为。
(3)根据已知信息②知格氏试剂的C—Mg键非常活泼,极易和发生反应,所以化合物B应保存在无水的环境下,A正确;化合物C中没有手性碳原子,B错误;亚硝酸HO—NO中的N为杂化,化合物H中的N带1个单位的正电荷,形成了3个σ键,1个π键,无孤对电子,因此也为杂化,C正确;1 mol—COOH可消耗1 mol NaOH,1 mol—Br可消耗1 mol NaOH,故1 mol F最多消耗2 mol NaOH,D错误。
(5)分析目标产物的碳骨架可知,两个五元环来自,根据已知信息②可将转化为,六元环来自,通过将中的—CHO转化为—CHO,再利用转化为—,根据已知信息③,—再与格氏试剂反应、酸化可得到目标产物。但根据题给B→C反应可知,格氏试剂会和CO反应,所以在与格氏试剂反应前先需要对中的羰基进行保护,按照上述思路,逐步梳理即可写出合成路线。
(6)第一步,根据题给条件写出该同分异构体的分子式和不饱和度。D的分子式为,不饱和度为5。第二步,根据题给条件确定同分异构体中可能含有的结构。该同分异构体含有苯环,且不含其他环状结构,则还剩余1个不饱和度,可能存在或或核磁共振氢谱只有3组峰说明该分子结构高度对称。第三步,写出符合条件的同分异构体的结构简式。符合条件的同分异构体的结构简式有等。
20.答案:(1)恒压滴液漏斗;溶液
(2)Zn与HCl反应产生足够多的,将溶液压入装置3与溶液反应;与充分反应得到CrCl
(3)BD
(4)c;b;e
(5)94%
(6)abe
解析:(1)仪器X为恒压滴液漏斗;试剂a是溶液,因为先要使Zn和盐酸充分反应生成,将装置中的空气排尽后,再进行Zn和溶液的反应,以免生成的被氧气氧化。
(2)Zn过量,一方面是Zn和溶液反应,另一方面是保证能生成足够多的,后续将装置2中的液体压入装置3中。
(3)需过量,因为从装置2中压入装置3的溶液中可能含有未反应的盐酸,会消耗醋酸钠,A正确;实验操作中,需要利用气体压强将装置2中的反应液压入装置3中,如果改用Zn粉,则液体流动时,可能会将Zn粉一并压入装置3中,影响产品的纯度,B错误;根据题干信息可知,产物难溶于冷水和乙醚,先用冷水洗去无机盐杂质,再用易挥发的乙醚洗涤,能将产物表面的水分带走,利于产品的干燥,C正确;装置4中水的作用是液封,防止空气中的氧气进入,而碱石灰并不能吸收氧气,D错误。
(4)Zn与盐酸产生氢气,应该是止水夹A关,B开,让H 能从B处通往后面的装置,排尽装置内空气,待Zn和溶液反应后,止水夹A开,B关,随着装置2中压强逐渐增大,装置2中溶液被压入装置3中,待装置3中反应结束后,将装置3置于冰水浴中冷却结晶。
(5)第一步,根据题给条件分析产品中的质量。根据题给数据,灼烧后获得的质量为(32.750-31.230) g,其物质的量为,根据元素守恒,产物的质量为。第二步,计算产品中的质量分数。产品中的质量分数为。
(6)根据题给信息,Cr原子之间为非极性共价键而非金属键,与Cr原子之间形成配位键,中有非极性共价键。
同课章节目录
