【任务驱动式】第 2 章第 4 节羧酸 羧酸的衍生物-认识防腐家族 探秘苯甲酸 教学课件(共21张PPT)-鲁科版高中化学(2019)选择性必修 3
文档属性
| 名称 | 【任务驱动式】第 2 章第 4 节羧酸 羧酸的衍生物-认识防腐家族 探秘苯甲酸 教学课件(共21张PPT)-鲁科版高中化学(2019)选择性必修 3 |  | |
| 格式 | pptx | ||
| 文件大小 | 21.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-24 11:19:45 | ||
图片预览







文档简介
(共21张PPT)
《认识防腐家族》大单元项目
第二课时 探秘苯甲酸
——
第 2 章第 4 节《羧酸 羧酸的衍生物》
食品中的防腐剂
尼泊金乙酯
山梨酸及其盐
脱氢乙酸钠
苯 甲 酸 及 其 盐
双乙酸钠
亚硝酸盐
1.认识羧酸的组成和结构特点,借助电负性分析化学键中电荷的分布,预测羧酸的化学性质。(宏观辨识与微观探析)
2.总结并掌握醇、醛、羧酸、酯的转化关系及其在有机合成中的重要应用。(证据推理与模型认知)
3. 知道酯化反应的机理,并能熟练掌握酰胺、酰卤、酸酐等羧酸衍生物的结构特点。(科学探究与创新意识)
学习目标
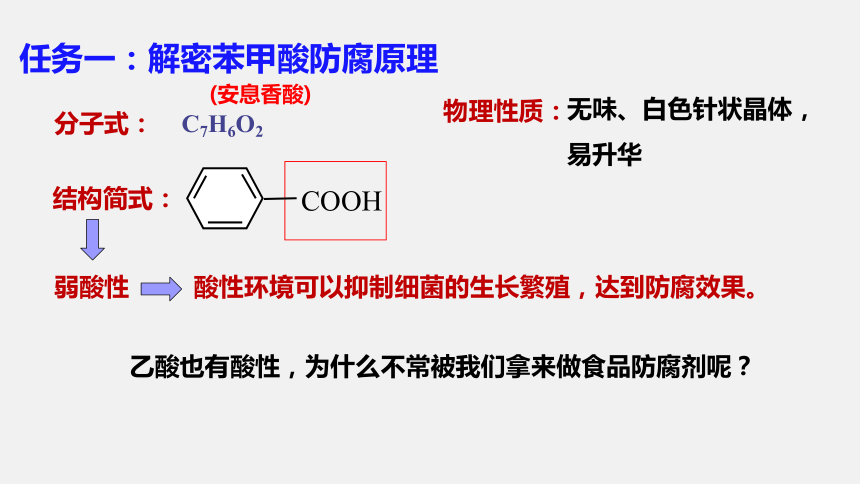
任务一:解密苯甲酸防腐原理
任务一:解密苯甲酸防腐原理
分子式:
结构简式:
(安息香酸)
C7H6O2
弱酸性
COOH
乙酸也有酸性,为什么不常被我们拿来做食品防腐剂呢?
物理性质:
无味、白色针状晶体,易升华
酸性环境可以抑制细菌的生长繁殖,达到防腐效果。
为什么苯甲酸分子可以进入到细胞膜内发挥作用呢?
任务一:解密苯甲酸防腐原理
溶 解 性:
—COOH 亲水性
分子式:
结构简式:
C7H6O2
亲脂性
(安息香酸)
羧酸:
官能团:
O
—C—OH
—COOH
羧基
O
R—C—OH
R:—H或烃基
微溶于水,易溶于有机溶剂
COOH
任务一:解密苯甲酸防腐原理
(疏水性)
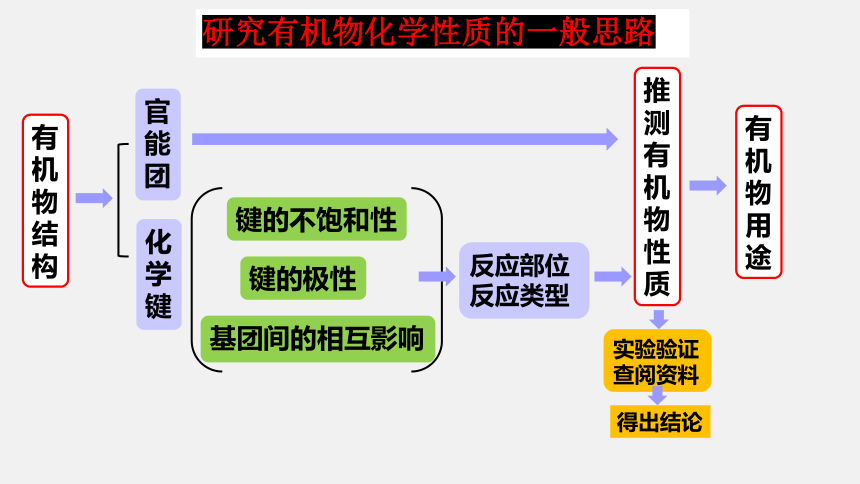
任务二:预测羧酸化学性质
有机物结构
官能团
化学键
键的不饱和性
键的极性
基团间的相互影响
反应部位
反应类型
推测有机物性质
有机物用途
实验验证
查阅资料
研究有机物化学性质的一般思路
得出结论
任务二:预测羧酸化学性质
请在羧酸的结构式中标出可能发生断键的部位,并推测可能发生的反应。
分析结构 预测性质
断裂C-O键,羟基被取代
断裂O-H键,具有酸性
断裂C=O键,可能发生加成反应
δ+
δ-
H
O
C
O
R
结 构 分 析
性 质 预 测
发 现 问 题
断裂C=O键
为什么羧基难以发生加成反应?
任务二:预测羧酸化学性质
(思考角度:苯为什么难以发生加成反应?)
体系能量低,难加成
形成共轭π键
结 构 分 析
性 质 预 测
发 现 问 题
断裂C=O键
羧基难以发生加成反应的原因
【 醛、羧酸中羰基的比较 】
任务二:预测羧酸化学性质
O
C
H
O
C
H
O
【归纳小结1】
羰基与O、N等原子连接时,会发生p-π共轭,使双键难以发生加成反应。
任务三:探究羧酸化学性质
任务三:探究羧酸化学性质
断裂O-H键,具有酸性
预测苯甲酸、乙酸、丙酸的酸性强弱顺序并解释原因。
交 流 研 讨
结 构 分 析
性 质 预 测
CH3
O
—C—OH
CH2
O
—C—OH
CH3
O
—C—OH
推电子基团
吸电子基团
H-O极性增强
H-O极性减弱
H-O极性减弱
苯甲酸>乙酸>丙酸
任务三:探究羧酸化学性质
断裂O-H键,具有酸性
【实验探究一】羧酸的酸性酸性强弱
将手持pH计分别测量 0.1 mol·L-1苯甲酸、乙酸、丙酸溶液中,记录仪器所示pH值,验证上述结论。
结 构 分 析
性 质 预 测
实 验 验 证
物质类别 苯甲酸 乙酸 丙酸
pH
【归纳小结2】
羧基连接吸电子基团时,氢氧键极性增强,酸性增强;羧基连接推电子基团时,氢氧键极性减弱,酸性减弱。
任务三:探究羧酸化学性质
苯甲酸及其盐只能在酸性环境中表现防腐作用,如果让羧基不再电离,是不是可以获得适用pH范围更广的防腐剂呢?
尼泊金乙酯
尼泊金酯的抗菌活性成分是其分子态,由于其分子中内的羧基已被酯化不再电离,在pH 4—8的范围内均有良好的杀菌效果
任务三:探究羧酸化学性质
原 理 探 究
RC-O-H+H-O-R′
浓硫酸
△
反应机理:
酸脱羟基,醇脱氢
证明方法:
同位素示踪法
O
断裂C-O键,羟基可能被取代
结 构 分 析
性 质 预 测
实 验 验 证
注意:
用针安全;
佩戴手套;
小心浓硫酸;
上口胶塞不可塞紧
任务三:探究羧酸化学性质
结 构 分 析
性 质 预 测
断裂C-O键,羟基可能被取代
拓 展 延 伸
写一写
O
R–C–O–H + NH3
=
RCOONH4
O
R–C–NH2
=
△
原 理 探 究
反应机理:
酸脱羟基,氨脱氢
酰 胺
乳酸链球菌素
聚赖氨酸
食品中的天然防腐剂
课堂小结
H
O
C
O
R
羟基取代
酸性
p-π共轭,难加成
酸性强弱比较
酯、酰胺等羧酸衍生物
相邻基团间的相互影响
抑菌防腐
有机物结构
有机物性质
有机物用途
官能团
化学键
实现
决定
课后作业:
1.请查阅资料,了解尼泊金酯类防腐剂的相关知识。
2.完成【课后巩固区】习题
《认识防腐家族》大单元项目
第二课时 探秘苯甲酸
——
第 2 章第 4 节《羧酸 羧酸的衍生物》
食品中的防腐剂
尼泊金乙酯
山梨酸及其盐
脱氢乙酸钠
苯 甲 酸 及 其 盐
双乙酸钠
亚硝酸盐
1.认识羧酸的组成和结构特点,借助电负性分析化学键中电荷的分布,预测羧酸的化学性质。(宏观辨识与微观探析)
2.总结并掌握醇、醛、羧酸、酯的转化关系及其在有机合成中的重要应用。(证据推理与模型认知)
3. 知道酯化反应的机理,并能熟练掌握酰胺、酰卤、酸酐等羧酸衍生物的结构特点。(科学探究与创新意识)
学习目标
任务一:解密苯甲酸防腐原理
任务一:解密苯甲酸防腐原理
分子式:
结构简式:
(安息香酸)
C7H6O2
弱酸性
COOH
乙酸也有酸性,为什么不常被我们拿来做食品防腐剂呢?
物理性质:
无味、白色针状晶体,易升华
酸性环境可以抑制细菌的生长繁殖,达到防腐效果。
为什么苯甲酸分子可以进入到细胞膜内发挥作用呢?
任务一:解密苯甲酸防腐原理
溶 解 性:
—COOH 亲水性
分子式:
结构简式:
C7H6O2
亲脂性
(安息香酸)
羧酸:
官能团:
O
—C—OH
—COOH
羧基
O
R—C—OH
R:—H或烃基
微溶于水,易溶于有机溶剂
COOH
任务一:解密苯甲酸防腐原理
(疏水性)
任务二:预测羧酸化学性质
有机物结构
官能团
化学键
键的不饱和性
键的极性
基团间的相互影响
反应部位
反应类型
推测有机物性质
有机物用途
实验验证
查阅资料
研究有机物化学性质的一般思路
得出结论
任务二:预测羧酸化学性质
请在羧酸的结构式中标出可能发生断键的部位,并推测可能发生的反应。
分析结构 预测性质
断裂C-O键,羟基被取代
断裂O-H键,具有酸性
断裂C=O键,可能发生加成反应
δ+
δ-
H
O
C
O
R
结 构 分 析
性 质 预 测
发 现 问 题
断裂C=O键
为什么羧基难以发生加成反应?
任务二:预测羧酸化学性质
(思考角度:苯为什么难以发生加成反应?)
体系能量低,难加成
形成共轭π键
结 构 分 析
性 质 预 测
发 现 问 题
断裂C=O键
羧基难以发生加成反应的原因
【 醛、羧酸中羰基的比较 】
任务二:预测羧酸化学性质
O
C
H
O
C
H
O
【归纳小结1】
羰基与O、N等原子连接时,会发生p-π共轭,使双键难以发生加成反应。
任务三:探究羧酸化学性质
任务三:探究羧酸化学性质
断裂O-H键,具有酸性
预测苯甲酸、乙酸、丙酸的酸性强弱顺序并解释原因。
交 流 研 讨
结 构 分 析
性 质 预 测
CH3
O
—C—OH
CH2
O
—C—OH
CH3
O
—C—OH
推电子基团
吸电子基团
H-O极性增强
H-O极性减弱
H-O极性减弱
苯甲酸>乙酸>丙酸
任务三:探究羧酸化学性质
断裂O-H键,具有酸性
【实验探究一】羧酸的酸性酸性强弱
将手持pH计分别测量 0.1 mol·L-1苯甲酸、乙酸、丙酸溶液中,记录仪器所示pH值,验证上述结论。
结 构 分 析
性 质 预 测
实 验 验 证
物质类别 苯甲酸 乙酸 丙酸
pH
【归纳小结2】
羧基连接吸电子基团时,氢氧键极性增强,酸性增强;羧基连接推电子基团时,氢氧键极性减弱,酸性减弱。
任务三:探究羧酸化学性质
苯甲酸及其盐只能在酸性环境中表现防腐作用,如果让羧基不再电离,是不是可以获得适用pH范围更广的防腐剂呢?
尼泊金乙酯
尼泊金酯的抗菌活性成分是其分子态,由于其分子中内的羧基已被酯化不再电离,在pH 4—8的范围内均有良好的杀菌效果
任务三:探究羧酸化学性质
原 理 探 究
RC-O-H+H-O-R′
浓硫酸
△
反应机理:
酸脱羟基,醇脱氢
证明方法:
同位素示踪法
O
断裂C-O键,羟基可能被取代
结 构 分 析
性 质 预 测
实 验 验 证
注意:
用针安全;
佩戴手套;
小心浓硫酸;
上口胶塞不可塞紧
任务三:探究羧酸化学性质
结 构 分 析
性 质 预 测
断裂C-O键,羟基可能被取代
拓 展 延 伸
写一写
O
R–C–O–H + NH3
=
RCOONH4
O
R–C–NH2
=
△
原 理 探 究
反应机理:
酸脱羟基,氨脱氢
酰 胺
乳酸链球菌素
聚赖氨酸
食品中的天然防腐剂
课堂小结
H
O
C
O
R
羟基取代
酸性
p-π共轭,难加成
酸性强弱比较
酯、酰胺等羧酸衍生物
相邻基团间的相互影响
抑菌防腐
有机物结构
有机物性质
有机物用途
官能团
化学键
实现
决定
课后作业:
1.请查阅资料,了解尼泊金酯类防腐剂的相关知识。
2.完成【课后巩固区】习题
