山东省青岛第五十八中学2024-2025学年高三下学期期中考试 化学试题(含答案)
文档属性
| 名称 | 山东省青岛第五十八中学2024-2025学年高三下学期期中考试 化学试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-24 21:24:50 | ||
图片预览



文档简介
2024-2025学年第二学期青岛58中高三期中考试化学试题
一、单项选择题(本题共10小题,每小题2分,共20分)
1.化学使生活更美好,下列说法错误的是( )
A.玻璃能制成规则外观的玻璃球是由于晶体的自范性
B.人体血浆中存在H2CO3/HCO3-的缓冲体系,可以避免体系pH出现大幅度变化
C.肥皂能去污是由于肥皂的主要成分中存在疏水基和亲水基
D.医用软膏中的“凡士林”,其主要成分是含碳原子数较多的烷烃
2.下列化学用语或图示正确的是( )
A.HCHO的核磁共振氢谱(右图)
B.丙炔的球棍模型为:
C.硼原子由1s22s22px1→1s22s22py1时,由基态转化为激发态,形成吸收光谱
D.NCl3的水解方程式可表示为:NCl3+3H2O=NH3+3HClO
3.类比推理是化学中常用的思维方法。下列推理正确的是( )
A.NH3能与HCl反应生成NH4Cl,则H2N-NH2也可以与HCl反应生成N2H6Cl2
B.CO2与Ca(ClO)2反应生成CaCO3和HClO,则CO2与NaClO反应生成Na2CO3和HClO
C.NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4加热可制HBr
D.Cl2与NaBr溶液反应生成Br2,推测F2与NaCl溶液反应生成Cl2
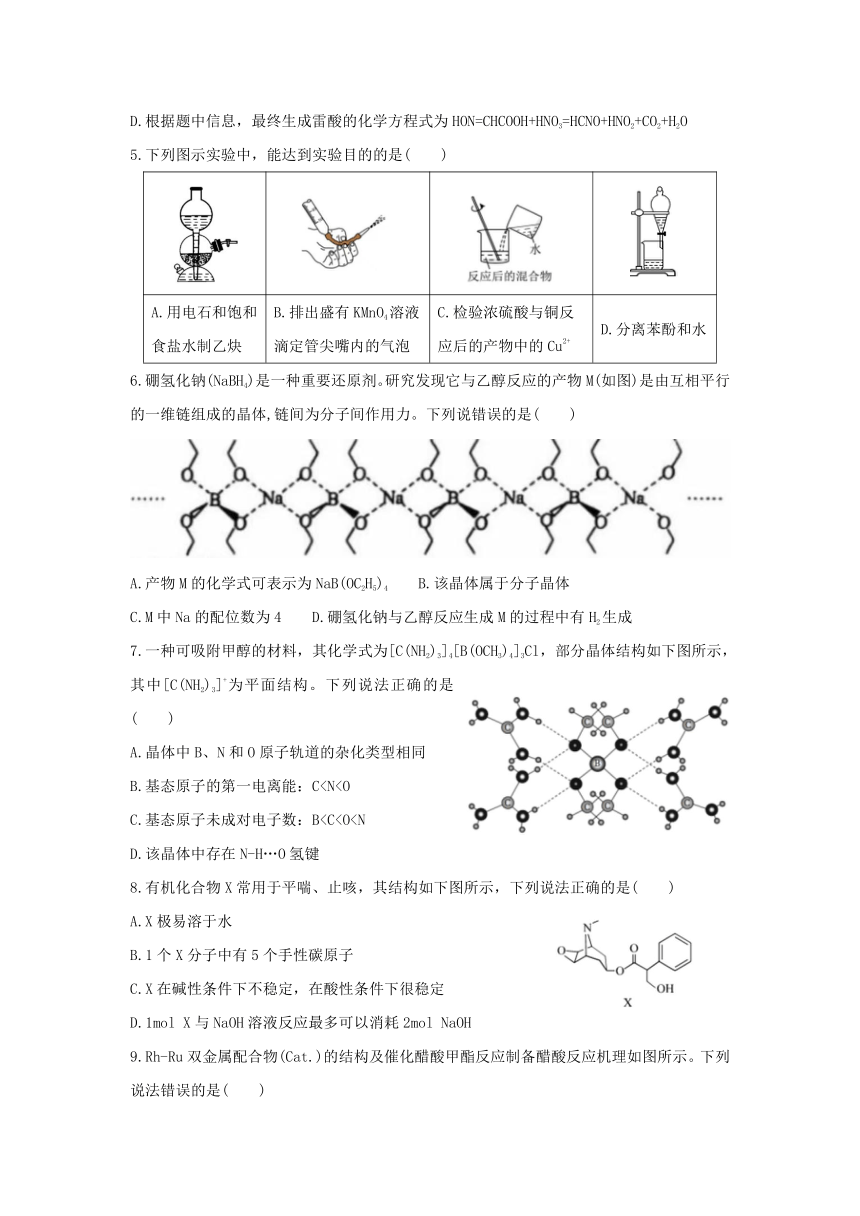
4.雷酸的分子式为HCNO,科学家分析其可能有两种结构:①C=N-OH或②H-C≡N=O,实验测得的经外光谱数据如下表。雷酸可由硝酸氧化乙醇制得,最终反应为中间产物肟基乙酸(HON=CHCOOH)与硝酸经历脱羧、脱亚硝酸可生成雷酸。下列说法错误的是( )
基团 频率/cm-1
C-H伸缩 3336
C=N伸缩 2196
N=O伸缩 1254
CNO弯曲 537
HCN弯曲 224
A.李比希法可以确定分子中各元素的最简比
B.质谱仪可以测定雷酸的相对分子质量
C.根据红外光谱数据可知,雷酸的结构为第①种
D.根据题中信息,最终生成雷酸的化学方程式为HON=CHCOOH+HNO3=HCNO+HNO2+CO2+H2O
5.下列图示实验中,能达到实验目的的是( )
A.用电石和饱和食盐水制乙炔 B.排出盛有KMnO4溶液滴定管尖嘴内的气泡 C.检验浓硫酸与铜反应后的产物中的Cu2+ D.分离苯酚和水
6.硼氢化钠(NaBH4)是一种重要还原剂。研究发现它与乙醇反应的产物M(如图)是由互相平行的一维链组成的晶体,链间为分子间作用力。下列说错误的是( )
A.产物M的化学式可表示为NaB(OC2H5)4 B.该晶体属于分子晶体
C.M中Na的配位数为4 D.硼氢化钠与乙醇反应生成M的过程中有H2生成
7.一种可吸附甲醇的材料,其化学式为[C(NH2)3]4[B(OCH3)4]3Cl,部分晶体结构如下图所示,其中[C(NH2)3]+为平面结构。下列说法正确的是( )
A.晶体中B、N和O原子轨道的杂化类型相同
B.基态原子的第一电离能:CC.基态原子未成对电子数:BD.该晶体中存在N-H…O氢键
8.有机化合物X常用于平喘、止咳,其结构如下图所示,下列说法正确的是( )
A.X极易溶于水
B.1个X分子中有5个手性碳原子
C.X在碱性条件下不稳定,在酸性条件下很稳定
D.1mol X与NaOH溶液反应最多可以消耗2mol NaOH
9.Rh-Ru双金属配合物(Cat.)的结构及催化醋酸甲酯反应制备醋酸反应机理如图所示。下列说法错误的是( )
A催化剂(Cat.)Rh、Ru均为4配位,且均为sp3杂化
B.催化剂(Cat.)中若Ru的化合价为+1,则Rh的化合价为+3,且反应过程中Ru的化合价始终保持不变
C.CH3COI和HI均为反应中间体,且反应①和②均为取代反应
D.总反应方程式可表示为CH3COOCH3+CO+H2O=2CH3COOH
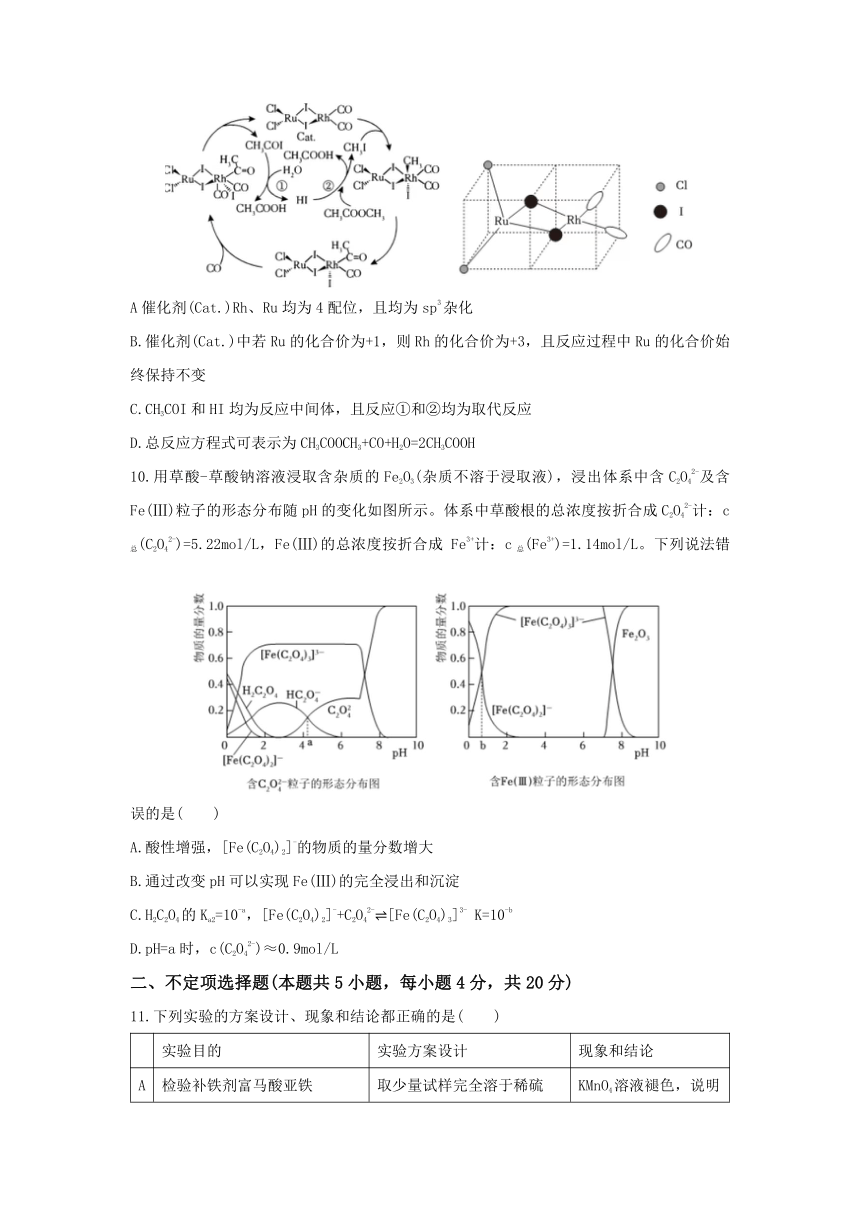
10.用草酸-草酸钠溶液浸取含杂质的Fe2O3(杂质不溶于浸取液),浸出体系中含C2O42-及含Fe(Ⅲ)粒子的形态分布随pH的变化如图所示。体系中草酸根的总浓度按折合成C2O42-计:c总(C2O42-)=5.22mol/L,Fe(Ⅲ)的总浓度按折合成 Fe3+计:c总(Fe3+)=1.14mol/L。下列说法错误的是( )
A.酸性增强,[Fe(C2O4)2]-的物质的量分数增大
B.通过改变pH可以实现Fe(Ⅲ)的完全浸出和沉淀
C.H2C2O4的Ka2=10-a,[Fe(C2O4)2]-+C2O42- [Fe(C2O4)3]3- K=10-b
D.pH=a时,c(C2O42-)≈0.9mol/L
二、不定项选择题(本题共5小题,每小题4分,共20分)
11.下列实验的方案设计、现象和结论都正确的是( )
实验目的 实验方案设计 现象和结论
A 检验补铁剂富马酸亚铁[(OOCCH=CHCOO)Fe]中的Fe2+ 取少量试样完全溶于稀硫酸,再滴加KMnO4溶液 KMnO4溶液褪色,说明该试样中存在Fe2+
B 探究淀粉水解程度 取2mL淀粉溶液,加入少量稀硫酸,加热2-3min,冷却后加入NaOH溶液至碱性,再滴加碘水 若溶液未变蓝色,说明淀粉已经完全水解
C 比较Ksp(CaSO4)与Ksp(CaCO3) 向饱和CaSO4溶液中滴加相同浓度的Na2CO3溶液 产生白色沉淀,说明Ksp(CaSO4)>Ksp(CaCO3)
D 比较配合物离子稳定性 向硫酸铜溶液中逐滴滴加氨水至过量 先生成蓝色沉淀后变为深蓝色溶液、说明稳定性[Cu(NH3)4]2+> [Cu(H2O)4]2-
12.继电器在控制电路中应用非常广泛,有一种新型继电器是以对电池的循环充放电实现自动离合(如图所示)。以下关于该继电器的说法中错误的是( )
已知:图中左电池的电极材料为纳米Fe2O3,另一极为金属锂和石墨的复合材料。
A.充电完成时,电池能被磁铁吸引
B.该电池电解液是非水溶剂
C.充电时,该电池正极的电极反应式为
3Li2O+2Fe-6e-=Fe2O3+6Li+
D.放电时,电解质溶液中Li+的浓度减少
13.一种海水提溴的部分工艺流程如图所示,下列说法错误的是( )
A.“氧化”和“转化”工序中Cl2的主要作用相同
B.水相Ⅱ中含有大量H+、Cl-、Br-和SO42-
C.理论上消耗R3N[ClBr2]与SO2的物质的量之比为2:1
D.“洗脱”工序发生的反应可表示为R3NBr+HCl R3NCl+HBr
14.硫代硫酸钠(Na2S2O3)能与人体内的重金属离子结合,减少其对身体的毒性影响。实验小组探究影响Na2S2O3溶液与含Cu2+溶液反应机理的因素做如下表实验。
查阅资料:Cu+不能稳定存在于水溶液中;Cu+与S2O32-形成的配位化合物为无色,Cu2+与S2O32-形成的配位化合物为黄色;叠色原理:黄+蓝=绿。
实验 滴管中试剂 试管中试剂 编号及现象
2mL 2.0mol/L Na2S2O3溶液 1mL 1.0mol/L CuSO4溶液,1mL H2O 实验a:溶液先变绿后变黄至接近无色,静置无变化
x mL 2.0mol/L Na2S2O3溶液 1mL 1.0mol/L CuSO4溶液, y mL H2O 实验b:溶液先变绿后变黄色,静置无变化
0.5mL 2.0mol/L Na2S2O3溶液 1mL 1.0mol/L CuSO4溶液,2.5mL H2O 实验c:溶液变为绿色,静置无变化
2mL 2.0mol/L Na2S2O3溶液 1mL 1.0mol/L CuCl2溶液,1mL H2O 实验d:溶液先变绿后变黄色,静置后很快出现白色沉淀,溶液颜色进一步变浅
下列说法正确的是( )
A.若保证n(Cu2+):n(S2O32-)=0.5,则表中数据 x=2,y=1
B.由实验a、b和c可知,随着n(Cu2+):n(S2O32-)的减小,发生氧化还原反应的趋势增大
C.由实验a和d可知,Cu+与Cl-生成沉淀的速率小于Cu+与S2O32-发生配合反应的速率
D.硫代硫酸钠能与铜的离子形成配合物是由于S有孤对电子,具有良好的配位能力
15.向恒容密闭容器中加入1mol CH4和一定量的H2O,发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)。CH4的平衡转化率按不同投料比x[x=n(CH4)/n(H2O)]随温度的变化曲线如图所示。下列说法错误的是( )
A.x1B.反应速率:Vb正C.点a、b、c对应的平衡常数:Ka<Kb=Kc
D.反应温度为T1,当容器内压强不变时,反应达到平衡状态
三、填空题(本题共5小题,每小题12 分,共 60分)
16.周期表中ⅡA 族元素包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)、镭(Ra),也称为碱土金属,这些元素单质及其化合物在生活、工业、医药等领域有重要的用途。
(1)下列铍元素的不同微粒,若再失去一个电子需要能量最大的是________(填字母)。
(2)镁元素所在周期,第一电离能大于镁的主族元素有____种。MgH2是一种具有良好的复合储氢材料之一,是一种单层的二维材料,二维晶胞俯视图如右图,MgH2中Mg的配位数为____。
(3)螯合钙比普通的补钙剂更容易被人体吸收,结构如左下图,其中∠1____∠2(填“>”、“<”或“=”),螯合物中非金属元素的杂化类型为____,所含元素电负性由大到小的顺序________。
(4)Ca与B组成的金属硼化物结构如右上图所示,硼原子全部组成B6正八面体,各个顶点通过 B-B键互相连接成三维骨架,具有立方晶系的对称性。该晶体的化学式为____。M 点原子的分数坐标为(1/2,1/2,1/2),已知B6八面体中B-B键的键长为r pm,晶胞参数为a pm,则N点原子的分数坐标为____,Ca 与最近 B原子间的距离d=____pm(列出计算式即可)。
17.荆芥内酯为中药荆芥的活性成分,可用作安眠药、抗痉挛药等,合成路径如下。
回答下列问题:
(1)A→B为取代反应,则A分子含有的官能团是________。D→E的反应类型________。
(2)E→F的化学方程式是___________________________________________。
(3)F→G的②及H→I的①的目的是__________________________________。
(4)H的结构简式为______________________。
(5)F的同分异构体中符合下列情况的有____种(不含立体异构);其中核磁共振氢谱峰面积比为1:2:2:2:9的结构简式为_____________________。
①含苯环且苯环上仅有两个取代基;②遇FeCl3溶液显紫色;
(6)以香茅醛为原料合成荆芥内酯的部分转化过程如下,写出中间产物M、N的结构简式____、____。
18.钪(Sc)是一种在国防、航空航天、 核能等领域具有重要作用的稀土元素。以钛白酸性废水(含Sc3+、TiO2+、Fe2+、Fe3+等离子)为原料制备Sc及TiO2的工艺流程如图所示:
已知:i.“萃取”前Sc3+、Fe2+、Fe3+浓度分别为0.010mol/L、0.001mol/L、0.001mol/L;当某离子的浓度小于1.0×10-5mol/L时,可忽略该离子的存在;
ii.HA代表有机萃取剂,X代表金属元素,萃取时发生反应xn++nHA XAn+nH+;
回答下列问题:
(1)“萃取"前需要调节废水的pH,pH太小或太大时,Sc3+的萃取率均不大的原因________。
(2)“洗涤”过程中加入H2O2溶液的作用为____________________________。
(3)“溶解富集"后,金属离子浓度变为原来的12.5倍,则调溶液pH时范围为______,可实现铁元素和钪元素的究全分离。常温下,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Sc(OH)3]=1.0×10-30,Ksp[Fe(OH)2]=4.9×10-17,lg2=0.3。
(4)“热还原”时得到钪和另一产物M,用惰性电极电解M溶液时,阴极的电极反应式为_______。
(5)“转化”过程中氧化剂和还原剂物质的量之比为________。
(6)“沉钛”过程发生反应的化学方程式为___________________________________________。
(7)该流程中能够循环利用的物质有_____________。(填化学式)
19.硫化钠主要用于皮革、毛纺、高档纸张、染料等行业。回答下列问题:
(1)工业上常用芒硝(Na2SO4·10H2O)和煤粉在高温下生产硫化钠,同时生成CO,该反应的化学方程式为____________________。工业生产的硫化钠粗品中常含有一定量的煤灰及重金属硫化物等杂质。硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇。实验室中常用95%乙醇重结晶纯化硫化钠粗品。
(2)仪器a的名称________。
(3)溶解回流装置如图所示,回流前无需加入沸石,其原因是_______。
(4)回流结束后,需进行的操作有①停止加热、②关闭冷凝水、③移去水浴,正确的顺序为____(填标号)。
a.①②③ b.③①② c.②①③ d.①③②
(5)Na2S中S2-的含量可以用“碘量法”测得。称量a g Na2S样品,置于碘量瓶中,接着移取50mL 0.100mol/L的I2-KI溶液于其中,往碘量瓶中加入乙酸溶液,密闭,置黑暗处反应5min,有单质S析出。以淀粉溶液为指示剂,过量的I2用0.10mol/L的Na2S2O3溶液滴定,反应式为I2+2S2O32-=2I-+S4O62-。测定时消耗Na2S2O3溶液的体积为V mL。终点现象为__________,样品中S2-的质量分数为_____________________(写出表达式)。
(6)皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图所示)。为使除汞效果最佳,应控制的条件是x=_______、pH在__________范围内。
20.CO2催化加氢既有利于“碳中和”,又能得到重要的能源甲醇。CO2催化加氢过程中发生的主要反应如下(K1、K2、K3为平衡常数):
Ⅰ.CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49kJ/mol K1
Ⅱ.CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2 K2
Ⅲ.CO(g)+2H2(g)=CH3OH(g) ΔH3=-90kJ/mol K3
回答下列问题:
(1)标准摩尔生成焓的定义为“由标准状态的单质生成1mol化合物的焓变”,部分物质的标准摩尔生成焓数据如下表:
物质 CO2(g) H2(g) CO(g) CH3OH(g)
标准摩尔生成焓/(kJ/mol) -393.5 0 -110.5 x
则CH3OH(g)的标准摩尔生成焓x= ;升高温度时,K1/K3的值 (填“增大”、“减小”或“不变”)。
(2)研究表明,反应的速率方程为v=k[x(CO2)·x(H2)-x(CO)·x(H2O)·Kp],x表示气体的物质的量分数,Kp为压强平衡常数,k为反应的速率常数。其他条件一定时,反应速率随温度的变化如图1所示,根据速率方程分析,T>T0时,v逐渐增大的原因是 。反应Ⅰ的速率方程v 正=k正c(CO2)·c3(H2),v 逆=k逆c(CH3OH)·c(H2O),图2表示该反应的速率常数k正、k逆的对数lgk与温度的倒数1/T之间的关系,则直线 (填“A”或“B”)表示 lgk逆与1/T的关系。
(3)在保持3.0MPa条件下,将3mol H2,1mol CO2的气体通入装有某催化剂的密闭容器充分反应,甲醇的选择性[n(生成CH3OH)/n(消耗CO2)x100%]、CO的选择性、CO2的平衡转化率随温度变化如图3所示。250℃时达平衡,混合气体总的物质的量为 ,该条件下反应Ⅰ的物质的量分数平衡常数Kx= ,若在该温度下缩小容器体积,三个反应均达到新平衡时,n(CO)/n(CO2)的值____(填“增大”、“减小”或“不变”)。
一、单项选择题(本题共10小题,每小题2分,共20分)
1.化学使生活更美好,下列说法错误的是( )
A.玻璃能制成规则外观的玻璃球是由于晶体的自范性
B.人体血浆中存在H2CO3/HCO3-的缓冲体系,可以避免体系pH出现大幅度变化
C.肥皂能去污是由于肥皂的主要成分中存在疏水基和亲水基
D.医用软膏中的“凡士林”,其主要成分是含碳原子数较多的烷烃
2.下列化学用语或图示正确的是( )
A.HCHO的核磁共振氢谱(右图)
B.丙炔的球棍模型为:
C.硼原子由1s22s22px1→1s22s22py1时,由基态转化为激发态,形成吸收光谱
D.NCl3的水解方程式可表示为:NCl3+3H2O=NH3+3HClO
3.类比推理是化学中常用的思维方法。下列推理正确的是( )
A.NH3能与HCl反应生成NH4Cl,则H2N-NH2也可以与HCl反应生成N2H6Cl2
B.CO2与Ca(ClO)2反应生成CaCO3和HClO,则CO2与NaClO反应生成Na2CO3和HClO
C.NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4加热可制HBr
D.Cl2与NaBr溶液反应生成Br2,推测F2与NaCl溶液反应生成Cl2
4.雷酸的分子式为HCNO,科学家分析其可能有两种结构:①C=N-OH或②H-C≡N=O,实验测得的经外光谱数据如下表。雷酸可由硝酸氧化乙醇制得,最终反应为中间产物肟基乙酸(HON=CHCOOH)与硝酸经历脱羧、脱亚硝酸可生成雷酸。下列说法错误的是( )
基团 频率/cm-1
C-H伸缩 3336
C=N伸缩 2196
N=O伸缩 1254
CNO弯曲 537
HCN弯曲 224
A.李比希法可以确定分子中各元素的最简比
B.质谱仪可以测定雷酸的相对分子质量
C.根据红外光谱数据可知,雷酸的结构为第①种
D.根据题中信息,最终生成雷酸的化学方程式为HON=CHCOOH+HNO3=HCNO+HNO2+CO2+H2O
5.下列图示实验中,能达到实验目的的是( )
A.用电石和饱和食盐水制乙炔 B.排出盛有KMnO4溶液滴定管尖嘴内的气泡 C.检验浓硫酸与铜反应后的产物中的Cu2+ D.分离苯酚和水
6.硼氢化钠(NaBH4)是一种重要还原剂。研究发现它与乙醇反应的产物M(如图)是由互相平行的一维链组成的晶体,链间为分子间作用力。下列说错误的是( )
A.产物M的化学式可表示为NaB(OC2H5)4 B.该晶体属于分子晶体
C.M中Na的配位数为4 D.硼氢化钠与乙醇反应生成M的过程中有H2生成
7.一种可吸附甲醇的材料,其化学式为[C(NH2)3]4[B(OCH3)4]3Cl,部分晶体结构如下图所示,其中[C(NH2)3]+为平面结构。下列说法正确的是( )
A.晶体中B、N和O原子轨道的杂化类型相同
B.基态原子的第一电离能:C
8.有机化合物X常用于平喘、止咳,其结构如下图所示,下列说法正确的是( )
A.X极易溶于水
B.1个X分子中有5个手性碳原子
C.X在碱性条件下不稳定,在酸性条件下很稳定
D.1mol X与NaOH溶液反应最多可以消耗2mol NaOH
9.Rh-Ru双金属配合物(Cat.)的结构及催化醋酸甲酯反应制备醋酸反应机理如图所示。下列说法错误的是( )
A催化剂(Cat.)Rh、Ru均为4配位,且均为sp3杂化
B.催化剂(Cat.)中若Ru的化合价为+1,则Rh的化合价为+3,且反应过程中Ru的化合价始终保持不变
C.CH3COI和HI均为反应中间体,且反应①和②均为取代反应
D.总反应方程式可表示为CH3COOCH3+CO+H2O=2CH3COOH
10.用草酸-草酸钠溶液浸取含杂质的Fe2O3(杂质不溶于浸取液),浸出体系中含C2O42-及含Fe(Ⅲ)粒子的形态分布随pH的变化如图所示。体系中草酸根的总浓度按折合成C2O42-计:c总(C2O42-)=5.22mol/L,Fe(Ⅲ)的总浓度按折合成 Fe3+计:c总(Fe3+)=1.14mol/L。下列说法错误的是( )
A.酸性增强,[Fe(C2O4)2]-的物质的量分数增大
B.通过改变pH可以实现Fe(Ⅲ)的完全浸出和沉淀
C.H2C2O4的Ka2=10-a,[Fe(C2O4)2]-+C2O42- [Fe(C2O4)3]3- K=10-b
D.pH=a时,c(C2O42-)≈0.9mol/L
二、不定项选择题(本题共5小题,每小题4分,共20分)
11.下列实验的方案设计、现象和结论都正确的是( )
实验目的 实验方案设计 现象和结论
A 检验补铁剂富马酸亚铁[(OOCCH=CHCOO)Fe]中的Fe2+ 取少量试样完全溶于稀硫酸,再滴加KMnO4溶液 KMnO4溶液褪色,说明该试样中存在Fe2+
B 探究淀粉水解程度 取2mL淀粉溶液,加入少量稀硫酸,加热2-3min,冷却后加入NaOH溶液至碱性,再滴加碘水 若溶液未变蓝色,说明淀粉已经完全水解
C 比较Ksp(CaSO4)与Ksp(CaCO3) 向饱和CaSO4溶液中滴加相同浓度的Na2CO3溶液 产生白色沉淀,说明Ksp(CaSO4)>Ksp(CaCO3)
D 比较配合物离子稳定性 向硫酸铜溶液中逐滴滴加氨水至过量 先生成蓝色沉淀后变为深蓝色溶液、说明稳定性[Cu(NH3)4]2+> [Cu(H2O)4]2-
12.继电器在控制电路中应用非常广泛,有一种新型继电器是以对电池的循环充放电实现自动离合(如图所示)。以下关于该继电器的说法中错误的是( )
已知:图中左电池的电极材料为纳米Fe2O3,另一极为金属锂和石墨的复合材料。
A.充电完成时,电池能被磁铁吸引
B.该电池电解液是非水溶剂
C.充电时,该电池正极的电极反应式为
3Li2O+2Fe-6e-=Fe2O3+6Li+
D.放电时,电解质溶液中Li+的浓度减少
13.一种海水提溴的部分工艺流程如图所示,下列说法错误的是( )
A.“氧化”和“转化”工序中Cl2的主要作用相同
B.水相Ⅱ中含有大量H+、Cl-、Br-和SO42-
C.理论上消耗R3N[ClBr2]与SO2的物质的量之比为2:1
D.“洗脱”工序发生的反应可表示为R3NBr+HCl R3NCl+HBr
14.硫代硫酸钠(Na2S2O3)能与人体内的重金属离子结合,减少其对身体的毒性影响。实验小组探究影响Na2S2O3溶液与含Cu2+溶液反应机理的因素做如下表实验。
查阅资料:Cu+不能稳定存在于水溶液中;Cu+与S2O32-形成的配位化合物为无色,Cu2+与S2O32-形成的配位化合物为黄色;叠色原理:黄+蓝=绿。
实验 滴管中试剂 试管中试剂 编号及现象
2mL 2.0mol/L Na2S2O3溶液 1mL 1.0mol/L CuSO4溶液,1mL H2O 实验a:溶液先变绿后变黄至接近无色,静置无变化
x mL 2.0mol/L Na2S2O3溶液 1mL 1.0mol/L CuSO4溶液, y mL H2O 实验b:溶液先变绿后变黄色,静置无变化
0.5mL 2.0mol/L Na2S2O3溶液 1mL 1.0mol/L CuSO4溶液,2.5mL H2O 实验c:溶液变为绿色,静置无变化
2mL 2.0mol/L Na2S2O3溶液 1mL 1.0mol/L CuCl2溶液,1mL H2O 实验d:溶液先变绿后变黄色,静置后很快出现白色沉淀,溶液颜色进一步变浅
下列说法正确的是( )
A.若保证n(Cu2+):n(S2O32-)=0.5,则表中数据 x=2,y=1
B.由实验a、b和c可知,随着n(Cu2+):n(S2O32-)的减小,发生氧化还原反应的趋势增大
C.由实验a和d可知,Cu+与Cl-生成沉淀的速率小于Cu+与S2O32-发生配合反应的速率
D.硫代硫酸钠能与铜的离子形成配合物是由于S有孤对电子,具有良好的配位能力
15.向恒容密闭容器中加入1mol CH4和一定量的H2O,发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)。CH4的平衡转化率按不同投料比x[x=n(CH4)/n(H2O)]随温度的变化曲线如图所示。下列说法错误的是( )
A.x1
D.反应温度为T1,当容器内压强不变时,反应达到平衡状态
三、填空题(本题共5小题,每小题12 分,共 60分)
16.周期表中ⅡA 族元素包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)、镭(Ra),也称为碱土金属,这些元素单质及其化合物在生活、工业、医药等领域有重要的用途。
(1)下列铍元素的不同微粒,若再失去一个电子需要能量最大的是________(填字母)。
(2)镁元素所在周期,第一电离能大于镁的主族元素有____种。MgH2是一种具有良好的复合储氢材料之一,是一种单层的二维材料,二维晶胞俯视图如右图,MgH2中Mg的配位数为____。
(3)螯合钙比普通的补钙剂更容易被人体吸收,结构如左下图,其中∠1____∠2(填“>”、“<”或“=”),螯合物中非金属元素的杂化类型为____,所含元素电负性由大到小的顺序________。
(4)Ca与B组成的金属硼化物结构如右上图所示,硼原子全部组成B6正八面体,各个顶点通过 B-B键互相连接成三维骨架,具有立方晶系的对称性。该晶体的化学式为____。M 点原子的分数坐标为(1/2,1/2,1/2),已知B6八面体中B-B键的键长为r pm,晶胞参数为a pm,则N点原子的分数坐标为____,Ca 与最近 B原子间的距离d=____pm(列出计算式即可)。
17.荆芥内酯为中药荆芥的活性成分,可用作安眠药、抗痉挛药等,合成路径如下。
回答下列问题:
(1)A→B为取代反应,则A分子含有的官能团是________。D→E的反应类型________。
(2)E→F的化学方程式是___________________________________________。
(3)F→G的②及H→I的①的目的是__________________________________。
(4)H的结构简式为______________________。
(5)F的同分异构体中符合下列情况的有____种(不含立体异构);其中核磁共振氢谱峰面积比为1:2:2:2:9的结构简式为_____________________。
①含苯环且苯环上仅有两个取代基;②遇FeCl3溶液显紫色;
(6)以香茅醛为原料合成荆芥内酯的部分转化过程如下,写出中间产物M、N的结构简式____、____。
18.钪(Sc)是一种在国防、航空航天、 核能等领域具有重要作用的稀土元素。以钛白酸性废水(含Sc3+、TiO2+、Fe2+、Fe3+等离子)为原料制备Sc及TiO2的工艺流程如图所示:
已知:i.“萃取”前Sc3+、Fe2+、Fe3+浓度分别为0.010mol/L、0.001mol/L、0.001mol/L;当某离子的浓度小于1.0×10-5mol/L时,可忽略该离子的存在;
ii.HA代表有机萃取剂,X代表金属元素,萃取时发生反应xn++nHA XAn+nH+;
回答下列问题:
(1)“萃取"前需要调节废水的pH,pH太小或太大时,Sc3+的萃取率均不大的原因________。
(2)“洗涤”过程中加入H2O2溶液的作用为____________________________。
(3)“溶解富集"后,金属离子浓度变为原来的12.5倍,则调溶液pH时范围为______,可实现铁元素和钪元素的究全分离。常温下,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Sc(OH)3]=1.0×10-30,Ksp[Fe(OH)2]=4.9×10-17,lg2=0.3。
(4)“热还原”时得到钪和另一产物M,用惰性电极电解M溶液时,阴极的电极反应式为_______。
(5)“转化”过程中氧化剂和还原剂物质的量之比为________。
(6)“沉钛”过程发生反应的化学方程式为___________________________________________。
(7)该流程中能够循环利用的物质有_____________。(填化学式)
19.硫化钠主要用于皮革、毛纺、高档纸张、染料等行业。回答下列问题:
(1)工业上常用芒硝(Na2SO4·10H2O)和煤粉在高温下生产硫化钠,同时生成CO,该反应的化学方程式为____________________。工业生产的硫化钠粗品中常含有一定量的煤灰及重金属硫化物等杂质。硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇。实验室中常用95%乙醇重结晶纯化硫化钠粗品。
(2)仪器a的名称________。
(3)溶解回流装置如图所示,回流前无需加入沸石,其原因是_______。
(4)回流结束后,需进行的操作有①停止加热、②关闭冷凝水、③移去水浴,正确的顺序为____(填标号)。
a.①②③ b.③①② c.②①③ d.①③②
(5)Na2S中S2-的含量可以用“碘量法”测得。称量a g Na2S样品,置于碘量瓶中,接着移取50mL 0.100mol/L的I2-KI溶液于其中,往碘量瓶中加入乙酸溶液,密闭,置黑暗处反应5min,有单质S析出。以淀粉溶液为指示剂,过量的I2用0.10mol/L的Na2S2O3溶液滴定,反应式为I2+2S2O32-=2I-+S4O62-。测定时消耗Na2S2O3溶液的体积为V mL。终点现象为__________,样品中S2-的质量分数为_____________________(写出表达式)。
(6)皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图所示)。为使除汞效果最佳,应控制的条件是x=_______、pH在__________范围内。
20.CO2催化加氢既有利于“碳中和”,又能得到重要的能源甲醇。CO2催化加氢过程中发生的主要反应如下(K1、K2、K3为平衡常数):
Ⅰ.CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49kJ/mol K1
Ⅱ.CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2 K2
Ⅲ.CO(g)+2H2(g)=CH3OH(g) ΔH3=-90kJ/mol K3
回答下列问题:
(1)标准摩尔生成焓的定义为“由标准状态的单质生成1mol化合物的焓变”,部分物质的标准摩尔生成焓数据如下表:
物质 CO2(g) H2(g) CO(g) CH3OH(g)
标准摩尔生成焓/(kJ/mol) -393.5 0 -110.5 x
则CH3OH(g)的标准摩尔生成焓x= ;升高温度时,K1/K3的值 (填“增大”、“减小”或“不变”)。
(2)研究表明,反应的速率方程为v=k[x(CO2)·x(H2)-x(CO)·x(H2O)·Kp],x表示气体的物质的量分数,Kp为压强平衡常数,k为反应的速率常数。其他条件一定时,反应速率随温度的变化如图1所示,根据速率方程分析,T>T0时,v逐渐增大的原因是 。反应Ⅰ的速率方程v 正=k正c(CO2)·c3(H2),v 逆=k逆c(CH3OH)·c(H2O),图2表示该反应的速率常数k正、k逆的对数lgk与温度的倒数1/T之间的关系,则直线 (填“A”或“B”)表示 lgk逆与1/T的关系。
(3)在保持3.0MPa条件下,将3mol H2,1mol CO2的气体通入装有某催化剂的密闭容器充分反应,甲醇的选择性[n(生成CH3OH)/n(消耗CO2)x100%]、CO的选择性、CO2的平衡转化率随温度变化如图3所示。250℃时达平衡,混合气体总的物质的量为 ,该条件下反应Ⅰ的物质的量分数平衡常数Kx= ,若在该温度下缩小容器体积,三个反应均达到新平衡时,n(CO)/n(CO2)的值____(填“增大”、“减小”或“不变”)。
同课章节目录
