专题6 化学反应与能量变化 分层作业4 化学反应中能量变化原因 燃料燃烧释放的能量和氢燃料的应用(含答案)前景--2025苏教版化学必修第二册同步练习题
文档属性
| 名称 | 专题6 化学反应与能量变化 分层作业4 化学反应中能量变化原因 燃料燃烧释放的能量和氢燃料的应用(含答案)前景--2025苏教版化学必修第二册同步练习题 |
|
|
| 格式 | docx | ||
| 文件大小 | 518.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-27 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2025苏教版化学必修第二册
分层作业4 化学反应中能量变化原因 燃料燃
烧释放的能量和氢燃料的应用前景
A级必备知识基础练
1.下列能源组合中,均属于更清洁、更高效能源的一组是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能
⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.①⑤⑥⑦⑧
C.③④⑤⑥⑦⑧ D.③⑤⑥⑦⑧
2.下列反应过程中的能量变化,与图相符的是( )
A.氢氧化钠溶液与盐酸反应
B.铁与盐酸反应
C.Ba(OH)2·8H2O与NH4Cl反应
D.生石灰与水反应
3.已知2A(g)B(g)是放热反应,下列关于2A(g)B(g)和2A(g)B(l)能量变化示意图正确的是( )
4.(2024北京顺义高一期中)氢气在氯气中燃烧时发生反应:H2+Cl22HCl。下列关于该反应的说法中,不正确的是( )
A.属于放热反应
B.属于氧化还原反应
C.反应物的总能量小于生成物的总能量
D.化学键的断裂和形成是该反应中能量变化的主要原因
5.下列关于能源和作为能源的物质的叙述中,不正确的是( )
A.化石能源物质内部蕴藏着大量的能量
B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C.物质的化学能可以在不同条件下转为热能、电能为人类所利用
D.吸热反应不加热不能进行
6.已知2H2+O22H2O,关于该反应的下列说法错误的是( )
A.该反应是一个放热反应
B.参加反应的氢气和氧气的总能量高于反应生成的水的总能量
C.反应条件“点燃”决定了该反应是一个吸热反应
D.2 mol H2和1 mol O2反应时断裂化学键吸收的总能量小于生成2 mol H2O时形成化学键释放的总能量
7.已知2H→H2的能量变化如图所示。下列说法不正确的是( )
A.2H→H2过程中形成的化学键是共价键
B.相同质量的氢气分子的能量比氢原子的能量低
C.2H→H2过程中形成1 mol新化学键放出437.6 kJ的能量
D.1 mol H2离解成2 mol H要放出437.6 kJ热量
8.(2024山东菏泽高一期末)理论研究表明,在101 kPa和298 K下,HCN(g)HNC(g)异构化反应过程的能量变化如图所示。下列说法错误的是 ( )
A.一分子HCN中的总键能比一分子HNC的总键能大
B.该异构化反应的ΔH=59.3 kJ·mol-1
C.HCN的能量小于HNC的能量
D.使用催化剂,可以改变该反应的ΔH
9.已知反应H2(g)+O2(g)H2O(g),反应过程中能量变化如图所示,则
(1)a、b、c分别代表什么意义
a ;
b ;
c 。
(2)该反应是 (填“吸热”或“放热”)反应,放出的热量为 kJ(用字母表示)。
B级关键能力提升练
10.液态储氢技术就是在常温常压下将氢气融入一种化合物“储油”中,形成“氢油”,便于储存和运输。下列有关说法错误的是( )
A.“氢油”不稳定
B.氢能源属于可再生能源
C.该技术实现了常温常压下储氢技术的新突破
D.液态储氢项目有利于发展氢能源电动机,从而带来新能源汽车的升级
11.化学家证实了氢气与氮气在固体催化剂表面合成氨的反应过程,如图所示:
下列关于合成氨反应的叙述不正确的是( )
A.该过程表明,在化学反应中存在化学键的断裂与形成
B.在催化剂的作用下,反应物的化学键变得容易断裂
C.过程②需吸收能量,过程③则放出能量
D.常温下该反应难以进行,是因为常温下生成物的化学键难以形成
12.科学界已获得了气态N4分子,其结构为正四面体(如图所示)。已知断裂1 mol N—N吸收159 kJ能量,断裂1 mol N≡N吸收946 kJ能量,下列说法正确的是( )
A.N4属于一种新型的化合物
B.1 mol N4(g)完全转化为N(g)的过程中释放954 kJ能量
C.1 mol N4(g)完全转化为N2(g)时释放938 kJ能量
D.N4和N2互称为同素异形体,N4转化为N2属于物理变化
13.25 ℃、101 kPa下,煤炭、氢气、天然气和甲醇(CH3OH)等几种燃料的热值依次是约33 kJ·g-1、143 kJ·g-1、约56 kJ·g-1、23 kJ·g-1,则下列热化学方程式正确的是( )
A.C(s)+O2(g)CO(g) ΔH=-396 kJ·mol-1
B.CH4(g)+2O2(g)CO2(g)+2H2O(l)
ΔH=-896 kJ·mol-1
C.2H2(g)+O2(g)2H2O(l) ΔH=-286 kJ·mol-1
D.CH3OH(l)+O2(g)CO2(g)+2H2O(l)
ΔH=736 kJ·mol-1
14.(2024河北保定高一期中)白磷(P4)与氯气反应的能量变化如图所示。回答下列问题:
(1)白磷在氯气中燃烧的反应是放热反应,但是启动反应时需要点燃或加热,其原因是 。
(2)PCl5(g)PCl3(g)+Cl2(g) ΔH= 。
(3)写出白磷蒸气在氯气中反应生成五氯化磷气体的热化学方程式: 。
(4)在密闭容器中充入1 mol PCl3(g)和3 mol Cl2(g),发生反应:PCl3(g)+Cl2(g)PCl5(g),若平衡时有70%的PCl3参与反应,反应放出的热量为 kJ。
(5)白磷在氯气中燃烧,开始引燃之后,停止加热,反应能继续进行的原因是 。
15.化学反应过程中释放或吸收的热量在生活、生产、科技及科研中应用广泛。
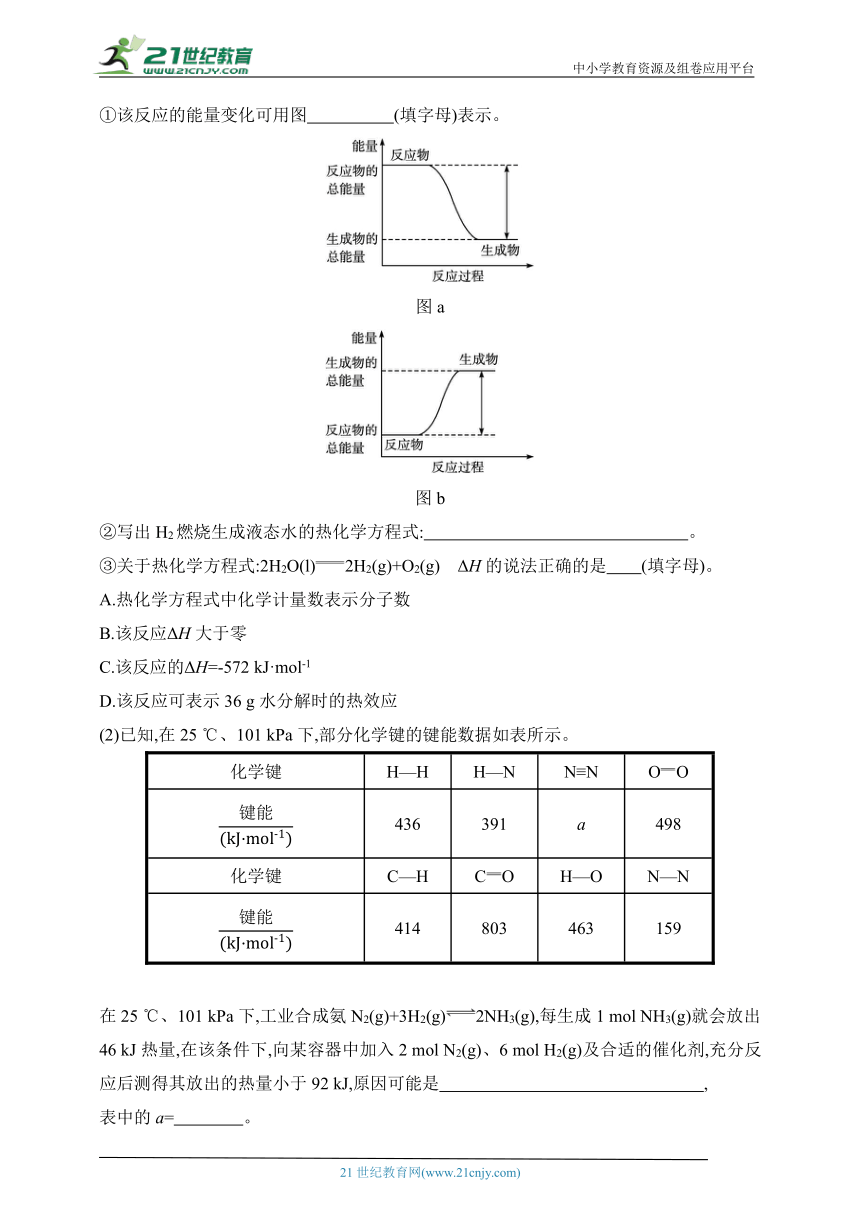
(1)已知:2 mol H2与足量O2充分燃烧生成液态水时放出572 kJ热量。
①该反应的能量变化可用图 (填字母)表示。
图a
图b
②写出H2燃烧生成液态水的热化学方程式: 。
③关于热化学方程式:2H2O(l)2H2(g)+O2(g) ΔH的说法正确的是 (填字母)。
A.热化学方程式中化学计量数表示分子数
B.该反应ΔH大于零
C.该反应的ΔH=-572 kJ·mol-1
D.该反应可表示36 g水分解时的热效应
(2)已知,在25 ℃、101 kPa下,部分化学键的键能数据如表所示。
化学键 H—H H—N N≡N OO
436 391 a 498
化学键 C—H CO H—O N—N
414 803 463 159
在25 ℃、101 kPa下,工业合成氨N2(g)+3H2(g)2NH3(g),每生成1 mol NH3(g)就会放出46 kJ热量,在该条件下,向某容器中加入2 mol N2(g)、6 mol H2(g)及合适的催化剂,充分反应后测得其放出的热量小于92 kJ,原因可能是 ,
表中的a= 。
C级学科素养拔高练
16.小明的爸爸是一名出租车司机,为倡导“绿水青山就是金山银山”这一理念,小明回到家和爸爸进行了一番争论。
小明认为:现在空气污染比较严重,应将汽车燃料改为新能源,或者污染较小的燃料。
小明的爸爸认为:现在城市污染不是很严重,新能源汽车价格高,续航能力差,不经济,汽油作为燃料性价比高,适合长时间运行。
为了说服爸爸,小明又给爸爸展示了三张图片。
图1 中国已探明燃料储量及使用年限
燃料 液化石油气 天然气(CNG) 95号乙醇汽油
价格(元/升) 4.8 2.3 6.9
4.5×104 4.0×104 4.6×104
图2 常用车用燃料热值及价格
图3 不同能源在各年代所占比例
最后小明的爸爸赞同了小明的观点,决定将汽油改为天然气。
(1)小明鼓励爸爸,将汽油改为天然气的目的是 。
(2)结合图3,对于能源的选择,请你再提一条符合小明的目的的建议: 。
(3)“开源节流”是应对能源危机的重要举措,下列做法有助于能源“开源节流”的是 (填字母)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
分层作业4 化学反应中能量变化原因 燃料
燃烧释放的能量和氢燃料的应用前景
1.D
2.C 解析 根据图像可知,反应物的总能量比生成物的总能量低,即该反应为吸热反应。氢氧化钠与盐酸发生中和反应,属于放热反应,A错误;铁与盐酸发生置换反应,该反应属于放热反应,B错误;生石灰与水反应生成Ca(OH)2,该反应属于放热反应,D错误。
3.B
4.C 解析 该反应为放热反应,反应物总能量大于生成物总能量,C错误。
5.D
6.C 解析 氢气与氧气的反应是放热反应,反应物的总能量大于生成物的总能量,反应物中断裂化学键吸收的总能量小于生成物中形成化学键释放的总能量,与反应条件无关,故C错误。
7.D 解析 H2分子中含有共价键,故2H→H2过程中形成共价键,A正确;由题图可知,H原子变成H2放出能量,则相同质量的氢气分子的能量比氢原子的能量低,B正确;由题图可知,2H→H2过程中,形成1 mol H—H要放出437.6 kJ能量,C正确;1 mol H2离解成2 mol H原子,要断裂H—H,故要吸收437.6 kJ能量,D不正确。
8.D 解析 根据图中信息得到HCN转化为HNC为吸热反应,1 mol HCN断键吸收的能量大于1 mol HNC成键放出的能量,故一分子HCN中的总键能比一分子HNC的总键能大,故A正确;根据反应热等于生成物总能量减去反应物总能量可知该反应的ΔH=59.3 kJ·mol-1,故B正确;该反应为吸热反应,HCN的能量小于HNC的能量,故C正确;使用催化剂,不改变反应物和生成物的能量,该反应的ΔH不变,D错误。
9.答案 (1)旧的化学键断裂所吸收的能量 新的化学键形成所放出的能量 总反应所放出的能量
(2)放热 c(或b-a)
解析 (1)由题图分析可知,a表示旧的化学键断裂所吸收的能量,b表示新的化学键形成所放出的能量,c表示总反应所放出的能量。(2)反应物的总能量高于生成物的总能量,所以该反应是放热反应,放出的热量为c(或b-a) kJ。
10.A 解析 “氢油”便于储存和运输,说明它比较稳定,故A错误;氢气燃烧生成水,水分解又生成氢气,则氢能源属于可再生能源,故B正确;常温常压下可以将氢气融入一种化合物“储油”中,则该技术实现了常温常压下储氢技术的新突破,故C正确;液态储氢解决了氢能储存难、运输难的问题,能实现氢能的广泛应用,有利于发展氢能源电动机,从而带来新能源汽车的升级,故D正确。
11.D 解析 由题图可知,每3个氢气分子和1个氮气分子断键得到原子,然后氢原子和氮原子生成2个氨分子,A项正确;催化剂能改变化学反应的速率,合成氨的反应在催化剂作用下,反应速率增大,意味着反应物化学键的断裂和生成物化学键的形成变得更容易,B项正确;旧的化学键的断裂需要吸收能量,而新的化学键的形成则放出能量,从题图中可看出②为旧的化学键断裂过程,③为新的化学键形成过程,C项正确;旧的化学键的断裂需要吸收能量,所以该反应在常温下难以进行,D项错误。
12.C 解析 N4是氮元素组成的一种单质,A错误;1 mol N4(g)完全转化为N(g)要断裂6 mol N—N,吸收总能量为159 kJ×6=954 kJ,B错误;1 mol N4(g)完全转化为N2(g),断键吸收总能量为954 kJ,成键释放总能量为946 kJ×2=1 892 kJ,则该反应放出热量为1 892 kJ-954 kJ=938 kJ,C正确;N4转化为N2是化学变化,D错误。
13.B 解析 A项,煤炭的热值约33 kJ·g-1,则12 g煤炭完全燃烧放出的热量约为396 kJ,所以热化学方程式为C(s)+O2(g)CO2(g) ΔH=-396 kJ·mol-1,错误;B项,天然气的热值约56 kJ·g-1,则16 g CH4完全燃烧放出的热量约为896 kJ,所以热化学方程式为CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH=-896 kJ·mol-1,正确;C项,氢气的热值是143 kJ·g-1,则4 g H2完全燃烧放出的热量为572 kJ,所以热化学方程式为2H2(g)+O2(g)2H2O(l) ΔH=-572 kJ·mol-1,错误;D项,甲醇(CH3OH)的热值是23 kJ·g-1,则32 g CH3OH完全燃烧放出的热量为736 kJ,所以热化学方程式为CH3OH(l)+O2(g)CO2(g)+2H2O(l) ΔH=-736 kJ·mol-1,错误。
14.答案 (1)断开旧键需要吸收能量 (2)88 kJ·mol-1
(3)P4(g)+10Cl2(g)4PCl5(g) ΔH=-1 559 kJ·mol-1
(4)61.6
(5)白磷与氯气反应放出的热量能维持反应持续进行
解析 (2)由图可知,4 mol PCl5分解生成4 mol PCl3和4 mol Cl2(g)需要吸收能量352 kJ,故PCl5分解的热化学方程式为PCl5(g)PCl3(g)+Cl2(g) ΔH=88 kJ·mol-1。
(3)由图可知,1 mol P4蒸气完全反应生成PCl5气体放出的热量为1 559 kJ,故白磷蒸气在氯气中反应生成五氯化磷气体的热化学方程式为P4(g)+10Cl2(g)4PCl5(g) ΔH=-1 559 kJ·mol-1。
(4)由小问(2)可知,PCl5(g)PCl3(g)+Cl2(g) ΔH=88 kJ·mol-1,若平衡时有70%的PCl3参与反应,放出的热量为88 kJ×70%=61.6 kJ。
15.答案 (1)①a ②2H2(g)+O2(g)2H2O(l) ΔH=-572 kJ·mol-1 ③B (2)该反应是可逆反应,2 mol氮气反应不完全,因此放出的热量小于92 kJ 946
解析 (1)①图a是反应物总能量大于生成物总能量,图b是反应物总能量小于生成物总能量,因此该反应的能量变化可用图a表示;③热化学方程式中化学计量数表示物质的量,故A错误;该反应是吸热反应即ΔH大于零,故B正确;该反应的ΔH=+572 kJ·mol-1,故C错误;该反应可表示36 g液态水分解生成4 g气态氢气和32 g气态氧气时的热效应,故D错误。(2)根据每生成1 mol NH3(g)就会放出46 kJ热量,则每生成2 mol NH3(g)就会放出92 kJ热量,则ΔH=436 kJ·mol-1×3+a kJ·mol-1-391 kJ·mol-1×6=-92 kJ·mol-1,解得a=946。
16.答案 (1)节约石油资源,减少对空气的污染,天然气作为燃料性价比相对较高
(2)为减少化石能源对环境的影响,可以大力开发利用新能源,如太阳能、风能、水能、氢能等 (3)acd
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025苏教版化学必修第二册
分层作业4 化学反应中能量变化原因 燃料燃
烧释放的能量和氢燃料的应用前景
A级必备知识基础练
1.下列能源组合中,均属于更清洁、更高效能源的一组是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能
⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.①⑤⑥⑦⑧
C.③④⑤⑥⑦⑧ D.③⑤⑥⑦⑧
2.下列反应过程中的能量变化,与图相符的是( )
A.氢氧化钠溶液与盐酸反应
B.铁与盐酸反应
C.Ba(OH)2·8H2O与NH4Cl反应
D.生石灰与水反应
3.已知2A(g)B(g)是放热反应,下列关于2A(g)B(g)和2A(g)B(l)能量变化示意图正确的是( )
4.(2024北京顺义高一期中)氢气在氯气中燃烧时发生反应:H2+Cl22HCl。下列关于该反应的说法中,不正确的是( )
A.属于放热反应
B.属于氧化还原反应
C.反应物的总能量小于生成物的总能量
D.化学键的断裂和形成是该反应中能量变化的主要原因
5.下列关于能源和作为能源的物质的叙述中,不正确的是( )
A.化石能源物质内部蕴藏着大量的能量
B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C.物质的化学能可以在不同条件下转为热能、电能为人类所利用
D.吸热反应不加热不能进行
6.已知2H2+O22H2O,关于该反应的下列说法错误的是( )
A.该反应是一个放热反应
B.参加反应的氢气和氧气的总能量高于反应生成的水的总能量
C.反应条件“点燃”决定了该反应是一个吸热反应
D.2 mol H2和1 mol O2反应时断裂化学键吸收的总能量小于生成2 mol H2O时形成化学键释放的总能量
7.已知2H→H2的能量变化如图所示。下列说法不正确的是( )
A.2H→H2过程中形成的化学键是共价键
B.相同质量的氢气分子的能量比氢原子的能量低
C.2H→H2过程中形成1 mol新化学键放出437.6 kJ的能量
D.1 mol H2离解成2 mol H要放出437.6 kJ热量
8.(2024山东菏泽高一期末)理论研究表明,在101 kPa和298 K下,HCN(g)HNC(g)异构化反应过程的能量变化如图所示。下列说法错误的是 ( )
A.一分子HCN中的总键能比一分子HNC的总键能大
B.该异构化反应的ΔH=59.3 kJ·mol-1
C.HCN的能量小于HNC的能量
D.使用催化剂,可以改变该反应的ΔH
9.已知反应H2(g)+O2(g)H2O(g),反应过程中能量变化如图所示,则
(1)a、b、c分别代表什么意义
a ;
b ;
c 。
(2)该反应是 (填“吸热”或“放热”)反应,放出的热量为 kJ(用字母表示)。
B级关键能力提升练
10.液态储氢技术就是在常温常压下将氢气融入一种化合物“储油”中,形成“氢油”,便于储存和运输。下列有关说法错误的是( )
A.“氢油”不稳定
B.氢能源属于可再生能源
C.该技术实现了常温常压下储氢技术的新突破
D.液态储氢项目有利于发展氢能源电动机,从而带来新能源汽车的升级
11.化学家证实了氢气与氮气在固体催化剂表面合成氨的反应过程,如图所示:
下列关于合成氨反应的叙述不正确的是( )
A.该过程表明,在化学反应中存在化学键的断裂与形成
B.在催化剂的作用下,反应物的化学键变得容易断裂
C.过程②需吸收能量,过程③则放出能量
D.常温下该反应难以进行,是因为常温下生成物的化学键难以形成
12.科学界已获得了气态N4分子,其结构为正四面体(如图所示)。已知断裂1 mol N—N吸收159 kJ能量,断裂1 mol N≡N吸收946 kJ能量,下列说法正确的是( )
A.N4属于一种新型的化合物
B.1 mol N4(g)完全转化为N(g)的过程中释放954 kJ能量
C.1 mol N4(g)完全转化为N2(g)时释放938 kJ能量
D.N4和N2互称为同素异形体,N4转化为N2属于物理变化
13.25 ℃、101 kPa下,煤炭、氢气、天然气和甲醇(CH3OH)等几种燃料的热值依次是约33 kJ·g-1、143 kJ·g-1、约56 kJ·g-1、23 kJ·g-1,则下列热化学方程式正确的是( )
A.C(s)+O2(g)CO(g) ΔH=-396 kJ·mol-1
B.CH4(g)+2O2(g)CO2(g)+2H2O(l)
ΔH=-896 kJ·mol-1
C.2H2(g)+O2(g)2H2O(l) ΔH=-286 kJ·mol-1
D.CH3OH(l)+O2(g)CO2(g)+2H2O(l)
ΔH=736 kJ·mol-1
14.(2024河北保定高一期中)白磷(P4)与氯气反应的能量变化如图所示。回答下列问题:
(1)白磷在氯气中燃烧的反应是放热反应,但是启动反应时需要点燃或加热,其原因是 。
(2)PCl5(g)PCl3(g)+Cl2(g) ΔH= 。
(3)写出白磷蒸气在氯气中反应生成五氯化磷气体的热化学方程式: 。
(4)在密闭容器中充入1 mol PCl3(g)和3 mol Cl2(g),发生反应:PCl3(g)+Cl2(g)PCl5(g),若平衡时有70%的PCl3参与反应,反应放出的热量为 kJ。
(5)白磷在氯气中燃烧,开始引燃之后,停止加热,反应能继续进行的原因是 。
15.化学反应过程中释放或吸收的热量在生活、生产、科技及科研中应用广泛。
(1)已知:2 mol H2与足量O2充分燃烧生成液态水时放出572 kJ热量。
①该反应的能量变化可用图 (填字母)表示。
图a
图b
②写出H2燃烧生成液态水的热化学方程式: 。
③关于热化学方程式:2H2O(l)2H2(g)+O2(g) ΔH的说法正确的是 (填字母)。
A.热化学方程式中化学计量数表示分子数
B.该反应ΔH大于零
C.该反应的ΔH=-572 kJ·mol-1
D.该反应可表示36 g水分解时的热效应
(2)已知,在25 ℃、101 kPa下,部分化学键的键能数据如表所示。
化学键 H—H H—N N≡N OO
436 391 a 498
化学键 C—H CO H—O N—N
414 803 463 159
在25 ℃、101 kPa下,工业合成氨N2(g)+3H2(g)2NH3(g),每生成1 mol NH3(g)就会放出46 kJ热量,在该条件下,向某容器中加入2 mol N2(g)、6 mol H2(g)及合适的催化剂,充分反应后测得其放出的热量小于92 kJ,原因可能是 ,
表中的a= 。
C级学科素养拔高练
16.小明的爸爸是一名出租车司机,为倡导“绿水青山就是金山银山”这一理念,小明回到家和爸爸进行了一番争论。
小明认为:现在空气污染比较严重,应将汽车燃料改为新能源,或者污染较小的燃料。
小明的爸爸认为:现在城市污染不是很严重,新能源汽车价格高,续航能力差,不经济,汽油作为燃料性价比高,适合长时间运行。
为了说服爸爸,小明又给爸爸展示了三张图片。
图1 中国已探明燃料储量及使用年限
燃料 液化石油气 天然气(CNG) 95号乙醇汽油
价格(元/升) 4.8 2.3 6.9
4.5×104 4.0×104 4.6×104
图2 常用车用燃料热值及价格
图3 不同能源在各年代所占比例
最后小明的爸爸赞同了小明的观点,决定将汽油改为天然气。
(1)小明鼓励爸爸,将汽油改为天然气的目的是 。
(2)结合图3,对于能源的选择,请你再提一条符合小明的目的的建议: 。
(3)“开源节流”是应对能源危机的重要举措,下列做法有助于能源“开源节流”的是 (填字母)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
分层作业4 化学反应中能量变化原因 燃料
燃烧释放的能量和氢燃料的应用前景
1.D
2.C 解析 根据图像可知,反应物的总能量比生成物的总能量低,即该反应为吸热反应。氢氧化钠与盐酸发生中和反应,属于放热反应,A错误;铁与盐酸发生置换反应,该反应属于放热反应,B错误;生石灰与水反应生成Ca(OH)2,该反应属于放热反应,D错误。
3.B
4.C 解析 该反应为放热反应,反应物总能量大于生成物总能量,C错误。
5.D
6.C 解析 氢气与氧气的反应是放热反应,反应物的总能量大于生成物的总能量,反应物中断裂化学键吸收的总能量小于生成物中形成化学键释放的总能量,与反应条件无关,故C错误。
7.D 解析 H2分子中含有共价键,故2H→H2过程中形成共价键,A正确;由题图可知,H原子变成H2放出能量,则相同质量的氢气分子的能量比氢原子的能量低,B正确;由题图可知,2H→H2过程中,形成1 mol H—H要放出437.6 kJ能量,C正确;1 mol H2离解成2 mol H原子,要断裂H—H,故要吸收437.6 kJ能量,D不正确。
8.D 解析 根据图中信息得到HCN转化为HNC为吸热反应,1 mol HCN断键吸收的能量大于1 mol HNC成键放出的能量,故一分子HCN中的总键能比一分子HNC的总键能大,故A正确;根据反应热等于生成物总能量减去反应物总能量可知该反应的ΔH=59.3 kJ·mol-1,故B正确;该反应为吸热反应,HCN的能量小于HNC的能量,故C正确;使用催化剂,不改变反应物和生成物的能量,该反应的ΔH不变,D错误。
9.答案 (1)旧的化学键断裂所吸收的能量 新的化学键形成所放出的能量 总反应所放出的能量
(2)放热 c(或b-a)
解析 (1)由题图分析可知,a表示旧的化学键断裂所吸收的能量,b表示新的化学键形成所放出的能量,c表示总反应所放出的能量。(2)反应物的总能量高于生成物的总能量,所以该反应是放热反应,放出的热量为c(或b-a) kJ。
10.A 解析 “氢油”便于储存和运输,说明它比较稳定,故A错误;氢气燃烧生成水,水分解又生成氢气,则氢能源属于可再生能源,故B正确;常温常压下可以将氢气融入一种化合物“储油”中,则该技术实现了常温常压下储氢技术的新突破,故C正确;液态储氢解决了氢能储存难、运输难的问题,能实现氢能的广泛应用,有利于发展氢能源电动机,从而带来新能源汽车的升级,故D正确。
11.D 解析 由题图可知,每3个氢气分子和1个氮气分子断键得到原子,然后氢原子和氮原子生成2个氨分子,A项正确;催化剂能改变化学反应的速率,合成氨的反应在催化剂作用下,反应速率增大,意味着反应物化学键的断裂和生成物化学键的形成变得更容易,B项正确;旧的化学键的断裂需要吸收能量,而新的化学键的形成则放出能量,从题图中可看出②为旧的化学键断裂过程,③为新的化学键形成过程,C项正确;旧的化学键的断裂需要吸收能量,所以该反应在常温下难以进行,D项错误。
12.C 解析 N4是氮元素组成的一种单质,A错误;1 mol N4(g)完全转化为N(g)要断裂6 mol N—N,吸收总能量为159 kJ×6=954 kJ,B错误;1 mol N4(g)完全转化为N2(g),断键吸收总能量为954 kJ,成键释放总能量为946 kJ×2=1 892 kJ,则该反应放出热量为1 892 kJ-954 kJ=938 kJ,C正确;N4转化为N2是化学变化,D错误。
13.B 解析 A项,煤炭的热值约33 kJ·g-1,则12 g煤炭完全燃烧放出的热量约为396 kJ,所以热化学方程式为C(s)+O2(g)CO2(g) ΔH=-396 kJ·mol-1,错误;B项,天然气的热值约56 kJ·g-1,则16 g CH4完全燃烧放出的热量约为896 kJ,所以热化学方程式为CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH=-896 kJ·mol-1,正确;C项,氢气的热值是143 kJ·g-1,则4 g H2完全燃烧放出的热量为572 kJ,所以热化学方程式为2H2(g)+O2(g)2H2O(l) ΔH=-572 kJ·mol-1,错误;D项,甲醇(CH3OH)的热值是23 kJ·g-1,则32 g CH3OH完全燃烧放出的热量为736 kJ,所以热化学方程式为CH3OH(l)+O2(g)CO2(g)+2H2O(l) ΔH=-736 kJ·mol-1,错误。
14.答案 (1)断开旧键需要吸收能量 (2)88 kJ·mol-1
(3)P4(g)+10Cl2(g)4PCl5(g) ΔH=-1 559 kJ·mol-1
(4)61.6
(5)白磷与氯气反应放出的热量能维持反应持续进行
解析 (2)由图可知,4 mol PCl5分解生成4 mol PCl3和4 mol Cl2(g)需要吸收能量352 kJ,故PCl5分解的热化学方程式为PCl5(g)PCl3(g)+Cl2(g) ΔH=88 kJ·mol-1。
(3)由图可知,1 mol P4蒸气完全反应生成PCl5气体放出的热量为1 559 kJ,故白磷蒸气在氯气中反应生成五氯化磷气体的热化学方程式为P4(g)+10Cl2(g)4PCl5(g) ΔH=-1 559 kJ·mol-1。
(4)由小问(2)可知,PCl5(g)PCl3(g)+Cl2(g) ΔH=88 kJ·mol-1,若平衡时有70%的PCl3参与反应,放出的热量为88 kJ×70%=61.6 kJ。
15.答案 (1)①a ②2H2(g)+O2(g)2H2O(l) ΔH=-572 kJ·mol-1 ③B (2)该反应是可逆反应,2 mol氮气反应不完全,因此放出的热量小于92 kJ 946
解析 (1)①图a是反应物总能量大于生成物总能量,图b是反应物总能量小于生成物总能量,因此该反应的能量变化可用图a表示;③热化学方程式中化学计量数表示物质的量,故A错误;该反应是吸热反应即ΔH大于零,故B正确;该反应的ΔH=+572 kJ·mol-1,故C错误;该反应可表示36 g液态水分解生成4 g气态氢气和32 g气态氧气时的热效应,故D错误。(2)根据每生成1 mol NH3(g)就会放出46 kJ热量,则每生成2 mol NH3(g)就会放出92 kJ热量,则ΔH=436 kJ·mol-1×3+a kJ·mol-1-391 kJ·mol-1×6=-92 kJ·mol-1,解得a=946。
16.答案 (1)节约石油资源,减少对空气的污染,天然气作为燃料性价比相对较高
(2)为减少化石能源对环境的影响,可以大力开发利用新能源,如太阳能、风能、水能、氢能等 (3)acd
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
