专题6 化学反应与能量变化 分层作业6 化学电源--2025苏教版化学必修第二册同步练习题(含答案)
文档属性
| 名称 | 专题6 化学反应与能量变化 分层作业6 化学电源--2025苏教版化学必修第二册同步练习题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 523.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-27 18:33:31 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2025苏教版化学必修第二册
分层作业6 化学电源
A级必备知识基础练
1.下列对化学电源的叙述正确的是( )
A.化学电源比火力发电对化学能的利用率高
B.最早使用的化学电源是铅蓄电池
C.化学电源均是安全、无污染的
D.化学电源是指干电池
2.下列化学电池不易造成环境污染的是( )
A.氢氧燃料电池 B.锌锰干电池
C.镍镉电池 D.铅蓄电池
3.废电池处理不当不仅造成浪费,还会对环境造成严重污染,对人体健康也存在极大的危害。有同学想变废为宝,他的以下想法你认为不正确的是( )
A.把锌皮取下洗净用于实验室制取氢气
B.碳棒取出洗净用作电极
C.把铜帽取下洗净回收利用
D.电池内部填有NH4Cl等化学物质,将废电池中的黑色糊状物作化肥施用
4.(2024河北石家庄高一期末改编)化学电源在日常生活和高科技领域中都有广泛应用。下列说法正确的是( )
甲 乙
丙 丁
A.图甲所示电池为二次电池
B.图乙装置工作时,PbO2作正极材料和正极反应物
C.图丙装置工作时,Mg电极是负极
D.图丁装置工作时,KOH溶液中的OH-向Ag2O电极迁移
5.微型纽扣电池在现代生活中有广泛应用。一种银锌纽扣电池的电极分别为Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-ZnO+H2O和Ag2O+H2O+2e-2Ag+2OH-。下列说法错误的是( )
A.在使用过程中,电池负极区溶液的碱性减弱
B.使用过程中,电子由Zn极经外电路流向Ag2O极
C.电池总反应为Ag2O+Zn2Ag+ZnO
D.Zn是负极发生还原反应,Ag2O是正极发生氧化反应
6.化学电源在通信、交通及日常生活中有着广泛的应用。
(1)锌锰干电池是应用最普遍的电池之一(如图所示),锌锰干电池的负极材料是 ,负极发生的电极反应式为 。
锌锰干电池的构造示意图
若反应消耗32.5 g负极材料,则电池中转移电子的物质的量为 mol。
(2)目前常用的镍镉电池的电池总反应式可以表示为Cd+2NiO(OH)+2H2O2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法正确的是 (填字母)。
A.NiO(OH)作负极
B.Cd作负极
C.此电池是一次电池
D.放电时化学能转变为电能
(3)如图为氢氧燃料电池的构造示意图,根据电子运动方向可知,X极为电池的 (填“正”或“负”)极,Y极的电极反应式为 。
氢氧燃料电池的构造示意图
7.有人设计以铂和锌为电极材料的原电池,植入人体做某种心脏病患者的心脏起搏器的电源装置,它依靠人体血液中一定浓度的O2和H2O进行工作。请回答下列问题:
(1)负极材料是 ,电极反应为 。
(2)正极材料是 ,电极反应为 。
B级关键能力提升练
8.可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是( )
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为O2+2H2O+4e-4OH-
B.以NaOH溶液为电解液时,负极反应为Al-3e-A
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
9.《Nature》期刊曾报道一例CH3OH-O2原电池,其工作示意图如图。下列说法不正确的是( )
A.电极A是负极,发生氧化反应
B.电极B的电极反应为O2+H++2e-H
C.电解质溶液中H+由电极A流向电极B
D.外电路中通过6 mol电子,生成22.4 L CO2
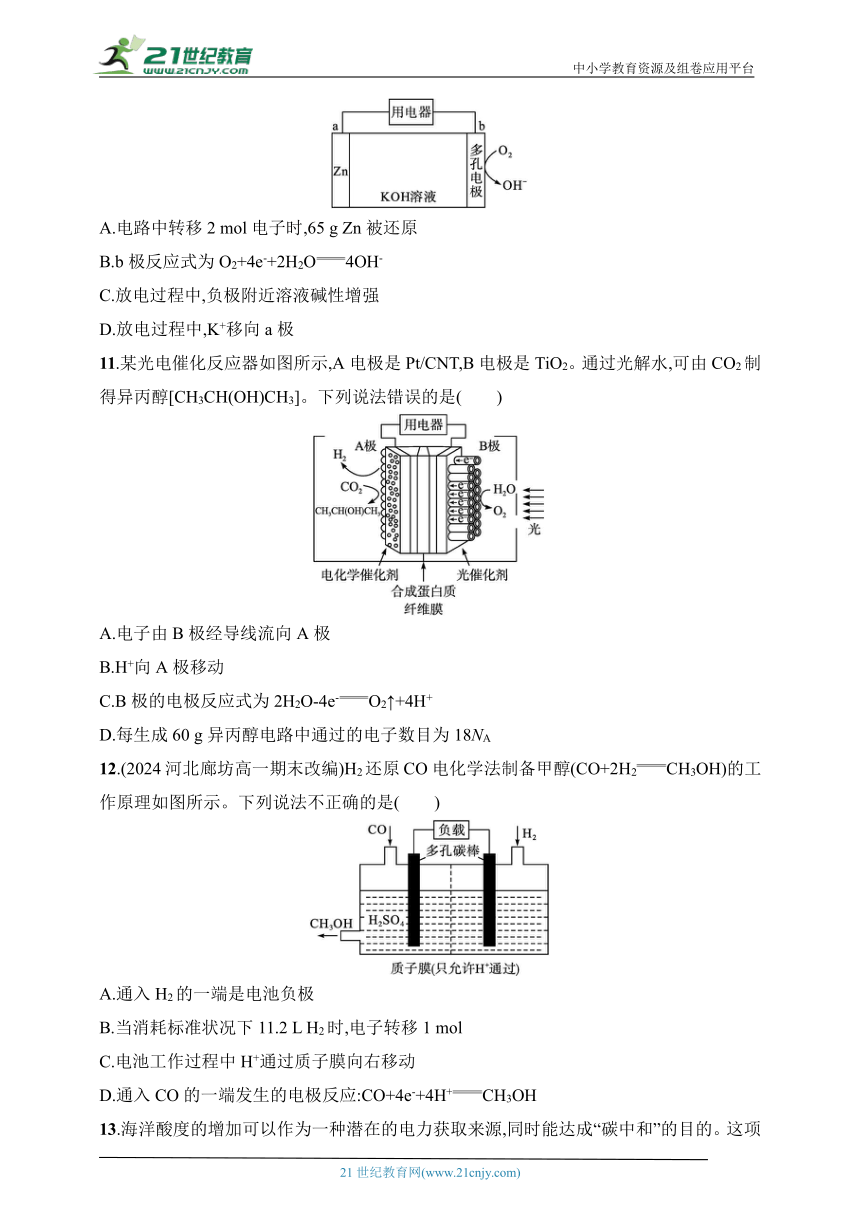
10.(2024河北保定高一期末)金属空气电池具有低材料成本、高能量密度、安全性好等优点。一种锌-空气电池的构造如图,放电时Zn→[Zn(OH)4]2-。下列有关说法正确的是( )
A.电路中转移2 mol电子时,65 g Zn被还原
B.b极反应式为O2+4e-+2H2O4OH-
C.放电过程中,负极附近溶液碱性增强
D.放电过程中,K+移向a极
11.某光电催化反应器如图所示,A电极是Pt/CNT,B电极是TiO2。通过光解水,可由CO2制得异丙醇[CH3CH(OH)CH3]。下列说法错误的是( )
A.电子由B极经导线流向A极
B.H+向A极移动
C.B极的电极反应式为2H2O-4e-O2↑+4H+
D.每生成60 g异丙醇电路中通过的电子数目为18NA
12.(2024河北廊坊高一期末改编)H2还原CO电化学法制备甲醇(CO+2H2CH3OH)的工作原理如图所示。下列说法不正确的是( )
A.通入H2的一端是电池负极
B.当消耗标准状况下11.2 L H2时,电子转移1 mol
C.电池工作过程中H+通过质子膜向右移动
D.通入CO的一端发生的电极反应:CO+4e-+4H+CH3OH
13.海洋酸度的增加可以作为一种潜在的电力获取来源,同时能达成“碳中和”的目的。这项技术的装置示意图如图:
下列说法错误的是( )
A.Na电极为该原电池装置的负极
B.CO2在正极发生还原反应
C.“有机电解质”不可换成NaOH溶液
D.当电路中转移1 mol e-时,理论上吸收44 g CO2
14.一种新一代集电致变色功能和储能功能于一体的电子器件的工作原理如图所示,放电时该器件的透光率增强,下列说法错误的是( )
A.放电时,Li+移向a极
B.放电时,b极材料中Li元素化合价升高
C.放电时,a极的电极反应式为FePO4+Li++e-LiFePO4
D.当a、b两极质量变化差为14 g时,外电路转移1 mol电子
15.(1)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
①该电池的正极材料是 。
②若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速其电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填字母)。
A.NaOH B.Zn
C.Fe D.NH3·H2O
(2)目前已经使用的乙醇(CH3CH2OH)燃料电池的X极电极反应式为O2+2H2O+4e-4OH-,则
①X是 (填“正极”或“负极”),发生 (填“氧化”或“还原”)反应。该电池的电解质显 (填“酸性”“碱性”或“中性”)。
②若将电解质换成酸性介质,则正极反应式为 ,通入乙醇的一极是 (填“正”或“负”)极。
③标准状况下,有5.6 L O2完全反应,则电路中转移 mol电子。
C级学科素养拔高练
16.同学们在“简易电池的设计与制作”的实验中,对影响自制电池效果的因素进行了实验探究。
[提出问题]影响自制电池效果的因素有哪些
[查阅资源]电极材料,电极间距,水果种类对自制水果电池的效果可能有影响。
[实验探究]Ⅰ.按如图所示连接水果电池。
Ⅱ.实验记录如下:
序号 电极 电极间距 水果种类 电流表示数(μA)
① Cu-Al 2.0 cm 西红柿 78.5
② Cu-Fe 2.0 cm 西红柿 70.3
③ Al-Al 2.0 cm 西红柿 0
④ Cu-Al 2.0 cm 柠檬 45.7
⑤ Cu-Al 1.0 cm 柠檬 98.4
⑥ 石墨棒-Al 1.0 cm 柠檬 104.5
[解释与结论]
(1)实验①②③的目的是 。
对比实验①②③得出的结论是 。
(2)欲得出“水果种类对自制水果电池效果有影响”的结论,需要对比实验 (填序号)。
对比实验④⑤得出结论是 。
[反思与探讨]
(3)水果电池中,水果的作用是 。
(4)对比实验①②③可知,构成水果电池的电极必须具备的条件为 ,构成水果电池的其他要素还有 、 、 。
(5)水果电池是利用水果中的化学物质和金属发生化学反应而产生电能的一种装置,如将实验①中的西红柿换成硫酸铜溶液进行实验,电流表示数不为零,Cu片和Al片上发生的电极反应式分别为 、 ,总反应的离子方程式为 。
分层作业6 化学电源
1.A 2.A 3.D
4.B 解析 图甲所示电池为干电池,属于一次电池,A错误;图乙装置为铅蓄电池,工作时,PbO作正极材料和正极反应物,负极是铅,B正确;图丙装置工作时,Al电极是负极,C错误;图丁装置工作时锌电极是负极,氧化银电极是正极,KOH溶液中的OH-向锌电极迁移,D错误。
5.D 解析 根据电极反应式知,锌作负极,氧化银作正极,负极上氢氧根离子参与反应导致氢氧根离子浓度减小,负极的碱性减弱,A正确;锌是负极,氧化银是正极,电子从锌沿导线流向氧化银,B正确;根据得失电子守恒,将两极反应式相加可得总反应:Ag2O+Zn2Ag+ZnO,C正确;负极锌失电子发生氧化反应,正极氧化银得电子发生还原反应,D错误。
6.答案 (1)锌 Zn-2e-Zn2+ 1.0 (2)BD
(3)负 O2+2H2O+4e-4OH-
解析 (1)锌锰干电池的负极是Zn,失去电子发生氧化反应,电极反应式为Zn-2e-Zn2+;32.50 g Zn的物质的量是=0.5 mol,1 mol Zn失去2 mol电子,所以电池中转移电子的物质的量是1.0 mol。
(2)由电池总反应式可知,Cd元素化合价由0价→+2价,化合价升高被氧化,Cd作电池的负极,A错误、B正确;电池可以充放电,因此是二次电池,C错误;放电时化学能转变为电能,D正确。
(3)氢氧燃料电池中,电子从负极向正极移动,X是电子流出的一极,X是负极,发生氧化反应,Y是正极,发生还原反应,电解质溶液是KOH溶液,氧气得到电子生成氢氧根离子,电极反应式为O2+2H2O+4e-4OH-。
7.答案 (1)锌 2Zn-4e-2Zn2+
(2)铂 O2+2H2O+4e-4OH-
解析 工作时,负极锌被氧化,血液中的O2得到电子被还原。正极的反应为O2+2H2O+4e-4OH-,负极的反应为2Zn-4e-2Zn2+。
8.A 解析 碱性或中性条件下,形成原电池,Al易失电子作负极,负极反应式为Al+4OH--3e-Al+2H2O,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-4OH-,所以电池反应式为4Al+4OH-+3O24Al+2H2O,放电时,电子从负极沿导线流向正极,故A正确,B、D错误;以NaOH溶液为电解液时,氢氧根离子参加反应且生成水,所以溶液的pH降低,故C错误。
9.D 解析 通入CH3OH的一极A为负极,失去电子发生氧化反应,电极反应为CH3OH+H2O-6e-CO2+6H+,A正确;B极为正极,得电子发生还原反应,电极反应为O2+H++2e-H,B正确;阳离子向正极移动,则电解质溶液中H+由电极A流向电极B,C正确;题目未说明气体所处的状态,无法计算生成气体的体积,D错误。
10.B 解析 锌-空气电池中锌为负极,即a为负极,b为正极,电解质溶液为氢氧化钾溶液。电路中转移2 mol电子时,65 g Zn被氧化,A错误;b极氧气得电子发生还原反应,电极反应式为O2+4e-+2H2O4OH-,B正确;放电过程中,负极消耗OH-,负极附近溶液碱性减弱,C错误;放电过程中,K+移向正极b极,D错误。
11.D 解析 装置无外接电源,则为原电池,根据B电极H2O→O2,氧元素化合价升高可知,B为负极,电极反应式为2H2O-4e-O2↑+4H+,故C正确; B为负极,A为正极,电子由B极经导线流向A极,故A正确;A为正极,生成的H+向A极移动,故B正确;A极发生两个反应:2H++2e-H2↑、3CO2+18e-+18H+CH3CH(OH)CH3+5H2O,每生成60 g即1 mol异丙醇,转移电子数大于18NA,故D错误。
12.C 解析 通入H2的一端是电池负极,A正确;负极反应为H2-2e-2H+,当消耗标准状况下11.2 L(0.5 mol)H2时,电子转移1 mol,B正确;原电池工作时,阳离子向正极移动,即H+由右通过质子膜向左移动,C错误;CO在正极得电子被还原为CH3OH,电极反应为CO+4e-+4H+CH3OH,D正确。
13.B 解析 题图中Na→Na+发生氧化反应,则Na电极为负极,A正确;题图中正极上H+发生还原反应生成H2(g),CO2→HC未发生氧化还原反应,B错误;Na与水剧烈反应生成NaOH和H2,故“有机电解质”不能换成NaOH溶液,C正确;当电路中转移1 mol e-时,正极区溶液生成1 mol HC,据碳原子守恒推知理论上吸收1 mol CO2,D正确。
14.B 解析 由图可知,放电时,a极为原电池正极,锂离子作用下FePO4在正极得到电子发生还原反应生成LiFePO4,b极为负极,Li7Ti5O12在负极失去电子发生氧化反应生成Li4Ti5O12。由上述分析可知,放电时,a极为原电池正极,b极为负极,则阳离子锂离子移向正极a极,故A正确;由上述分析可知,放电时,Li7Ti5O12在负极失去电子发生氧化反应生成Li4Ti5O12,钛元素的化合价升高,Li元素的化合价不变,故B错误;由上述分析可知,放电时,a极为原电池正极,锂离子作用下FePO4在正极得到电子发生还原反应生成LiFePO4,电极反应式为FePO4+Li++e-LiFePO4,故C正确;由上述分析可知,放电时总反应为3FePO4+Li7Ti5O123LiFePO4+Li4Ti5O12,则外电路转移1 mol电子时,负极质量减少7 g,正极质量增加7 g,两极质量变化差为14 g,故D正确。
15.答案 (1)①MnO2 ②锌与还原出来的铜形成铜锌原电池而加快锌的腐蚀 B
(2)①正极 还原 碱性
②O2+4H++4e-2H2O 负 ③1
解析 (1)②锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀。除杂的基本要求是不能引入新杂质,所以应选Zn将Cu2+置换为单质而除去。
(2)①X极是O2得电子发生还原反应,作正极,根据X极的电极反应式确定电解质显碱性。
③在标准状况下,有5.6 L O2即0.25 mol O2完全反应,1 mol O2得4 mol电子,则电路中转移1 mol电子。
16.答案 (1)探究电极材料对自制水果电池效果的影响 在其他条件相同时,电极材料活动性差别越大,自制水果电池效果越好
(2)①④ 在其他条件相同时,电极间距越小,电流越大,自制水果电池效果越好
(3)作电解质溶液
(4)两极金属活动性不同 能发生自发的氧化还原反应 形成闭合回路 有电解质溶液
(5)3Cu2++6e-3Cu 2Al-6e-2Al3+
2Al+3Cu2+3Cu+2Al3+
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025苏教版化学必修第二册
分层作业6 化学电源
A级必备知识基础练
1.下列对化学电源的叙述正确的是( )
A.化学电源比火力发电对化学能的利用率高
B.最早使用的化学电源是铅蓄电池
C.化学电源均是安全、无污染的
D.化学电源是指干电池
2.下列化学电池不易造成环境污染的是( )
A.氢氧燃料电池 B.锌锰干电池
C.镍镉电池 D.铅蓄电池
3.废电池处理不当不仅造成浪费,还会对环境造成严重污染,对人体健康也存在极大的危害。有同学想变废为宝,他的以下想法你认为不正确的是( )
A.把锌皮取下洗净用于实验室制取氢气
B.碳棒取出洗净用作电极
C.把铜帽取下洗净回收利用
D.电池内部填有NH4Cl等化学物质,将废电池中的黑色糊状物作化肥施用
4.(2024河北石家庄高一期末改编)化学电源在日常生活和高科技领域中都有广泛应用。下列说法正确的是( )
甲 乙
丙 丁
A.图甲所示电池为二次电池
B.图乙装置工作时,PbO2作正极材料和正极反应物
C.图丙装置工作时,Mg电极是负极
D.图丁装置工作时,KOH溶液中的OH-向Ag2O电极迁移
5.微型纽扣电池在现代生活中有广泛应用。一种银锌纽扣电池的电极分别为Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-ZnO+H2O和Ag2O+H2O+2e-2Ag+2OH-。下列说法错误的是( )
A.在使用过程中,电池负极区溶液的碱性减弱
B.使用过程中,电子由Zn极经外电路流向Ag2O极
C.电池总反应为Ag2O+Zn2Ag+ZnO
D.Zn是负极发生还原反应,Ag2O是正极发生氧化反应
6.化学电源在通信、交通及日常生活中有着广泛的应用。
(1)锌锰干电池是应用最普遍的电池之一(如图所示),锌锰干电池的负极材料是 ,负极发生的电极反应式为 。
锌锰干电池的构造示意图
若反应消耗32.5 g负极材料,则电池中转移电子的物质的量为 mol。
(2)目前常用的镍镉电池的电池总反应式可以表示为Cd+2NiO(OH)+2H2O2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法正确的是 (填字母)。
A.NiO(OH)作负极
B.Cd作负极
C.此电池是一次电池
D.放电时化学能转变为电能
(3)如图为氢氧燃料电池的构造示意图,根据电子运动方向可知,X极为电池的 (填“正”或“负”)极,Y极的电极反应式为 。
氢氧燃料电池的构造示意图
7.有人设计以铂和锌为电极材料的原电池,植入人体做某种心脏病患者的心脏起搏器的电源装置,它依靠人体血液中一定浓度的O2和H2O进行工作。请回答下列问题:
(1)负极材料是 ,电极反应为 。
(2)正极材料是 ,电极反应为 。
B级关键能力提升练
8.可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是( )
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为O2+2H2O+4e-4OH-
B.以NaOH溶液为电解液时,负极反应为Al-3e-A
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
9.《Nature》期刊曾报道一例CH3OH-O2原电池,其工作示意图如图。下列说法不正确的是( )
A.电极A是负极,发生氧化反应
B.电极B的电极反应为O2+H++2e-H
C.电解质溶液中H+由电极A流向电极B
D.外电路中通过6 mol电子,生成22.4 L CO2
10.(2024河北保定高一期末)金属空气电池具有低材料成本、高能量密度、安全性好等优点。一种锌-空气电池的构造如图,放电时Zn→[Zn(OH)4]2-。下列有关说法正确的是( )
A.电路中转移2 mol电子时,65 g Zn被还原
B.b极反应式为O2+4e-+2H2O4OH-
C.放电过程中,负极附近溶液碱性增强
D.放电过程中,K+移向a极
11.某光电催化反应器如图所示,A电极是Pt/CNT,B电极是TiO2。通过光解水,可由CO2制得异丙醇[CH3CH(OH)CH3]。下列说法错误的是( )
A.电子由B极经导线流向A极
B.H+向A极移动
C.B极的电极反应式为2H2O-4e-O2↑+4H+
D.每生成60 g异丙醇电路中通过的电子数目为18NA
12.(2024河北廊坊高一期末改编)H2还原CO电化学法制备甲醇(CO+2H2CH3OH)的工作原理如图所示。下列说法不正确的是( )
A.通入H2的一端是电池负极
B.当消耗标准状况下11.2 L H2时,电子转移1 mol
C.电池工作过程中H+通过质子膜向右移动
D.通入CO的一端发生的电极反应:CO+4e-+4H+CH3OH
13.海洋酸度的增加可以作为一种潜在的电力获取来源,同时能达成“碳中和”的目的。这项技术的装置示意图如图:
下列说法错误的是( )
A.Na电极为该原电池装置的负极
B.CO2在正极发生还原反应
C.“有机电解质”不可换成NaOH溶液
D.当电路中转移1 mol e-时,理论上吸收44 g CO2
14.一种新一代集电致变色功能和储能功能于一体的电子器件的工作原理如图所示,放电时该器件的透光率增强,下列说法错误的是( )
A.放电时,Li+移向a极
B.放电时,b极材料中Li元素化合价升高
C.放电时,a极的电极反应式为FePO4+Li++e-LiFePO4
D.当a、b两极质量变化差为14 g时,外电路转移1 mol电子
15.(1)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
①该电池的正极材料是 。
②若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速其电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填字母)。
A.NaOH B.Zn
C.Fe D.NH3·H2O
(2)目前已经使用的乙醇(CH3CH2OH)燃料电池的X极电极反应式为O2+2H2O+4e-4OH-,则
①X是 (填“正极”或“负极”),发生 (填“氧化”或“还原”)反应。该电池的电解质显 (填“酸性”“碱性”或“中性”)。
②若将电解质换成酸性介质,则正极反应式为 ,通入乙醇的一极是 (填“正”或“负”)极。
③标准状况下,有5.6 L O2完全反应,则电路中转移 mol电子。
C级学科素养拔高练
16.同学们在“简易电池的设计与制作”的实验中,对影响自制电池效果的因素进行了实验探究。
[提出问题]影响自制电池效果的因素有哪些
[查阅资源]电极材料,电极间距,水果种类对自制水果电池的效果可能有影响。
[实验探究]Ⅰ.按如图所示连接水果电池。
Ⅱ.实验记录如下:
序号 电极 电极间距 水果种类 电流表示数(μA)
① Cu-Al 2.0 cm 西红柿 78.5
② Cu-Fe 2.0 cm 西红柿 70.3
③ Al-Al 2.0 cm 西红柿 0
④ Cu-Al 2.0 cm 柠檬 45.7
⑤ Cu-Al 1.0 cm 柠檬 98.4
⑥ 石墨棒-Al 1.0 cm 柠檬 104.5
[解释与结论]
(1)实验①②③的目的是 。
对比实验①②③得出的结论是 。
(2)欲得出“水果种类对自制水果电池效果有影响”的结论,需要对比实验 (填序号)。
对比实验④⑤得出结论是 。
[反思与探讨]
(3)水果电池中,水果的作用是 。
(4)对比实验①②③可知,构成水果电池的电极必须具备的条件为 ,构成水果电池的其他要素还有 、 、 。
(5)水果电池是利用水果中的化学物质和金属发生化学反应而产生电能的一种装置,如将实验①中的西红柿换成硫酸铜溶液进行实验,电流表示数不为零,Cu片和Al片上发生的电极反应式分别为 、 ,总反应的离子方程式为 。
分层作业6 化学电源
1.A 2.A 3.D
4.B 解析 图甲所示电池为干电池,属于一次电池,A错误;图乙装置为铅蓄电池,工作时,PbO作正极材料和正极反应物,负极是铅,B正确;图丙装置工作时,Al电极是负极,C错误;图丁装置工作时锌电极是负极,氧化银电极是正极,KOH溶液中的OH-向锌电极迁移,D错误。
5.D 解析 根据电极反应式知,锌作负极,氧化银作正极,负极上氢氧根离子参与反应导致氢氧根离子浓度减小,负极的碱性减弱,A正确;锌是负极,氧化银是正极,电子从锌沿导线流向氧化银,B正确;根据得失电子守恒,将两极反应式相加可得总反应:Ag2O+Zn2Ag+ZnO,C正确;负极锌失电子发生氧化反应,正极氧化银得电子发生还原反应,D错误。
6.答案 (1)锌 Zn-2e-Zn2+ 1.0 (2)BD
(3)负 O2+2H2O+4e-4OH-
解析 (1)锌锰干电池的负极是Zn,失去电子发生氧化反应,电极反应式为Zn-2e-Zn2+;32.50 g Zn的物质的量是=0.5 mol,1 mol Zn失去2 mol电子,所以电池中转移电子的物质的量是1.0 mol。
(2)由电池总反应式可知,Cd元素化合价由0价→+2价,化合价升高被氧化,Cd作电池的负极,A错误、B正确;电池可以充放电,因此是二次电池,C错误;放电时化学能转变为电能,D正确。
(3)氢氧燃料电池中,电子从负极向正极移动,X是电子流出的一极,X是负极,发生氧化反应,Y是正极,发生还原反应,电解质溶液是KOH溶液,氧气得到电子生成氢氧根离子,电极反应式为O2+2H2O+4e-4OH-。
7.答案 (1)锌 2Zn-4e-2Zn2+
(2)铂 O2+2H2O+4e-4OH-
解析 工作时,负极锌被氧化,血液中的O2得到电子被还原。正极的反应为O2+2H2O+4e-4OH-,负极的反应为2Zn-4e-2Zn2+。
8.A 解析 碱性或中性条件下,形成原电池,Al易失电子作负极,负极反应式为Al+4OH--3e-Al+2H2O,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-4OH-,所以电池反应式为4Al+4OH-+3O24Al+2H2O,放电时,电子从负极沿导线流向正极,故A正确,B、D错误;以NaOH溶液为电解液时,氢氧根离子参加反应且生成水,所以溶液的pH降低,故C错误。
9.D 解析 通入CH3OH的一极A为负极,失去电子发生氧化反应,电极反应为CH3OH+H2O-6e-CO2+6H+,A正确;B极为正极,得电子发生还原反应,电极反应为O2+H++2e-H,B正确;阳离子向正极移动,则电解质溶液中H+由电极A流向电极B,C正确;题目未说明气体所处的状态,无法计算生成气体的体积,D错误。
10.B 解析 锌-空气电池中锌为负极,即a为负极,b为正极,电解质溶液为氢氧化钾溶液。电路中转移2 mol电子时,65 g Zn被氧化,A错误;b极氧气得电子发生还原反应,电极反应式为O2+4e-+2H2O4OH-,B正确;放电过程中,负极消耗OH-,负极附近溶液碱性减弱,C错误;放电过程中,K+移向正极b极,D错误。
11.D 解析 装置无外接电源,则为原电池,根据B电极H2O→O2,氧元素化合价升高可知,B为负极,电极反应式为2H2O-4e-O2↑+4H+,故C正确; B为负极,A为正极,电子由B极经导线流向A极,故A正确;A为正极,生成的H+向A极移动,故B正确;A极发生两个反应:2H++2e-H2↑、3CO2+18e-+18H+CH3CH(OH)CH3+5H2O,每生成60 g即1 mol异丙醇,转移电子数大于18NA,故D错误。
12.C 解析 通入H2的一端是电池负极,A正确;负极反应为H2-2e-2H+,当消耗标准状况下11.2 L(0.5 mol)H2时,电子转移1 mol,B正确;原电池工作时,阳离子向正极移动,即H+由右通过质子膜向左移动,C错误;CO在正极得电子被还原为CH3OH,电极反应为CO+4e-+4H+CH3OH,D正确。
13.B 解析 题图中Na→Na+发生氧化反应,则Na电极为负极,A正确;题图中正极上H+发生还原反应生成H2(g),CO2→HC未发生氧化还原反应,B错误;Na与水剧烈反应生成NaOH和H2,故“有机电解质”不能换成NaOH溶液,C正确;当电路中转移1 mol e-时,正极区溶液生成1 mol HC,据碳原子守恒推知理论上吸收1 mol CO2,D正确。
14.B 解析 由图可知,放电时,a极为原电池正极,锂离子作用下FePO4在正极得到电子发生还原反应生成LiFePO4,b极为负极,Li7Ti5O12在负极失去电子发生氧化反应生成Li4Ti5O12。由上述分析可知,放电时,a极为原电池正极,b极为负极,则阳离子锂离子移向正极a极,故A正确;由上述分析可知,放电时,Li7Ti5O12在负极失去电子发生氧化反应生成Li4Ti5O12,钛元素的化合价升高,Li元素的化合价不变,故B错误;由上述分析可知,放电时,a极为原电池正极,锂离子作用下FePO4在正极得到电子发生还原反应生成LiFePO4,电极反应式为FePO4+Li++e-LiFePO4,故C正确;由上述分析可知,放电时总反应为3FePO4+Li7Ti5O123LiFePO4+Li4Ti5O12,则外电路转移1 mol电子时,负极质量减少7 g,正极质量增加7 g,两极质量变化差为14 g,故D正确。
15.答案 (1)①MnO2 ②锌与还原出来的铜形成铜锌原电池而加快锌的腐蚀 B
(2)①正极 还原 碱性
②O2+4H++4e-2H2O 负 ③1
解析 (1)②锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀。除杂的基本要求是不能引入新杂质,所以应选Zn将Cu2+置换为单质而除去。
(2)①X极是O2得电子发生还原反应,作正极,根据X极的电极反应式确定电解质显碱性。
③在标准状况下,有5.6 L O2即0.25 mol O2完全反应,1 mol O2得4 mol电子,则电路中转移1 mol电子。
16.答案 (1)探究电极材料对自制水果电池效果的影响 在其他条件相同时,电极材料活动性差别越大,自制水果电池效果越好
(2)①④ 在其他条件相同时,电极间距越小,电流越大,自制水果电池效果越好
(3)作电解质溶液
(4)两极金属活动性不同 能发生自发的氧化还原反应 形成闭合回路 有电解质溶液
(5)3Cu2++6e-3Cu 2Al-6e-2Al3+
2Al+3Cu2+3Cu+2Al3+
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
