第2章 元素与物质世界 分层作业10 离子反应--2025鲁科版化学必修第一册同步练习题(含答案)
文档属性
| 名称 | 第2章 元素与物质世界 分层作业10 离子反应--2025鲁科版化学必修第一册同步练习题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 468.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-27 18:44:20 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2025鲁科版化学必修第一册
分层作业10 离子反应
A级 必备知识基础练
题组1.离子反应的判断
1.(2024安徽淮南模拟)下列有关反应中不属于离子反应的是( )
A.Na2CO3溶液与澄清石灰水的反应
B.氢氧化铜与稀硫酸的反应
C.锌与氯化铜溶液的反应
D.二氧化碳与生石灰作用生成碳酸钙的反应
2.(2024山东青岛二中高一检测)某同学在实验室中进行如下实验:
编号 Ⅰ Ⅱ Ⅲ
实验
现象 没有明显变化,溶液仍为无色 有白色沉淀生成,溶液为蓝色 有无色气体放出
以下结论正确的是( )
A.Ⅰ中无明显变化,说明两溶液不反应
B.Ⅱ中的白色沉淀为CuCl2
C.Ⅲ中的离子方程式为2H++ZnZn2++H2↑
D.Ⅲ中发生的反应不是离子反应
题组2.离子共存
3.(2024山东临沂四中模拟)常温下,在下列各组指定溶液中一定能大量共存的是( )
A.无色溶液:K+、Na+、Ba2+、S
B.能使pH试纸变深蓝色的溶液:Cl-、HC、S、Na+
C.酸性溶液:Mg2+、Na+、S、Cl-
D.碱性溶液:K+、S、N、Cu2+
题组3.离子反应的应用
4.只用一种试剂就能把浓度为1 mol·L-1的Na2SO4、Na2SO3、Na2CO3和BaCl2溶液鉴别出来,则这种试剂是( )
A.CaCl2溶液 B.AgNO3溶液
C.稀硫酸 D.稀盐酸
5.(2024山东莱阳一中模拟)某废水中存在大量的Na+、Cl-、N、S,欲除去其中的N和S,设计了如图流程:
(已知N+OH-NH3↑+H2O)
下列说法不正确的是( )
A.NaOH的作用是除去N
B.Na2CO3的作用是除去过量的Ba2+
C.试剂a为H2SO4溶液
D.NaOH改在过滤后加入可达到相同目的
题组4.离子方程式的书写与正误判断
6.(2024江苏高一学情调研)下列离子方程式书写正确的是( )
A.澄清石灰水与稀硝酸反应:OH-+H+H2O
B.小苏打与稀盐酸反应:C+2H+CO2↑+H2O
C.稀硫酸除铁锈:6H++Fe2O32Fe2++3H2O
D.向氯化钙溶液中通入CO2:CO2+Ca2++H2OCaCO3↓+2H+
7.(2024河北石家庄一中模拟)下列离子方程式中,只能表示一个化学反应的是( )
A.C+2H+CO2↑+H2O
B.Ba2++2OH-+2H++SBaSO4↓+2H2O
C.Cl2+H2OH++Cl-+HClO
D.Fe+Cu2+Fe2++Cu
8.(2024河南部分学校高一大联考)分类是认识和研究物质及其变化的一种常用的科学方法,通过分类可以设计物质间的转化途径。
Ⅰ.“生活离不开化学”。现有厨房中的下列调味品:
①食盐;②小苏打;③面碱(主要成分为Na2CO3);④食醋(主要成分为醋酸);⑤白酒(主要成分为乙醇);⑥白砂糖(主要成分为蔗糖)。
(1)主要成分属于酸的是 (填序号)。
(2)Na2CO3在水溶液中的电离方程式是 。
(3)面碱中含有少量NaCl。检验此混合物中Cl-的实验步骤如下:将少量混合物加水溶解后,加入足量稀硝酸,再加入 溶液(填化学式),可观察到白色沉淀,说明溶液中存在Cl-,生成白色沉淀的离子方程式为 。
(4)保温瓶中水垢的主要成分之一是CaCO3,利用食醋可以浸泡除去,反应的离子方程式为 。
(5)小苏打与面碱比较,其与酸反应更剧烈,因此家庭中可用醋酸鉴别小苏打和面碱。小苏打与醋酸溶液反应的离子方程式为 。
Ⅱ.请从下列试剂中选择最合适的试剂完成指定转化(试剂可以重复选择)。
试剂:NaOH溶液、澄清石灰水、NaCl溶液、Na2CO3溶液、稀盐酸。
(6)NaHCO3溶液→Na2CO3溶液的化学方程式: 。
(7)SO2→S的离子方程式: 。
B级 关键能力提升练
以下选择题有1~2个选项符合题意。
9.(2024山东淄博实验中学模拟)下列各组离子或分子能大量共存且当加入相应试剂后发生反应的离子方程式书写正确并完整的是( )
选项 离子或分子 加入试剂 离子方程式
A K+、Mg2+、S Ba(OH)2溶液 Ba2++SBaSO4↓
B Na+、HC、Cl- NaOH溶液 OH-+HCC+H2O
C K+、 NH3·H2O、Cl- 通入少量CO2 2OH-+CO2C+H2O
D Ca2+、N、C NaHSO4溶液 C+2H+CO2↑+H2O
10.(2024山东青岛五十八中模拟)下列离子方程式正确的是( )
A.硫酸溶液中滴加足量氢氧化钡溶液:H++S+Ba2++OH-H2O+BaSO4↓
B.澄清石灰水中加入碳酸钠溶液:Ca2++CCaCO3↓
C.碳酸钙与醋酸溶液反应:CaCO3+2H+Ca2++H2O+CO2↑
D.小苏打与氢氧化钠溶液的反应:HC+OH-C+H2O
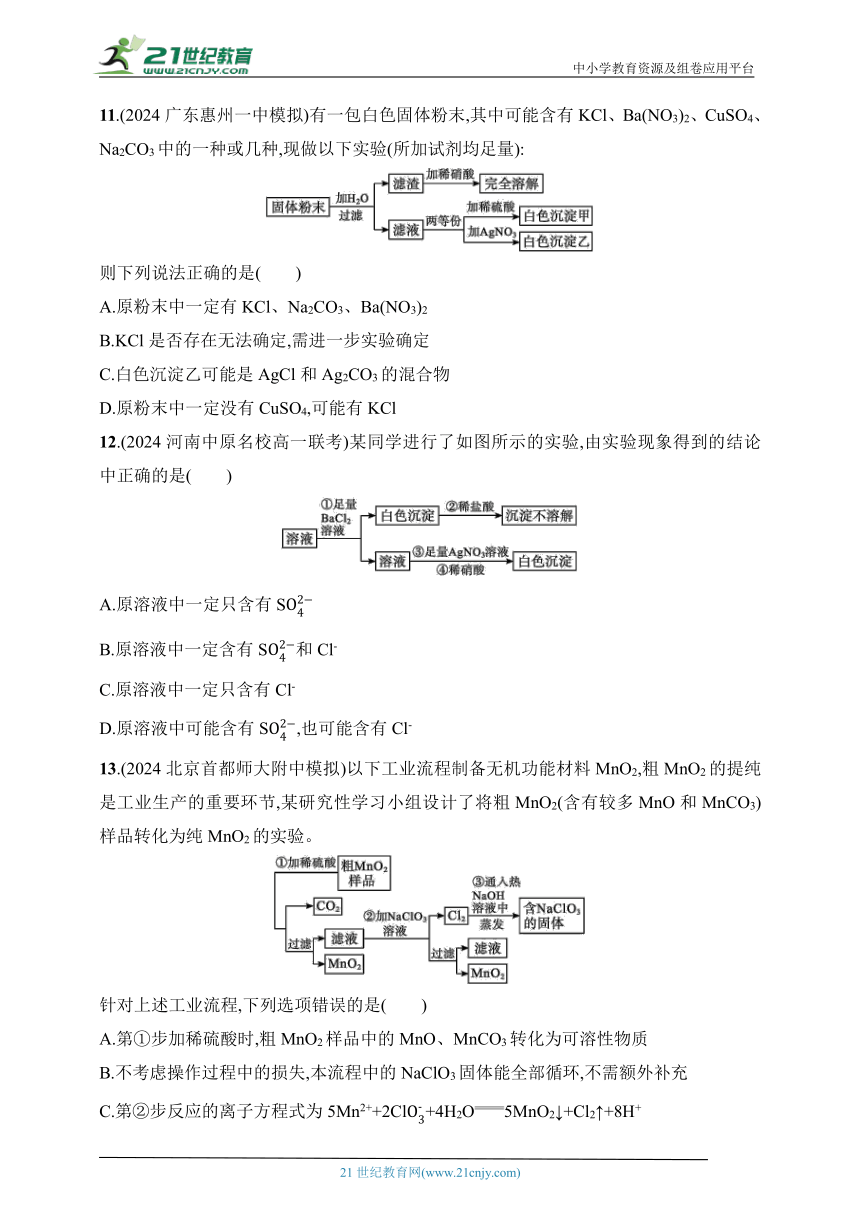
11.(2024广东惠州一中模拟)有一包白色固体粉末,其中可能含有KCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验(所加试剂均足量):
则下列说法正确的是( )
A.原粉末中一定有KCl、Na2CO3、Ba(NO3)2
B.KCl是否存在无法确定,需进一步实验确定
C.白色沉淀乙可能是AgCl和Ag2CO3的混合物
D.原粉末中一定没有CuSO4,可能有KCl
12.(2024河南中原名校高一联考)某同学进行了如图所示的实验,由实验现象得到的结论中正确的是( )
A.原溶液中一定只含有S
B.原溶液中一定含有S和Cl-
C.原溶液中一定只含有Cl-
D.原溶液中可能含有S,也可能含有Cl-
13.(2024北京首都师大附中模拟)以下工业流程制备无机功能材料MnO2,粗MnO2的提纯是工业生产的重要环节,某研究性学习小组设计了将粗MnO2(含有较多MnO和MnCO3)样品转化为纯MnO2的实验。
针对上述工业流程,下列选项错误的是( )
A.第①步加稀硫酸时,粗MnO2样品中的MnO、MnCO3转化为可溶性物质
B.不考虑操作过程中的损失,本流程中的NaClO3固体能全部循环,不需额外补充
C.第②步反应的离子方程式为5Mn2++2Cl+4H2O5MnO2↓+Cl2↑+8H+
D.实验室模拟上述工业流程中得到MnO2固体的操作必须用到的玻璃仪器有玻璃棒、烧杯、漏斗
14.(2023广东实验中学越秀学校模拟)某地工业废水中仅大量含有下表离子中的4种:
阴离子 Cl-、N、C、S
阳离子 N、Mg2+、Ca2+、Ba2+
某同学取适量该废水进行下列实验以确定废水成分:
(1)废水一定含有的离子是 ;一定不存在的离子是 。
(2)生成白色固体Ⅰ的离子方程式为 。
(3)若要确定上述实验中无法确定是否存在的离子,可取适量该废水加入足量Ba(NO3)2溶液中,过滤后向滤液中加入 溶液(填化学式),产生白色沉淀,可确定 存在(填离子符号)。
C级 学科素养拔高练
15.(2024河南中原名校高一联考)
Ⅰ.已知A和B两支试管的溶液中共含有K+、Ag+、Mg2+、Cl-、OH-、N六种离子(A、B中不含相同离子),向试管B的溶液中滴入酚酞,溶液呈粉红色。请回答下列问题:
(1)试管B中含有的离子为 。
(2)若向试管A的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是 (填化学式)。
(3)若将试管A和试管B中的溶液按一定体积比混合过滤后,蒸干滤液可得到一种纯净物,该物质可以用作 (列举一种用途即可),混合过程中发生反应的离子方程式有 、 。
Ⅱ.向Ba(OH)2溶液中逐滴加入稀硫酸,请回答下列问题:
(4)写出反应的离子方程式: 。
(5)下列三种情况下,离子方程式与(4)相同的是 (填字母)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至S恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(6)在一定温度下,向不同电解质溶液中加入新物质时溶液电导率(σ)随新物质加入量(V)的变化曲线如图所示。分别与A、B、C曲线变化趋势一致的是 (按字母顺序填序号)。
①向氨水中通入HCl气体直至过量
②向Ba(OH)2溶液中逐滴加入稀硫酸
③向硝酸中逐滴加入等浓度的氢氧化钾溶液至过量
答案:
1.D 解析 Na2CO3溶液与澄清石灰水的反应是盐和碱发生的反应,是复分解反应,实质是碳酸根离子和钙离子生成碳酸钙沉淀的离子反应,故A不选;氢氧化铜与稀硫酸的反应是碱和酸的反应,属于复分解反应,实质是氢氧化铜和氢离子反应生成铜离子和水的离子反应,故B不选;锌与氯化铜溶液反应的实质是锌与铜离子生成单质铜和锌离子的离子反应,故C不选;二氧化碳与生石灰作用生成碳酸钙的反应是气体和固体发生的化合反应,不是在溶液中发生的,不是离子反应,故选D。
2.C 解析 氢氧化钠和硫酸反应生成硫酸钠和水,但是没有明显现象,A错误;氯化钡和硫酸铜反应生成白色的硫酸钡沉淀和氯化铜,B错误;稀盐酸和锌反应生成氯化锌和氢气,其离子方程式为2H++ZnZn2++H2↑,C正确;Ⅲ中锌和稀盐酸的反应有离子参与,属于离子反应,D错误。
3.C 解析 Ba2+与S反应生成沉淀,不能大量共存,故A不选;能使pH试纸变深蓝色的溶液显碱性,OH-与HC反应,不能大量共存,故B不选;酸性溶液中,Mg2+、Na+、S、Cl-与H+不反应,相互也不反应,可以大量共存,故C符合题意;碱性溶液中OH-与Cu2+反应生成沉淀,不能大量共存,故D不选。
4.C 解析 CaCl2与Na2SO4反应生成白色硫酸钙沉淀,与Na2SO3反应生成白色亚硫酸钙沉淀,与Na2CO3反应生成白色碳酸钙沉淀,与BaCl2不反应,无法鉴别,A错误;AgNO3与Na2SO4反应生成白色硫酸银沉淀,与Na2SO3反应生成白色亚硫酸银沉淀,与Na2CO3反应生成白色碳酸银沉淀,与BaCl2反应生成白色氯化银沉淀,无法鉴别,B错误;稀硫酸与Na2SO4不反应,与Na2SO3反应生成有刺激性气味的二氧化硫气体,与Na2CO3反应生成无色无味的二氧化碳气体,与BaCl2反应生成白色硫酸钡沉淀,现象均不同,可以鉴别,C正确;稀盐酸与Na2SO4不反应,与Na2SO3反应生成有刺激性气味的二氧化硫气体,与Na2CO3反应生成无色无味的二氧化碳气体,与BaCl2不反应,无法鉴别,D错误。
5.C 解析 N与NaOH反应后加热可生成NH3,除去N,A正确;为完全除去S,加入的BaCl2需要稍过量,可利用BaCl2与Na2CO3反应生成沉淀,除去过量的Ba2+,B正确;为不引入新的杂质,试剂a为能与过量Na2CO3和NaOH反应且不引入其他杂质离子的HCl,C不正确;NaOH改在过滤后加入,则同样能除去N,且过量的NaOH一样可被HCl除去,故可达到相同目的,D正确。
6.A 解析 澄清石灰水与稀硝酸反应生成硝酸钙和水,反应的离子方程式为OH-+H+H2O,故A正确;小苏打与稀盐酸反应生成氯化钠、二氧化碳、水,反应的离子方程式为HC+H+CO2↑+H2O,故B错误;稀硫酸除铁锈生成硫酸铁、水,反应的离子方程式为6H++Fe2O32Fe3++3H2O,故C错误;弱酸不能制取强酸,氯化钙溶液和二氧化碳不反应,故D错误。
7.C 解析 C+2H+CO2↑+H2O,可以表示可溶性碳酸盐与强酸反应生成二氧化碳、水和可溶性盐,能够表示一类反应,A不符合题意;Ba2++2OH-+2H++SBaSO4↓+2H2O可表示硫酸与氢氧化钡反应或者氢氧化钡与硫酸氢盐反应,不只表示一个反应,B不符合题意;Cl2+H2OH++Cl-+HClO,只能表示氯气和水的反应,C符合题意;Fe+Cu2+Fe2++Cu,表示铁与可溶性铜盐反应,能够表示一类反应,D不符合题意。
8.答案 (1)④ (2)Na2CO32Na++C
(3)AgNO3 Ag++Cl-AgCl↓
(4)2CH3COOH+CaCO32CH3COO-+Ca2++CO2↑+H2O
(5)CH3COOH+HCCH3COO-+CO2↑+H2O
(6)NaHCO3+NaOHNa2CO3+H2O
(7)SO2+2OH-S+H2O
解析 (1)电离时生成的阳离子全部是H+的化合物是酸。题干中属于酸的为醋酸。
(2)Na2CO3在溶液中能完全电离,故电离方程式为Na2CO32Na++C。
(3)Ag+与Cl-反应生成不溶于硝酸的白色沉淀AgCl,可用AgNO3检验Cl-的存在,离子反应为Ag++Cl-AgCl↓。
(4)CH3COOH是弱酸,CaCO3难溶于水,所以在反应中都不能拆开,离子方程式为2CH3COOH+CaCO32CH3COO-+Ca2++CO2↑+H2O。
(5)CH3COOH是弱酸不能拆开,HC不能拆开,两者反应的离子方程式为CH3COOH+HCCH3COO-+CO2↑+H2O。
(6)酸式盐与碱反应转化为正盐,NaHCO3转化为Na2CO3的化学方程式为NaHCO3+NaOHNa2CO3+H2O。
(7)酸性氧化物与碱反应生成盐和水,SO2转化为S,若选择澄清石灰水生成的CaSO3难溶,所以碱选择NaOH,离子反应为SO2+2OH-S+H2O。
9.B 解析 K+、Mg2+、S可大量共存,加入Ba(OH)2溶液后,发生反应:Ba2++S+Mg2++2OH-BaSO4↓+Mg(OH)2↓,故A错误;Na+、HC、Cl-可大量共存,加入NaOH溶液后,发生反应:OH-+HCC+H2O,故B正确;K+、NH3·H2O、Cl-可大量共存,通入少量CO2后,发生反应:2NH3·H2O+CO22N+C+H2O,故C错误;Ca2+、N、C不能大量共存,Ca2+可与C生成CaCO3沉淀,故D错误。
10.BD 解析 硫酸溶液中滴加足量氢氧化钡溶液生成硫酸钡和水,A中离子个数配比不符合物质组成,离子方程式应为2H++S+Ba2++2OH-2H2O+BaSO4↓,故A错误;澄清石灰水中加入碳酸钠溶液,离子方程式:Ca2++CCaCO3↓,故B正确;碳酸钙与醋酸溶液反应,醋酸为弱酸,应保留化学式,离子方程式:CaCO3+2CH3COOHCa2++H2O+CO2↑+2CH3COO-,故C错误;碳酸氢钠与氢氧化钠反应生成碳酸钠和水,离子方程式为HC+OH-C+H2O,故D正确。
11.A 解析 固体粉末加水溶解后过滤,有完全溶于稀硝酸的滤渣,该滤渣可能是BaCO3或CuCO3,即原粉末中一定含Na2CO3;滤液加稀硫酸生成的白色沉淀甲为BaSO4,即原粉末中一定含Ba(NO3)2,则一定无CuSO4;滤液中加AgNO3生成的白色沉淀乙应为AgCl,即原粉末中含KCl。原粉末中一定有KCl、Na2CO3、Ba(NO3)2,A正确,B错误;滤液中含Ba2+,则肯定没有C,即白色沉淀乙是AgCl,不可能含Ag2CO3,C错误;原粉末中一定没有CuSO4,一定有KCl,D错误。
12.D 解析 溶液中加入氯化钡溶液,产生了白色沉淀,白色沉淀不溶于稀盐酸,则白色沉淀可能为硫酸钡、氯化银,原溶液中可能存在S或Ag+;由于①中加入了氯化钡,引进了氯离子,所以无法确定原溶液中是否含有氯离子。
13.B 解析 粗MnO2(含有较多的MnO和MnCO3)样品加入硫酸,MnO2不溶于硫酸,所以加稀硫酸时样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4,同时产生二氧化碳,向MnSO4中加入NaClO3,反应的离子方程式为5Mn2++2Cl+4H2O5MnO2↓+Cl2↑+8H+,将产生的氯气和热的氢氧化钠溶液反应可以得到NaCl和NaClO3的溶液,蒸发浓缩结晶可以得到NaClO3的固体循环利用。由以上分析可知,A正确;Cl2通入热的NaOH溶液中除生成NaClO3,还生成NaCl,则流程中NaClO3固体不可能完全循环利用,故B错误;由分析可知,C正确;过滤所需的仪器有烧杯、漏斗、玻璃棒,流程中得到MnO2固体的操作必须用到的玻璃仪器有玻璃棒、烧杯、漏斗,故D正确。
14.答案 (1)C、S、N Mg2+、Ca2+、Ba2+
(2)CO2+2OH-+Ba2+BaCO3↓+H2O
(3)AgNO3 Cl-
解析 废水中加入足量盐酸,生成的气体能与Ba(OH)2溶液反应生成白色固体Ⅰ,该气体为CO2,则溶液中含有C,固体Ⅰ为BaCO3,根据离子共存可知,原溶液中不含有Mg2+、Ca2+、Ba2+;溶液Ⅰ中含有过量盐酸,加入足量Ba(NO3)2溶液时生成白色固体Ⅱ,则原溶液中含有S,白色固体Ⅱ为BaSO4;溶液Ⅱ中加入足量AgNO3溶液,生成白色固体Ⅲ为AgCl,但起始过程中加入了足量盐酸,则Cl-是否含有不能确定;根据溶液不显电性,则原溶液中一定含有阳离子N。废水中仅大量含有表中离子中的4种,则废水中一定含有的离子是C、S、N和Cl-或N,不能确定的离子为Cl-、N,一定不存在的离子是Mg2+、Ca2+、Ba2+。
(3)由分析可知,不能确定的离子为Cl-、N,原溶液中含有C、S,会干扰Cl-的检验,检验Cl-必须先加入足量Ba(NO3)2溶液,过滤除去C、S,再加入AgNO3溶液,若产生白色沉淀,可确定含有Cl-。
15.答案 (1)K+、Cl-、OH- (2)Mg
(3)肥料 Ag++Cl-AgCl↓ Mg2++2OH-Mg(OH)2↓
(4)Ba2++2OH-+2H++SBaSO4↓+2H2O
(5)A (6)②③①
解析 (1)已知A和B两支试管的溶液中共含有K+、Ag+、Mg2+、Cl-、OH-、N六种离子,向试管B的溶液中滴入酚酞,溶液呈粉红色,则试管B中有OH-,则无Ag+、Mg2+,则有K+,由于Ag+和Cl-能反应生成沉淀,那么试管B中还有Cl-。综上,试管B中含有的离子为K+、Cl-、OH-。
(2)由(1)的分析可知,试管A中含有的离子为Ag+、Mg2+、N三种,向试管A的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是Mg,得到的金属是Ag。
(3)试管A中含有的离子为Ag+、Mg2+、N,试管B中含有的离子为K+、Cl-、OH-,将试管A和试管B中的溶液按一定体积比混合,混合过程中发生反应的离子方程式为Ag++Cl-AgCl↓、Mg2++2OH-Mg(OH)2↓,过滤、蒸干滤液可得到纯净物KNO3,KNO3可以用作肥料。
(4)向Ba(OH)2溶液中逐滴加入稀硫酸,二者反应生成硫酸钡沉淀和水,对应的离子方程式:Ba2++2OH-+2H++SBaSO4↓+2H2O。
(5)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性,离子方程式为Ba2++2OH-+2H++SBaSO4↓+2H2O,与(4)的离子方程式相同,A符合题意;向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至S恰好完全沉淀,离子方程式为Ba2++OH-+H++SBaSO4↓+H2O,与(4)的离子方程式不相同,B不符合题意;向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量,离子方程式为Ba2++OH-+H++SBaSO4↓+H2O,与(4)的离子方程式不相同,C不符合题意。
(6)溶液的导电能力与溶液中离子的浓度、离子所带的电荷数有关,离子带的电荷数越多、离子浓度越大,溶液的导电能力越强,溶液浓度差别不大的情况下,强电解质溶液的导电能力强于弱电解质溶液的导电能力。①向氨水中通入HCl气体直至过量,溶液的变化情况:NH3·H2O溶液→NH4Cl溶液→NH4Cl、HCl混合溶液,溶液由弱电解质溶液转变成强电解质溶液,导电能力增大,这与C曲线变化趋势一致;②向Ba(OH)2溶液中逐滴加入稀硫酸,溶液的变化情况:Ba(OH)2溶液→水→稀硫酸,一开始溶液的导电能力较强,随着硫酸的加入,生成了硫酸钡沉淀和水,水为弱电解质,导电能力非常小(几乎不导电),硫酸是强电解质,继续加入硫酸溶液,导电能力增大,这与A曲线变化趋势一致;③向硝酸中逐滴加入等浓度的氢氧化钾溶液至过量,溶液的变化情况:HNO3溶液→KNO3溶液→HNO3、KNO3的混合溶液,在HNO3溶液→KNO3溶液过程中发生反应KOH+HNO3KNO3+H2O,溶液离子浓度减小,导电能力不断减小,后来再加KOH溶液,导电能力稍有提升,但由于溶液一直属于强电解质溶液,导电能力变化幅度不是太大,这与B曲线变化趋势一致。故分别与A、B、C曲线变化趋势一致的是②③①。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025鲁科版化学必修第一册
分层作业10 离子反应
A级 必备知识基础练
题组1.离子反应的判断
1.(2024安徽淮南模拟)下列有关反应中不属于离子反应的是( )
A.Na2CO3溶液与澄清石灰水的反应
B.氢氧化铜与稀硫酸的反应
C.锌与氯化铜溶液的反应
D.二氧化碳与生石灰作用生成碳酸钙的反应
2.(2024山东青岛二中高一检测)某同学在实验室中进行如下实验:
编号 Ⅰ Ⅱ Ⅲ
实验
现象 没有明显变化,溶液仍为无色 有白色沉淀生成,溶液为蓝色 有无色气体放出
以下结论正确的是( )
A.Ⅰ中无明显变化,说明两溶液不反应
B.Ⅱ中的白色沉淀为CuCl2
C.Ⅲ中的离子方程式为2H++ZnZn2++H2↑
D.Ⅲ中发生的反应不是离子反应
题组2.离子共存
3.(2024山东临沂四中模拟)常温下,在下列各组指定溶液中一定能大量共存的是( )
A.无色溶液:K+、Na+、Ba2+、S
B.能使pH试纸变深蓝色的溶液:Cl-、HC、S、Na+
C.酸性溶液:Mg2+、Na+、S、Cl-
D.碱性溶液:K+、S、N、Cu2+
题组3.离子反应的应用
4.只用一种试剂就能把浓度为1 mol·L-1的Na2SO4、Na2SO3、Na2CO3和BaCl2溶液鉴别出来,则这种试剂是( )
A.CaCl2溶液 B.AgNO3溶液
C.稀硫酸 D.稀盐酸
5.(2024山东莱阳一中模拟)某废水中存在大量的Na+、Cl-、N、S,欲除去其中的N和S,设计了如图流程:
(已知N+OH-NH3↑+H2O)
下列说法不正确的是( )
A.NaOH的作用是除去N
B.Na2CO3的作用是除去过量的Ba2+
C.试剂a为H2SO4溶液
D.NaOH改在过滤后加入可达到相同目的
题组4.离子方程式的书写与正误判断
6.(2024江苏高一学情调研)下列离子方程式书写正确的是( )
A.澄清石灰水与稀硝酸反应:OH-+H+H2O
B.小苏打与稀盐酸反应:C+2H+CO2↑+H2O
C.稀硫酸除铁锈:6H++Fe2O32Fe2++3H2O
D.向氯化钙溶液中通入CO2:CO2+Ca2++H2OCaCO3↓+2H+
7.(2024河北石家庄一中模拟)下列离子方程式中,只能表示一个化学反应的是( )
A.C+2H+CO2↑+H2O
B.Ba2++2OH-+2H++SBaSO4↓+2H2O
C.Cl2+H2OH++Cl-+HClO
D.Fe+Cu2+Fe2++Cu
8.(2024河南部分学校高一大联考)分类是认识和研究物质及其变化的一种常用的科学方法,通过分类可以设计物质间的转化途径。
Ⅰ.“生活离不开化学”。现有厨房中的下列调味品:
①食盐;②小苏打;③面碱(主要成分为Na2CO3);④食醋(主要成分为醋酸);⑤白酒(主要成分为乙醇);⑥白砂糖(主要成分为蔗糖)。
(1)主要成分属于酸的是 (填序号)。
(2)Na2CO3在水溶液中的电离方程式是 。
(3)面碱中含有少量NaCl。检验此混合物中Cl-的实验步骤如下:将少量混合物加水溶解后,加入足量稀硝酸,再加入 溶液(填化学式),可观察到白色沉淀,说明溶液中存在Cl-,生成白色沉淀的离子方程式为 。
(4)保温瓶中水垢的主要成分之一是CaCO3,利用食醋可以浸泡除去,反应的离子方程式为 。
(5)小苏打与面碱比较,其与酸反应更剧烈,因此家庭中可用醋酸鉴别小苏打和面碱。小苏打与醋酸溶液反应的离子方程式为 。
Ⅱ.请从下列试剂中选择最合适的试剂完成指定转化(试剂可以重复选择)。
试剂:NaOH溶液、澄清石灰水、NaCl溶液、Na2CO3溶液、稀盐酸。
(6)NaHCO3溶液→Na2CO3溶液的化学方程式: 。
(7)SO2→S的离子方程式: 。
B级 关键能力提升练
以下选择题有1~2个选项符合题意。
9.(2024山东淄博实验中学模拟)下列各组离子或分子能大量共存且当加入相应试剂后发生反应的离子方程式书写正确并完整的是( )
选项 离子或分子 加入试剂 离子方程式
A K+、Mg2+、S Ba(OH)2溶液 Ba2++SBaSO4↓
B Na+、HC、Cl- NaOH溶液 OH-+HCC+H2O
C K+、 NH3·H2O、Cl- 通入少量CO2 2OH-+CO2C+H2O
D Ca2+、N、C NaHSO4溶液 C+2H+CO2↑+H2O
10.(2024山东青岛五十八中模拟)下列离子方程式正确的是( )
A.硫酸溶液中滴加足量氢氧化钡溶液:H++S+Ba2++OH-H2O+BaSO4↓
B.澄清石灰水中加入碳酸钠溶液:Ca2++CCaCO3↓
C.碳酸钙与醋酸溶液反应:CaCO3+2H+Ca2++H2O+CO2↑
D.小苏打与氢氧化钠溶液的反应:HC+OH-C+H2O
11.(2024广东惠州一中模拟)有一包白色固体粉末,其中可能含有KCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验(所加试剂均足量):
则下列说法正确的是( )
A.原粉末中一定有KCl、Na2CO3、Ba(NO3)2
B.KCl是否存在无法确定,需进一步实验确定
C.白色沉淀乙可能是AgCl和Ag2CO3的混合物
D.原粉末中一定没有CuSO4,可能有KCl
12.(2024河南中原名校高一联考)某同学进行了如图所示的实验,由实验现象得到的结论中正确的是( )
A.原溶液中一定只含有S
B.原溶液中一定含有S和Cl-
C.原溶液中一定只含有Cl-
D.原溶液中可能含有S,也可能含有Cl-
13.(2024北京首都师大附中模拟)以下工业流程制备无机功能材料MnO2,粗MnO2的提纯是工业生产的重要环节,某研究性学习小组设计了将粗MnO2(含有较多MnO和MnCO3)样品转化为纯MnO2的实验。
针对上述工业流程,下列选项错误的是( )
A.第①步加稀硫酸时,粗MnO2样品中的MnO、MnCO3转化为可溶性物质
B.不考虑操作过程中的损失,本流程中的NaClO3固体能全部循环,不需额外补充
C.第②步反应的离子方程式为5Mn2++2Cl+4H2O5MnO2↓+Cl2↑+8H+
D.实验室模拟上述工业流程中得到MnO2固体的操作必须用到的玻璃仪器有玻璃棒、烧杯、漏斗
14.(2023广东实验中学越秀学校模拟)某地工业废水中仅大量含有下表离子中的4种:
阴离子 Cl-、N、C、S
阳离子 N、Mg2+、Ca2+、Ba2+
某同学取适量该废水进行下列实验以确定废水成分:
(1)废水一定含有的离子是 ;一定不存在的离子是 。
(2)生成白色固体Ⅰ的离子方程式为 。
(3)若要确定上述实验中无法确定是否存在的离子,可取适量该废水加入足量Ba(NO3)2溶液中,过滤后向滤液中加入 溶液(填化学式),产生白色沉淀,可确定 存在(填离子符号)。
C级 学科素养拔高练
15.(2024河南中原名校高一联考)
Ⅰ.已知A和B两支试管的溶液中共含有K+、Ag+、Mg2+、Cl-、OH-、N六种离子(A、B中不含相同离子),向试管B的溶液中滴入酚酞,溶液呈粉红色。请回答下列问题:
(1)试管B中含有的离子为 。
(2)若向试管A的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是 (填化学式)。
(3)若将试管A和试管B中的溶液按一定体积比混合过滤后,蒸干滤液可得到一种纯净物,该物质可以用作 (列举一种用途即可),混合过程中发生反应的离子方程式有 、 。
Ⅱ.向Ba(OH)2溶液中逐滴加入稀硫酸,请回答下列问题:
(4)写出反应的离子方程式: 。
(5)下列三种情况下,离子方程式与(4)相同的是 (填字母)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至S恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(6)在一定温度下,向不同电解质溶液中加入新物质时溶液电导率(σ)随新物质加入量(V)的变化曲线如图所示。分别与A、B、C曲线变化趋势一致的是 (按字母顺序填序号)。
①向氨水中通入HCl气体直至过量
②向Ba(OH)2溶液中逐滴加入稀硫酸
③向硝酸中逐滴加入等浓度的氢氧化钾溶液至过量
答案:
1.D 解析 Na2CO3溶液与澄清石灰水的反应是盐和碱发生的反应,是复分解反应,实质是碳酸根离子和钙离子生成碳酸钙沉淀的离子反应,故A不选;氢氧化铜与稀硫酸的反应是碱和酸的反应,属于复分解反应,实质是氢氧化铜和氢离子反应生成铜离子和水的离子反应,故B不选;锌与氯化铜溶液反应的实质是锌与铜离子生成单质铜和锌离子的离子反应,故C不选;二氧化碳与生石灰作用生成碳酸钙的反应是气体和固体发生的化合反应,不是在溶液中发生的,不是离子反应,故选D。
2.C 解析 氢氧化钠和硫酸反应生成硫酸钠和水,但是没有明显现象,A错误;氯化钡和硫酸铜反应生成白色的硫酸钡沉淀和氯化铜,B错误;稀盐酸和锌反应生成氯化锌和氢气,其离子方程式为2H++ZnZn2++H2↑,C正确;Ⅲ中锌和稀盐酸的反应有离子参与,属于离子反应,D错误。
3.C 解析 Ba2+与S反应生成沉淀,不能大量共存,故A不选;能使pH试纸变深蓝色的溶液显碱性,OH-与HC反应,不能大量共存,故B不选;酸性溶液中,Mg2+、Na+、S、Cl-与H+不反应,相互也不反应,可以大量共存,故C符合题意;碱性溶液中OH-与Cu2+反应生成沉淀,不能大量共存,故D不选。
4.C 解析 CaCl2与Na2SO4反应生成白色硫酸钙沉淀,与Na2SO3反应生成白色亚硫酸钙沉淀,与Na2CO3反应生成白色碳酸钙沉淀,与BaCl2不反应,无法鉴别,A错误;AgNO3与Na2SO4反应生成白色硫酸银沉淀,与Na2SO3反应生成白色亚硫酸银沉淀,与Na2CO3反应生成白色碳酸银沉淀,与BaCl2反应生成白色氯化银沉淀,无法鉴别,B错误;稀硫酸与Na2SO4不反应,与Na2SO3反应生成有刺激性气味的二氧化硫气体,与Na2CO3反应生成无色无味的二氧化碳气体,与BaCl2反应生成白色硫酸钡沉淀,现象均不同,可以鉴别,C正确;稀盐酸与Na2SO4不反应,与Na2SO3反应生成有刺激性气味的二氧化硫气体,与Na2CO3反应生成无色无味的二氧化碳气体,与BaCl2不反应,无法鉴别,D错误。
5.C 解析 N与NaOH反应后加热可生成NH3,除去N,A正确;为完全除去S,加入的BaCl2需要稍过量,可利用BaCl2与Na2CO3反应生成沉淀,除去过量的Ba2+,B正确;为不引入新的杂质,试剂a为能与过量Na2CO3和NaOH反应且不引入其他杂质离子的HCl,C不正确;NaOH改在过滤后加入,则同样能除去N,且过量的NaOH一样可被HCl除去,故可达到相同目的,D正确。
6.A 解析 澄清石灰水与稀硝酸反应生成硝酸钙和水,反应的离子方程式为OH-+H+H2O,故A正确;小苏打与稀盐酸反应生成氯化钠、二氧化碳、水,反应的离子方程式为HC+H+CO2↑+H2O,故B错误;稀硫酸除铁锈生成硫酸铁、水,反应的离子方程式为6H++Fe2O32Fe3++3H2O,故C错误;弱酸不能制取强酸,氯化钙溶液和二氧化碳不反应,故D错误。
7.C 解析 C+2H+CO2↑+H2O,可以表示可溶性碳酸盐与强酸反应生成二氧化碳、水和可溶性盐,能够表示一类反应,A不符合题意;Ba2++2OH-+2H++SBaSO4↓+2H2O可表示硫酸与氢氧化钡反应或者氢氧化钡与硫酸氢盐反应,不只表示一个反应,B不符合题意;Cl2+H2OH++Cl-+HClO,只能表示氯气和水的反应,C符合题意;Fe+Cu2+Fe2++Cu,表示铁与可溶性铜盐反应,能够表示一类反应,D不符合题意。
8.答案 (1)④ (2)Na2CO32Na++C
(3)AgNO3 Ag++Cl-AgCl↓
(4)2CH3COOH+CaCO32CH3COO-+Ca2++CO2↑+H2O
(5)CH3COOH+HCCH3COO-+CO2↑+H2O
(6)NaHCO3+NaOHNa2CO3+H2O
(7)SO2+2OH-S+H2O
解析 (1)电离时生成的阳离子全部是H+的化合物是酸。题干中属于酸的为醋酸。
(2)Na2CO3在溶液中能完全电离,故电离方程式为Na2CO32Na++C。
(3)Ag+与Cl-反应生成不溶于硝酸的白色沉淀AgCl,可用AgNO3检验Cl-的存在,离子反应为Ag++Cl-AgCl↓。
(4)CH3COOH是弱酸,CaCO3难溶于水,所以在反应中都不能拆开,离子方程式为2CH3COOH+CaCO32CH3COO-+Ca2++CO2↑+H2O。
(5)CH3COOH是弱酸不能拆开,HC不能拆开,两者反应的离子方程式为CH3COOH+HCCH3COO-+CO2↑+H2O。
(6)酸式盐与碱反应转化为正盐,NaHCO3转化为Na2CO3的化学方程式为NaHCO3+NaOHNa2CO3+H2O。
(7)酸性氧化物与碱反应生成盐和水,SO2转化为S,若选择澄清石灰水生成的CaSO3难溶,所以碱选择NaOH,离子反应为SO2+2OH-S+H2O。
9.B 解析 K+、Mg2+、S可大量共存,加入Ba(OH)2溶液后,发生反应:Ba2++S+Mg2++2OH-BaSO4↓+Mg(OH)2↓,故A错误;Na+、HC、Cl-可大量共存,加入NaOH溶液后,发生反应:OH-+HCC+H2O,故B正确;K+、NH3·H2O、Cl-可大量共存,通入少量CO2后,发生反应:2NH3·H2O+CO22N+C+H2O,故C错误;Ca2+、N、C不能大量共存,Ca2+可与C生成CaCO3沉淀,故D错误。
10.BD 解析 硫酸溶液中滴加足量氢氧化钡溶液生成硫酸钡和水,A中离子个数配比不符合物质组成,离子方程式应为2H++S+Ba2++2OH-2H2O+BaSO4↓,故A错误;澄清石灰水中加入碳酸钠溶液,离子方程式:Ca2++CCaCO3↓,故B正确;碳酸钙与醋酸溶液反应,醋酸为弱酸,应保留化学式,离子方程式:CaCO3+2CH3COOHCa2++H2O+CO2↑+2CH3COO-,故C错误;碳酸氢钠与氢氧化钠反应生成碳酸钠和水,离子方程式为HC+OH-C+H2O,故D正确。
11.A 解析 固体粉末加水溶解后过滤,有完全溶于稀硝酸的滤渣,该滤渣可能是BaCO3或CuCO3,即原粉末中一定含Na2CO3;滤液加稀硫酸生成的白色沉淀甲为BaSO4,即原粉末中一定含Ba(NO3)2,则一定无CuSO4;滤液中加AgNO3生成的白色沉淀乙应为AgCl,即原粉末中含KCl。原粉末中一定有KCl、Na2CO3、Ba(NO3)2,A正确,B错误;滤液中含Ba2+,则肯定没有C,即白色沉淀乙是AgCl,不可能含Ag2CO3,C错误;原粉末中一定没有CuSO4,一定有KCl,D错误。
12.D 解析 溶液中加入氯化钡溶液,产生了白色沉淀,白色沉淀不溶于稀盐酸,则白色沉淀可能为硫酸钡、氯化银,原溶液中可能存在S或Ag+;由于①中加入了氯化钡,引进了氯离子,所以无法确定原溶液中是否含有氯离子。
13.B 解析 粗MnO2(含有较多的MnO和MnCO3)样品加入硫酸,MnO2不溶于硫酸,所以加稀硫酸时样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4,同时产生二氧化碳,向MnSO4中加入NaClO3,反应的离子方程式为5Mn2++2Cl+4H2O5MnO2↓+Cl2↑+8H+,将产生的氯气和热的氢氧化钠溶液反应可以得到NaCl和NaClO3的溶液,蒸发浓缩结晶可以得到NaClO3的固体循环利用。由以上分析可知,A正确;Cl2通入热的NaOH溶液中除生成NaClO3,还生成NaCl,则流程中NaClO3固体不可能完全循环利用,故B错误;由分析可知,C正确;过滤所需的仪器有烧杯、漏斗、玻璃棒,流程中得到MnO2固体的操作必须用到的玻璃仪器有玻璃棒、烧杯、漏斗,故D正确。
14.答案 (1)C、S、N Mg2+、Ca2+、Ba2+
(2)CO2+2OH-+Ba2+BaCO3↓+H2O
(3)AgNO3 Cl-
解析 废水中加入足量盐酸,生成的气体能与Ba(OH)2溶液反应生成白色固体Ⅰ,该气体为CO2,则溶液中含有C,固体Ⅰ为BaCO3,根据离子共存可知,原溶液中不含有Mg2+、Ca2+、Ba2+;溶液Ⅰ中含有过量盐酸,加入足量Ba(NO3)2溶液时生成白色固体Ⅱ,则原溶液中含有S,白色固体Ⅱ为BaSO4;溶液Ⅱ中加入足量AgNO3溶液,生成白色固体Ⅲ为AgCl,但起始过程中加入了足量盐酸,则Cl-是否含有不能确定;根据溶液不显电性,则原溶液中一定含有阳离子N。废水中仅大量含有表中离子中的4种,则废水中一定含有的离子是C、S、N和Cl-或N,不能确定的离子为Cl-、N,一定不存在的离子是Mg2+、Ca2+、Ba2+。
(3)由分析可知,不能确定的离子为Cl-、N,原溶液中含有C、S,会干扰Cl-的检验,检验Cl-必须先加入足量Ba(NO3)2溶液,过滤除去C、S,再加入AgNO3溶液,若产生白色沉淀,可确定含有Cl-。
15.答案 (1)K+、Cl-、OH- (2)Mg
(3)肥料 Ag++Cl-AgCl↓ Mg2++2OH-Mg(OH)2↓
(4)Ba2++2OH-+2H++SBaSO4↓+2H2O
(5)A (6)②③①
解析 (1)已知A和B两支试管的溶液中共含有K+、Ag+、Mg2+、Cl-、OH-、N六种离子,向试管B的溶液中滴入酚酞,溶液呈粉红色,则试管B中有OH-,则无Ag+、Mg2+,则有K+,由于Ag+和Cl-能反应生成沉淀,那么试管B中还有Cl-。综上,试管B中含有的离子为K+、Cl-、OH-。
(2)由(1)的分析可知,试管A中含有的离子为Ag+、Mg2+、N三种,向试管A的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是Mg,得到的金属是Ag。
(3)试管A中含有的离子为Ag+、Mg2+、N,试管B中含有的离子为K+、Cl-、OH-,将试管A和试管B中的溶液按一定体积比混合,混合过程中发生反应的离子方程式为Ag++Cl-AgCl↓、Mg2++2OH-Mg(OH)2↓,过滤、蒸干滤液可得到纯净物KNO3,KNO3可以用作肥料。
(4)向Ba(OH)2溶液中逐滴加入稀硫酸,二者反应生成硫酸钡沉淀和水,对应的离子方程式:Ba2++2OH-+2H++SBaSO4↓+2H2O。
(5)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性,离子方程式为Ba2++2OH-+2H++SBaSO4↓+2H2O,与(4)的离子方程式相同,A符合题意;向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至S恰好完全沉淀,离子方程式为Ba2++OH-+H++SBaSO4↓+H2O,与(4)的离子方程式不相同,B不符合题意;向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量,离子方程式为Ba2++OH-+H++SBaSO4↓+H2O,与(4)的离子方程式不相同,C不符合题意。
(6)溶液的导电能力与溶液中离子的浓度、离子所带的电荷数有关,离子带的电荷数越多、离子浓度越大,溶液的导电能力越强,溶液浓度差别不大的情况下,强电解质溶液的导电能力强于弱电解质溶液的导电能力。①向氨水中通入HCl气体直至过量,溶液的变化情况:NH3·H2O溶液→NH4Cl溶液→NH4Cl、HCl混合溶液,溶液由弱电解质溶液转变成强电解质溶液,导电能力增大,这与C曲线变化趋势一致;②向Ba(OH)2溶液中逐滴加入稀硫酸,溶液的变化情况:Ba(OH)2溶液→水→稀硫酸,一开始溶液的导电能力较强,随着硫酸的加入,生成了硫酸钡沉淀和水,水为弱电解质,导电能力非常小(几乎不导电),硫酸是强电解质,继续加入硫酸溶液,导电能力增大,这与A曲线变化趋势一致;③向硝酸中逐滴加入等浓度的氢氧化钾溶液至过量,溶液的变化情况:HNO3溶液→KNO3溶液→HNO3、KNO3的混合溶液,在HNO3溶液→KNO3溶液过程中发生反应KOH+HNO3KNO3+H2O,溶液离子浓度减小,导电能力不断减小,后来再加KOH溶液,导电能力稍有提升,但由于溶液一直属于强电解质溶液,导电能力变化幅度不是太大,这与B曲线变化趋势一致。故分别与A、B、C曲线变化趋势一致的是②③①。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
