第2章 元素与物质世界 分层作业12 氧化剂和还原剂--2025鲁科版化学必修第一册同步练习题(含答案)
文档属性
| 名称 | 第2章 元素与物质世界 分层作业12 氧化剂和还原剂--2025鲁科版化学必修第一册同步练习题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 460.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-27 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2025鲁科版化学必修第一册
分层作业12 氧化剂和还原剂
A级 必备知识基础练
题组1.氧化剂与还原剂的相关判断
1.下列有关氧化还原反应的说法中正确的是( )
A.氧化剂与还原剂一定不是同一种物质
B.一种元素被氧化,肯定有另一种元素被还原
C.某种元素失电子数目越多,其还原性越强
D.氧化剂和还原剂混合不一定发生氧化还原反应
2.下列物质的转化需要加入还原剂才能实现的是( )
A.Cu→Cu2+ B.KMnO4→MnO2
C.Na2CO3→CO2 D.H2SO4→H2
3.(2024长郡中学模拟)菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有+5价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的+3价砷。下列说法中,正确的是( )
A.在该反应中维生素C做催化剂
B.由上述信息可推知砒霜中含有的砷是+3价的
C.因为河虾中含有砷元素,所以不能食用
D.上述反应中维生素C做氧化剂
4.(2024陕西西安中学模拟)已知钠和氯元素的相关反应如下:
①Na+Al+2H2NaAlH4
②8Na+10HNO38NaNO3+NH4NO3+3H2O
③5Cl2+I2+6H2O2HIO3+10HCl
④2Fe(OH)3+3NaClO+4NaOH2Na2FeO4+3NaCl+5H2O
下列判断错误的是( )
A.反应①中,NaAlH4既是氧化产物,又是还原产物
B.反应②中,还原剂、氧化剂的物质的量之比为8∶1
C.反应③中,水既不是氧化剂,也不是还原剂
D.反应④中,Na2FeO4的氧化性比NaClO的强
题组2.氧化还原反应规律及应用
5.在室温下,发生下列几种反应:
①14H++6Z-+X22X3++3Z2+7H2O;②2A2++B22A3++2B-;③2B-+Z2B2+2Z-。
根据上述反应,判断下列结论错误的是( )
A.氧化性强弱顺序为X2>Z2>B2>A3+
B.X3+是X2的还原产物,B2是B-的氧化产物
C.在溶液中可能发生反应:14H++6A2++X22X3++6A3++7H2O
D.要将含有A2+、Z-和B-混合溶液中的A2+转化为A3+,而不氧化Z-和B-,应加入Z2
6.(2024山东淄博实验中学高一月考)欲制备Na2S2O3,从氧化还原角度分析,下列选项中合理的反应物是( )
A.Na2SO3与S B.Na2S与S
C.SO2与Na2SO4 D.Na2SO3与Na2SO4
题组3.氧化还原反应方程式的配平与有关计算
7.(2024北京人大附中模拟)某氧化还原反应中,起氧化作用的是X2,在溶液中X2和S个数比为1∶3时两者恰好完全反应,则X2被还原后,X的化合价为( )
A.+1 B.+2
C.+3 D.+4
8.(2024河南济源四中模拟)钛铁矿与过氧化钠熔融后得到钛酸钠(Na2TiO4),反应的化学方程式为FeTiO3+3Na2O2Na2FeO4+Na2TiO4+Na2O,下列有关说法正确的是( )
A.化合物Na2O2中阴、阳离子的个数比为1∶1
B.该反应中的还原产物只有Na2O
C.若有1 mol Fe2+被氧化,则被Fe2+还原的Na2O2为1 mol
D.每生成18.6 g氧化钠,转移电子的物质的量是1.8 mol
9.(2024陕西西安中学模拟)回答下列问题:
(1)已知CuO具有氧化性,能够和氨反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式: 。
(2)在一定条件下,R和Cl2可发生反应:R+Cl2+2OH-R+2Cl-+H2O,在上述过程中R被 (填“氧化”或“还原”),R中R的化合价是 价。
(3)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生过程:H2O2→O2。
①该反应中的氧化剂是 (填化学式,下同)。
②该反应中,还原产物是 。
(4)配平下列化学方程式并用双线桥法标出反应中电子转移的方向和数目:
H2O2+ Cr2(SO4)3+ KOH K2CrO4+ K2SO4+ H2O
反应中氧化剂是 ,被氧化的元素是 ,还原产物是 。发生反应时,每生成4个水分子,转移 个电子。
B级 关键能力提升练
以下选择题有1~2个选项符合题意。
10.(2024福建永春一中模拟)臭氧氧化法处理含氰废水的工艺原理如图所示。下列说法错误的是( )
A.Ⅰ阶段中1 mol NaCN被氧化需消耗0.5 mol O3
B.Ⅱ阶段的反应为2NaCNO+H2O+3O32NaHCO3+N2+3O2
C.Ⅰ阶段产生的O2在Ⅱ阶段中作为氧化剂参与反应
D.两个阶段总反应的化学方程式为2NaCN+H2O+5O32NaHCO3+N2+5O2
11.(2024北京八一学校模拟)通常利用反应:Mn2++PbO2+H+Mn+Pb2++H2O定性检验Mn2+,关于该反应的下列说法中,不正确的是( )
A.Mn2+被氧化
B.每消耗1 mol PbO2,转移1 mol e-
C.Mn和Pb2+的物质的量之比为5∶2
D.在该反应的条件下,氧化性:PbO2>Mn
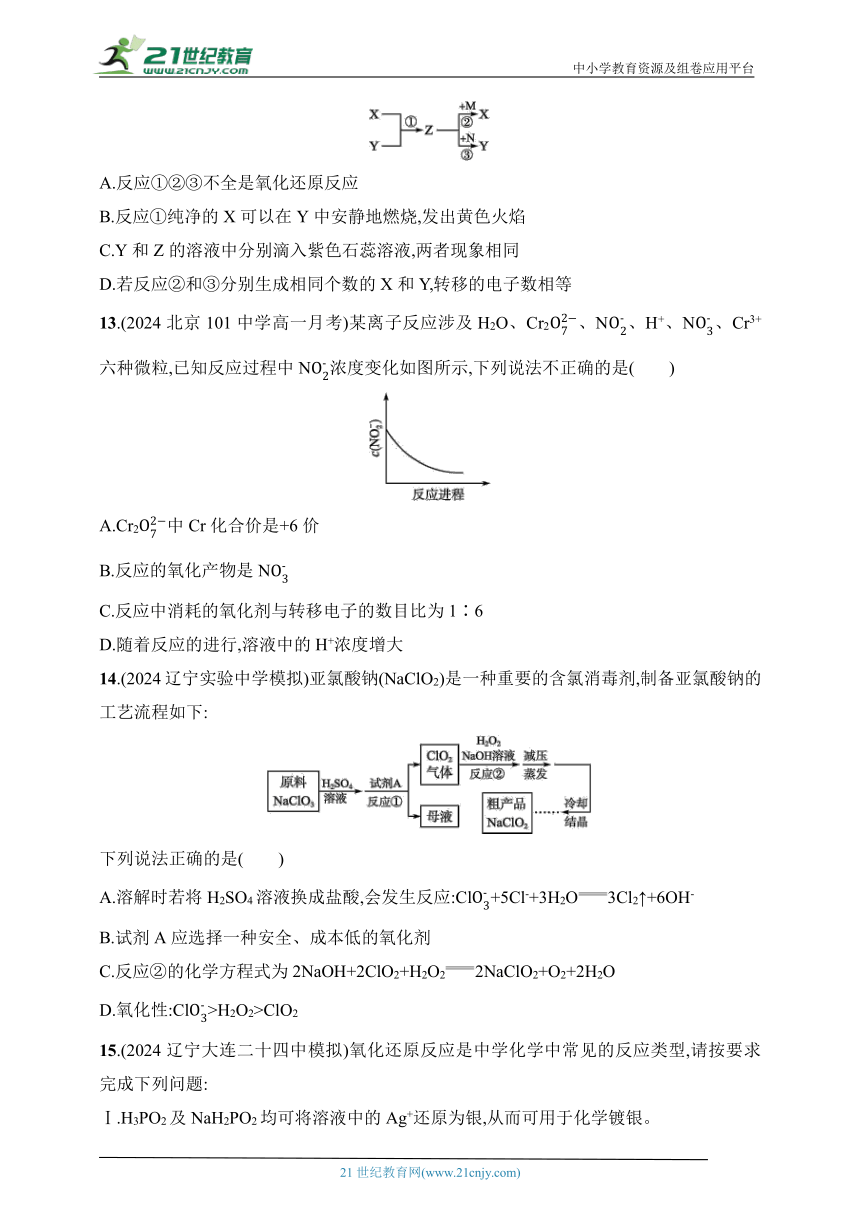
12.(2024广东广州八十九中模拟)现有X、Y、Z三种气体,常温下,X是密度最小的气体,Y是黄绿色单质气体,M是金属,N是一种常见的氧化剂且溶于水显紫红色。部分物质间的转化关系如图所示,下列说法中正确的是( )
A.反应①②③不全是氧化还原反应
B.反应①纯净的X可以在Y中安静地燃烧,发出黄色火焰
C.Y和Z的溶液中分别滴入紫色石蕊溶液,两者现象相同
D.若反应②和③分别生成相同个数的X和Y,转移的电子数相等
13.(2024北京101中学高一月考)某离子反应涉及H2O、Cr2、N、H+、N、Cr3+六种微粒,已知反应过程中N浓度变化如图所示,下列说法不正确的是( )
A.Cr2中Cr化合价是+6价
B.反应的氧化产物是N
C.反应中消耗的氧化剂与转移电子的数目比为1∶6
D.随着反应的进行,溶液中的H+浓度增大
14.(2024辽宁实验中学模拟)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,制备亚氯酸钠的工艺流程如下:
下列说法正确的是( )
A.溶解时若将H2SO4溶液换成盐酸,会发生反应:Cl+5Cl-+3H2O3Cl2↑+6OH-
B.试剂A应选择一种安全、成本低的氧化剂
C.反应②的化学方程式为2NaOH+2ClO2+H2O22NaClO2+O2+2H2O
D.氧化性:Cl>H2O2>ClO2
15.(2024辽宁大连二十四中模拟)氧化还原反应是中学化学中常见的反应类型,请按要求完成下列问题:
Ⅰ.H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
(1)H3PO2中,P元素的化合价为 。
(2)利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为 (填化学式)。
(3)取300 mL 0.2 mol·L-1的KI溶液与一定量的酸性KMnO4溶液(在反应中生成Mn2+)恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是 mol。
Ⅱ.高铁酸钾(K2FeO4)是一种新型绿色消毒剂,常用于处理饮用水。工业上有干法与湿法两种制备高铁酸钾的方法。
(4)干法制备:
先制备得到Na2FeO4,反应为2FeSO4+6Na2O22Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中,氧化剂是 ,氧化产物是 。
(5)配平湿法制备K2FeO4的离子方程式并用双线桥表示出电子转移的方向和数目。
Fe(OH)3+ ClO-+ OH- Fe+ Cl-+ H2O
(6)取少量K2FeO4溶液,滴加盐酸,有Cl2产生,该反应表明氧化性:K2FeO4 (填“>”或“<”)Cl2。
16.H2O2被称为绿色氧化剂,其性质与用途具有多样性,在生产工艺中应用广泛。请回答下列有关过氧化氢的问题:
(1)实验室可用H2O2在MnO2做催化剂的条件下制备O2,写出该反应的化学方程式:
,当生成1 mol O2时,转移电子为 mol。
(2)KMnO4是常用氧化剂,H2O2与之反应,H2O2为还原剂。在酸性条件下,KMnO4溶液可以与H2O2反应,已知变化过程中存在KMnO4转化为Mn2+的过程,则该反应的离子方程式为 ,H2O2发生 反应,该反应中 是氧化剂。
(3)Fe3+可以催化H2O2分解,请写出该反应的化学方程式: ;
(4)酸性条件下,在FeCl3和FeCl2的混合溶液中加入H2O2以除去Fe2+,反应的离子方程式为 。
(5)H2O2可用于SO2的尾气处理,请写出反应的化学方程式: 。
(6)稀硫酸不与Cu反应,但在稀硫酸中加入H2O2后则可使Cu溶解,写出该反应的化学方程式,并用单线桥标明电子转移的方向和数目。
C级 学科素养拔高练
17.(2024湖北重点高中智学联盟高一联考)氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)在一定条件下,Fe2O3+3CO2Fe+3CO2反应中, (填名称)是还原剂, (填化学式)发生还原反应。生成112 g Fe时,消耗CO质量是 。
(2)高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,其一种制备原理如下:
ClO-+ Fe3++ Fe+ Cl-+ H2O
请补齐反应物并配平该方程式: 。
(3)已知KMnO4、Na2CO3、FeO、Fe2(SO4)3四种物质中的一种可以与稀硝酸反应生成NO,则该反应的离子方程式为 。
(4)某反应体系有反应物和生成物共7种:CO2、KMnO4、MnSO4、H2SO4、H2O、H2C2O4、K2SO4。已知该反应中KMnO4是氧化剂,试回答下列问题:
①该反应中,还原剂是 (填化学式)。
②请正确书写反应的化学方程式并用单线桥法标出反应中电子转移的方向和数目。
答案:
1.D 解析 氧化剂与还原剂可能是同一种物质,例如过氧化氢分解生成氧气,过氧化氢既是氧化剂又是还原剂,A错误;一种元素被氧化,不一定有另一种元素被还原,例如过氧化氢分解生成氧气,过氧化氢中氧元素自身发生氧化还原反应,B错误;某种元素失电子数目越多,与其还原性强弱无必然关系,和其失去电子难易程度有关,C错误;氧化剂和还原剂混合不一定发生氧化还原反应,例如硫酸和二氧化硫不反应,D正确。
2.D 解析 Cu元素的化合价升高,需要加入氧化剂,A项不符合题意;KMnO4加热可以生成MnO2,B项不符合题意;碳元素没有发生化合价升降,C项不符合题意;硫酸转化为氢气,氢元素化合价降低,被还原,需要加入还原剂,D符合题意。
3.B 解析 由信息可知,反应中砷元素的化合价降低,则维生素C中某元素的化合价升高,则维生素C在反应中做还原剂,故A、D错误;题给信息中+3价砷有毒,则可推知砒霜中含有的砷是+3价,故B正确;河虾中含有五价砷,无毒,则能够食用,故C错误。
4.D 解析 反应①中只有一种产物,四氢铝钠既是氧化产物,又是还原产物,A项正确;10 mol HNO3参与反应,只有1 mol HNO3做氧化剂,B项正确;水中氢、氧元素化合价没有变化,C项正确;氧化性:NaClO>Na2FeO4,D项错误。
5.D 解析 反应①中,Z元素的化合价升高,X元素的化合价降低反应;反应②中,A元素的化合价升高,B元素的化合价降低;反应③中,Z元素的化合价降低,B元素的化合价升高;由上述3个反应知氧化性强弱顺序为X2>Z2>B2>A3+,还原性强弱顺序为A2+>B->Z->X3+,A正确;X3+是X2的还原产物,B2是B-的氧化产物,B正确;根据氧化性强弱顺序可知,在溶液中可能发生反应14H++6A2++X22X3++6A3++7H2O,C正确;要将含有A2+、Z-和B-混合溶液中的A2+转化为A3+,而不氧化Z-和B-,应加入B2,若加入Z2,将氧化B-,D错误。
6.A 解析 Na2S2O3中硫元素平均化合价为+2价,从氧化还原角度分析,反应物化合价有升高也有下降。Na2SO3与S若生成Na2S2O3,Na2SO3中S元素由+4价下降到+2价,硫单质中S元素由0价上升到+2价,A正确;Na2S与S若生成Na2S2O3,则只有化合价上升,B错误;SO2与Na2SO4若生成Na2S2O3,则只有化合价下降,C错误;SO2与Na2SO4若生成Na2S2O3,则只有化合价下降,D错误。
7.C 解析 设X2被还原后X的化合价为a,X2中X的化合价为+6价,S被氧化,S元素化合价从+4价升高到+6价,变成S,由得失电子守恒可列式:1×(6-a)×2=3×(6-4),解得a=3,则X2被还原后,X的化合价为+3。
8.D 解析 Na2O2中阳离子为Na+、阴离子为,所以Na2O2晶体中阴、阳离子个数之比为1∶2,A错误;该反应中,FeTiO3中铁、钛元素的化合价升高,被氧化,Na2O2中氧元素的化合价降低,Na2FeO4和Na2TiO4既是氧化产物又是还原产物,Na2O是还原产物,B错误;由化学计量数可知,有1 mol Fe2+被氧化,失去4 mol电子,则被Fe2+还原的Na2O2为2 mol,C错误;n(Na2O)==0.3 mol,每生成1 mol Na2O转移6 mol电子,则生成0.3 mol Na2O转移1.8 mol电子,D正确。
9.答案 (1)3CuO+2NH33Cu+N2+3H2O
(2)氧化 +4
(3)①H2CrO4 ②Cr(OH)3
(4)
H2O2 Cr H2O 3
解析 (1)CuO具有氧化性,在加热条件下与NH3反应生成单质铜、氮气和水,反应的化学方程式为3CuO+2NH33Cu+N2+3H2O。
(2)该反应中,氯元素化合价降低,共降低了2价,所以R元素化合价升高,R被氧化,R共升高了6-(6-n)价,根据升降总数相等,可推知n=2,故R的化合价为+4价。
(3)由信息H2O2→O2,可知O元素化合价升高,H2O2做还原剂,则另一种物质所含元素化合价降低,为氧化剂。由题中所给物质可知,H2CrO4中Cr由+6价降低到Cr(OH)3中的+3价,则H2CrO4为氧化剂,还原产物为Cr(OH)3。
(4)根据化合价升降相等,可得到配平后的方程式,用双线桥法标出反应中电子转移的方向和数目:,反应中H2O2做氧化剂,被氧化的元素是Cr,还原产物是化合价降低得到的H2O,每生成4个水分子,转移3个电子。
10.AC 解析 由图可知,Ⅰ阶段发生的反应为NaCN与O3反应生成NaCNO和O2,反应的化学方程式为NaCN+O3NaCNO+O2,Ⅱ阶段发生的反应为NaCNO与H2O、O3反应生成NaHCO3、N2和O2,反应的化学方程式为2NaCNO+H2O+3O32NaHCO3+N2+3O2,整合可知,两个阶段总反应的化学方程式为2NaCN+H2O+5O32NaHCO3+N2+5O2。Ⅰ阶段反应中1 mol O3氧化1 mol NaCN,故A错误;由以上分析可知,B正确、D正确;Ⅰ阶段和Ⅱ阶段中O2都为生成物,故C错误。
11.BC 解析 锰元素化合价升高,Mn2+被氧化,故A正确;PbO2中Pb元素化合价由+4降低为+2,每消耗1 mol PbO2,转移2 mol e-,故B错误;锰元素化合价由+2升高为+7,Pb元素化合价由+4降低为+2,根据得失电子守恒,Mn和Pb2+的物质的量之比为2∶5,故C错误;Mn2++PbO2+H+Mn+Pb2++H2O反应中,PbO2是氧化剂、Mn是氧化产物,在该反应的条件下,氧化性PbO2>Mn,故D正确。
12.D 解析 常温下,X是密度最小的气体,应为H2,Y是黄绿色单质气体,应为Cl2,则由转化关系可知Z为HCl,N是一种常见的氧化剂且溶于水显紫红色,应为KMnO4,M为金属,可与盐酸反应生成氢气,则可为Fe、Zn等。反应①②③都为单质参加或生成的反应,则一定存在元素化合价的变化,属于氧化还原反应,故A错误;氢气在氯气中安静地燃烧,应发出苍白色火焰,故B错误;盐酸滴入紫色石蕊溶液,溶液变为红色,而氯水滴入紫色石蕊溶液,先变红后褪色,氯水中的次氯酸起到漂白作用,现象不同,故C错误;反应中H元素化合价由+1价变为0价,Cl元素化合价由-1价变为0价,则反应②和③分别生成相同个数的X和Y,转移的电子数相等,故D正确。
13.D 解析 根据题图可知,反应过程中N浓度逐渐减小,说明N被氧化生成N,则Cr2被还原生成Cr3+,N元素化合价从+3变为+5,化合价升高2价,Cr元素化合价从+6变为+3,化合价降低3价,根据化合价升降相等配平可得:Cr2+3N+8H+3N+2Cr3++4H2O。N元素的化合价升高,被氧化,得到氧化产物N,B正确;反应中Cr的化合价从+6价降低到+3价,则消耗1 mol氧化剂Cr2,转移电子6 mol,C正确;根据反应可知,随着反应的进行,溶液中的H+被消耗,氢离子浓度逐渐减小,D错误。
14.C 解析 溶解时若将H2SO4溶液换成盐酸,会发生反应:Cl+5Cl-+6H+3Cl2↑+3H2O,故A错误;NaClO3→ClO2发生还原反应,所以试剂A应选择一种安全、成本低的还原剂,故B错误;反应②是用H2O2把ClO2还原为NaClO2,反应的化学方程式为2NaOH+2ClO2+H2O22NaClO2+O2+2H2O,故C正确;ClO2把H2O2氧化为O2,所以氧化性:Cl>ClO2>H2O2,故D错误。
15.答案 (1)+1 (2)H3PO4 (3)0.032
(4)Na2O2 Na2FeO4、O2
(5)2 3 4 2 3 5
(6)>
解析 (1)根据化合物中各元素化合价代数和为0,则P元素化合价为+1价。
(2)H3PO2进行化学镀银反应中,Ag元素化合价由+1价变为0价,得电子发生还原反应,Ag+为氧化剂,则H3PO2为还原剂,氧化剂与还原剂物质的量之比为4∶1,根据得失电子守恒,假设氧化产物中P化合价为x,则4×(1-0)=1×(x-1),解得x=+5,则氧化产物为H3PO4。
(3)根据题意,碘化钾的氧化产物为碘单质和碘酸钾,高锰酸钾的还原产物为二价锰离子,假设生成的I2和KIO3物质的量均为x,消耗高锰酸钾物质的量为y,根据得失电子守恒计算:2x+x=0.3 L×0.2 mol·L-1,2x+6x=(7-2)×y,联立解得y=0.032 mol。
(4)2FeSO4+6Na2O22Na2FeO4+2Na2O+2Na2SO4+O2↑,FeSO4中的Fe元素由+2价全部升高到+6价,Na2O2中的O元素,一部分由-1价升高到0价(生成O2),一部分由-1价降低到-2价(生成Na2FeO4、Na2O)。则该反应中,氧化剂是Na2O2,氧化产物是Na2FeO4、O2。
(5)Fe(OH)3是还原剂,Fe元素由+3价升高到+6价,化合价升高3价,ClO-是氧化剂,Cl元素由+1价降低到-1价,化合价降低2价,依据得失电子守恒、质量守恒可配成如下形式:
2Fe(OH)3+3ClO-+4OH-2Fe+3Cl-+5H2O;电子转移的方向和数目:
。
(6)往K2FeO4溶液中滴加盐酸,有Cl2产生,该反应的化学方程式:2K2FeO4+16HCl4KCl+2FeCl3+3Cl2↑+8H2O,K2FeO4是氧化剂,Cl2是氧化产物,根据氧化性:氧化剂>氧化产物,则氧化性:K2FeO4>Cl2。
16.答案 (1)2H2O22H2O+O2↑ 2
(2)2Mn+5H2O2+6H+2Mn2++5O2↑+8H2O 氧化 KMnO4
(3)2H2O22H2O+O2↑
(4)2H++H2O2+2Fe2+2Fe3++2H2O
(5)SO2+H2O2H2SO4
(6)
解析 (1)H2O2既是氧化剂又是还原剂,1 mol H2O2发生反应转移1 mol电子,故生成1 mol O2时,转移2 mol电子。
(2)在酸性条件下,KMnO4溶液可以与H2O2反应,KMnO4转化为Mn2+,则该反应的离子方程式为2Mn+5H2O2+6H+2Mn2++5O2↑+8H2O。
(3)H2O2被Fe3+催化分解得O2和H2O。
(4)酸性环境下,Fe2+被H2O2氧化为Fe3+,H2O2被还原,酸性环境下生成H2O。
(5)SO2具有还原性,H2O2具有氧化性,二者发生氧化还原反应生成H2SO4,H2O2+SO2H2SO4。
(6)Cu与稀硫酸、H2O2反应的化学方程式为Cu+H2O2+H2SO4CuSO4+2H2O,反应中Cu做还原剂,H2O2做氧化剂,1 mol H2O2反应转移2 mol电子。
17.答案 (1)一氧化碳 Fe2O3 84 g
(2)3ClO-+2Fe3++10OH-2Fe+3Cl-+5H2O
(3)10H++N+3FeONO↑+3Fe3++5H2O
(4)①H2C2O4
②
解析 (1)Fe2O3+3CO2Fe+3CO2反应,CO中C元素化合价升高,一氧化碳是还原剂;Fe2O3中Fe元素化合价降低,Fe2O3发生还原反应。112 g Fe的物质的量为2 mol,生成112 g Fe时,消耗3 mol CO,消耗CO的质量是3 mol×28 g·mol-1=84 g。
(2)ClO-中Cl元素化合价由+1降低为-1,Fe元素化合价由+3升高为+6,根据得失电子守恒配平ClO-的化学计量数为3,Cl-的化学计量数为3,Fe3+的化学计量数为2、Fe的化学计量数为2,根据电荷守恒,可知缺项为OH-,OH-化学计量数为10,根据质量守恒,可知H2O的化学计量数为5,反应离子方程式为3ClO-+2Fe3++10OH-2Fe+3Cl-+5H2O。
(3)已知KMnO4、Na2CO3、FeO、Fe2(SO4)3四种物质中的一种可以与稀硝酸反应生成NO,可知该物质具有还原性,则该物质为FeO,硝酸和FeO反应生成硝酸铁、NO、水,根据得失电子守恒,该反应的离子方程式为10H++N+3FeONO↑+3Fe3++5H2O。
(4)①该反应中,C元素化合价升高,H2C2O4是还原剂;
②该反应中KMnO4是氧化剂,Mn元素化合价降低,生成还原产物MnSO4,根据化合价升降规律,C元素化合价升高,H2C2O4是还原剂、CO2是氧化产物,根据元素守恒,H2SO4是反应物、K2SO4是生成物、H2O是生成物,反应方程式为2KMnO4+5H2C2O4+3H2SO4K2SO4+2MnSO4+10CO2↑+8H2O,用单线桥法标出反应中电子转移的方向和数目为
。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025鲁科版化学必修第一册
分层作业12 氧化剂和还原剂
A级 必备知识基础练
题组1.氧化剂与还原剂的相关判断
1.下列有关氧化还原反应的说法中正确的是( )
A.氧化剂与还原剂一定不是同一种物质
B.一种元素被氧化,肯定有另一种元素被还原
C.某种元素失电子数目越多,其还原性越强
D.氧化剂和还原剂混合不一定发生氧化还原反应
2.下列物质的转化需要加入还原剂才能实现的是( )
A.Cu→Cu2+ B.KMnO4→MnO2
C.Na2CO3→CO2 D.H2SO4→H2
3.(2024长郡中学模拟)菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有+5价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的+3价砷。下列说法中,正确的是( )
A.在该反应中维生素C做催化剂
B.由上述信息可推知砒霜中含有的砷是+3价的
C.因为河虾中含有砷元素,所以不能食用
D.上述反应中维生素C做氧化剂
4.(2024陕西西安中学模拟)已知钠和氯元素的相关反应如下:
①Na+Al+2H2NaAlH4
②8Na+10HNO38NaNO3+NH4NO3+3H2O
③5Cl2+I2+6H2O2HIO3+10HCl
④2Fe(OH)3+3NaClO+4NaOH2Na2FeO4+3NaCl+5H2O
下列判断错误的是( )
A.反应①中,NaAlH4既是氧化产物,又是还原产物
B.反应②中,还原剂、氧化剂的物质的量之比为8∶1
C.反应③中,水既不是氧化剂,也不是还原剂
D.反应④中,Na2FeO4的氧化性比NaClO的强
题组2.氧化还原反应规律及应用
5.在室温下,发生下列几种反应:
①14H++6Z-+X22X3++3Z2+7H2O;②2A2++B22A3++2B-;③2B-+Z2B2+2Z-。
根据上述反应,判断下列结论错误的是( )
A.氧化性强弱顺序为X2>Z2>B2>A3+
B.X3+是X2的还原产物,B2是B-的氧化产物
C.在溶液中可能发生反应:14H++6A2++X22X3++6A3++7H2O
D.要将含有A2+、Z-和B-混合溶液中的A2+转化为A3+,而不氧化Z-和B-,应加入Z2
6.(2024山东淄博实验中学高一月考)欲制备Na2S2O3,从氧化还原角度分析,下列选项中合理的反应物是( )
A.Na2SO3与S B.Na2S与S
C.SO2与Na2SO4 D.Na2SO3与Na2SO4
题组3.氧化还原反应方程式的配平与有关计算
7.(2024北京人大附中模拟)某氧化还原反应中,起氧化作用的是X2,在溶液中X2和S个数比为1∶3时两者恰好完全反应,则X2被还原后,X的化合价为( )
A.+1 B.+2
C.+3 D.+4
8.(2024河南济源四中模拟)钛铁矿与过氧化钠熔融后得到钛酸钠(Na2TiO4),反应的化学方程式为FeTiO3+3Na2O2Na2FeO4+Na2TiO4+Na2O,下列有关说法正确的是( )
A.化合物Na2O2中阴、阳离子的个数比为1∶1
B.该反应中的还原产物只有Na2O
C.若有1 mol Fe2+被氧化,则被Fe2+还原的Na2O2为1 mol
D.每生成18.6 g氧化钠,转移电子的物质的量是1.8 mol
9.(2024陕西西安中学模拟)回答下列问题:
(1)已知CuO具有氧化性,能够和氨反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式: 。
(2)在一定条件下,R和Cl2可发生反应:R+Cl2+2OH-R+2Cl-+H2O,在上述过程中R被 (填“氧化”或“还原”),R中R的化合价是 价。
(3)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生过程:H2O2→O2。
①该反应中的氧化剂是 (填化学式,下同)。
②该反应中,还原产物是 。
(4)配平下列化学方程式并用双线桥法标出反应中电子转移的方向和数目:
H2O2+ Cr2(SO4)3+ KOH K2CrO4+ K2SO4+ H2O
反应中氧化剂是 ,被氧化的元素是 ,还原产物是 。发生反应时,每生成4个水分子,转移 个电子。
B级 关键能力提升练
以下选择题有1~2个选项符合题意。
10.(2024福建永春一中模拟)臭氧氧化法处理含氰废水的工艺原理如图所示。下列说法错误的是( )
A.Ⅰ阶段中1 mol NaCN被氧化需消耗0.5 mol O3
B.Ⅱ阶段的反应为2NaCNO+H2O+3O32NaHCO3+N2+3O2
C.Ⅰ阶段产生的O2在Ⅱ阶段中作为氧化剂参与反应
D.两个阶段总反应的化学方程式为2NaCN+H2O+5O32NaHCO3+N2+5O2
11.(2024北京八一学校模拟)通常利用反应:Mn2++PbO2+H+Mn+Pb2++H2O定性检验Mn2+,关于该反应的下列说法中,不正确的是( )
A.Mn2+被氧化
B.每消耗1 mol PbO2,转移1 mol e-
C.Mn和Pb2+的物质的量之比为5∶2
D.在该反应的条件下,氧化性:PbO2>Mn
12.(2024广东广州八十九中模拟)现有X、Y、Z三种气体,常温下,X是密度最小的气体,Y是黄绿色单质气体,M是金属,N是一种常见的氧化剂且溶于水显紫红色。部分物质间的转化关系如图所示,下列说法中正确的是( )
A.反应①②③不全是氧化还原反应
B.反应①纯净的X可以在Y中安静地燃烧,发出黄色火焰
C.Y和Z的溶液中分别滴入紫色石蕊溶液,两者现象相同
D.若反应②和③分别生成相同个数的X和Y,转移的电子数相等
13.(2024北京101中学高一月考)某离子反应涉及H2O、Cr2、N、H+、N、Cr3+六种微粒,已知反应过程中N浓度变化如图所示,下列说法不正确的是( )
A.Cr2中Cr化合价是+6价
B.反应的氧化产物是N
C.反应中消耗的氧化剂与转移电子的数目比为1∶6
D.随着反应的进行,溶液中的H+浓度增大
14.(2024辽宁实验中学模拟)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,制备亚氯酸钠的工艺流程如下:
下列说法正确的是( )
A.溶解时若将H2SO4溶液换成盐酸,会发生反应:Cl+5Cl-+3H2O3Cl2↑+6OH-
B.试剂A应选择一种安全、成本低的氧化剂
C.反应②的化学方程式为2NaOH+2ClO2+H2O22NaClO2+O2+2H2O
D.氧化性:Cl>H2O2>ClO2
15.(2024辽宁大连二十四中模拟)氧化还原反应是中学化学中常见的反应类型,请按要求完成下列问题:
Ⅰ.H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
(1)H3PO2中,P元素的化合价为 。
(2)利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为 (填化学式)。
(3)取300 mL 0.2 mol·L-1的KI溶液与一定量的酸性KMnO4溶液(在反应中生成Mn2+)恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是 mol。
Ⅱ.高铁酸钾(K2FeO4)是一种新型绿色消毒剂,常用于处理饮用水。工业上有干法与湿法两种制备高铁酸钾的方法。
(4)干法制备:
先制备得到Na2FeO4,反应为2FeSO4+6Na2O22Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中,氧化剂是 ,氧化产物是 。
(5)配平湿法制备K2FeO4的离子方程式并用双线桥表示出电子转移的方向和数目。
Fe(OH)3+ ClO-+ OH- Fe+ Cl-+ H2O
(6)取少量K2FeO4溶液,滴加盐酸,有Cl2产生,该反应表明氧化性:K2FeO4 (填“>”或“<”)Cl2。
16.H2O2被称为绿色氧化剂,其性质与用途具有多样性,在生产工艺中应用广泛。请回答下列有关过氧化氢的问题:
(1)实验室可用H2O2在MnO2做催化剂的条件下制备O2,写出该反应的化学方程式:
,当生成1 mol O2时,转移电子为 mol。
(2)KMnO4是常用氧化剂,H2O2与之反应,H2O2为还原剂。在酸性条件下,KMnO4溶液可以与H2O2反应,已知变化过程中存在KMnO4转化为Mn2+的过程,则该反应的离子方程式为 ,H2O2发生 反应,该反应中 是氧化剂。
(3)Fe3+可以催化H2O2分解,请写出该反应的化学方程式: ;
(4)酸性条件下,在FeCl3和FeCl2的混合溶液中加入H2O2以除去Fe2+,反应的离子方程式为 。
(5)H2O2可用于SO2的尾气处理,请写出反应的化学方程式: 。
(6)稀硫酸不与Cu反应,但在稀硫酸中加入H2O2后则可使Cu溶解,写出该反应的化学方程式,并用单线桥标明电子转移的方向和数目。
C级 学科素养拔高练
17.(2024湖北重点高中智学联盟高一联考)氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)在一定条件下,Fe2O3+3CO2Fe+3CO2反应中, (填名称)是还原剂, (填化学式)发生还原反应。生成112 g Fe时,消耗CO质量是 。
(2)高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,其一种制备原理如下:
ClO-+ Fe3++ Fe+ Cl-+ H2O
请补齐反应物并配平该方程式: 。
(3)已知KMnO4、Na2CO3、FeO、Fe2(SO4)3四种物质中的一种可以与稀硝酸反应生成NO,则该反应的离子方程式为 。
(4)某反应体系有反应物和生成物共7种:CO2、KMnO4、MnSO4、H2SO4、H2O、H2C2O4、K2SO4。已知该反应中KMnO4是氧化剂,试回答下列问题:
①该反应中,还原剂是 (填化学式)。
②请正确书写反应的化学方程式并用单线桥法标出反应中电子转移的方向和数目。
答案:
1.D 解析 氧化剂与还原剂可能是同一种物质,例如过氧化氢分解生成氧气,过氧化氢既是氧化剂又是还原剂,A错误;一种元素被氧化,不一定有另一种元素被还原,例如过氧化氢分解生成氧气,过氧化氢中氧元素自身发生氧化还原反应,B错误;某种元素失电子数目越多,与其还原性强弱无必然关系,和其失去电子难易程度有关,C错误;氧化剂和还原剂混合不一定发生氧化还原反应,例如硫酸和二氧化硫不反应,D正确。
2.D 解析 Cu元素的化合价升高,需要加入氧化剂,A项不符合题意;KMnO4加热可以生成MnO2,B项不符合题意;碳元素没有发生化合价升降,C项不符合题意;硫酸转化为氢气,氢元素化合价降低,被还原,需要加入还原剂,D符合题意。
3.B 解析 由信息可知,反应中砷元素的化合价降低,则维生素C中某元素的化合价升高,则维生素C在反应中做还原剂,故A、D错误;题给信息中+3价砷有毒,则可推知砒霜中含有的砷是+3价,故B正确;河虾中含有五价砷,无毒,则能够食用,故C错误。
4.D 解析 反应①中只有一种产物,四氢铝钠既是氧化产物,又是还原产物,A项正确;10 mol HNO3参与反应,只有1 mol HNO3做氧化剂,B项正确;水中氢、氧元素化合价没有变化,C项正确;氧化性:NaClO>Na2FeO4,D项错误。
5.D 解析 反应①中,Z元素的化合价升高,X元素的化合价降低反应;反应②中,A元素的化合价升高,B元素的化合价降低;反应③中,Z元素的化合价降低,B元素的化合价升高;由上述3个反应知氧化性强弱顺序为X2>Z2>B2>A3+,还原性强弱顺序为A2+>B->Z->X3+,A正确;X3+是X2的还原产物,B2是B-的氧化产物,B正确;根据氧化性强弱顺序可知,在溶液中可能发生反应14H++6A2++X22X3++6A3++7H2O,C正确;要将含有A2+、Z-和B-混合溶液中的A2+转化为A3+,而不氧化Z-和B-,应加入B2,若加入Z2,将氧化B-,D错误。
6.A 解析 Na2S2O3中硫元素平均化合价为+2价,从氧化还原角度分析,反应物化合价有升高也有下降。Na2SO3与S若生成Na2S2O3,Na2SO3中S元素由+4价下降到+2价,硫单质中S元素由0价上升到+2价,A正确;Na2S与S若生成Na2S2O3,则只有化合价上升,B错误;SO2与Na2SO4若生成Na2S2O3,则只有化合价下降,C错误;SO2与Na2SO4若生成Na2S2O3,则只有化合价下降,D错误。
7.C 解析 设X2被还原后X的化合价为a,X2中X的化合价为+6价,S被氧化,S元素化合价从+4价升高到+6价,变成S,由得失电子守恒可列式:1×(6-a)×2=3×(6-4),解得a=3,则X2被还原后,X的化合价为+3。
8.D 解析 Na2O2中阳离子为Na+、阴离子为,所以Na2O2晶体中阴、阳离子个数之比为1∶2,A错误;该反应中,FeTiO3中铁、钛元素的化合价升高,被氧化,Na2O2中氧元素的化合价降低,Na2FeO4和Na2TiO4既是氧化产物又是还原产物,Na2O是还原产物,B错误;由化学计量数可知,有1 mol Fe2+被氧化,失去4 mol电子,则被Fe2+还原的Na2O2为2 mol,C错误;n(Na2O)==0.3 mol,每生成1 mol Na2O转移6 mol电子,则生成0.3 mol Na2O转移1.8 mol电子,D正确。
9.答案 (1)3CuO+2NH33Cu+N2+3H2O
(2)氧化 +4
(3)①H2CrO4 ②Cr(OH)3
(4)
H2O2 Cr H2O 3
解析 (1)CuO具有氧化性,在加热条件下与NH3反应生成单质铜、氮气和水,反应的化学方程式为3CuO+2NH33Cu+N2+3H2O。
(2)该反应中,氯元素化合价降低,共降低了2价,所以R元素化合价升高,R被氧化,R共升高了6-(6-n)价,根据升降总数相等,可推知n=2,故R的化合价为+4价。
(3)由信息H2O2→O2,可知O元素化合价升高,H2O2做还原剂,则另一种物质所含元素化合价降低,为氧化剂。由题中所给物质可知,H2CrO4中Cr由+6价降低到Cr(OH)3中的+3价,则H2CrO4为氧化剂,还原产物为Cr(OH)3。
(4)根据化合价升降相等,可得到配平后的方程式,用双线桥法标出反应中电子转移的方向和数目:,反应中H2O2做氧化剂,被氧化的元素是Cr,还原产物是化合价降低得到的H2O,每生成4个水分子,转移3个电子。
10.AC 解析 由图可知,Ⅰ阶段发生的反应为NaCN与O3反应生成NaCNO和O2,反应的化学方程式为NaCN+O3NaCNO+O2,Ⅱ阶段发生的反应为NaCNO与H2O、O3反应生成NaHCO3、N2和O2,反应的化学方程式为2NaCNO+H2O+3O32NaHCO3+N2+3O2,整合可知,两个阶段总反应的化学方程式为2NaCN+H2O+5O32NaHCO3+N2+5O2。Ⅰ阶段反应中1 mol O3氧化1 mol NaCN,故A错误;由以上分析可知,B正确、D正确;Ⅰ阶段和Ⅱ阶段中O2都为生成物,故C错误。
11.BC 解析 锰元素化合价升高,Mn2+被氧化,故A正确;PbO2中Pb元素化合价由+4降低为+2,每消耗1 mol PbO2,转移2 mol e-,故B错误;锰元素化合价由+2升高为+7,Pb元素化合价由+4降低为+2,根据得失电子守恒,Mn和Pb2+的物质的量之比为2∶5,故C错误;Mn2++PbO2+H+Mn+Pb2++H2O反应中,PbO2是氧化剂、Mn是氧化产物,在该反应的条件下,氧化性PbO2>Mn,故D正确。
12.D 解析 常温下,X是密度最小的气体,应为H2,Y是黄绿色单质气体,应为Cl2,则由转化关系可知Z为HCl,N是一种常见的氧化剂且溶于水显紫红色,应为KMnO4,M为金属,可与盐酸反应生成氢气,则可为Fe、Zn等。反应①②③都为单质参加或生成的反应,则一定存在元素化合价的变化,属于氧化还原反应,故A错误;氢气在氯气中安静地燃烧,应发出苍白色火焰,故B错误;盐酸滴入紫色石蕊溶液,溶液变为红色,而氯水滴入紫色石蕊溶液,先变红后褪色,氯水中的次氯酸起到漂白作用,现象不同,故C错误;反应中H元素化合价由+1价变为0价,Cl元素化合价由-1价变为0价,则反应②和③分别生成相同个数的X和Y,转移的电子数相等,故D正确。
13.D 解析 根据题图可知,反应过程中N浓度逐渐减小,说明N被氧化生成N,则Cr2被还原生成Cr3+,N元素化合价从+3变为+5,化合价升高2价,Cr元素化合价从+6变为+3,化合价降低3价,根据化合价升降相等配平可得:Cr2+3N+8H+3N+2Cr3++4H2O。N元素的化合价升高,被氧化,得到氧化产物N,B正确;反应中Cr的化合价从+6价降低到+3价,则消耗1 mol氧化剂Cr2,转移电子6 mol,C正确;根据反应可知,随着反应的进行,溶液中的H+被消耗,氢离子浓度逐渐减小,D错误。
14.C 解析 溶解时若将H2SO4溶液换成盐酸,会发生反应:Cl+5Cl-+6H+3Cl2↑+3H2O,故A错误;NaClO3→ClO2发生还原反应,所以试剂A应选择一种安全、成本低的还原剂,故B错误;反应②是用H2O2把ClO2还原为NaClO2,反应的化学方程式为2NaOH+2ClO2+H2O22NaClO2+O2+2H2O,故C正确;ClO2把H2O2氧化为O2,所以氧化性:Cl>ClO2>H2O2,故D错误。
15.答案 (1)+1 (2)H3PO4 (3)0.032
(4)Na2O2 Na2FeO4、O2
(5)2 3 4 2 3 5
(6)>
解析 (1)根据化合物中各元素化合价代数和为0,则P元素化合价为+1价。
(2)H3PO2进行化学镀银反应中,Ag元素化合价由+1价变为0价,得电子发生还原反应,Ag+为氧化剂,则H3PO2为还原剂,氧化剂与还原剂物质的量之比为4∶1,根据得失电子守恒,假设氧化产物中P化合价为x,则4×(1-0)=1×(x-1),解得x=+5,则氧化产物为H3PO4。
(3)根据题意,碘化钾的氧化产物为碘单质和碘酸钾,高锰酸钾的还原产物为二价锰离子,假设生成的I2和KIO3物质的量均为x,消耗高锰酸钾物质的量为y,根据得失电子守恒计算:2x+x=0.3 L×0.2 mol·L-1,2x+6x=(7-2)×y,联立解得y=0.032 mol。
(4)2FeSO4+6Na2O22Na2FeO4+2Na2O+2Na2SO4+O2↑,FeSO4中的Fe元素由+2价全部升高到+6价,Na2O2中的O元素,一部分由-1价升高到0价(生成O2),一部分由-1价降低到-2价(生成Na2FeO4、Na2O)。则该反应中,氧化剂是Na2O2,氧化产物是Na2FeO4、O2。
(5)Fe(OH)3是还原剂,Fe元素由+3价升高到+6价,化合价升高3价,ClO-是氧化剂,Cl元素由+1价降低到-1价,化合价降低2价,依据得失电子守恒、质量守恒可配成如下形式:
2Fe(OH)3+3ClO-+4OH-2Fe+3Cl-+5H2O;电子转移的方向和数目:
。
(6)往K2FeO4溶液中滴加盐酸,有Cl2产生,该反应的化学方程式:2K2FeO4+16HCl4KCl+2FeCl3+3Cl2↑+8H2O,K2FeO4是氧化剂,Cl2是氧化产物,根据氧化性:氧化剂>氧化产物,则氧化性:K2FeO4>Cl2。
16.答案 (1)2H2O22H2O+O2↑ 2
(2)2Mn+5H2O2+6H+2Mn2++5O2↑+8H2O 氧化 KMnO4
(3)2H2O22H2O+O2↑
(4)2H++H2O2+2Fe2+2Fe3++2H2O
(5)SO2+H2O2H2SO4
(6)
解析 (1)H2O2既是氧化剂又是还原剂,1 mol H2O2发生反应转移1 mol电子,故生成1 mol O2时,转移2 mol电子。
(2)在酸性条件下,KMnO4溶液可以与H2O2反应,KMnO4转化为Mn2+,则该反应的离子方程式为2Mn+5H2O2+6H+2Mn2++5O2↑+8H2O。
(3)H2O2被Fe3+催化分解得O2和H2O。
(4)酸性环境下,Fe2+被H2O2氧化为Fe3+,H2O2被还原,酸性环境下生成H2O。
(5)SO2具有还原性,H2O2具有氧化性,二者发生氧化还原反应生成H2SO4,H2O2+SO2H2SO4。
(6)Cu与稀硫酸、H2O2反应的化学方程式为Cu+H2O2+H2SO4CuSO4+2H2O,反应中Cu做还原剂,H2O2做氧化剂,1 mol H2O2反应转移2 mol电子。
17.答案 (1)一氧化碳 Fe2O3 84 g
(2)3ClO-+2Fe3++10OH-2Fe+3Cl-+5H2O
(3)10H++N+3FeONO↑+3Fe3++5H2O
(4)①H2C2O4
②
解析 (1)Fe2O3+3CO2Fe+3CO2反应,CO中C元素化合价升高,一氧化碳是还原剂;Fe2O3中Fe元素化合价降低,Fe2O3发生还原反应。112 g Fe的物质的量为2 mol,生成112 g Fe时,消耗3 mol CO,消耗CO的质量是3 mol×28 g·mol-1=84 g。
(2)ClO-中Cl元素化合价由+1降低为-1,Fe元素化合价由+3升高为+6,根据得失电子守恒配平ClO-的化学计量数为3,Cl-的化学计量数为3,Fe3+的化学计量数为2、Fe的化学计量数为2,根据电荷守恒,可知缺项为OH-,OH-化学计量数为10,根据质量守恒,可知H2O的化学计量数为5,反应离子方程式为3ClO-+2Fe3++10OH-2Fe+3Cl-+5H2O。
(3)已知KMnO4、Na2CO3、FeO、Fe2(SO4)3四种物质中的一种可以与稀硝酸反应生成NO,可知该物质具有还原性,则该物质为FeO,硝酸和FeO反应生成硝酸铁、NO、水,根据得失电子守恒,该反应的离子方程式为10H++N+3FeONO↑+3Fe3++5H2O。
(4)①该反应中,C元素化合价升高,H2C2O4是还原剂;
②该反应中KMnO4是氧化剂,Mn元素化合价降低,生成还原产物MnSO4,根据化合价升降规律,C元素化合价升高,H2C2O4是还原剂、CO2是氧化产物,根据元素守恒,H2SO4是反应物、K2SO4是生成物、H2O是生成物,反应方程式为2KMnO4+5H2C2O4+3H2SO4K2SO4+2MnSO4+10CO2↑+8H2O,用单线桥法标出反应中电子转移的方向和数目为
。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
