第3章 物质的性质与转化 分层作业14 亚铁盐和铁盐--2025鲁科版化学必修第一册同步练习题(含答案)
文档属性
| 名称 | 第3章 物质的性质与转化 分层作业14 亚铁盐和铁盐--2025鲁科版化学必修第一册同步练习题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 412.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-27 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2025鲁科版化学必修第一册
分层作业14 亚铁盐和铁盐
A级 必备知识基础练
题组1.亚铁盐和铁盐的性质
1.(2024广东四会、广信中学高一联考)在FeCl3和CuCl2的混合溶液中加入铁屑,反应结束后滤出固体物质,滤液中的阳离子可能是( )
①只有Fe2+;②Fe2+和Fe3+;③Fe2+和Cu2+;
④Cu2+和Fe3+
A.②③ B.②④
C.①④ D.①③
2.(2024山东枣庄高一联考)已知如下三个实验均能发生化学反应:
① ② ③
将铁钉放入硫酸铜溶液中 向硫酸亚铁溶液中滴入几滴氯水 将铜丝放入氯化铁溶液中
下列判断正确的是( )
A.实验①中铁作还原剂
B.实验②中Fe2+既显氧化性又显还原性
C.实验③中发生的是置换反应
D.上述实验证明氧化性:Fe3+>Fe2+>Cu2+
题组2.Fe2+、Fe3+的检验
3.(2024福建三明一中高一模拟)为了检验某FeCl2溶液是否变质,可向溶液中加入( )
A.NaOH溶液 B.铁片
C.KSCN溶液 D.石蕊溶液
4.(2024河南开封高一模拟)能证明只含Fe2+而不含Fe3+的实验及现象是( )
A.只需滴加KSCN溶液,溶液不显红色
B.先滴加氯水,再滴加KSCN溶液后显红色
C.先滴加KSCN溶液,溶液呈红色,再加足量铁粉红色消失
D.先滴加KSCN溶液,溶液不显红色,再滴加氯水后显红色
题组3.亚铁盐和铁盐性质的应用及实验探究
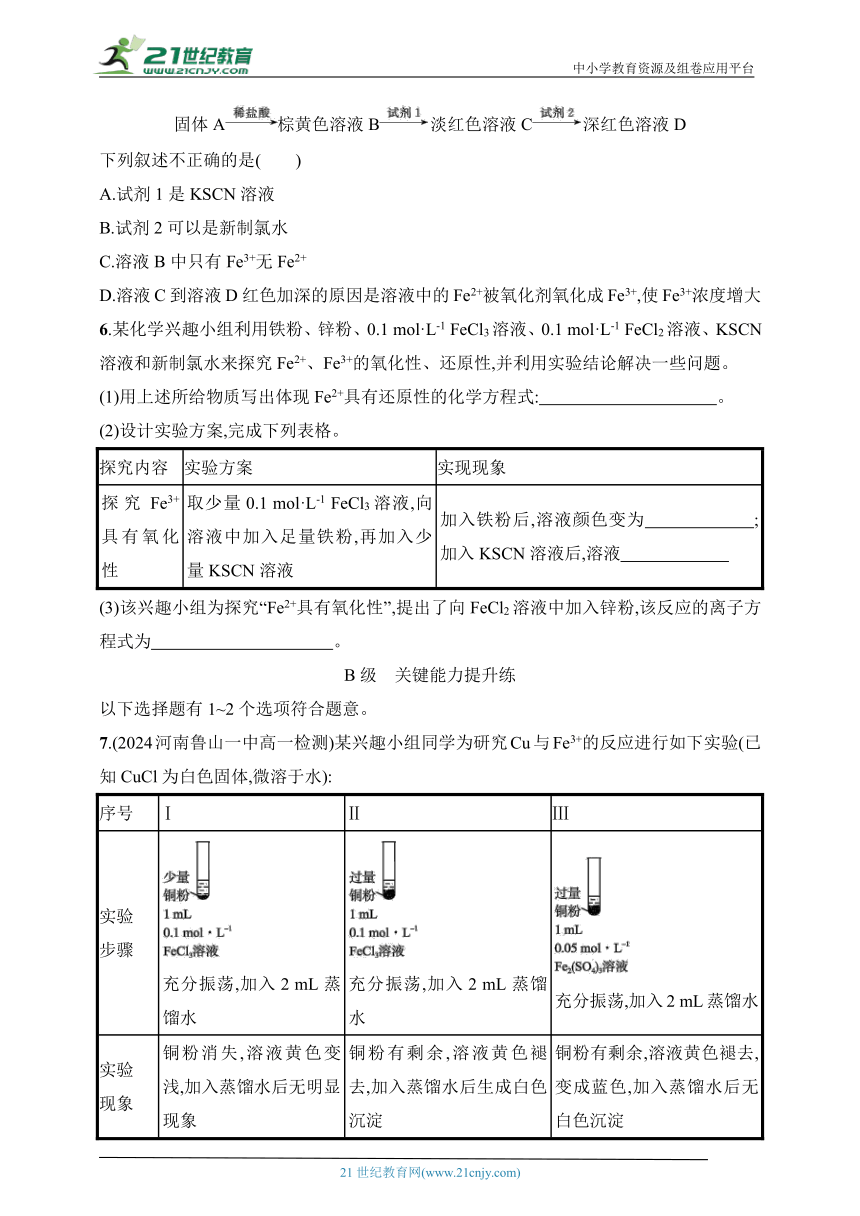
5.取某含铁元素的固体A进行如下实验:
固体A棕黄色溶液B淡红色溶液C深红色溶液D
下列叙述不正确的是( )
A.试剂1是KSCN溶液
B.试剂2可以是新制氯水
C.溶液B中只有Fe3+无Fe2+
D.溶液C到溶液D红色加深的原因是溶液中的Fe2+被氧化剂氧化成Fe3+,使Fe3+浓度增大
6.某化学兴趣小组利用铁粉、锌粉、0.1 mol·L-1 FeCl3溶液、0.1 mol·L-1 FeCl2溶液、KSCN溶液和新制氯水来探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
(1)用上述所给物质写出体现Fe2+具有还原性的化学方程式: 。
(2)设计实验方案,完成下列表格。
探究内容 实验方案 实现现象
探究Fe3+具有氧化性 取少量0.1 mol·L-1 FeCl3溶液,向溶液中加入足量铁粉,再加入少量KSCN溶液 加入铁粉后,溶液颜色变为 ;加入KSCN溶液后,溶液
(3)该兴趣小组为探究“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,该反应的离子方程式为 。
B级 关键能力提升练
以下选择题有1~2个选项符合题意。
7.(2024河南鲁山一中高一检测)某兴趣小组同学为研究Cu与Fe3+的反应进行如下实验(已知CuCl为白色固体,微溶于水):
序号 Ⅰ Ⅱ Ⅲ
实验 步骤 充分振荡,加入2 mL蒸馏水 充分振荡,加入2 mL蒸馏水 充分振荡,加入2 mL蒸馏水
实验 现象 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀
下列说法不正确的是( )
A.3个实验中消耗的铜粉的量完全一样
B.实验Ⅰ、Ⅱ、Ⅲ中均发生了反应2Fe3++CuCu2++2Fe2+
C.Ⅱ中加水后的离子反应可能是Cu2++Cu+2Cl-2CuCl↓
D.上述实验表明能否形成白色沉淀取决于加入Cu的量
8.将1.12 g铁粉加入25 mL 2 mol·L-1的氯化铁溶液中,充分反应后,其结果是( )
A.铁粉剩余,溶液呈浅绿色
B.向溶液中滴入无色KSCN溶液,不显红色
C.溶液中Fe2+与Fe3+的物质的量之比为6∶1
D.氧化产物与还原产物的物质的量之比为2∶5
9.(2024广东广州高一测试)某工厂的工业废水中含有大量的Fe2+、Fe3+、Cu2+和少量Na+,同时含有S。工厂计划从该废水中回收硫酸亚铁和金属铜,设计如下流程。
下列说法正确的是( )
A.加入过量A,发生的反应均为置换反应
B.固体B为混合物而固体E为纯净物
C.物质D既可以用稀硫酸也可以用稀盐酸
D.滤液C和滤液F组成不完全相同
10.(2024江苏江南十校高一联考)有某种含有少量FeCl2杂质的FeCl3样品,现要测定其中铁元素的质量分数,实验采用下列步骤进行:
①准确称量m g样品(在2~3 g范围内);
②向样品中加入10 mL 6 mol·L-1的盐酸,再加入蒸馏水,配制成250 mL溶液;
③量取25 mL操作②中所配的溶液,加入3 mL氯水,加热使FeCl2反应完全;
④趁热迅速加入10%的氨水至过量,充分搅拌,使沉淀完全;
⑤过滤,将沉淀洗涤后,灼烧、冷却、称重,并重复操作至恒重,坩埚质量为W1 g,坩埚及灼烧后的固体总质量为W2 g。
下列说法正确的是( )
A.步骤③中的离子反应为Fe2++Cl2Fe3++2Cl-
B.最后坩埚中的固体是FeO和Fe2O3
C.样品中铁元素的质量分数为%
D.向样品水溶液中先通Cl2再滴加KSCN溶液,出现红色,判断有Fe2+
11.(2024湖南长沙高一月考)向100 mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示(忽略溶液体积的变化)。下列说法不正确的是( )
A.a点时溶液中金属阳离子有Cu2+、Fe2+、Fe3+
B.b点时溶液中发生的反应为Fe+Cu2+Cu+Fe2+
C.c点时溶液中溶质的物质的量浓度无法计算
D.原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶2
12.(2024山东菏泽一中高一月考)长期放置的FeSO4溶液易被氧化而变质。某兴趣小组分别对新制和久置的两瓶FeSO4溶液进行实验。
Ⅰ.分别取2 mL新制的FeSO4溶液于三支试管中,进行实验。
实验 试剂X 实验现象
实验ⅰ 1 mL 1 mol·L-1 NaOH溶液 现象a
实验ⅱ 5滴酸性 KMnO4溶液 现象b:紫色褪去
实验ⅲ 依次加入5滴KSCN溶液、5滴氯水 现象c
(1)实验ⅰ中,现象a是立即产生白色沉淀,白色沉淀逐渐变为灰绿色,最终变为红褐色。白色沉淀的化学式是 ,最终变为红褐色的化学方程式是
。
(2)实验ⅲ的实验现象是 ,写出氯水参与反应的离子方程式: 。
Ⅱ.久置的FeSO4溶液。
实验操作 实验现象 实验结论
实验ⅳ 取少量久置的FeSO4溶液于试管中,向其中滴加5滴KSCN溶液 溶液变红 FeSO4溶液部分变质
实验ⅴ
(3)将上述实验ⅴ中的实验操作和现象补充完整。
(4)若要使部分变质的FeSO4复原,发生反应的离子反应方程式是 。
(5)小组同学查阅资料得知,“维生素C可将Fe3+转化为Fe2+”。为了验证维生素C的作用,设计了实验ⅵ。
实验操作 实验现象
实验ⅵ 取一定量Fe2(SO4)3溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性KMnO4溶液 紫色褪去
由实验ⅵ能否得出“维生素C可将Fe3+转化为Fe2+”的结论 请说明理由。
C级 学科素养拔高练
13.(2024北京理工附中高一检测)某小组同学分别探究FeCl2溶液、FeCl3溶液的性质。
Ⅰ.探究FeCl2溶液的性质。
(1)从物质类别角度判断FeCl2属于 ,因此可以与某些碱反应。
(2)预测FeCl2具有氧化性,因此可以与Zn反应,此时Zn体现 性。
(3)预测FeCl2具有还原性,预测依据是 ,因此可以与酸性KMnO4溶液反应。
(4)进行如下实验操作:
序号 操作
ⅰ 滴加NaOH溶液
ⅱ 加入少量锌粉
ⅲ 滴加酸性KMnO4溶液
①ⅰ中的现象是 ,用化学方程式表示产生该现象的原因: 、 。
②ⅱ中反应的离子方程式是 。
③ⅲ中的现象是 。
(5)某同学认为ⅲ中现象并不能证明Fe2+具有还原性,他的理由有二,
理由一:将酸性高锰酸钾稀释也可能产生该现象;
理由二: 。
Ⅱ.探究FeCl3溶液的性质。
小组同学进行如下实验操作并观察到对应现象:
操作
现象 溶液由棕黄色变为浅绿色 无明显现象 溶液变为红色,而后红色褪去
Ⅲ.小组同学探究ⅵ中褪色原因,提出两种假设:
a.铁离子被转化,b.SCN-被转化。
(6)分别向褪色后的溶液中滴加0.1 mol·L-1 FeCl3溶液和KSCN溶液各1滴,观察到 现象,得出结论:假设b成立。
(7)进一步预测SCN-可能被转化为S,通过实验验证了该预测,写出实验操作及现象:
。
答案:
1.D 解析 由于Fe3+能氧化Fe、Cu,充分反应后滤去固体物质,固体为Cu或Fe、Cu,所以滤液中一定无Fe3+,可排除②④,固体物质存在两种可能:当固体为铁、铜时,溶液中的Fe3+、Cu2+全部参加反应生成Fe2+和Cu,反应的化学方程式为2FeCl3+Fe3FeCl2、CuCl2+FeCu+FeCl2,所以溶液中一定没有Fe3+、Cu2+,只有Fe2+,故①正确;当固体为铜时,溶液中一定没有Fe3+,Cu2+恰好全部参加反应或部分反应生成Fe2+和Cu,所以溶液中可能含有Cu2+,一定含有Fe2+,故③正确。
2.A 解析 ①中:Fe+Cu2+Fe2++Cu,Fe元素的化合价升高,则Fe做还原剂,故A正确;向硫酸亚铁溶液中滴入几滴氯水:2Fe2++Cl22Fe3++2Cl-,反应中Fe元素的化合价升高,则Fe2+只表现还原性,故B错误;③中发生反应Cu+2Fe3+2Fe2++Cu2+,生成物中没有单质,则不是置换反应,故C错误;利用氧化剂的氧化性大于氧化产物的氧化性可知,氧化性:Fe3+>Cu2+>Fe2+,故D错误。
3.C 解析 FeCl2溶液变质是因为Fe2+被氧化为Fe3+,检验某FeCl2溶液是否变质,即检验溶液中是否有Fe3+,Fe3+能和SCN-反应使溶液呈现红色,可向溶液中加入KSCN溶液。
4.D 解析 滴加KSCN溶液,溶液不显红色,只能说明溶液中不含有Fe3+,无法证明其中含有Fe2+,A不符合题意;先滴加氯水,再滴加KSCN溶液后显红色,只能证明加入氯水后,溶液中含有Fe3+,无法证明原溶液中含有Fe2+或Fe3+,B不符合题意;先滴加KSCN溶液,溶液呈红色,说明原溶液中含有Fe3+,再加足量铁粉红色消失,说明Fe与Fe3+发生反应,与题意要求不符,C不符合题意;先滴加KSCN溶液,溶液不显红色,说明原溶液中不含Fe3+,再滴加氯水后显红色,说明原溶液中含有Fe2+,与题意要求相符,D符合题意。
5.C 解析 从框图可知,A和稀盐酸反应生成棕黄色溶液,加入试剂1变成淡红色溶液C,可以推断溶液B中含有Fe3+,加入KSCN溶液后生成Fe(SCN)3;加入试剂2得到深红色溶液D,可知试剂2为强氧化剂,则溶液B中还含有Fe2+,加入试剂2(强氧化剂),Fe2+被氧化为Fe3+,并进一步转化为Fe(SCN)3,所以溶液红色加深,故A、B、D项正确,C项错误。
6.答案 (1)2FeCl2+Cl22FeCl3
(2)浅绿色 不变红 (3)Fe2++ZnZn2++Fe
解析 (1)在反应中Fe2+体现还原性,做还原剂,因此应选择氧化剂,所以选用新制氯水,发生的反应为2FeCl2+Cl22FeCl3。(2)向FeCl3溶液中加入足量铁粉,发生的反应为2Fe3++Fe3Fe2+,所以溶液由黄色变为浅绿色;再滴加KSCN溶液不变红。(3)向FeCl2溶液中加入锌粉,发生反应的离子方程式为Zn+Fe2+Fe+Zn2+。
7.AD 解析 实验Ⅱ中Cu部分转化为Cu(Ⅰ)消耗的铜粉多于其他两个实验,A不正确;实验Ⅰ、Ⅱ、Ⅲ中溶液黄色均褪去,都发生了反应2Fe3++CuCu2++2Fe2+,B正确;Ⅱ中加水后生成白色沉淀,根据已知信息推测白色沉淀应为CuCl,可能的离子反应:Cu2++Cu+2Cl-2CuCl↓,C正确;实验Ⅱ、Ⅲ均加入过量的铜,后者未产生白色沉淀,表明能否形成白色沉淀由Cu的量和Cl-的浓度共同决定,D不正确。
8.C 解析 n(Fe)=0.02 mol,n(FeCl3)=0.05 mol,由Fe+2Fe3+3Fe2+可知,Fe3+过量0.01 mol,铁粉全部溶解,反应生成0.06 mol Fe2+,故A错误、C正确;Fe3+过量,滴入无色KSCN溶液,溶液显红色,故B错误;氧化生成的Fe2+和还原生成的Fe2+的物质的量之比为1∶2,故D错误。
9.BD 解析 向工业废水中加入过量的铁粉,铁粉与废水中的Fe3+、Cu2+反应生成Fe2+和Cu,因此固体B为Fe、Cu,滤液C含Fe2+。向固体B中加入过量的H2SO4,生成FeSO4和Cu。经过滤后得到Cu(固体E)和FeSO4、H2SO4(滤液F)。滤液F和滤液C再经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到FeSO4·7H2O晶体。A为Fe,发生反应:Fe+2Fe3+3Fe2+、Fe+Cu2+Fe2++Cu,包含化合反应和置换反应,A项错误;固体B为Fe、Cu的混合物,固体E为Cu,B项正确;物质D只能用硫酸,用稀盐酸会引入杂质,制得的FeSO4·7H2O晶体不纯,C项错误;滤液C中含Fe2+,滤液F中除含Fe2+,还有过量的H2SO4,因此滤液C和滤液F组成不完全相同,D项正确。
10.C 解析 由题意可知,步骤①②为称量、溶解样品得到含有氯化亚铁杂质的氯化铁溶液,步骤③为向溶液中加入氯水将溶液中氯化亚铁氧化为氯化铁,步骤④为向溶液中加入氨水使铁离子转化为氢氧化铁沉淀,步骤⑤为过滤得到氢氧化铁,将氢氧化铁灼烧分解转化为氧化铁。步骤③中的离子反应为2Fe2++Cl22Fe3++2Cl-,A错误;最后坩埚中发生的反应为氢氧化铁灼烧分解生成氧化铁和水,B错误;氧化铁的质量为(W2-W1) g,由铁原子守恒可知,样品中铁元素的质量分数为×100%=%,C正确;样品水溶液是含有氯化亚铁杂质的氯化铁溶液,无论是否通入氯气,加入硫氰化钾溶液,溶液一定会变为红色,D错误。
11.C 解析 铁粉先和Fe3+反应,再和Cu2+反应,所以a点时溶液中发生的反应为Fe+2Fe3+3Fe2+,此时Fe3+未完全反应,故a点时溶液中金属阳离子有Cu2+、Fe2+、Fe3+,A正确;由图可知,b点时溶液中发生的反应为Fe+Cu2+Cu+Fe2+,B正确;当加入铁粉质量在1.68 g至2.24 g之间时,剩余固体质量从1.28 g至1.84 g,说明c点时铁粉过量,c点时溶液的溶质只有FeSO4,由图可知,结合Fe+2Fe3+3Fe2+、Fe+Cu2+Cu+Fe2+,计算得溶液中Fe2+的物质的量为0.05 mol,所以溶质的物质的量浓度为0.5 mol·L-1,C错误;由C易得原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶2,D正确。
12.答案 (1)Fe(OH)2 4Fe(OH)2+O2+2H2O4Fe(OH)3
(2)加入KSCN溶液后无明显现象,加入氯水后溶液变成红色 Cl2+2Fe2+2Cl-+2Fe3+
(3)取少量久置的FeSO4溶液于试管中,向其中滴加5滴酸性KMnO4溶液 紫色褪去
(4)2Fe3++Fe3Fe2+
(5)不能,维生素C可能过量,维生素C也可使酸性KMnO4溶液褪色,则无法说明一定有Fe2+生成。[能,如果维生素C恰好被Fe2(SO4)3溶液反应完,加入酸性KMnO4溶液褪色,则证明一定含有Fe2+]
解析 (1)实验ⅰ中,现象a是立即产生白色沉淀,白色沉淀逐渐变为灰绿色,最终变为红褐色,白色沉淀的化学式是Fe(OH)2,最终变为红褐色的化学方程式为4Fe(OH)2+O2+2H2O4Fe(OH)3。
(2)实验ⅱ的实验现象:加入KSCN溶液后无明显现象,加入氯水后溶液变成红色,证明含亚铁离子,不含铁离子,氯水参与反应的离子方程式为Cl2+2Fe2+2Cl-+2Fe3+。
(3)要想证明FeSO4溶液部分变质,需要证明溶液中含有Fe3+和Fe2+,实验ⅳ中,向待测液中加入KSCN溶液,溶液变为红色,说明溶液中含有Fe3+,实验ⅴ中,取少量久置的FeSO4溶液于试管中,向待测液中滴加5滴酸性KMnO4溶液,酸性KMnO4溶液紫色褪去,说明溶液中含有Fe2+。
(4)若要使变质的FeSO4溶液复原,可以向溶液中加入过量的Fe粉,再经过滤除去剩余的Fe粉即可,反应的离子方程式为2Fe3++Fe3Fe2+。
(5)由实验ⅵ不一定得出“维生素C可将Fe3+转化为Fe2+”的结论,因为维生素C可能过量。
13.答案 (1)盐 (2)还原
(3)FeCl2中铁元素为+2价,可以升高
(4)①产生白色沉淀,迅速变为灰绿色,最终为红褐色 FeCl2+2NaOHFe(OH)2↓+2NaCl 4Fe(OH)2+O2+2H2O4Fe(OH)3 ②Zn+Fe2+Fe+Zn2+ ③酸性KMnO4溶液褪色
(5)Cl-具有还原性,也可以使酸性高锰酸钾溶液褪色
(6)滴加KSCN的溶液变红
(7)向褪色后的溶液中滴加盐酸酸化的氯化钡溶液,产生白色沉淀
解析 (1)FeCl2属于盐。
(2)Zn和氯化亚铁反应生成铁单质和氯化锌,锌的化合价由0价升高为+2价,化合价升高,锌体现还原性。
(3)FeCl2具有还原性,预测依据:FeCl2中铁元素为+2价,化合价可以升高,因此可以与酸性KMnO4溶液反应。
(4)①FeCl2溶液中加入NaOH溶液,现象是产生白色沉淀,迅速变为灰绿色,最终变为红褐色;产生该现象的原因:二价铁离子和氢氧根离子形成氢氧化亚铁白色沉淀,氢氧化亚铁易被空气中氧气氧化成氢氧化铁,化学方程式:FeCl2+2NaOHFe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O4Fe(OH)3。②FeCl2溶液中加入少量锌粉,反应的离子方程式:Zn+Fe2+Fe+Zn2+。③FeCl2溶液中滴加酸性KMnO4溶液,现象是酸性KMnO4溶液褪色。
(5)Cl-有还原性,对Fe2+还原性的检验产生干扰。
(6)2Fe3++Fe3Fe2+,溶液由棕黄色变为浅绿色,滴加KSCN溶液无明显现象,逐滴滴加氯水后,2Fe2++Cl22Fe3++2Cl-,Fe3++3SCN-Fe(SCN)3,溶液变为红色,而后红色褪去可能原因是a.铁离子被转化,b.SCN-被转化;为证明假设b成立,可以向褪色后的溶液中滴加KSCN溶液,若溶液变红,说明SCN-被转化。
(7)进一步预测SCN-可能被转化为S,需要对S进行检验。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025鲁科版化学必修第一册
分层作业14 亚铁盐和铁盐
A级 必备知识基础练
题组1.亚铁盐和铁盐的性质
1.(2024广东四会、广信中学高一联考)在FeCl3和CuCl2的混合溶液中加入铁屑,反应结束后滤出固体物质,滤液中的阳离子可能是( )
①只有Fe2+;②Fe2+和Fe3+;③Fe2+和Cu2+;
④Cu2+和Fe3+
A.②③ B.②④
C.①④ D.①③
2.(2024山东枣庄高一联考)已知如下三个实验均能发生化学反应:
① ② ③
将铁钉放入硫酸铜溶液中 向硫酸亚铁溶液中滴入几滴氯水 将铜丝放入氯化铁溶液中
下列判断正确的是( )
A.实验①中铁作还原剂
B.实验②中Fe2+既显氧化性又显还原性
C.实验③中发生的是置换反应
D.上述实验证明氧化性:Fe3+>Fe2+>Cu2+
题组2.Fe2+、Fe3+的检验
3.(2024福建三明一中高一模拟)为了检验某FeCl2溶液是否变质,可向溶液中加入( )
A.NaOH溶液 B.铁片
C.KSCN溶液 D.石蕊溶液
4.(2024河南开封高一模拟)能证明只含Fe2+而不含Fe3+的实验及现象是( )
A.只需滴加KSCN溶液,溶液不显红色
B.先滴加氯水,再滴加KSCN溶液后显红色
C.先滴加KSCN溶液,溶液呈红色,再加足量铁粉红色消失
D.先滴加KSCN溶液,溶液不显红色,再滴加氯水后显红色
题组3.亚铁盐和铁盐性质的应用及实验探究
5.取某含铁元素的固体A进行如下实验:
固体A棕黄色溶液B淡红色溶液C深红色溶液D
下列叙述不正确的是( )
A.试剂1是KSCN溶液
B.试剂2可以是新制氯水
C.溶液B中只有Fe3+无Fe2+
D.溶液C到溶液D红色加深的原因是溶液中的Fe2+被氧化剂氧化成Fe3+,使Fe3+浓度增大
6.某化学兴趣小组利用铁粉、锌粉、0.1 mol·L-1 FeCl3溶液、0.1 mol·L-1 FeCl2溶液、KSCN溶液和新制氯水来探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
(1)用上述所给物质写出体现Fe2+具有还原性的化学方程式: 。
(2)设计实验方案,完成下列表格。
探究内容 实验方案 实现现象
探究Fe3+具有氧化性 取少量0.1 mol·L-1 FeCl3溶液,向溶液中加入足量铁粉,再加入少量KSCN溶液 加入铁粉后,溶液颜色变为 ;加入KSCN溶液后,溶液
(3)该兴趣小组为探究“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,该反应的离子方程式为 。
B级 关键能力提升练
以下选择题有1~2个选项符合题意。
7.(2024河南鲁山一中高一检测)某兴趣小组同学为研究Cu与Fe3+的反应进行如下实验(已知CuCl为白色固体,微溶于水):
序号 Ⅰ Ⅱ Ⅲ
实验 步骤 充分振荡,加入2 mL蒸馏水 充分振荡,加入2 mL蒸馏水 充分振荡,加入2 mL蒸馏水
实验 现象 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀
下列说法不正确的是( )
A.3个实验中消耗的铜粉的量完全一样
B.实验Ⅰ、Ⅱ、Ⅲ中均发生了反应2Fe3++CuCu2++2Fe2+
C.Ⅱ中加水后的离子反应可能是Cu2++Cu+2Cl-2CuCl↓
D.上述实验表明能否形成白色沉淀取决于加入Cu的量
8.将1.12 g铁粉加入25 mL 2 mol·L-1的氯化铁溶液中,充分反应后,其结果是( )
A.铁粉剩余,溶液呈浅绿色
B.向溶液中滴入无色KSCN溶液,不显红色
C.溶液中Fe2+与Fe3+的物质的量之比为6∶1
D.氧化产物与还原产物的物质的量之比为2∶5
9.(2024广东广州高一测试)某工厂的工业废水中含有大量的Fe2+、Fe3+、Cu2+和少量Na+,同时含有S。工厂计划从该废水中回收硫酸亚铁和金属铜,设计如下流程。
下列说法正确的是( )
A.加入过量A,发生的反应均为置换反应
B.固体B为混合物而固体E为纯净物
C.物质D既可以用稀硫酸也可以用稀盐酸
D.滤液C和滤液F组成不完全相同
10.(2024江苏江南十校高一联考)有某种含有少量FeCl2杂质的FeCl3样品,现要测定其中铁元素的质量分数,实验采用下列步骤进行:
①准确称量m g样品(在2~3 g范围内);
②向样品中加入10 mL 6 mol·L-1的盐酸,再加入蒸馏水,配制成250 mL溶液;
③量取25 mL操作②中所配的溶液,加入3 mL氯水,加热使FeCl2反应完全;
④趁热迅速加入10%的氨水至过量,充分搅拌,使沉淀完全;
⑤过滤,将沉淀洗涤后,灼烧、冷却、称重,并重复操作至恒重,坩埚质量为W1 g,坩埚及灼烧后的固体总质量为W2 g。
下列说法正确的是( )
A.步骤③中的离子反应为Fe2++Cl2Fe3++2Cl-
B.最后坩埚中的固体是FeO和Fe2O3
C.样品中铁元素的质量分数为%
D.向样品水溶液中先通Cl2再滴加KSCN溶液,出现红色,判断有Fe2+
11.(2024湖南长沙高一月考)向100 mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示(忽略溶液体积的变化)。下列说法不正确的是( )
A.a点时溶液中金属阳离子有Cu2+、Fe2+、Fe3+
B.b点时溶液中发生的反应为Fe+Cu2+Cu+Fe2+
C.c点时溶液中溶质的物质的量浓度无法计算
D.原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶2
12.(2024山东菏泽一中高一月考)长期放置的FeSO4溶液易被氧化而变质。某兴趣小组分别对新制和久置的两瓶FeSO4溶液进行实验。
Ⅰ.分别取2 mL新制的FeSO4溶液于三支试管中,进行实验。
实验 试剂X 实验现象
实验ⅰ 1 mL 1 mol·L-1 NaOH溶液 现象a
实验ⅱ 5滴酸性 KMnO4溶液 现象b:紫色褪去
实验ⅲ 依次加入5滴KSCN溶液、5滴氯水 现象c
(1)实验ⅰ中,现象a是立即产生白色沉淀,白色沉淀逐渐变为灰绿色,最终变为红褐色。白色沉淀的化学式是 ,最终变为红褐色的化学方程式是
。
(2)实验ⅲ的实验现象是 ,写出氯水参与反应的离子方程式: 。
Ⅱ.久置的FeSO4溶液。
实验操作 实验现象 实验结论
实验ⅳ 取少量久置的FeSO4溶液于试管中,向其中滴加5滴KSCN溶液 溶液变红 FeSO4溶液部分变质
实验ⅴ
(3)将上述实验ⅴ中的实验操作和现象补充完整。
(4)若要使部分变质的FeSO4复原,发生反应的离子反应方程式是 。
(5)小组同学查阅资料得知,“维生素C可将Fe3+转化为Fe2+”。为了验证维生素C的作用,设计了实验ⅵ。
实验操作 实验现象
实验ⅵ 取一定量Fe2(SO4)3溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性KMnO4溶液 紫色褪去
由实验ⅵ能否得出“维生素C可将Fe3+转化为Fe2+”的结论 请说明理由。
C级 学科素养拔高练
13.(2024北京理工附中高一检测)某小组同学分别探究FeCl2溶液、FeCl3溶液的性质。
Ⅰ.探究FeCl2溶液的性质。
(1)从物质类别角度判断FeCl2属于 ,因此可以与某些碱反应。
(2)预测FeCl2具有氧化性,因此可以与Zn反应,此时Zn体现 性。
(3)预测FeCl2具有还原性,预测依据是 ,因此可以与酸性KMnO4溶液反应。
(4)进行如下实验操作:
序号 操作
ⅰ 滴加NaOH溶液
ⅱ 加入少量锌粉
ⅲ 滴加酸性KMnO4溶液
①ⅰ中的现象是 ,用化学方程式表示产生该现象的原因: 、 。
②ⅱ中反应的离子方程式是 。
③ⅲ中的现象是 。
(5)某同学认为ⅲ中现象并不能证明Fe2+具有还原性,他的理由有二,
理由一:将酸性高锰酸钾稀释也可能产生该现象;
理由二: 。
Ⅱ.探究FeCl3溶液的性质。
小组同学进行如下实验操作并观察到对应现象:
操作
现象 溶液由棕黄色变为浅绿色 无明显现象 溶液变为红色,而后红色褪去
Ⅲ.小组同学探究ⅵ中褪色原因,提出两种假设:
a.铁离子被转化,b.SCN-被转化。
(6)分别向褪色后的溶液中滴加0.1 mol·L-1 FeCl3溶液和KSCN溶液各1滴,观察到 现象,得出结论:假设b成立。
(7)进一步预测SCN-可能被转化为S,通过实验验证了该预测,写出实验操作及现象:
。
答案:
1.D 解析 由于Fe3+能氧化Fe、Cu,充分反应后滤去固体物质,固体为Cu或Fe、Cu,所以滤液中一定无Fe3+,可排除②④,固体物质存在两种可能:当固体为铁、铜时,溶液中的Fe3+、Cu2+全部参加反应生成Fe2+和Cu,反应的化学方程式为2FeCl3+Fe3FeCl2、CuCl2+FeCu+FeCl2,所以溶液中一定没有Fe3+、Cu2+,只有Fe2+,故①正确;当固体为铜时,溶液中一定没有Fe3+,Cu2+恰好全部参加反应或部分反应生成Fe2+和Cu,所以溶液中可能含有Cu2+,一定含有Fe2+,故③正确。
2.A 解析 ①中:Fe+Cu2+Fe2++Cu,Fe元素的化合价升高,则Fe做还原剂,故A正确;向硫酸亚铁溶液中滴入几滴氯水:2Fe2++Cl22Fe3++2Cl-,反应中Fe元素的化合价升高,则Fe2+只表现还原性,故B错误;③中发生反应Cu+2Fe3+2Fe2++Cu2+,生成物中没有单质,则不是置换反应,故C错误;利用氧化剂的氧化性大于氧化产物的氧化性可知,氧化性:Fe3+>Cu2+>Fe2+,故D错误。
3.C 解析 FeCl2溶液变质是因为Fe2+被氧化为Fe3+,检验某FeCl2溶液是否变质,即检验溶液中是否有Fe3+,Fe3+能和SCN-反应使溶液呈现红色,可向溶液中加入KSCN溶液。
4.D 解析 滴加KSCN溶液,溶液不显红色,只能说明溶液中不含有Fe3+,无法证明其中含有Fe2+,A不符合题意;先滴加氯水,再滴加KSCN溶液后显红色,只能证明加入氯水后,溶液中含有Fe3+,无法证明原溶液中含有Fe2+或Fe3+,B不符合题意;先滴加KSCN溶液,溶液呈红色,说明原溶液中含有Fe3+,再加足量铁粉红色消失,说明Fe与Fe3+发生反应,与题意要求不符,C不符合题意;先滴加KSCN溶液,溶液不显红色,说明原溶液中不含Fe3+,再滴加氯水后显红色,说明原溶液中含有Fe2+,与题意要求相符,D符合题意。
5.C 解析 从框图可知,A和稀盐酸反应生成棕黄色溶液,加入试剂1变成淡红色溶液C,可以推断溶液B中含有Fe3+,加入KSCN溶液后生成Fe(SCN)3;加入试剂2得到深红色溶液D,可知试剂2为强氧化剂,则溶液B中还含有Fe2+,加入试剂2(强氧化剂),Fe2+被氧化为Fe3+,并进一步转化为Fe(SCN)3,所以溶液红色加深,故A、B、D项正确,C项错误。
6.答案 (1)2FeCl2+Cl22FeCl3
(2)浅绿色 不变红 (3)Fe2++ZnZn2++Fe
解析 (1)在反应中Fe2+体现还原性,做还原剂,因此应选择氧化剂,所以选用新制氯水,发生的反应为2FeCl2+Cl22FeCl3。(2)向FeCl3溶液中加入足量铁粉,发生的反应为2Fe3++Fe3Fe2+,所以溶液由黄色变为浅绿色;再滴加KSCN溶液不变红。(3)向FeCl2溶液中加入锌粉,发生反应的离子方程式为Zn+Fe2+Fe+Zn2+。
7.AD 解析 实验Ⅱ中Cu部分转化为Cu(Ⅰ)消耗的铜粉多于其他两个实验,A不正确;实验Ⅰ、Ⅱ、Ⅲ中溶液黄色均褪去,都发生了反应2Fe3++CuCu2++2Fe2+,B正确;Ⅱ中加水后生成白色沉淀,根据已知信息推测白色沉淀应为CuCl,可能的离子反应:Cu2++Cu+2Cl-2CuCl↓,C正确;实验Ⅱ、Ⅲ均加入过量的铜,后者未产生白色沉淀,表明能否形成白色沉淀由Cu的量和Cl-的浓度共同决定,D不正确。
8.C 解析 n(Fe)=0.02 mol,n(FeCl3)=0.05 mol,由Fe+2Fe3+3Fe2+可知,Fe3+过量0.01 mol,铁粉全部溶解,反应生成0.06 mol Fe2+,故A错误、C正确;Fe3+过量,滴入无色KSCN溶液,溶液显红色,故B错误;氧化生成的Fe2+和还原生成的Fe2+的物质的量之比为1∶2,故D错误。
9.BD 解析 向工业废水中加入过量的铁粉,铁粉与废水中的Fe3+、Cu2+反应生成Fe2+和Cu,因此固体B为Fe、Cu,滤液C含Fe2+。向固体B中加入过量的H2SO4,生成FeSO4和Cu。经过滤后得到Cu(固体E)和FeSO4、H2SO4(滤液F)。滤液F和滤液C再经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到FeSO4·7H2O晶体。A为Fe,发生反应:Fe+2Fe3+3Fe2+、Fe+Cu2+Fe2++Cu,包含化合反应和置换反应,A项错误;固体B为Fe、Cu的混合物,固体E为Cu,B项正确;物质D只能用硫酸,用稀盐酸会引入杂质,制得的FeSO4·7H2O晶体不纯,C项错误;滤液C中含Fe2+,滤液F中除含Fe2+,还有过量的H2SO4,因此滤液C和滤液F组成不完全相同,D项正确。
10.C 解析 由题意可知,步骤①②为称量、溶解样品得到含有氯化亚铁杂质的氯化铁溶液,步骤③为向溶液中加入氯水将溶液中氯化亚铁氧化为氯化铁,步骤④为向溶液中加入氨水使铁离子转化为氢氧化铁沉淀,步骤⑤为过滤得到氢氧化铁,将氢氧化铁灼烧分解转化为氧化铁。步骤③中的离子反应为2Fe2++Cl22Fe3++2Cl-,A错误;最后坩埚中发生的反应为氢氧化铁灼烧分解生成氧化铁和水,B错误;氧化铁的质量为(W2-W1) g,由铁原子守恒可知,样品中铁元素的质量分数为×100%=%,C正确;样品水溶液是含有氯化亚铁杂质的氯化铁溶液,无论是否通入氯气,加入硫氰化钾溶液,溶液一定会变为红色,D错误。
11.C 解析 铁粉先和Fe3+反应,再和Cu2+反应,所以a点时溶液中发生的反应为Fe+2Fe3+3Fe2+,此时Fe3+未完全反应,故a点时溶液中金属阳离子有Cu2+、Fe2+、Fe3+,A正确;由图可知,b点时溶液中发生的反应为Fe+Cu2+Cu+Fe2+,B正确;当加入铁粉质量在1.68 g至2.24 g之间时,剩余固体质量从1.28 g至1.84 g,说明c点时铁粉过量,c点时溶液的溶质只有FeSO4,由图可知,结合Fe+2Fe3+3Fe2+、Fe+Cu2+Cu+Fe2+,计算得溶液中Fe2+的物质的量为0.05 mol,所以溶质的物质的量浓度为0.5 mol·L-1,C错误;由C易得原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶2,D正确。
12.答案 (1)Fe(OH)2 4Fe(OH)2+O2+2H2O4Fe(OH)3
(2)加入KSCN溶液后无明显现象,加入氯水后溶液变成红色 Cl2+2Fe2+2Cl-+2Fe3+
(3)取少量久置的FeSO4溶液于试管中,向其中滴加5滴酸性KMnO4溶液 紫色褪去
(4)2Fe3++Fe3Fe2+
(5)不能,维生素C可能过量,维生素C也可使酸性KMnO4溶液褪色,则无法说明一定有Fe2+生成。[能,如果维生素C恰好被Fe2(SO4)3溶液反应完,加入酸性KMnO4溶液褪色,则证明一定含有Fe2+]
解析 (1)实验ⅰ中,现象a是立即产生白色沉淀,白色沉淀逐渐变为灰绿色,最终变为红褐色,白色沉淀的化学式是Fe(OH)2,最终变为红褐色的化学方程式为4Fe(OH)2+O2+2H2O4Fe(OH)3。
(2)实验ⅱ的实验现象:加入KSCN溶液后无明显现象,加入氯水后溶液变成红色,证明含亚铁离子,不含铁离子,氯水参与反应的离子方程式为Cl2+2Fe2+2Cl-+2Fe3+。
(3)要想证明FeSO4溶液部分变质,需要证明溶液中含有Fe3+和Fe2+,实验ⅳ中,向待测液中加入KSCN溶液,溶液变为红色,说明溶液中含有Fe3+,实验ⅴ中,取少量久置的FeSO4溶液于试管中,向待测液中滴加5滴酸性KMnO4溶液,酸性KMnO4溶液紫色褪去,说明溶液中含有Fe2+。
(4)若要使变质的FeSO4溶液复原,可以向溶液中加入过量的Fe粉,再经过滤除去剩余的Fe粉即可,反应的离子方程式为2Fe3++Fe3Fe2+。
(5)由实验ⅵ不一定得出“维生素C可将Fe3+转化为Fe2+”的结论,因为维生素C可能过量。
13.答案 (1)盐 (2)还原
(3)FeCl2中铁元素为+2价,可以升高
(4)①产生白色沉淀,迅速变为灰绿色,最终为红褐色 FeCl2+2NaOHFe(OH)2↓+2NaCl 4Fe(OH)2+O2+2H2O4Fe(OH)3 ②Zn+Fe2+Fe+Zn2+ ③酸性KMnO4溶液褪色
(5)Cl-具有还原性,也可以使酸性高锰酸钾溶液褪色
(6)滴加KSCN的溶液变红
(7)向褪色后的溶液中滴加盐酸酸化的氯化钡溶液,产生白色沉淀
解析 (1)FeCl2属于盐。
(2)Zn和氯化亚铁反应生成铁单质和氯化锌,锌的化合价由0价升高为+2价,化合价升高,锌体现还原性。
(3)FeCl2具有还原性,预测依据:FeCl2中铁元素为+2价,化合价可以升高,因此可以与酸性KMnO4溶液反应。
(4)①FeCl2溶液中加入NaOH溶液,现象是产生白色沉淀,迅速变为灰绿色,最终变为红褐色;产生该现象的原因:二价铁离子和氢氧根离子形成氢氧化亚铁白色沉淀,氢氧化亚铁易被空气中氧气氧化成氢氧化铁,化学方程式:FeCl2+2NaOHFe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O4Fe(OH)3。②FeCl2溶液中加入少量锌粉,反应的离子方程式:Zn+Fe2+Fe+Zn2+。③FeCl2溶液中滴加酸性KMnO4溶液,现象是酸性KMnO4溶液褪色。
(5)Cl-有还原性,对Fe2+还原性的检验产生干扰。
(6)2Fe3++Fe3Fe2+,溶液由棕黄色变为浅绿色,滴加KSCN溶液无明显现象,逐滴滴加氯水后,2Fe2++Cl22Fe3++2Cl-,Fe3++3SCN-Fe(SCN)3,溶液变为红色,而后红色褪去可能原因是a.铁离子被转化,b.SCN-被转化;为证明假设b成立,可以向褪色后的溶液中滴加KSCN溶液,若溶液变红,说明SCN-被转化。
(7)进一步预测SCN-可能被转化为S,需要对S进行检验。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
