第1讲 物质的分类 物质的量 学案(含答案)2026届高三化学一轮总复习
文档属性
| 名称 | 第1讲 物质的分类 物质的量 学案(含答案)2026届高三化学一轮总复习 |
|
|
| 格式 | doc | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-27 00:00:00 | ||
图片预览



文档简介
第1讲 物质的分类 物质的量
复习要求 1. 根据物质的组成和性质可以对物质进行分类。2. 感受分类方法对化学研究和学习化学的重要作用,体会日常生产、生活中分类法的应用。3. 知道胶体是一种常见的分散系和胶体的丁达尔效应。4. 能对酸、碱、盐、氧化物及它们之间的反应进行描述和符号表征。5. 理解物质的量、摩尔质量、阿伏加德罗常数、气体摩尔体积、物质的量浓度的含义,并能进行简单计算。6. 掌握一定溶质质量分数、一定物质的量浓度溶液的配制方法。
知识体系
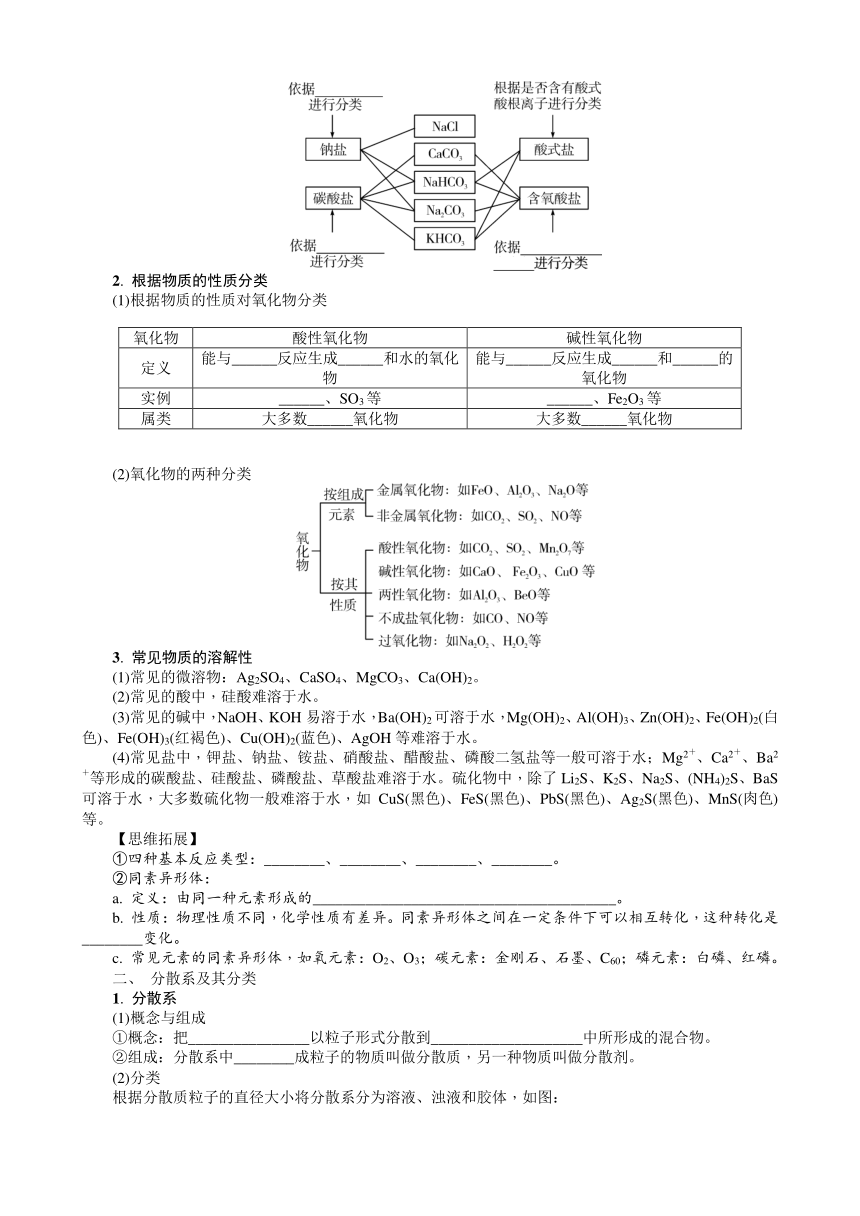
考点一 根据物质的组成和性质分类
一、 物质的分类
1. 根据物质的组成分类
(1)根据物质组成分类
(2)从不同角度对物质分类
2. 根据物质的性质分类
(1)根据物质的性质对氧化物分类
氧化物 酸性氧化物 碱性氧化物
定义 能与______反应生成______和水的氧化物 能与______反应生成______和______的氧化物
实例 ______、SO3等 ______、Fe2O3等
属类 大多数______氧化物 大多数______氧化物
(2)氧化物的两种分类
3. 常见物质的溶解性
(1)常见的微溶物:Ag2SO4、CaSO4、MgCO3、Ca(OH)2。
(2)常见的酸中,硅酸难溶于水。
(3)常见的碱中,NaOH、KOH易溶于水,Ba(OH)2可溶于水,Mg(OH)2、Al(OH)3、Zn(OH)2、Fe(OH)2(白色)、Fe(OH)3(红褐色)、Cu(OH)2(蓝色)、AgOH等难溶于水。
(4)常见盐中,钾盐、钠盐、铵盐、硝酸盐、醋酸盐、磷酸二氢盐等一般可溶于水;Mg2+、Ca2+、Ba2+等形成的碳酸盐、硅酸盐、磷酸盐、草酸盐难溶于水。硫化物中,除了Li2S、K2S、Na2S、(NH4)2S、BaS可溶于水,大多数硫化物一般难溶于水,如CuS(黑色)、FeS(黑色)、PbS(黑色)、Ag2S(黑色)、MnS(肉色)等。
【思维拓展】
①四种基本反应类型:________、________、________、________。
②同素异形体:
a. 定义:由同一种元素形成的________________________________________。
b. 性质:物理性质不同,化学性质有差异。同素异形体之间在一定条件下可以相互转化,这种转化是________变化。
c. 常见元素的同素异形体,如氧元素:O2、O3;碳元素:金刚石、石墨、C60;磷元素:白磷、红磷。
二、 分散系及其分类
1. 分散系
(1)概念与组成
①概念:把________________以粒子形式分散到____________________中所形成的混合物。
②组成:分散系中________成粒子的物质叫做分散质,另一种物质叫做分散剂。
(2)分类
根据分散质粒子的直径大小将分散系分为溶液、浊液和胶体,如图:
(3)常见分散系
(4)三种分散系的比较
分散系 溶液 胶体 浊液
分散质微粒成分 离子或小分子 大分子或离子集合体 巨大分子或离子集合体
分散质粒子直径大小 __________ __________ __________
外观特征 ________ ________ ______________
稳定性 稳定 介稳定 不稳定
分散质能否透过滤纸或半透膜 均能 能透过滤纸,不能透过半透膜 均不能
鉴别 ____________________ ____________________ ____________________________
2. 胶体的性质与应用
(1)丁达尔效应
①定义:当光束通过胶体时,可以看到一条光亮的“通路”,该现象称为丁达尔效应。
②应用:可以鉴别________和________。
(2)介稳性
①定义:胶体的稳定性介于________与________之间,在一定条件下能稳定存在,属于介稳体系,但改变条件胶体有可能发生________。
②应用:涂料、墨水的制造等。
(3)聚沉
①定义:在一定条件下,胶体粒子聚集成较大的颗粒,形成________从分散剂中析出。
②使胶体聚沉的常见方法:a. 加入电解质溶液,b. 加入与胶粒带相反电荷的胶体,c. 加热、搅拌。
③应用:明矾、铁盐能够净水;江河入海口处三角洲的形成;卤水点豆腐。
3. Fe(OH)3胶体的制备
(1)方法:向沸水中逐滴加入5~6滴饱和________溶液,继续煮沸至溶液呈________色,所得的液体就是Fe(OH)3胶体。
(2)原理:FeCl3+3H2OFe(OH)3(胶体)+3HCl。
【思维拓展】
①蒸馏水不能换成NaOH溶液或氨水;②不能边加热边搅拌,不能过度加热;③氢氧化铁胶体的胶粒具有吸附性,能吸附水中的悬浮颗粒物并沉降,常用于净水。明矾能够净水,是因为明矾溶于水后能形成氢氧化铝胶体。
【易错辨析】
1. (2024·无锡期末)NO和NO2都是酸性氧化物。( )
2. (2024·前黄中学二模)纯碱是可用于净水的盐。( )
3. (2024·广东卷)制作日晷圆盘的石材,属于无机非金属材料。( )
4. (2024·南通四模)向酒精中加入适量NaCl(s),充分振荡形成无色透明液体。用激光笔照射液体,出现一条光亮的通路,说明该分散系是胶体。( )
5. 将饱和FeCl3溶液缓慢滴入氢氧化钠溶液中,可制取Fe(OH)3胶体。( )
(2024·宝应高三上期末)化学在文物的研究和修复中有重要作用。下列说法错误的是( )
A. 古壁画颜料中所用的铁红,其成分为Fe2O3
B. 古陶瓷修复所用的熟石膏,其成分为Ca(OH)2
C. 龟甲的成分之一羟基磷灰石属于无机物
D. 竹简的成分之一纤维素属于天然高分子
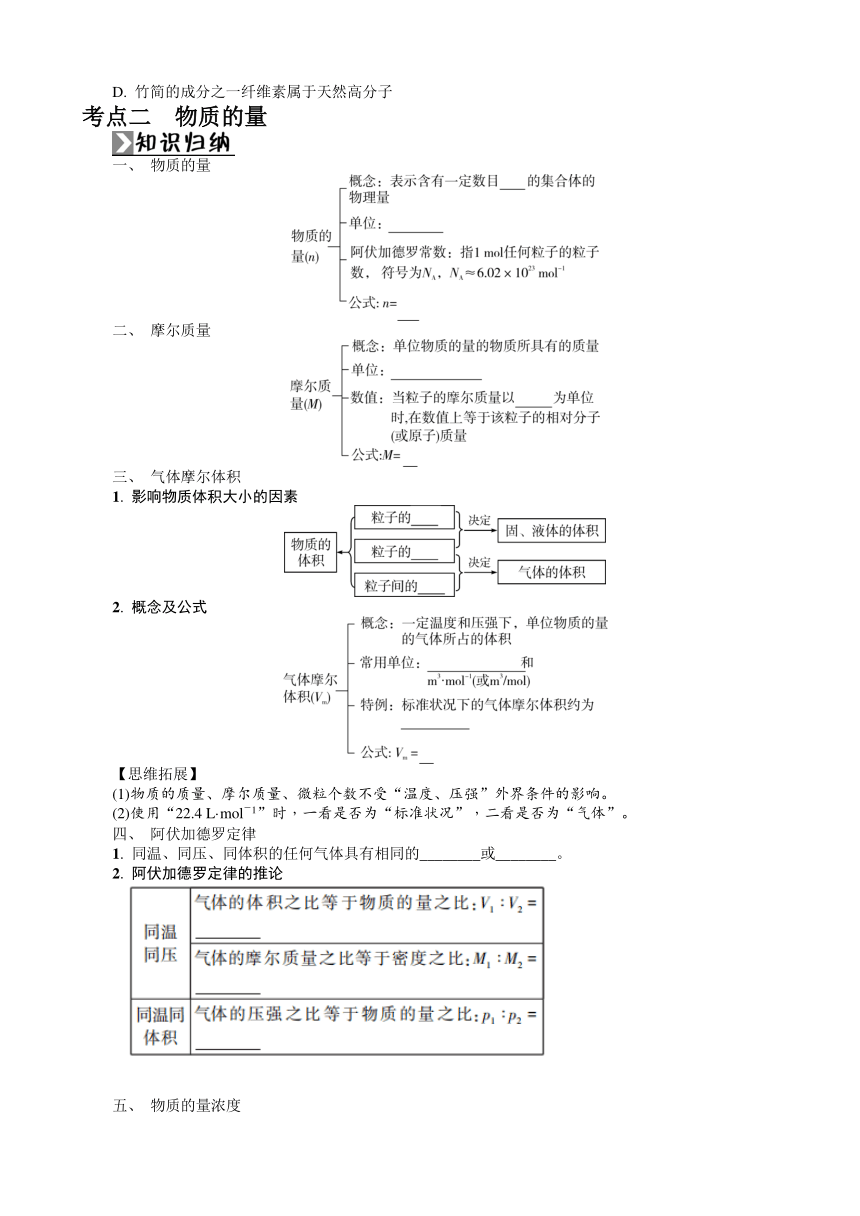
考点二 物质的量
一、 物质的量
二、 摩尔质量
三、 气体摩尔体积
1. 影响物质体积大小的因素
2. 概念及公式
【思维拓展】
(1)物质的质量、摩尔质量、微粒个数不受“温度、压强”外界条件的影响。
(2)使用“22.4 L·mol-1”时,一看是否为“标准状况”,二看是否为“气体”。
四、 阿伏加德罗定律
1. 同温、同压、同体积的任何气体具有相同的________或________。
2. 阿伏加德罗定律的推论
五、 物质的量浓度
溶液组成的两种表示方法
内容 物质的量浓度 溶质质量分数
含义 以________________里所含溶质B的物质的量来表示溶液组成的物理量,叫作溶质B的物质的量浓度,符号为________ 用________质量与________质量的比值来表示溶液组成的物理量,一般用________表示
表达式 cB=(变形:nB=cB·V;V=) (B)=×100%
单位 mol·L-1或mol/L 无
相互转化 c=(c为溶质的物质的量浓度,单位为mol·L-1;ρ为溶液密度,单位为g·cm-3;为溶质质量分数;M为溶质的摩尔质量,单位为g·mol-1)
【注意】 对于某浓度的溶液,取出任意体积的溶液,其浓度、密度、质量分数均不变,但所含溶质的质量、物质的量因体积不同而改变。
【思维拓展】
物质的量浓度计算的两要素
①正确判断溶质
a. 与水发生反应生成新物质:Na、Na2O、Na2O2NaOH;CO2、SO2、SO3H2CO3、H2SO3、H2SO4。
b. 特殊物质:NH3NH3·H2O(溶质按NH3进行计算)。
c. 含结晶水的物质:CuSO4·5H2O、Na2CO3·10H2OCuSO4、Na2CO3。
②确定溶液体积
溶液体积不是溶剂体积,也不是溶剂体积与溶质体积的简单加和,可以根据V=求算。
六、 一定物质的量浓度溶液的配制(以配制500 mL 1.00 mol·L-1 NaCl溶液为例)
1. 主要仪器
天平、药匙、量筒、玻璃棒、烧杯、容量瓶、胶头滴管、滤纸。
2. 配制过程
3. 误差分析
误差分析的思维流程:
(1)导致浓度偏低的错误操作:洗涤或转移时溶液溅出,未洗涤烧杯及玻璃棒,超过刻度线时用滴管吸出液体,定容时仰视,定容后发现液面低于刻度线再加水等。
(2)导致浓度偏高的错误操作:砝码生锈,定容时俯视,未等溶液冷却至室温就定容等。
【思维拓展】
容量瓶使用前应先查漏。查漏方法:向容量瓶中加入适量水,盖上瓶塞倒立,观察是否漏水,若不漏水,然后将容量瓶正立过来,旋转瓶塞180°,倒立,再观察是否漏水。
七、 溶液的稀释与混合
1. 溶液的稀释
(1)溶质的质量在稀释前后保持不变,即=,溶液的质量m稀=m浓+m水;
(2)溶质的物质的量在稀释前后保持不变,即c稀V稀=c浓V浓,但溶液的体积V稀≠V浓+V水。
2. 溶液(溶质相同)的混合
(1)物质的量浓度不同(分别为c1、c2)的两溶液:混合前后溶质的物质的量保持不变,即c1V1+c2V2=c混V混。
(2)质量分数不同(分别为a%、b%)的两溶液
①等体积混合
当溶液密度大于1 g·cm-3时,必然是溶液浓度越大,密度越大,等体积混合后,质量分数>(a%+b%);当溶液密度小于1 g·cm-3时,等体积混合后,质量分数<(a%+b%)。
②等质量混合
混合后溶液中溶质的质量分数=(a%+b%)。
【易错辨析】
1. (2024·安徽卷)标准状况下,2.24 L X(NO)和Y(N2O)混合气体中氧原子数为0.1NA。 ( )
2. (2023·浙江6月选考卷)4.4 g C2H4O中含有σ键数目最多为0.7NA。 ( )
3. (2024·安徽卷)1 L 0.1 mol·L-1 NaNO2溶液中Na+和NO数均为0.1NA。 ( )
4. (2023·浙江6月选考卷)标准状况下,11.2 L Cl2通入水中,溶液中氯离子数为0.5NA。 ( )
5. 溶质质量分数为49%、密度为1.4 g·cm-3的硫酸,其物质的量浓度为2.8 mol·L-1。 ( )
1. (2024·浙江高三下模拟预测)将Na2CO3和NaHCO3的混合物3.27 g加热到质量不再减轻时,测得残留固体2.65 g。另取相同质量的此混合物固体,跟100 mL某浓度的盐酸刚好完全反应生成NaCl,求:
(1)此混合物中NaHCO3与Na2CO3的物质的量之比为__________;
(2)所用盐酸的物质的量浓度为__________;
(3)生成CO2在标准状况下的体积为__________。
2. 利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
(1)溶液配制:称取1.200 0 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________中溶解,完全溶解后,全部转移至100 mL的__________中,加蒸馏水至刻度线摇匀。
(2)滴定:取0.009 50 mol·L-1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应:Cr2O+6I-+14H+===3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O===S4O+2I-。加入淀粉溶液作为指示剂,继续滴定,当溶液__________________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为________(保留1位小数,写出计算过程)。
考点三 有关化学方程式的计算
一、 计算的常用方法
1. 根据方程式计算
2. 守恒法
基本原理 (1)原子守恒:分析原料与产物之间所含相关的主要元素原子个数定量关系,忽略中间过程。如接触法制硫酸:FeS2~2H2SO4;工业制硝酸:NH3~HNO3。(2)电荷守恒:电解质溶液(或固体化合物)中,阴、阳离子所带的电荷总量相等。(3)得失电子守恒。
解题步骤 (1)明确题目要求解的物理量;(2)根据题目中要求解的物理量,分析反应过程中物质的变化,找出守恒类型及相关的物理量;(3)根据守恒原理,梳理出反应前后守恒的物理量,列式计算求解。
3. 关系式法
基本原理 表示两种或多种物质之间“物质的量”关系的一种简化式子。在多步反应中,把始态的反应物与终态的生成物之间的“物质的量”关系表示出来,把多步计算简化成一步计算。
解题步骤 (1)写出各步反应的化学方程式;(2)根据化学方程式找出作为中介的物质,并确定已知物质、中介物质、所求物质之间的量(质量或物质的量或相同条件下气体的体积)的关系;(3)确定已知物质和所求物质之间量的关系;(4)根据所确定的已知物质和所求物质之间量的关系和已知条件进行计算。
【注意】 关系式法解题的关键是建立关系式,建立关系式的方法有:①利用化学方程式中化学计量数间的关系;②利用原子守恒关系;③利用得失电子守恒关系;④利用化学方程式的加和等。
4. 列方程组进行二元混合物的计算
计算中的数学思想:在两种物质组成的混合物中,一般可设两个未知数x、y,题目中通常也会给出两个已知量(设为A、B),寻找x、y与A、B的数学关系,由此建立二元一次方程组进行联解:。
二、 常考化学计算类型
1. 有关混合物质量分数(或纯度)的计算
(1)根据关系式法、得失电子守恒法等,求出混合物中某一成分的量,再除以样品的总质量,即可得出其含量。
(2)解题时理清各物质之间的定量关系,运用质量守恒定律、得失电子守恒、电荷守恒等方法,找准计算关系。
2. 有关物质化学式的计算
(1)根据题给信息,计算出有关物质的物质的量。
(2)根据电荷守恒,计算出未知离子的物质的量。
(3)根据质量守恒定律,计算出结晶水的物质的量。
(4)各粒子的物质的量之比即为物质化学式中各粒子对应的下标比,确定物质的化学式。
3. 热重图像分析计算
(1)设晶体为1 mol,得出样品的质量m始。
(2)固体残留率=×100%,计算m余。
(3)减重一般是先失水,后失气态非金属氧化物。
(4)减重后所得物质一般为金属氧化物,根据金属原子守恒,求出n(金属)和m(金属),由质量守恒定律求得m(O),由n(金属)∶n(O)即可求出减重后物质的化学式。
【思维拓展】
热重曲线解题思维建模(以盐类或碱受热减重为例)
计算推导核心:减重全程金属原子的物质的量不变。
①先计算化合物中的m(金属)、m(H2O),用于判断脱水过程在哪一温度(阶段)结束。
②脱水后产物继续减重,常伴随CO、CO2等气体的产生。
③若为富氧环境,则金属元素或低价非金属元素价态可因氧化而升高。
类型1 有关化学方程式的计算
1. (2024·南通一模)学习小组利用废银催化剂制备乙炔银(Ag2C2)和酸性乙炔银(Ag2C2·nAgNO3)。已知乙炔银和酸性乙炔银在受热时均易发生分解。
制备酸性乙炔银并测定其组成。将乙炔通入硝酸银溶液中可制得酸性乙炔银。反应原理为C2H2+(n+2)AgNO3===Ag2C2·nAgNO3↓+2HNO3。
准确称取1.260 g样品,用浓硝酸完全溶解后,定容得200 mL溶液,取20.00 mL于锥形瓶中,以NH4Fe(SO4)2作指示剂,用0.050 00 mol·L-1 NH4SCN标准溶液进行滴定(Ag++SCN-===AgSCN↓),终点时消耗标准溶液的体积为16.00 mL。通过计算确定n的数值(写出计算过程)。
类型2 有关物质纯度的计算
2. (2024·宿迁三模)碘化亚铜(CuI)是一种难溶于水的白色固体,能被O2氧化。
已知荧光强度比值与Cu2+浓度关系如图所示。取0.000 1 g CuI粗产品,经预处理,将Cu元素全部转化为Cu2+并定容至1 000.00 mL。取1.00 mL所配溶液,测得荧光强度比值为10.2,则产品中CuI的纯度为__________(保留一位小数)。
类型3 有关化学式的计算
3. FeS2、FeS在空气中易被氧化,将FeS2在空气中氧化,测得氧化过程中剩余固体的质量与起始FeS2的质量的比值随温度变化的曲线如图所示。800 ℃时,FeS2氧化成含有两种元素的固体产物为________________________(填化学式,写出计算过程)。
类型4 有关热重曲线的计算
4. (2024·南京、盐城一模)碲广泛应用于冶金工业。以碲铜废料(主要含Cu2Te)为原料回收碲单质的一种工艺流程如下:
将一定质量的CuC2O4置于Ar气中热解,测得剩余固体的质量与原始固体的质量的比值随温度变化的曲线如图所示。350~400 ℃下剩余固体的化学式为__________。
素 养 评 估
1. 分类法可用于预测物质的性质及其变化规律。下列物质的分类与性质预测对应关系不正确的是( )
选项 物质 类别 性质预测
A SO2 酸性氧化物 能与水反应生成酸
B CO 还原剂 能与Fe2O3等氧化剂反应
C K2CO3 钾盐 能与酸反应
D H2SiO3 酸 能与NaOH反应生成盐
2. 朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”从化学的角度对这段文字的解读错误的是( )
A. “薄薄的青雾”是一种分散系
B. “薄薄的青雾”中某些微粒的直径在10-9~10-7 m之间
C. “参差的斑驳黑影”是一种丁达尔效应
D. “云雾润蒸华不注”与“薄薄的青雾”中“雾”的主要成分相同
3. (2024·南京、盐城一模)测定Cr(OH)3样品纯度。准确称取0.900 0 g样品,溶于过量硫酸并配成250.0 mL溶液。取25.00 mL溶液,用足量(NH4)2S2O8溶液将Cr3+氧化为Cr2O,煮沸除去过量的(NH4)2S2O8,冷却至室温。再加入过量KI溶液,以淀粉溶液为指示剂,用0.100 0 mol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液24.00 mL(已知反应:Cr2O+6I-+14H+===3I2+2Cr3++7H2O;I2+2S2O===S4O+2I-)。计算Cr(OH)3样品的纯度(写出计算过程)。
4. (2022·湖南卷)某实验小组以BaS溶液为原料制备BaCl2·2H2O,并用重量法测定产品中BaCl2·2H2O的含量。设计了如下实验方案:
①称取产品0.500 0 g,用100 mL水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液逐滴加入热的0.100 mol·L-1 H2SO4溶液;
③沉淀完全后,60 ℃水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为0.466 0 g。
产品中BaCl2·2H2O的质量分数为(保留三位有效数字,写出计算过程)。
第1讲 物质的分类 物质的量
考点一 根据物质的组成和性质分类
知识归纳
一、 1. (2)金属阳离子 酸根阴离子 酸根离子是否含有氧
2. (1)碱 盐 酸 盐 水 CO2 CaO 非金属 金属
思维拓展
①化合反应 分解反应 置换反应 复分解反应 ②a. 性质不同的单质互称同素异形体 b. 化学
二、 1. (1)①一种(或多种)物质 另一种(或多种)物质 ②被分散
(4)<1 nm 1~100 nm >100 nm 均一、透明 均一、透明 不均一、不透明 无丁达尔效应 有丁达尔效应 静置沉淀或分层
2. (1)②胶体 溶液 (2)①溶液 浊液 聚沉 (3)①沉淀
3. (1)FeCl3 红褐
【易错辨析】
1. × 2. × 3. √ 4. √ 5. ×
命题突破
B 解析:古壁画颜料中所用的铁红,其成分为Fe2O3,为红色固体,故A正确;古陶瓷修复所用的熟石膏,其成分为2CaSO4·H2O,Ca(OH)2是消石灰,故B错误;龟甲的成分之一羟基磷灰石,组成上分析为盐类化合物,属于无机物,故C正确;竹简的成分之一纤维素为多糖,属于天然高分子,故D正确。故选B。
考点二 物质的量
知识归纳
一、 粒子 摩尔(mol)
二、 g·mol-1(或g/mol) g·mol-1
三、 1. 大小 数目 距离
2. L·mol-1(或L/mol) 22.4 L·mol-1
四、 1. 分子数 物质的量
2. n1∶n2=N1∶N2 ρ1∶ρ2 n1∶n2
五、 单位体积溶液 cB 溶质 溶液 百分数
六、 2. 托盘天平 烧杯 冷却至室温 500 2~3 1~2 凹液面与刻度线
【易错辨析】
1. √ 2. √ 3. × 4. × 5. ×
命题突破
1. (1)4∶3 (2)0.5 mol·L (3)784 mL
解析:加热发生反应2NaHCO3Na2CO3+H2O+CO2↑,残留固体质量2.65 g为Na2CO3,包括加热分解生成的Na2CO3及原混合物中含有的Na2CO3,利用差量法计算NaHCO3的质量,进而计算Na2CO3的质量,再根据n=计算二者物质的量;根据氯离子守恒可知n(HCl)=n(NaCl)计算HCl的浓度,以此解题。
(1)设碳酸氢钠的质量为a,则2NaHCO3Na2CO3+H2O+CO2↑,质量减少为168 g-44 g-18 g=62 g,根据方程式反应的比例关系:168∶62=a∶(3.27 g-2.65 g),解得a=1.68 g,其物质的量==0.02 mol,混合物中Na2CO3的质量为3.27 g-1.68 g=1.59 g,其物质的量为:=0.015 mol,则此混合物中NaHCO3与Na2CO3的物质的量之比为0.02∶0.015=4∶3;
(2)由分析可知,残留固体质量2.65 g为Na2CO3,物质的量为:0.025 mol,则根据钠守恒可知,最终生成氯化钠的物质的量为0.025 mol×2=0.05 mol,则盐酸的物质的量为0.05 mol,其浓度为:=0.5 mol·L-1;
(3)由第一问分析可知,原混合物中Na2CO3和NaHCO3的物质的量分别为:0.015 mol和0.02 mol,和盐酸反应时,其中的碳元素都生成二氧化碳,根据碳守恒可知,二氧化碳的物质的量为:0.015 mol+0.02 mol=0.035 mol,其体积为:784 mL。
2. (1)烧杯 容量瓶
(2)蓝色褪去且半分钟不变化 95.0%(过程见解析)
解析:(1)溶液配制需要计算、称量、溶解、冷却、转移、洗涤转移、定容、摇匀等步骤,称取1.200 0 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后,全部转移至100 mL的容量瓶中,加蒸馏水至凹液面最低处与刻度线相平,摇匀;
(2)取0.009 50 mol·L-1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应:Cr2O+6I-+14H+===3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O===S4O+2I-。加入淀粉溶液作为指示剂,继续滴定,到反应终点,碘单质反应后溶液蓝色褪去且半分钟不变,说明反应到达滴定终点,平行滴定3次,样品溶液的平均用量为24.80 mL,结合化学方程式定量关系可得Cr2O~3I2~6S2O,因此溶液中硫代硫酸根离子物质的量=0.009 5 mol·L-1×0.02 L×6=0.001 14 mol,配制100 mL溶液中硫代硫酸根离子物质的量=0.001 14 mol×=0.004 6 mol,则样品纯度=×100%=95.0%。
考点三 有关化学方程式的计算
命题突破
1. 6(过程见解析)
解析:根据方程式可知,20 mL溶液中,n(Ag+)=n(SCN-)=0.8×10-3 mol,则200 mL溶液中总的银离子的物质的量为8×10-3 mol,×(2+n)=8×10-3 mol,则n=6。
2. 76.4%
解析:取样1 mL测得荧光强度比值为10.2,此时溶液中c(Cu2+)=0.4×10-6 mol·L-1,该溶液中n(Cu2+)=0.4×10-6 mol·L-1×1×10-3 L=4×10-10 mol,则产品中CuI的纯度为×100%=76.4%。
3. Fe2O3;设FeS2氧化成含有两种元素的固体产物化学式为FeOx,M(FeS2)=120 g·mol-1,则M(FeOx)=120 g·mol-1×66.7%=80.04 g·mol-1,则56+16x=80.04,x=,即固体产物为Fe2O3
解析:由图可知,800 ℃时,氧化过程中剩余固体的质量与起始FeS2的质量的比值为66.7%,设FeS2氧化成含有两种元素的固体产物化学式为FeOx,M(FeS2)=120 g·mol-1,则M(FeOx)=120 g·mol-1×66.7%=80.04 g·mol-1,56+16x=80.04,x=,所以固体产物为Fe2O3。
4. Cu
解析:由图可知,350~400 ℃时剩余固体的质量与原始固体的质量的比值为42.11%,CuC2O4的摩尔质量为152 g·mol-1,则剩余固体的摩尔质量为:152 g·mol-1×42.11%=64 g·mol-1,再结合化学反应前后元素种类不变,350~400 ℃下剩余固体的化学式为Cu。
素养评估
1. C 解析:SO2属于酸性氧化物,能与水反应生成H2SO3,A正确;CO作还原剂,能与Fe2O3反应,应用于高炉炼铁,B正确;K2CO3能与酸反应,是碳酸盐的性质,C错误;H2SiO3是一种难溶性的弱酸,能与碱发生中和反应,D正确。
2. C 解析:“薄薄的青雾”是胶体分散系,A正确;“薄薄的青雾”是胶体分散系,“薄薄的青雾”中某些微粒的直径在10-9~10-7 m之间,B正确;“参差的斑驳黑影”属于光沿直线传播的物理现象,不属于丁达尔效应的特征,C错误;“云雾润蒸华不注”与“薄薄的青雾”中“雾”都是胶体分散系,它们的主要成分相同,D正确。
3. 91.56%(过程见解析)
解析:n(S2O)=24.00×10-3 L×0.100 0 mol·L-1=2.4×10-3 mol。根据2Cr3+~3I2~6S2O,n[Cr(OH)3]=n(Cr3+)=eq \f(n(S2O),3)==8.0×10-4 mol,0.900 0 g样品中含n[Cr(OH)3]为8.0×10-4 mol×=8.0×10-3 mol,Cr(OH)3样品纯度为×100%≈91.56%。
4. 97.6%(过程见解析)
解析:由题意可知,硫酸钡的物质的量为=0.002 mol,依据钡原子守恒,产品中BaCl2·2H2O的物质的量为0.002 mol,质量为0.002 mol×244 g·mol-1=0.488 g,质量分数为×100%=97.6%。
复习要求 1. 根据物质的组成和性质可以对物质进行分类。2. 感受分类方法对化学研究和学习化学的重要作用,体会日常生产、生活中分类法的应用。3. 知道胶体是一种常见的分散系和胶体的丁达尔效应。4. 能对酸、碱、盐、氧化物及它们之间的反应进行描述和符号表征。5. 理解物质的量、摩尔质量、阿伏加德罗常数、气体摩尔体积、物质的量浓度的含义,并能进行简单计算。6. 掌握一定溶质质量分数、一定物质的量浓度溶液的配制方法。
知识体系
考点一 根据物质的组成和性质分类
一、 物质的分类
1. 根据物质的组成分类
(1)根据物质组成分类
(2)从不同角度对物质分类
2. 根据物质的性质分类
(1)根据物质的性质对氧化物分类
氧化物 酸性氧化物 碱性氧化物
定义 能与______反应生成______和水的氧化物 能与______反应生成______和______的氧化物
实例 ______、SO3等 ______、Fe2O3等
属类 大多数______氧化物 大多数______氧化物
(2)氧化物的两种分类
3. 常见物质的溶解性
(1)常见的微溶物:Ag2SO4、CaSO4、MgCO3、Ca(OH)2。
(2)常见的酸中,硅酸难溶于水。
(3)常见的碱中,NaOH、KOH易溶于水,Ba(OH)2可溶于水,Mg(OH)2、Al(OH)3、Zn(OH)2、Fe(OH)2(白色)、Fe(OH)3(红褐色)、Cu(OH)2(蓝色)、AgOH等难溶于水。
(4)常见盐中,钾盐、钠盐、铵盐、硝酸盐、醋酸盐、磷酸二氢盐等一般可溶于水;Mg2+、Ca2+、Ba2+等形成的碳酸盐、硅酸盐、磷酸盐、草酸盐难溶于水。硫化物中,除了Li2S、K2S、Na2S、(NH4)2S、BaS可溶于水,大多数硫化物一般难溶于水,如CuS(黑色)、FeS(黑色)、PbS(黑色)、Ag2S(黑色)、MnS(肉色)等。
【思维拓展】
①四种基本反应类型:________、________、________、________。
②同素异形体:
a. 定义:由同一种元素形成的________________________________________。
b. 性质:物理性质不同,化学性质有差异。同素异形体之间在一定条件下可以相互转化,这种转化是________变化。
c. 常见元素的同素异形体,如氧元素:O2、O3;碳元素:金刚石、石墨、C60;磷元素:白磷、红磷。
二、 分散系及其分类
1. 分散系
(1)概念与组成
①概念:把________________以粒子形式分散到____________________中所形成的混合物。
②组成:分散系中________成粒子的物质叫做分散质,另一种物质叫做分散剂。
(2)分类
根据分散质粒子的直径大小将分散系分为溶液、浊液和胶体,如图:
(3)常见分散系
(4)三种分散系的比较
分散系 溶液 胶体 浊液
分散质微粒成分 离子或小分子 大分子或离子集合体 巨大分子或离子集合体
分散质粒子直径大小 __________ __________ __________
外观特征 ________ ________ ______________
稳定性 稳定 介稳定 不稳定
分散质能否透过滤纸或半透膜 均能 能透过滤纸,不能透过半透膜 均不能
鉴别 ____________________ ____________________ ____________________________
2. 胶体的性质与应用
(1)丁达尔效应
①定义:当光束通过胶体时,可以看到一条光亮的“通路”,该现象称为丁达尔效应。
②应用:可以鉴别________和________。
(2)介稳性
①定义:胶体的稳定性介于________与________之间,在一定条件下能稳定存在,属于介稳体系,但改变条件胶体有可能发生________。
②应用:涂料、墨水的制造等。
(3)聚沉
①定义:在一定条件下,胶体粒子聚集成较大的颗粒,形成________从分散剂中析出。
②使胶体聚沉的常见方法:a. 加入电解质溶液,b. 加入与胶粒带相反电荷的胶体,c. 加热、搅拌。
③应用:明矾、铁盐能够净水;江河入海口处三角洲的形成;卤水点豆腐。
3. Fe(OH)3胶体的制备
(1)方法:向沸水中逐滴加入5~6滴饱和________溶液,继续煮沸至溶液呈________色,所得的液体就是Fe(OH)3胶体。
(2)原理:FeCl3+3H2OFe(OH)3(胶体)+3HCl。
【思维拓展】
①蒸馏水不能换成NaOH溶液或氨水;②不能边加热边搅拌,不能过度加热;③氢氧化铁胶体的胶粒具有吸附性,能吸附水中的悬浮颗粒物并沉降,常用于净水。明矾能够净水,是因为明矾溶于水后能形成氢氧化铝胶体。
【易错辨析】
1. (2024·无锡期末)NO和NO2都是酸性氧化物。( )
2. (2024·前黄中学二模)纯碱是可用于净水的盐。( )
3. (2024·广东卷)制作日晷圆盘的石材,属于无机非金属材料。( )
4. (2024·南通四模)向酒精中加入适量NaCl(s),充分振荡形成无色透明液体。用激光笔照射液体,出现一条光亮的通路,说明该分散系是胶体。( )
5. 将饱和FeCl3溶液缓慢滴入氢氧化钠溶液中,可制取Fe(OH)3胶体。( )
(2024·宝应高三上期末)化学在文物的研究和修复中有重要作用。下列说法错误的是( )
A. 古壁画颜料中所用的铁红,其成分为Fe2O3
B. 古陶瓷修复所用的熟石膏,其成分为Ca(OH)2
C. 龟甲的成分之一羟基磷灰石属于无机物
D. 竹简的成分之一纤维素属于天然高分子
考点二 物质的量
一、 物质的量
二、 摩尔质量
三、 气体摩尔体积
1. 影响物质体积大小的因素
2. 概念及公式
【思维拓展】
(1)物质的质量、摩尔质量、微粒个数不受“温度、压强”外界条件的影响。
(2)使用“22.4 L·mol-1”时,一看是否为“标准状况”,二看是否为“气体”。
四、 阿伏加德罗定律
1. 同温、同压、同体积的任何气体具有相同的________或________。
2. 阿伏加德罗定律的推论
五、 物质的量浓度
溶液组成的两种表示方法
内容 物质的量浓度 溶质质量分数
含义 以________________里所含溶质B的物质的量来表示溶液组成的物理量,叫作溶质B的物质的量浓度,符号为________ 用________质量与________质量的比值来表示溶液组成的物理量,一般用________表示
表达式 cB=(变形:nB=cB·V;V=) (B)=×100%
单位 mol·L-1或mol/L 无
相互转化 c=(c为溶质的物质的量浓度,单位为mol·L-1;ρ为溶液密度,单位为g·cm-3;为溶质质量分数;M为溶质的摩尔质量,单位为g·mol-1)
【注意】 对于某浓度的溶液,取出任意体积的溶液,其浓度、密度、质量分数均不变,但所含溶质的质量、物质的量因体积不同而改变。
【思维拓展】
物质的量浓度计算的两要素
①正确判断溶质
a. 与水发生反应生成新物质:Na、Na2O、Na2O2NaOH;CO2、SO2、SO3H2CO3、H2SO3、H2SO4。
b. 特殊物质:NH3NH3·H2O(溶质按NH3进行计算)。
c. 含结晶水的物质:CuSO4·5H2O、Na2CO3·10H2OCuSO4、Na2CO3。
②确定溶液体积
溶液体积不是溶剂体积,也不是溶剂体积与溶质体积的简单加和,可以根据V=求算。
六、 一定物质的量浓度溶液的配制(以配制500 mL 1.00 mol·L-1 NaCl溶液为例)
1. 主要仪器
天平、药匙、量筒、玻璃棒、烧杯、容量瓶、胶头滴管、滤纸。
2. 配制过程
3. 误差分析
误差分析的思维流程:
(1)导致浓度偏低的错误操作:洗涤或转移时溶液溅出,未洗涤烧杯及玻璃棒,超过刻度线时用滴管吸出液体,定容时仰视,定容后发现液面低于刻度线再加水等。
(2)导致浓度偏高的错误操作:砝码生锈,定容时俯视,未等溶液冷却至室温就定容等。
【思维拓展】
容量瓶使用前应先查漏。查漏方法:向容量瓶中加入适量水,盖上瓶塞倒立,观察是否漏水,若不漏水,然后将容量瓶正立过来,旋转瓶塞180°,倒立,再观察是否漏水。
七、 溶液的稀释与混合
1. 溶液的稀释
(1)溶质的质量在稀释前后保持不变,即=,溶液的质量m稀=m浓+m水;
(2)溶质的物质的量在稀释前后保持不变,即c稀V稀=c浓V浓,但溶液的体积V稀≠V浓+V水。
2. 溶液(溶质相同)的混合
(1)物质的量浓度不同(分别为c1、c2)的两溶液:混合前后溶质的物质的量保持不变,即c1V1+c2V2=c混V混。
(2)质量分数不同(分别为a%、b%)的两溶液
①等体积混合
当溶液密度大于1 g·cm-3时,必然是溶液浓度越大,密度越大,等体积混合后,质量分数>(a%+b%);当溶液密度小于1 g·cm-3时,等体积混合后,质量分数<(a%+b%)。
②等质量混合
混合后溶液中溶质的质量分数=(a%+b%)。
【易错辨析】
1. (2024·安徽卷)标准状况下,2.24 L X(NO)和Y(N2O)混合气体中氧原子数为0.1NA。 ( )
2. (2023·浙江6月选考卷)4.4 g C2H4O中含有σ键数目最多为0.7NA。 ( )
3. (2024·安徽卷)1 L 0.1 mol·L-1 NaNO2溶液中Na+和NO数均为0.1NA。 ( )
4. (2023·浙江6月选考卷)标准状况下,11.2 L Cl2通入水中,溶液中氯离子数为0.5NA。 ( )
5. 溶质质量分数为49%、密度为1.4 g·cm-3的硫酸,其物质的量浓度为2.8 mol·L-1。 ( )
1. (2024·浙江高三下模拟预测)将Na2CO3和NaHCO3的混合物3.27 g加热到质量不再减轻时,测得残留固体2.65 g。另取相同质量的此混合物固体,跟100 mL某浓度的盐酸刚好完全反应生成NaCl,求:
(1)此混合物中NaHCO3与Na2CO3的物质的量之比为__________;
(2)所用盐酸的物质的量浓度为__________;
(3)生成CO2在标准状况下的体积为__________。
2. 利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
(1)溶液配制:称取1.200 0 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________中溶解,完全溶解后,全部转移至100 mL的__________中,加蒸馏水至刻度线摇匀。
(2)滴定:取0.009 50 mol·L-1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应:Cr2O+6I-+14H+===3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O===S4O+2I-。加入淀粉溶液作为指示剂,继续滴定,当溶液__________________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为________(保留1位小数,写出计算过程)。
考点三 有关化学方程式的计算
一、 计算的常用方法
1. 根据方程式计算
2. 守恒法
基本原理 (1)原子守恒:分析原料与产物之间所含相关的主要元素原子个数定量关系,忽略中间过程。如接触法制硫酸:FeS2~2H2SO4;工业制硝酸:NH3~HNO3。(2)电荷守恒:电解质溶液(或固体化合物)中,阴、阳离子所带的电荷总量相等。(3)得失电子守恒。
解题步骤 (1)明确题目要求解的物理量;(2)根据题目中要求解的物理量,分析反应过程中物质的变化,找出守恒类型及相关的物理量;(3)根据守恒原理,梳理出反应前后守恒的物理量,列式计算求解。
3. 关系式法
基本原理 表示两种或多种物质之间“物质的量”关系的一种简化式子。在多步反应中,把始态的反应物与终态的生成物之间的“物质的量”关系表示出来,把多步计算简化成一步计算。
解题步骤 (1)写出各步反应的化学方程式;(2)根据化学方程式找出作为中介的物质,并确定已知物质、中介物质、所求物质之间的量(质量或物质的量或相同条件下气体的体积)的关系;(3)确定已知物质和所求物质之间量的关系;(4)根据所确定的已知物质和所求物质之间量的关系和已知条件进行计算。
【注意】 关系式法解题的关键是建立关系式,建立关系式的方法有:①利用化学方程式中化学计量数间的关系;②利用原子守恒关系;③利用得失电子守恒关系;④利用化学方程式的加和等。
4. 列方程组进行二元混合物的计算
计算中的数学思想:在两种物质组成的混合物中,一般可设两个未知数x、y,题目中通常也会给出两个已知量(设为A、B),寻找x、y与A、B的数学关系,由此建立二元一次方程组进行联解:。
二、 常考化学计算类型
1. 有关混合物质量分数(或纯度)的计算
(1)根据关系式法、得失电子守恒法等,求出混合物中某一成分的量,再除以样品的总质量,即可得出其含量。
(2)解题时理清各物质之间的定量关系,运用质量守恒定律、得失电子守恒、电荷守恒等方法,找准计算关系。
2. 有关物质化学式的计算
(1)根据题给信息,计算出有关物质的物质的量。
(2)根据电荷守恒,计算出未知离子的物质的量。
(3)根据质量守恒定律,计算出结晶水的物质的量。
(4)各粒子的物质的量之比即为物质化学式中各粒子对应的下标比,确定物质的化学式。
3. 热重图像分析计算
(1)设晶体为1 mol,得出样品的质量m始。
(2)固体残留率=×100%,计算m余。
(3)减重一般是先失水,后失气态非金属氧化物。
(4)减重后所得物质一般为金属氧化物,根据金属原子守恒,求出n(金属)和m(金属),由质量守恒定律求得m(O),由n(金属)∶n(O)即可求出减重后物质的化学式。
【思维拓展】
热重曲线解题思维建模(以盐类或碱受热减重为例)
计算推导核心:减重全程金属原子的物质的量不变。
①先计算化合物中的m(金属)、m(H2O),用于判断脱水过程在哪一温度(阶段)结束。
②脱水后产物继续减重,常伴随CO、CO2等气体的产生。
③若为富氧环境,则金属元素或低价非金属元素价态可因氧化而升高。
类型1 有关化学方程式的计算
1. (2024·南通一模)学习小组利用废银催化剂制备乙炔银(Ag2C2)和酸性乙炔银(Ag2C2·nAgNO3)。已知乙炔银和酸性乙炔银在受热时均易发生分解。
制备酸性乙炔银并测定其组成。将乙炔通入硝酸银溶液中可制得酸性乙炔银。反应原理为C2H2+(n+2)AgNO3===Ag2C2·nAgNO3↓+2HNO3。
准确称取1.260 g样品,用浓硝酸完全溶解后,定容得200 mL溶液,取20.00 mL于锥形瓶中,以NH4Fe(SO4)2作指示剂,用0.050 00 mol·L-1 NH4SCN标准溶液进行滴定(Ag++SCN-===AgSCN↓),终点时消耗标准溶液的体积为16.00 mL。通过计算确定n的数值(写出计算过程)。
类型2 有关物质纯度的计算
2. (2024·宿迁三模)碘化亚铜(CuI)是一种难溶于水的白色固体,能被O2氧化。
已知荧光强度比值与Cu2+浓度关系如图所示。取0.000 1 g CuI粗产品,经预处理,将Cu元素全部转化为Cu2+并定容至1 000.00 mL。取1.00 mL所配溶液,测得荧光强度比值为10.2,则产品中CuI的纯度为__________(保留一位小数)。
类型3 有关化学式的计算
3. FeS2、FeS在空气中易被氧化,将FeS2在空气中氧化,测得氧化过程中剩余固体的质量与起始FeS2的质量的比值随温度变化的曲线如图所示。800 ℃时,FeS2氧化成含有两种元素的固体产物为________________________(填化学式,写出计算过程)。
类型4 有关热重曲线的计算
4. (2024·南京、盐城一模)碲广泛应用于冶金工业。以碲铜废料(主要含Cu2Te)为原料回收碲单质的一种工艺流程如下:
将一定质量的CuC2O4置于Ar气中热解,测得剩余固体的质量与原始固体的质量的比值随温度变化的曲线如图所示。350~400 ℃下剩余固体的化学式为__________。
素 养 评 估
1. 分类法可用于预测物质的性质及其变化规律。下列物质的分类与性质预测对应关系不正确的是( )
选项 物质 类别 性质预测
A SO2 酸性氧化物 能与水反应生成酸
B CO 还原剂 能与Fe2O3等氧化剂反应
C K2CO3 钾盐 能与酸反应
D H2SiO3 酸 能与NaOH反应生成盐
2. 朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”从化学的角度对这段文字的解读错误的是( )
A. “薄薄的青雾”是一种分散系
B. “薄薄的青雾”中某些微粒的直径在10-9~10-7 m之间
C. “参差的斑驳黑影”是一种丁达尔效应
D. “云雾润蒸华不注”与“薄薄的青雾”中“雾”的主要成分相同
3. (2024·南京、盐城一模)测定Cr(OH)3样品纯度。准确称取0.900 0 g样品,溶于过量硫酸并配成250.0 mL溶液。取25.00 mL溶液,用足量(NH4)2S2O8溶液将Cr3+氧化为Cr2O,煮沸除去过量的(NH4)2S2O8,冷却至室温。再加入过量KI溶液,以淀粉溶液为指示剂,用0.100 0 mol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液24.00 mL(已知反应:Cr2O+6I-+14H+===3I2+2Cr3++7H2O;I2+2S2O===S4O+2I-)。计算Cr(OH)3样品的纯度(写出计算过程)。
4. (2022·湖南卷)某实验小组以BaS溶液为原料制备BaCl2·2H2O,并用重量法测定产品中BaCl2·2H2O的含量。设计了如下实验方案:
①称取产品0.500 0 g,用100 mL水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液逐滴加入热的0.100 mol·L-1 H2SO4溶液;
③沉淀完全后,60 ℃水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为0.466 0 g。
产品中BaCl2·2H2O的质量分数为(保留三位有效数字,写出计算过程)。
第1讲 物质的分类 物质的量
考点一 根据物质的组成和性质分类
知识归纳
一、 1. (2)金属阳离子 酸根阴离子 酸根离子是否含有氧
2. (1)碱 盐 酸 盐 水 CO2 CaO 非金属 金属
思维拓展
①化合反应 分解反应 置换反应 复分解反应 ②a. 性质不同的单质互称同素异形体 b. 化学
二、 1. (1)①一种(或多种)物质 另一种(或多种)物质 ②被分散
(4)<1 nm 1~100 nm >100 nm 均一、透明 均一、透明 不均一、不透明 无丁达尔效应 有丁达尔效应 静置沉淀或分层
2. (1)②胶体 溶液 (2)①溶液 浊液 聚沉 (3)①沉淀
3. (1)FeCl3 红褐
【易错辨析】
1. × 2. × 3. √ 4. √ 5. ×
命题突破
B 解析:古壁画颜料中所用的铁红,其成分为Fe2O3,为红色固体,故A正确;古陶瓷修复所用的熟石膏,其成分为2CaSO4·H2O,Ca(OH)2是消石灰,故B错误;龟甲的成分之一羟基磷灰石,组成上分析为盐类化合物,属于无机物,故C正确;竹简的成分之一纤维素为多糖,属于天然高分子,故D正确。故选B。
考点二 物质的量
知识归纳
一、 粒子 摩尔(mol)
二、 g·mol-1(或g/mol) g·mol-1
三、 1. 大小 数目 距离
2. L·mol-1(或L/mol) 22.4 L·mol-1
四、 1. 分子数 物质的量
2. n1∶n2=N1∶N2 ρ1∶ρ2 n1∶n2
五、 单位体积溶液 cB 溶质 溶液 百分数
六、 2. 托盘天平 烧杯 冷却至室温 500 2~3 1~2 凹液面与刻度线
【易错辨析】
1. √ 2. √ 3. × 4. × 5. ×
命题突破
1. (1)4∶3 (2)0.5 mol·L (3)784 mL
解析:加热发生反应2NaHCO3Na2CO3+H2O+CO2↑,残留固体质量2.65 g为Na2CO3,包括加热分解生成的Na2CO3及原混合物中含有的Na2CO3,利用差量法计算NaHCO3的质量,进而计算Na2CO3的质量,再根据n=计算二者物质的量;根据氯离子守恒可知n(HCl)=n(NaCl)计算HCl的浓度,以此解题。
(1)设碳酸氢钠的质量为a,则2NaHCO3Na2CO3+H2O+CO2↑,质量减少为168 g-44 g-18 g=62 g,根据方程式反应的比例关系:168∶62=a∶(3.27 g-2.65 g),解得a=1.68 g,其物质的量==0.02 mol,混合物中Na2CO3的质量为3.27 g-1.68 g=1.59 g,其物质的量为:=0.015 mol,则此混合物中NaHCO3与Na2CO3的物质的量之比为0.02∶0.015=4∶3;
(2)由分析可知,残留固体质量2.65 g为Na2CO3,物质的量为:0.025 mol,则根据钠守恒可知,最终生成氯化钠的物质的量为0.025 mol×2=0.05 mol,则盐酸的物质的量为0.05 mol,其浓度为:=0.5 mol·L-1;
(3)由第一问分析可知,原混合物中Na2CO3和NaHCO3的物质的量分别为:0.015 mol和0.02 mol,和盐酸反应时,其中的碳元素都生成二氧化碳,根据碳守恒可知,二氧化碳的物质的量为:0.015 mol+0.02 mol=0.035 mol,其体积为:784 mL。
2. (1)烧杯 容量瓶
(2)蓝色褪去且半分钟不变化 95.0%(过程见解析)
解析:(1)溶液配制需要计算、称量、溶解、冷却、转移、洗涤转移、定容、摇匀等步骤,称取1.200 0 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后,全部转移至100 mL的容量瓶中,加蒸馏水至凹液面最低处与刻度线相平,摇匀;
(2)取0.009 50 mol·L-1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应:Cr2O+6I-+14H+===3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O===S4O+2I-。加入淀粉溶液作为指示剂,继续滴定,到反应终点,碘单质反应后溶液蓝色褪去且半分钟不变,说明反应到达滴定终点,平行滴定3次,样品溶液的平均用量为24.80 mL,结合化学方程式定量关系可得Cr2O~3I2~6S2O,因此溶液中硫代硫酸根离子物质的量=0.009 5 mol·L-1×0.02 L×6=0.001 14 mol,配制100 mL溶液中硫代硫酸根离子物质的量=0.001 14 mol×=0.004 6 mol,则样品纯度=×100%=95.0%。
考点三 有关化学方程式的计算
命题突破
1. 6(过程见解析)
解析:根据方程式可知,20 mL溶液中,n(Ag+)=n(SCN-)=0.8×10-3 mol,则200 mL溶液中总的银离子的物质的量为8×10-3 mol,×(2+n)=8×10-3 mol,则n=6。
2. 76.4%
解析:取样1 mL测得荧光强度比值为10.2,此时溶液中c(Cu2+)=0.4×10-6 mol·L-1,该溶液中n(Cu2+)=0.4×10-6 mol·L-1×1×10-3 L=4×10-10 mol,则产品中CuI的纯度为×100%=76.4%。
3. Fe2O3;设FeS2氧化成含有两种元素的固体产物化学式为FeOx,M(FeS2)=120 g·mol-1,则M(FeOx)=120 g·mol-1×66.7%=80.04 g·mol-1,则56+16x=80.04,x=,即固体产物为Fe2O3
解析:由图可知,800 ℃时,氧化过程中剩余固体的质量与起始FeS2的质量的比值为66.7%,设FeS2氧化成含有两种元素的固体产物化学式为FeOx,M(FeS2)=120 g·mol-1,则M(FeOx)=120 g·mol-1×66.7%=80.04 g·mol-1,56+16x=80.04,x=,所以固体产物为Fe2O3。
4. Cu
解析:由图可知,350~400 ℃时剩余固体的质量与原始固体的质量的比值为42.11%,CuC2O4的摩尔质量为152 g·mol-1,则剩余固体的摩尔质量为:152 g·mol-1×42.11%=64 g·mol-1,再结合化学反应前后元素种类不变,350~400 ℃下剩余固体的化学式为Cu。
素养评估
1. C 解析:SO2属于酸性氧化物,能与水反应生成H2SO3,A正确;CO作还原剂,能与Fe2O3反应,应用于高炉炼铁,B正确;K2CO3能与酸反应,是碳酸盐的性质,C错误;H2SiO3是一种难溶性的弱酸,能与碱发生中和反应,D正确。
2. C 解析:“薄薄的青雾”是胶体分散系,A正确;“薄薄的青雾”是胶体分散系,“薄薄的青雾”中某些微粒的直径在10-9~10-7 m之间,B正确;“参差的斑驳黑影”属于光沿直线传播的物理现象,不属于丁达尔效应的特征,C错误;“云雾润蒸华不注”与“薄薄的青雾”中“雾”都是胶体分散系,它们的主要成分相同,D正确。
3. 91.56%(过程见解析)
解析:n(S2O)=24.00×10-3 L×0.100 0 mol·L-1=2.4×10-3 mol。根据2Cr3+~3I2~6S2O,n[Cr(OH)3]=n(Cr3+)=eq \f(n(S2O),3)==8.0×10-4 mol,0.900 0 g样品中含n[Cr(OH)3]为8.0×10-4 mol×=8.0×10-3 mol,Cr(OH)3样品纯度为×100%≈91.56%。
4. 97.6%(过程见解析)
解析:由题意可知,硫酸钡的物质的量为=0.002 mol,依据钡原子守恒,产品中BaCl2·2H2O的物质的量为0.002 mol,质量为0.002 mol×244 g·mol-1=0.488 g,质量分数为×100%=97.6%。
同课章节目录
