第2讲 氧化还原反应 学案(含答案)2026届高三化学一轮总复习
文档属性
| 名称 | 第2讲 氧化还原反应 学案(含答案)2026届高三化学一轮总复习 |
|
|
| 格式 | doc | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-27 00:00:00 | ||
图片预览



文档简介
第2讲 氧化还原反应
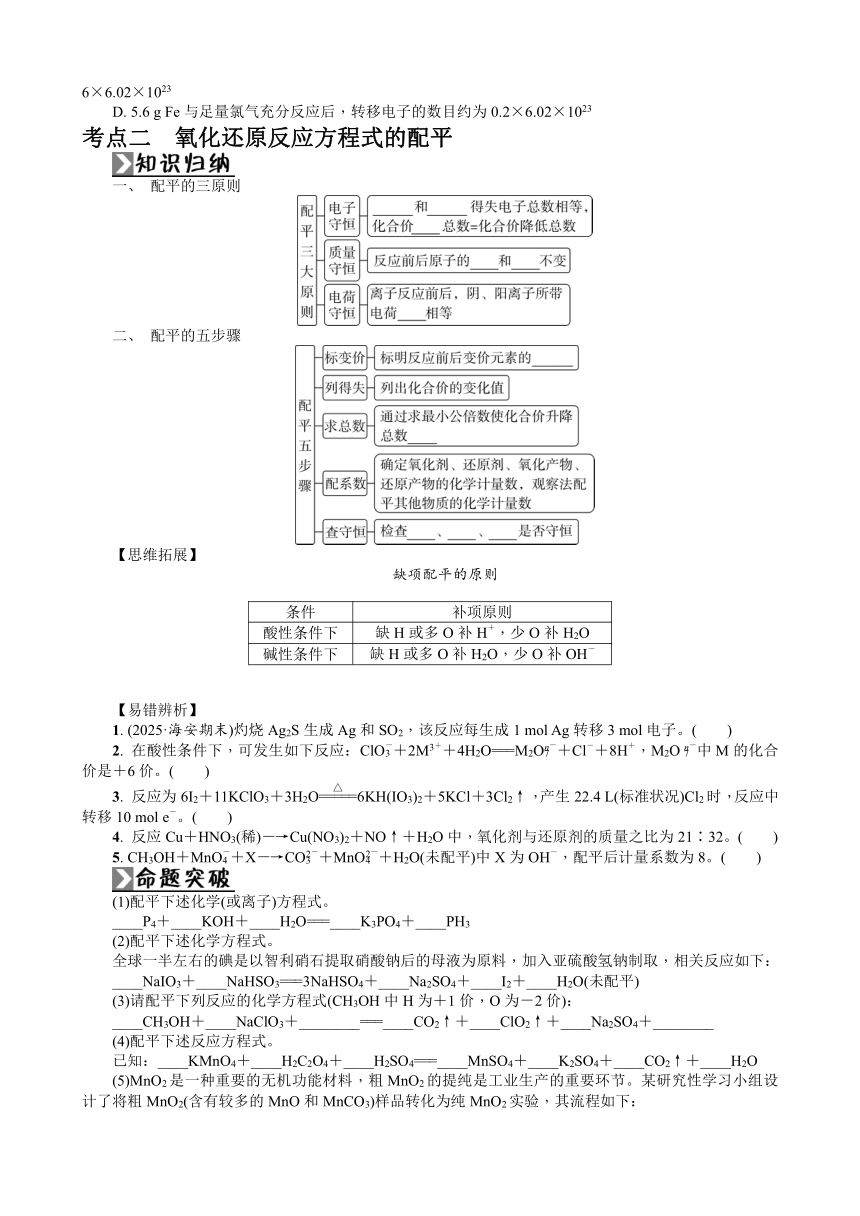
复习要求 1. 了解氧化还原反应的本质。2. 了解常见的氧化还原反应。根据化学式判断元素化合价。3. 会用“单、双线桥”分析电子转移的方向和数目。4. 掌握氧化性、还原性强弱的比较方法及价态规律的应用。5. 能利用“得失电子守恒”规律进行氧化还原反应的简单计算。6. 掌握氧化还原反应方程式的配平方法,整合有效信息书写氧化还原反应方程式。7. 了解氧化还原反应在生产、生活中的应用。
知识体系
考点一 氧化还原反应的基本概念和规律
一、 本质和特征
二、 相关概念间的关系
概括为“升失氧、降得还,剂性一致、其他相反”。
三、 电子转移的表示方法
1. 双线桥法
表示反应前后________由反应物转化为生成产物时电子转移的情况。
2. 单线桥法
表示反应过程中不同元素原子间的电子转移情况。
四、 氧化还原反应与四种基本反应类型的关系
1. ________都是氧化还原反应,________都不是氧化还原反应。
2. 有单质参加的________和有单质生成的________都是氧化还原反应。
五、 氧化还原反应的常见规律
1. 强弱规律
氧化性、还原性强弱的比较方法:
(1)根据化学方程式判断
氧化剂+还原剂===还原产物+氧化产物。
氧化性:________>________;
还原性:________>________。
如K2Cr2O7+14HCl(浓)===2KCl+2CrCl3+3Cl2↑+7H2O,可判断氧化性:K2Cr2O7>Cl2,还原性:HCl>CrCl3。
(2)根据反应条件及反应的剧烈程度判断
反应条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强。
如MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O、2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,可判断氧化性:KMnO4>MnO2。
(3)根据相同条件下产物的价态高低判断
如2Fe+3Cl22FeCl3、Fe+SFeS,可判断氧化性:Cl2>S。
2. 先后规律
同时含有几种还原剂(或氧化剂),发生氧化还原反应时,还原性(或氧化性)强的优先反应,即“强者优先”,如在FeBr2溶液中通入少量Cl2时,因为还原性:Fe2+>Br-,所以Fe2+先与Cl2反应,反应的离子方程式:2Fe2++Cl2===2Fe3++2Cl-;在FeBr2溶液中通入足量Cl2时,反应的离子方程式:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-。
【思维拓展】
①氧化性、还原性顺序判断:
a. 常见氧化剂的氧化性顺序:KMnO4(H+)>Cl2>Br2>Fe3+>Cu2+>I2>S。
b. 常见还原剂的还原性顺序:S2->SO(或HSO)>I->Fe2+>Br->Cl->Mn2+。
c. 金属活动性顺序:
d. 非金属活动性顺序:
②物质的还原性、氧化性强弱与反应环境的许多因素有关,如浓度、温度、酸碱性。
a. 浓度:一般来说,氧化剂的浓度越大,其氧化性越强;还原剂的浓度越大,其还原性越强。氧化性:浓硫酸>稀硫酸;浓硝酸>稀硝酸。还原性:浓盐酸>稀盐酸。
b. 温度:许多氧化还原反应是在加热条件下进行的,可见升高温度可增强氧化剂的氧化性(或还原剂的还原性)。如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。
c. 酸碱性:同一种物质,所处环境的酸性(或碱性)越强,其氧化性(或还原性)越强。
3. 价态升降规律
(1)归中反应规律
含不同价态的同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价→中间价”,而不会出现交叉现象。简记为“两相靠,不相交”。
例如,不同价态的硫之间可以发生的氧化还原反应是
注:不会出现⑤中H2S转化为SO2而H2SO4转化为S的情况。
(2)歧化反应规律
“中间价→高价+低价”。
具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应,如:Cl2+2NaOH===NaCl+NaClO+H2O。
(3)应用
①判断同种元素不同价态的物质间发生氧化还原反应的可能性。如浓硫酸与SO2不发生反应。
②根据化合价判断反应体系中的氧化剂、还原剂及氧化产物、还原产物。如6HCl+NaClO3===NaCl+3Cl2↑+3H2O中,氧化剂为NaClO3,还原剂为HCl,氧化产物和还原产物都为Cl2。
4. 得失电子守恒规律
(1)氧化还原反应中,氧化剂得电子总数与还原剂失电子总数相等。
(2)应用:运用“得失电子守恒规律”可进行氧化还原反应方程式的配平和相关计算。
【易错辨析】
1. (2024·南通一模)金属钠与液氨反应体现了NH3的还原性。( )
2. (2024·扬州三模)向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1 mL淀粉溶液,溶液显蓝色,则Br2的氧化性比I2强。( )
3. (2024·南通四模)F2与熔融Na2SO4反应制备SO2F2时,一定有氧元素化合价升高。( )
4. (2024·海安中学)向淀粉碘化钾溶液中通入过量Cl2,溶液颜色最终为无色,则氯气不能氧化I-。( )
5. (2024·江阴期末)向银氨溶液中加入1 mL 10%葡萄糖溶液,振荡,在60~70 ℃水浴中加热,观察到试管内壁形成了光亮银镜,说明葡萄糖具有还原性。( )
1. (2024·苏州模拟检测)下列实验探究方案能得出相应结论的是( )
选项 探究方案 结论
A 向FeBr2溶液中加入几滴氯水,振荡,再加CCl4萃取,观察CCl4层颜色变化 还原性:Fe2+>Br-
B 向MnO2固体中滴加稀盐酸,加热,观察是否有黄绿色气体产生 氧化性:MnO2>Cl2
C 向Fe(NO3)2和KSCN的混合溶液中滴入酸化的AgNO3溶液振荡,溶液颜色变红 氧化性:Ag+>Fe3+
D 向NaBr溶液中滴加过量的氯水,再加入淀粉KI溶液,观察溶液颜色变化 氧化性:Cl2>Br2>I2
2. (2024·南通高三下调研)下列应用中未涉及氧化还原反应的是( )
A. NaF、NH4F溶液均不能保存在玻璃试剂瓶中
B. 常温下,浓硫酸、浓硝酸常保存在铁罐中
C. 保存FeCl2溶液时,通常在溶液中加入少量的单质铁
D. Na2FeO4可用于自来水的消毒、净化
3. 列叙述正确的是( )
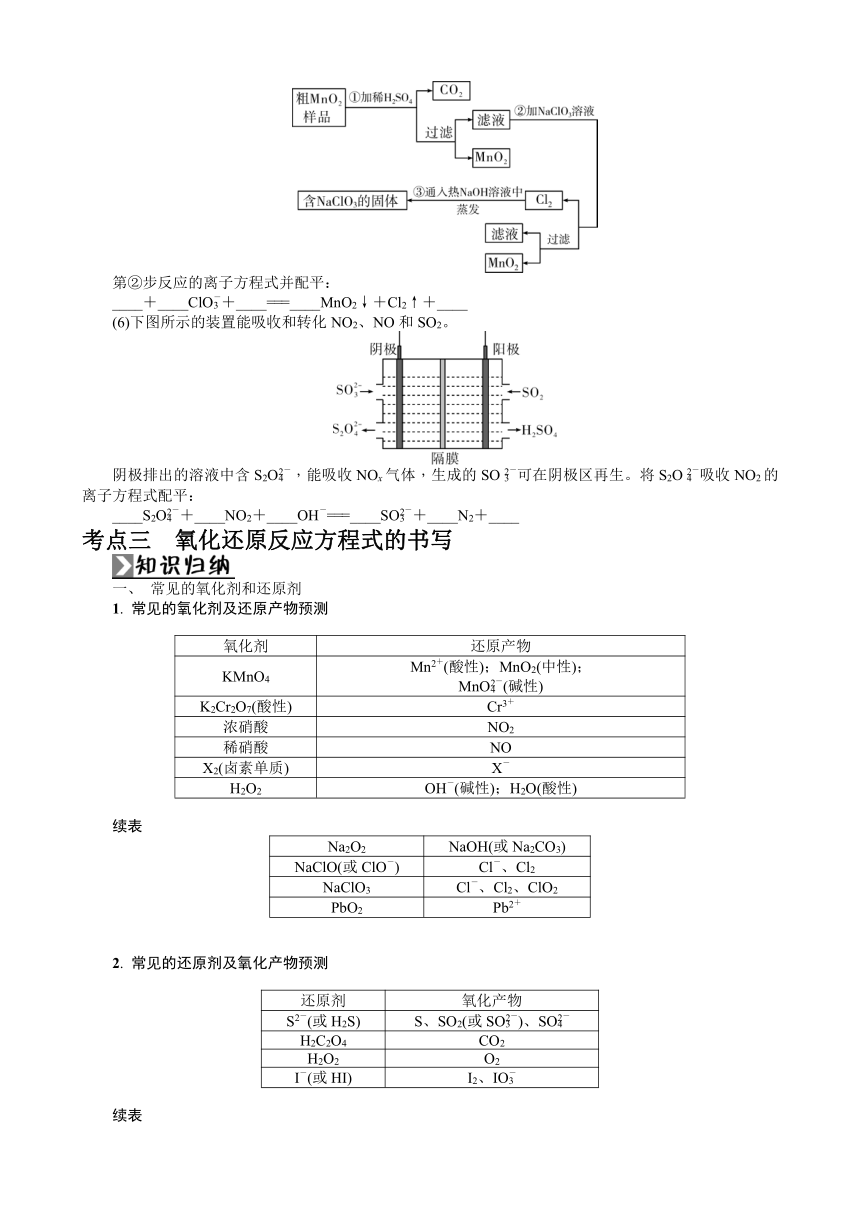
A. 2SO2(g)+O2(g)??2SO3(g),每充入2 mol SO2和1 mol O2,充分反应后转移电子的数目约为4×6.02×1023
B. Cu2S+O22Cu+SO2,每消耗1 mol O2,反应共转移6 mol电子
C. CH3CH===CHCH3+2O3―→2CH3CHO+2O2,每有1 mol O3参与该反应,转移电子的数目约为6×6.02×1023
D. 5.6 g Fe与足量氯气充分反应后,转移电子的数目约为0.2×6.02×1023
考点二 氧化还原反应方程式的配平
一、 配平的三原则
二、 配平的五步骤
【思维拓展】
缺项配平的原则
条件 补项原则
酸性条件下 缺H或多O补H+,少O补H2O
碱性条件下 缺H或多O补H2O,少O补OH-
【易错辨析】
1. (2025·海安期末)灼烧Ag2S生成Ag和SO2,该反应每生成1 mol Ag转移3 mol电子。( )
2. 在酸性条件下,可发生如下反应:ClO+2M3++4H2O===M2O+Cl-+8H+,M2O中M的化合价是+6价。( )
3. 反应为6I2+11KClO3+3H2O6KH(IO3)2+5KCl+3Cl2↑,产生22.4 L(标准状况)Cl2时,反应中转移10 mol e-。( )
4. 反应Cu+HNO3(稀)―→Cu(NO3)2+NO↑+H2O中,氧化剂与还原剂的质量之比为21∶32。( )
5. CH3OH+MnO+X―→CO+MnO+H2O(未配平)中X为OH-,配平后计量系数为8。( )
(1)配平下述化学(或离子)方程式。
____P4+____KOH+____H2O===____K3PO4+____PH3
(2)配平下述化学方程式。
全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下:
____NaIO3+____NaHSO3===3NaHSO4+____Na2SO4+____I2+____H2O(未配平)
(3)请配平下列反应的化学方程式(CH3OH中H为+1价,O为-2价):
____CH3OH+____NaClO3+________===____CO2↑+____ClO2↑+____Na2SO4+________
(4)配平下述反应方程式。
已知:____KMnO4+____H2C2O4+____H2SO4===____MnSO4+____K2SO4+____CO2↑+____H2O
(5)MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下:
第②步反应的离子方程式并配平:
____+____ClO+____===____MnO2↓+Cl2↑+____
(6)下图所示的装置能吸收和转化NO2、NO和SO2。
阴极排出的溶液中含S2O,能吸收NOx气体,生成的SO可在阴极区再生。将S2O吸收NO2的离子方程式配平:
____S2O+____NO2+____OH-===____SO+____N2+____
考点三 氧化还原反应方程式的书写
一、 常见的氧化剂和还原剂
1. 常见的氧化剂及还原产物预测
氧化剂 还原产物
KMnO4 Mn2+(酸性);MnO2(中性);MnO(碱性)
K2Cr2O7(酸性) Cr3+
浓硝酸 NO2
稀硝酸 NO
X2(卤素单质) X-
H2O2 OH-(碱性);H2O(酸性)
续表
Na2O2 NaOH(或Na2CO3)
NaClO(或ClO-) Cl-、Cl2
NaClO3 Cl-、Cl2、ClO2
PbO2 Pb2+
2. 常见的还原剂及氧化产物预测
还原剂 氧化产物
S2-(或H2S) S、SO2(或SO)、SO
H2C2O4 CO2
H2O2 O2
I-(或HI) I2、IO
续表
CO CO2
金属单质(Zn、Fe、Cu等) Zn2+、Fe2+(与强氧化剂反应生成Fe3+)、Cu2+
Fe2+ Fe3+(酸性);Fe(OH)3(碱性)
SO2(或H2SO3、SO) SO
【注意】 金属氢化物(如NaH等)、NaBH4也是重要的还原剂。
3. 元素化合价处于中间价态的物质既可以作氧化剂,又可以作还原剂。如:
具有中间价态的物质 氧化产物 还原产物
Fe2+ Fe3+ Fe
SO2 SO3或SO S
SO SO S
H2O2 O2 H2O或OH-
Cl2 HClO或ClO-或ClO Cl-
NO2 NO NO或N2
【注意】 Fe2+、SO2、SO主要表现还原性,H2O2、Cl2、NO2主要表现氧化性。
二、 新情境下氧化还原反应方程式的书写步骤
1. 确定氧化剂、还原剂、氧化产物、还原产物。
2. 用化合价升降配平。
3. 配平其他原子。
4. 若是离子方程式,要遵循电荷守恒。
(1)在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,同时生成NO。写出该反应的化学方程式:______________________________________。
(2)(2024·前黄中学)在酸性条件下,请写出NaHSO3与Cr2O反应的离子方程式:____________________________________________。
(3)(2024·南京、盐城一模)Ce2(SO4)3在空气中高温焙烧可得到CeO2和SO3,其反应的化学方程式为__________________________________。
(4)(2024·苏州期末)向KOH和KClO混合溶液中加入Fe(NO3)3,过滤得到K2FeO4固体。制备K2FeO4的化学方程式为______________________________________________。
(5)(2024·南通三模)写出酸性条件下葡萄糖还原MnO2并生成CO2的离子方程式:______________________________________________。
(6)Ag的抗菌性能。纳米Ag表面能产生Ag+杀死细菌(如图所示),其抗菌性能受溶解氧浓度影响。
纳米Ag溶解产生Ag+的离子方程式为______________________________________________。
素 养 评 估
1. 下表中,对化学反应类型判断错误的是( )
选项 化学方程式 反应类型
A N2O4??2NO2 分解反应,或氧化还原反应
B 2Al+Fe2O32Fe+Al2O3 置换反应,或氧化还原反应
C FeCl3+3H2OFe(OH)3(胶体)+3HCl 复分解反应,或非氧化还原反应
D 4Fe(OH)2+O2+2H2O===4Fe(OH)3 化合反应,或氧化还原反应
2. 下列各氧化还原反应的化学方程式表示的变化过程正确的是( )
A. Fe2O3+6HI===2F得到2×e-eI2+I2失去2×e-+3H2O
B. H2S+H2SO4===S得到6e-↓+S失去6e-O2+2H2O
C. Cl2+2NaOH===NaC得到2×e-l+NaC失去2×e-lO+H2O
D. MnO2+4HCl(浓)M失去2×e-nCl2+C得到2×e-l2↑+2H2O
3. 验证氧化性强弱:Cl2>Br2>I2,设计如下实验(已知:稀溴水呈黄色,浓溴水呈红棕色,碘水呈棕黄色;忽略氧气的影响)。下列说法不正确的是( )
实验① 实验②
溶液变为浅黄绿色 溶液变为黄色
续表
实验③ 实验④
溶液变为棕黄色 溶液变为蓝色
A. 实验①设计目的:排除实验②③④水稀释的影响
B. 实验②发生反应为2Br-+Cl2===Br2+2Cl-
C. 实验③的现象可以证明氧化性:Cl2>I2
D. 实验④能证明氧化性:Br2>I2
4. CuI是难溶于水的白色固体。已知:氧化性:Cu2+>I2>Cu+,还原性:Cu>I->Cu+。
(1)根据物质氧化性和还原性的强弱推测,在溶液中Cu2+和I-反应的产物是________、________。
(2)久置于空气中的HI溶液呈黄色,向其中加入一些铜粉,可使溶液黄色消失,反应的化学方程式为______________________________________。
(3)欲消除(2)中HI溶液的黄色,也可向其中通入少量H2S,这是因为当浓度接近时,还原性:H2S________(填“>”“<”或“=”)I-。提示:请及时完成配套课时作业
第2讲 氧化还原反应
考点一 氧化还原反应的基本概念和规律
知识归纳
一、 电子转移 化合价
二、 得 降低 失 升高
三、 1. 同一元素
2. 不同元素
四、 1. 置换反应 复分解反应 化合反应 分解反应
五、 1. (1)氧化剂 氧化产物 还原剂 还原产物
【易错辨析】
1. × 2. √ 3. √ 4. × 5. √
命题突破
1. A 解析:氯水中含有Cl2,可以氧化Br-、Fe2+,向FeBr2溶液中加入几滴氯水,CCl4无明显现象,说明无Br2生成,说明Fe2+的还原性强于Br-,A正确;MnO2固体与稀盐酸不反应,无法产生氯气,B错误;酸化的AgNO3中H+和NO可组成硝酸从而氧化Fe2+生成Fe3+,无法说明氧化性Ag+>Fe3+,C错误;由于氯水过量,2NaBr+Cl2===2NaCl+Br2反应后有氯水剩余,加入淀粉KI溶液时,KI先与Cl2反应,Br2和KI的反应不一定发生,溶液变蓝无法证明氧化性Br2>I2,D错误。
2. A 解析:NaF、NH4F溶液中F-水解生成HF,HF可以与玻璃中的SiO2反应生成SiF4和H2O,没有涉及氧化还原反应,A符合题意;常温下,Fe、Al表面能被浓硫酸、浓硝酸钝化,生成致密的氧化物保护膜,涉及氧化还原反应,B不符合题意;FeCl2溶液中的Fe2+易被空气中的O2氧化成Fe3+,2Fe3++Fe===3Fe2+,涉及氧化还原反应,C不符合题意;Na2FeO4中Fe为+6价,具有强氧化性,能对自来水进行消毒,同时被还原成Fe3+,Fe3+水解生成Fe(OH)3胶体,Fe(OH)3胶体中的胶体粒子能吸附水中的悬浮物从而净化水,对自来水进行消毒过程中涉及氧化还原反应,D不符合题意。故选A。
3. B 解析:可逆反应中的反应物不可能全部转化为产物,2 mol SO2和1 mol O2充分反应后转移电子的数目小于4×6.02×1023,A错误;氧化剂是Cu2S和O2,每消耗1 mol O2,反应共转移6 mol电子,B正确;1 mol O3参与反应,转移电子的物质的量为2 mol,C错误;5.6 g Fe与足量Cl2充分反应后,转移电子的数目约为0.3×6.02×1023,D错误。
考点二 氧化还原反应方程式的配平
知识归纳
一、 氧化剂 还原剂 升高 种类 个数 总数
二、 化合价 相等 质量 电荷 电子
【易错辨析】
1. √ 2. √ 3. × 4. √ 5. √
命题突破
(1)2 9 3 3 5 (2)2 5 2 1 1 (3)1 6 3H2SO4 1 6 3
5H2O (4)2 5 3 2 1 10 8 (5)5Mn2+ 2 4H2O 5 8H+ (6)4 2 8 8 1 4H2O
解析:(1)K3PO4中P为+5价,PH3中P为-3价,P元素发生歧化反应,化合价升高了5,降低了3,根据最小公倍数可得K3PO4系数为3、PH3系数为5,结合原子守恒配平化学方程式为2P4+9KOH+3H2O===3K3PO4+5PH3。
(2)根据氧化还原反应中化合价升降总数相等配平,该反应中碘元素的化合价由+5价得电子变为0价,所以一个碘酸根离子得5个电子,硫元素的化合价由+4价失电子变为+6,所以一个参加氧化还原反应的亚硫酸氢根离子失去2个电子,所以得失的最小公倍数是10,所以碘酸钠的计量数是2,亚硫酸氢钠的计量数是5,其他元素根据原子守恒进行配平,所以该方程式为2NaIO3+5NaHSO3===3NaHSO4+2Na2SO4+I2+H2O,单线桥标出电子转移的方向和数目为2NaIO3+5NaHS10e-O3===3NaHSO4+2Na2SO4+I2+H2O。
(3)根据元素守恒左边加入硫酸,右边加水,氧化剂是NaClO3,氯元素的化合价从+5降低到+4价,化合价降低了1,CH3OH中碳元素的化合价从-2升高到+4价,化合价升高了6,根据氧化剂得电子的物质的量等于还原剂失电子的物质的量相等,配平氧化剂和还原剂的系数,根据元素守恒,配平其余物质,得到化学反应为:CH3OH+6NaClO3+3H2SO4===CO2↑+6ClO2↑+3Na2SO4+5H2O。
(4)高锰酸钾中锰元素化合价从+7价降低到+2价,变化5价,草酸中的碳元素化合价从+3价升高到二氧化碳中的+4价,升高1价,所以二者比例为2∶5,再根据原子守恒配平其他物质的化学计量数,得方程式为2KMnO4+5H2C2O4+3H2SO4===2MnSO4+K2SO4+10CO2↑+8H2O。
(5)MnSO4要转化为MnO2,需失去电子,故需要加入NaClO3作氧化剂,依据得失电子守恒可以配平,反应的离子方程式5Mn2++2ClO+4H2O===5MnO2↓+Cl2↑+8H+。
(6)根据元素守恒,则产物的空白处为H2O,S2O中S元素的化合价是+3价,产物中S元素的化合价是+4价,S元素整体失去2个电子,二氧化氮中N元素的化合价是+4价,生成氮气N元素的化合价降低到0价,整体得到8个电子,根据得失电子守恒,则S2O的系数是4,亚硫酸根离子的系数是8,二氧化氮的系数是2,氮气的系数是1,再根据电荷守恒,氢氧根离子的系数是8,则水的系数是4,配平后的离子方程式为4S2O+2NO2+8OH-===8SO+N2+4H2O。
考点三 氧化还原反应方程式的书写
命题突破
(1)C6H12O6+6HNO33H2C2O4+6NO↑+6H2O
(2)3HSO+Cr2O+5H+===2Cr3++3SO+4H2O
(3)2Ce2(SO4)3+O24CeO2+6SO3
(4)3KClO+10KOH+2Fe(NO3)3===2K2FeO4↓+3KCl+6KNO3+5H2O
(5)C6H12O6+12MnO2+24H+===12Mn2++6CO2↑+18H2O
(6)4Ag+O2+4H+===4Ag++2H2O
素养评估
1. A 解析:反应N2O4??2NO2中元素的化合价没变化,不是氧化还原反应,A错误;反应2Al+Fe2O32Fe+Al2O3中,一种单质置换另一种单质,为置换反应,也为氧化还原反应,B正确;反应FeCl3+3H2OFe(OH)3(胶体)+3HCl中,两种化合物交换阴阳离子,为复分解反应,元素的化合价没有变化,为非氧化还原反应,C正确;反应4Fe(OH)2+O2+2H2O===4Fe(OH)3,多种物质生成一种物质,为化合反应,有元素化合价变化,为氧化还原反应,D正确。
2. A 解析:该反应中Fe元素化合价由+3价降低为+2价,I由-1价升高到0价,转移电子数目为2,A正确;硫化氢与浓硫酸反应,硫化氢被氧化成硫,浓硫酸被还原成二氧化硫,则1 mol硫化氢被氧化,转移2 mol电子,B错误;该反应中Cl元素化合价由0价变化为+1价、-1价,转移电子数目为1,C错误;该反应中,Mn元素的化合价降低,得电子,Cl元素的化合价升高,失去电子,D错误。故选A。
3. D 解析:实验①是将氯水加入蒸馏水将其稀释,后续实验都是在溶液中进行的,这样可以排除实验②③④水稀释的影响,A正确;溶液变为黄色是因为产生溴单质,说明氯气可以将溴单质置换出来,发生的反应为2Br-+Cl2===Br2+2Cl-,B正确;溶液变为棕黄色是因为产生碘单质,说明氯气可以将碘单质置换出来,发生的反应为2I-+Cl2===I2+2Cl-,可以证明氧化性:Cl2>I2,C正确;②反应后的黄色溶液是含有溴单质的溶液,但是不能排除含有氯单质,加入淀粉碘化钾溶液会变蓝,证明产生了碘单质,可能是氯气或是溴单质置换出了碘单质,不能证明氧化性:Br2>I2,D错误。故选D。
4. (1)CuI I2 (2)2Cu+I2===2CuI (3)>
解析:(1)氧化性:Cu2+>I2>Cu+,还原性:Cu>I->Cu+,所以Cu2+和I-反应,Cu2+被还原为Cu+、I-被氧化为I2,Cu+和I-结合生成难溶于水的CuI沉淀,所以反应的产物是CuI、I2。
(2)久置于空气中的HI溶液呈黄色,是因为其中的碘离子被氧化为碘单质,加入金属铜,金属铜可以和碘单质反应生成CuI,反应的化学方程式为2Cu+I2===2CuI。
(3)欲消除HI溶液的黄色,也可向其中通入少量H2S,碘单质可以和硫化氢反应生成单质硫和碘化氢,还原性:H2S>I-。
复习要求 1. 了解氧化还原反应的本质。2. 了解常见的氧化还原反应。根据化学式判断元素化合价。3. 会用“单、双线桥”分析电子转移的方向和数目。4. 掌握氧化性、还原性强弱的比较方法及价态规律的应用。5. 能利用“得失电子守恒”规律进行氧化还原反应的简单计算。6. 掌握氧化还原反应方程式的配平方法,整合有效信息书写氧化还原反应方程式。7. 了解氧化还原反应在生产、生活中的应用。
知识体系
考点一 氧化还原反应的基本概念和规律
一、 本质和特征
二、 相关概念间的关系
概括为“升失氧、降得还,剂性一致、其他相反”。
三、 电子转移的表示方法
1. 双线桥法
表示反应前后________由反应物转化为生成产物时电子转移的情况。
2. 单线桥法
表示反应过程中不同元素原子间的电子转移情况。
四、 氧化还原反应与四种基本反应类型的关系
1. ________都是氧化还原反应,________都不是氧化还原反应。
2. 有单质参加的________和有单质生成的________都是氧化还原反应。
五、 氧化还原反应的常见规律
1. 强弱规律
氧化性、还原性强弱的比较方法:
(1)根据化学方程式判断
氧化剂+还原剂===还原产物+氧化产物。
氧化性:________>________;
还原性:________>________。
如K2Cr2O7+14HCl(浓)===2KCl+2CrCl3+3Cl2↑+7H2O,可判断氧化性:K2Cr2O7>Cl2,还原性:HCl>CrCl3。
(2)根据反应条件及反应的剧烈程度判断
反应条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强。
如MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O、2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,可判断氧化性:KMnO4>MnO2。
(3)根据相同条件下产物的价态高低判断
如2Fe+3Cl22FeCl3、Fe+SFeS,可判断氧化性:Cl2>S。
2. 先后规律
同时含有几种还原剂(或氧化剂),发生氧化还原反应时,还原性(或氧化性)强的优先反应,即“强者优先”,如在FeBr2溶液中通入少量Cl2时,因为还原性:Fe2+>Br-,所以Fe2+先与Cl2反应,反应的离子方程式:2Fe2++Cl2===2Fe3++2Cl-;在FeBr2溶液中通入足量Cl2时,反应的离子方程式:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-。
【思维拓展】
①氧化性、还原性顺序判断:
a. 常见氧化剂的氧化性顺序:KMnO4(H+)>Cl2>Br2>Fe3+>Cu2+>I2>S。
b. 常见还原剂的还原性顺序:S2->SO(或HSO)>I->Fe2+>Br->Cl->Mn2+。
c. 金属活动性顺序:
d. 非金属活动性顺序:
②物质的还原性、氧化性强弱与反应环境的许多因素有关,如浓度、温度、酸碱性。
a. 浓度:一般来说,氧化剂的浓度越大,其氧化性越强;还原剂的浓度越大,其还原性越强。氧化性:浓硫酸>稀硫酸;浓硝酸>稀硝酸。还原性:浓盐酸>稀盐酸。
b. 温度:许多氧化还原反应是在加热条件下进行的,可见升高温度可增强氧化剂的氧化性(或还原剂的还原性)。如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。
c. 酸碱性:同一种物质,所处环境的酸性(或碱性)越强,其氧化性(或还原性)越强。
3. 价态升降规律
(1)归中反应规律
含不同价态的同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价→中间价”,而不会出现交叉现象。简记为“两相靠,不相交”。
例如,不同价态的硫之间可以发生的氧化还原反应是
注:不会出现⑤中H2S转化为SO2而H2SO4转化为S的情况。
(2)歧化反应规律
“中间价→高价+低价”。
具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应,如:Cl2+2NaOH===NaCl+NaClO+H2O。
(3)应用
①判断同种元素不同价态的物质间发生氧化还原反应的可能性。如浓硫酸与SO2不发生反应。
②根据化合价判断反应体系中的氧化剂、还原剂及氧化产物、还原产物。如6HCl+NaClO3===NaCl+3Cl2↑+3H2O中,氧化剂为NaClO3,还原剂为HCl,氧化产物和还原产物都为Cl2。
4. 得失电子守恒规律
(1)氧化还原反应中,氧化剂得电子总数与还原剂失电子总数相等。
(2)应用:运用“得失电子守恒规律”可进行氧化还原反应方程式的配平和相关计算。
【易错辨析】
1. (2024·南通一模)金属钠与液氨反应体现了NH3的还原性。( )
2. (2024·扬州三模)向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1 mL淀粉溶液,溶液显蓝色,则Br2的氧化性比I2强。( )
3. (2024·南通四模)F2与熔融Na2SO4反应制备SO2F2时,一定有氧元素化合价升高。( )
4. (2024·海安中学)向淀粉碘化钾溶液中通入过量Cl2,溶液颜色最终为无色,则氯气不能氧化I-。( )
5. (2024·江阴期末)向银氨溶液中加入1 mL 10%葡萄糖溶液,振荡,在60~70 ℃水浴中加热,观察到试管内壁形成了光亮银镜,说明葡萄糖具有还原性。( )
1. (2024·苏州模拟检测)下列实验探究方案能得出相应结论的是( )
选项 探究方案 结论
A 向FeBr2溶液中加入几滴氯水,振荡,再加CCl4萃取,观察CCl4层颜色变化 还原性:Fe2+>Br-
B 向MnO2固体中滴加稀盐酸,加热,观察是否有黄绿色气体产生 氧化性:MnO2>Cl2
C 向Fe(NO3)2和KSCN的混合溶液中滴入酸化的AgNO3溶液振荡,溶液颜色变红 氧化性:Ag+>Fe3+
D 向NaBr溶液中滴加过量的氯水,再加入淀粉KI溶液,观察溶液颜色变化 氧化性:Cl2>Br2>I2
2. (2024·南通高三下调研)下列应用中未涉及氧化还原反应的是( )
A. NaF、NH4F溶液均不能保存在玻璃试剂瓶中
B. 常温下,浓硫酸、浓硝酸常保存在铁罐中
C. 保存FeCl2溶液时,通常在溶液中加入少量的单质铁
D. Na2FeO4可用于自来水的消毒、净化
3. 列叙述正确的是( )
A. 2SO2(g)+O2(g)??2SO3(g),每充入2 mol SO2和1 mol O2,充分反应后转移电子的数目约为4×6.02×1023
B. Cu2S+O22Cu+SO2,每消耗1 mol O2,反应共转移6 mol电子
C. CH3CH===CHCH3+2O3―→2CH3CHO+2O2,每有1 mol O3参与该反应,转移电子的数目约为6×6.02×1023
D. 5.6 g Fe与足量氯气充分反应后,转移电子的数目约为0.2×6.02×1023
考点二 氧化还原反应方程式的配平
一、 配平的三原则
二、 配平的五步骤
【思维拓展】
缺项配平的原则
条件 补项原则
酸性条件下 缺H或多O补H+,少O补H2O
碱性条件下 缺H或多O补H2O,少O补OH-
【易错辨析】
1. (2025·海安期末)灼烧Ag2S生成Ag和SO2,该反应每生成1 mol Ag转移3 mol电子。( )
2. 在酸性条件下,可发生如下反应:ClO+2M3++4H2O===M2O+Cl-+8H+,M2O中M的化合价是+6价。( )
3. 反应为6I2+11KClO3+3H2O6KH(IO3)2+5KCl+3Cl2↑,产生22.4 L(标准状况)Cl2时,反应中转移10 mol e-。( )
4. 反应Cu+HNO3(稀)―→Cu(NO3)2+NO↑+H2O中,氧化剂与还原剂的质量之比为21∶32。( )
5. CH3OH+MnO+X―→CO+MnO+H2O(未配平)中X为OH-,配平后计量系数为8。( )
(1)配平下述化学(或离子)方程式。
____P4+____KOH+____H2O===____K3PO4+____PH3
(2)配平下述化学方程式。
全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下:
____NaIO3+____NaHSO3===3NaHSO4+____Na2SO4+____I2+____H2O(未配平)
(3)请配平下列反应的化学方程式(CH3OH中H为+1价,O为-2价):
____CH3OH+____NaClO3+________===____CO2↑+____ClO2↑+____Na2SO4+________
(4)配平下述反应方程式。
已知:____KMnO4+____H2C2O4+____H2SO4===____MnSO4+____K2SO4+____CO2↑+____H2O
(5)MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下:
第②步反应的离子方程式并配平:
____+____ClO+____===____MnO2↓+Cl2↑+____
(6)下图所示的装置能吸收和转化NO2、NO和SO2。
阴极排出的溶液中含S2O,能吸收NOx气体,生成的SO可在阴极区再生。将S2O吸收NO2的离子方程式配平:
____S2O+____NO2+____OH-===____SO+____N2+____
考点三 氧化还原反应方程式的书写
一、 常见的氧化剂和还原剂
1. 常见的氧化剂及还原产物预测
氧化剂 还原产物
KMnO4 Mn2+(酸性);MnO2(中性);MnO(碱性)
K2Cr2O7(酸性) Cr3+
浓硝酸 NO2
稀硝酸 NO
X2(卤素单质) X-
H2O2 OH-(碱性);H2O(酸性)
续表
Na2O2 NaOH(或Na2CO3)
NaClO(或ClO-) Cl-、Cl2
NaClO3 Cl-、Cl2、ClO2
PbO2 Pb2+
2. 常见的还原剂及氧化产物预测
还原剂 氧化产物
S2-(或H2S) S、SO2(或SO)、SO
H2C2O4 CO2
H2O2 O2
I-(或HI) I2、IO
续表
CO CO2
金属单质(Zn、Fe、Cu等) Zn2+、Fe2+(与强氧化剂反应生成Fe3+)、Cu2+
Fe2+ Fe3+(酸性);Fe(OH)3(碱性)
SO2(或H2SO3、SO) SO
【注意】 金属氢化物(如NaH等)、NaBH4也是重要的还原剂。
3. 元素化合价处于中间价态的物质既可以作氧化剂,又可以作还原剂。如:
具有中间价态的物质 氧化产物 还原产物
Fe2+ Fe3+ Fe
SO2 SO3或SO S
SO SO S
H2O2 O2 H2O或OH-
Cl2 HClO或ClO-或ClO Cl-
NO2 NO NO或N2
【注意】 Fe2+、SO2、SO主要表现还原性,H2O2、Cl2、NO2主要表现氧化性。
二、 新情境下氧化还原反应方程式的书写步骤
1. 确定氧化剂、还原剂、氧化产物、还原产物。
2. 用化合价升降配平。
3. 配平其他原子。
4. 若是离子方程式,要遵循电荷守恒。
(1)在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,同时生成NO。写出该反应的化学方程式:______________________________________。
(2)(2024·前黄中学)在酸性条件下,请写出NaHSO3与Cr2O反应的离子方程式:____________________________________________。
(3)(2024·南京、盐城一模)Ce2(SO4)3在空气中高温焙烧可得到CeO2和SO3,其反应的化学方程式为__________________________________。
(4)(2024·苏州期末)向KOH和KClO混合溶液中加入Fe(NO3)3,过滤得到K2FeO4固体。制备K2FeO4的化学方程式为______________________________________________。
(5)(2024·南通三模)写出酸性条件下葡萄糖还原MnO2并生成CO2的离子方程式:______________________________________________。
(6)Ag的抗菌性能。纳米Ag表面能产生Ag+杀死细菌(如图所示),其抗菌性能受溶解氧浓度影响。
纳米Ag溶解产生Ag+的离子方程式为______________________________________________。
素 养 评 估
1. 下表中,对化学反应类型判断错误的是( )
选项 化学方程式 反应类型
A N2O4??2NO2 分解反应,或氧化还原反应
B 2Al+Fe2O32Fe+Al2O3 置换反应,或氧化还原反应
C FeCl3+3H2OFe(OH)3(胶体)+3HCl 复分解反应,或非氧化还原反应
D 4Fe(OH)2+O2+2H2O===4Fe(OH)3 化合反应,或氧化还原反应
2. 下列各氧化还原反应的化学方程式表示的变化过程正确的是( )
A. Fe2O3+6HI===2F得到2×e-eI2+I2失去2×e-+3H2O
B. H2S+H2SO4===S得到6e-↓+S失去6e-O2+2H2O
C. Cl2+2NaOH===NaC得到2×e-l+NaC失去2×e-lO+H2O
D. MnO2+4HCl(浓)M失去2×e-nCl2+C得到2×e-l2↑+2H2O
3. 验证氧化性强弱:Cl2>Br2>I2,设计如下实验(已知:稀溴水呈黄色,浓溴水呈红棕色,碘水呈棕黄色;忽略氧气的影响)。下列说法不正确的是( )
实验① 实验②
溶液变为浅黄绿色 溶液变为黄色
续表
实验③ 实验④
溶液变为棕黄色 溶液变为蓝色
A. 实验①设计目的:排除实验②③④水稀释的影响
B. 实验②发生反应为2Br-+Cl2===Br2+2Cl-
C. 实验③的现象可以证明氧化性:Cl2>I2
D. 实验④能证明氧化性:Br2>I2
4. CuI是难溶于水的白色固体。已知:氧化性:Cu2+>I2>Cu+,还原性:Cu>I->Cu+。
(1)根据物质氧化性和还原性的强弱推测,在溶液中Cu2+和I-反应的产物是________、________。
(2)久置于空气中的HI溶液呈黄色,向其中加入一些铜粉,可使溶液黄色消失,反应的化学方程式为______________________________________。
(3)欲消除(2)中HI溶液的黄色,也可向其中通入少量H2S,这是因为当浓度接近时,还原性:H2S________(填“>”“<”或“=”)I-。提示:请及时完成配套课时作业
第2讲 氧化还原反应
考点一 氧化还原反应的基本概念和规律
知识归纳
一、 电子转移 化合价
二、 得 降低 失 升高
三、 1. 同一元素
2. 不同元素
四、 1. 置换反应 复分解反应 化合反应 分解反应
五、 1. (1)氧化剂 氧化产物 还原剂 还原产物
【易错辨析】
1. × 2. √ 3. √ 4. × 5. √
命题突破
1. A 解析:氯水中含有Cl2,可以氧化Br-、Fe2+,向FeBr2溶液中加入几滴氯水,CCl4无明显现象,说明无Br2生成,说明Fe2+的还原性强于Br-,A正确;MnO2固体与稀盐酸不反应,无法产生氯气,B错误;酸化的AgNO3中H+和NO可组成硝酸从而氧化Fe2+生成Fe3+,无法说明氧化性Ag+>Fe3+,C错误;由于氯水过量,2NaBr+Cl2===2NaCl+Br2反应后有氯水剩余,加入淀粉KI溶液时,KI先与Cl2反应,Br2和KI的反应不一定发生,溶液变蓝无法证明氧化性Br2>I2,D错误。
2. A 解析:NaF、NH4F溶液中F-水解生成HF,HF可以与玻璃中的SiO2反应生成SiF4和H2O,没有涉及氧化还原反应,A符合题意;常温下,Fe、Al表面能被浓硫酸、浓硝酸钝化,生成致密的氧化物保护膜,涉及氧化还原反应,B不符合题意;FeCl2溶液中的Fe2+易被空气中的O2氧化成Fe3+,2Fe3++Fe===3Fe2+,涉及氧化还原反应,C不符合题意;Na2FeO4中Fe为+6价,具有强氧化性,能对自来水进行消毒,同时被还原成Fe3+,Fe3+水解生成Fe(OH)3胶体,Fe(OH)3胶体中的胶体粒子能吸附水中的悬浮物从而净化水,对自来水进行消毒过程中涉及氧化还原反应,D不符合题意。故选A。
3. B 解析:可逆反应中的反应物不可能全部转化为产物,2 mol SO2和1 mol O2充分反应后转移电子的数目小于4×6.02×1023,A错误;氧化剂是Cu2S和O2,每消耗1 mol O2,反应共转移6 mol电子,B正确;1 mol O3参与反应,转移电子的物质的量为2 mol,C错误;5.6 g Fe与足量Cl2充分反应后,转移电子的数目约为0.3×6.02×1023,D错误。
考点二 氧化还原反应方程式的配平
知识归纳
一、 氧化剂 还原剂 升高 种类 个数 总数
二、 化合价 相等 质量 电荷 电子
【易错辨析】
1. √ 2. √ 3. × 4. √ 5. √
命题突破
(1)2 9 3 3 5 (2)2 5 2 1 1 (3)1 6 3H2SO4 1 6 3
5H2O (4)2 5 3 2 1 10 8 (5)5Mn2+ 2 4H2O 5 8H+ (6)4 2 8 8 1 4H2O
解析:(1)K3PO4中P为+5价,PH3中P为-3价,P元素发生歧化反应,化合价升高了5,降低了3,根据最小公倍数可得K3PO4系数为3、PH3系数为5,结合原子守恒配平化学方程式为2P4+9KOH+3H2O===3K3PO4+5PH3。
(2)根据氧化还原反应中化合价升降总数相等配平,该反应中碘元素的化合价由+5价得电子变为0价,所以一个碘酸根离子得5个电子,硫元素的化合价由+4价失电子变为+6,所以一个参加氧化还原反应的亚硫酸氢根离子失去2个电子,所以得失的最小公倍数是10,所以碘酸钠的计量数是2,亚硫酸氢钠的计量数是5,其他元素根据原子守恒进行配平,所以该方程式为2NaIO3+5NaHSO3===3NaHSO4+2Na2SO4+I2+H2O,单线桥标出电子转移的方向和数目为2NaIO3+5NaHS10e-O3===3NaHSO4+2Na2SO4+I2+H2O。
(3)根据元素守恒左边加入硫酸,右边加水,氧化剂是NaClO3,氯元素的化合价从+5降低到+4价,化合价降低了1,CH3OH中碳元素的化合价从-2升高到+4价,化合价升高了6,根据氧化剂得电子的物质的量等于还原剂失电子的物质的量相等,配平氧化剂和还原剂的系数,根据元素守恒,配平其余物质,得到化学反应为:CH3OH+6NaClO3+3H2SO4===CO2↑+6ClO2↑+3Na2SO4+5H2O。
(4)高锰酸钾中锰元素化合价从+7价降低到+2价,变化5价,草酸中的碳元素化合价从+3价升高到二氧化碳中的+4价,升高1价,所以二者比例为2∶5,再根据原子守恒配平其他物质的化学计量数,得方程式为2KMnO4+5H2C2O4+3H2SO4===2MnSO4+K2SO4+10CO2↑+8H2O。
(5)MnSO4要转化为MnO2,需失去电子,故需要加入NaClO3作氧化剂,依据得失电子守恒可以配平,反应的离子方程式5Mn2++2ClO+4H2O===5MnO2↓+Cl2↑+8H+。
(6)根据元素守恒,则产物的空白处为H2O,S2O中S元素的化合价是+3价,产物中S元素的化合价是+4价,S元素整体失去2个电子,二氧化氮中N元素的化合价是+4价,生成氮气N元素的化合价降低到0价,整体得到8个电子,根据得失电子守恒,则S2O的系数是4,亚硫酸根离子的系数是8,二氧化氮的系数是2,氮气的系数是1,再根据电荷守恒,氢氧根离子的系数是8,则水的系数是4,配平后的离子方程式为4S2O+2NO2+8OH-===8SO+N2+4H2O。
考点三 氧化还原反应方程式的书写
命题突破
(1)C6H12O6+6HNO33H2C2O4+6NO↑+6H2O
(2)3HSO+Cr2O+5H+===2Cr3++3SO+4H2O
(3)2Ce2(SO4)3+O24CeO2+6SO3
(4)3KClO+10KOH+2Fe(NO3)3===2K2FeO4↓+3KCl+6KNO3+5H2O
(5)C6H12O6+12MnO2+24H+===12Mn2++6CO2↑+18H2O
(6)4Ag+O2+4H+===4Ag++2H2O
素养评估
1. A 解析:反应N2O4??2NO2中元素的化合价没变化,不是氧化还原反应,A错误;反应2Al+Fe2O32Fe+Al2O3中,一种单质置换另一种单质,为置换反应,也为氧化还原反应,B正确;反应FeCl3+3H2OFe(OH)3(胶体)+3HCl中,两种化合物交换阴阳离子,为复分解反应,元素的化合价没有变化,为非氧化还原反应,C正确;反应4Fe(OH)2+O2+2H2O===4Fe(OH)3,多种物质生成一种物质,为化合反应,有元素化合价变化,为氧化还原反应,D正确。
2. A 解析:该反应中Fe元素化合价由+3价降低为+2价,I由-1价升高到0价,转移电子数目为2,A正确;硫化氢与浓硫酸反应,硫化氢被氧化成硫,浓硫酸被还原成二氧化硫,则1 mol硫化氢被氧化,转移2 mol电子,B错误;该反应中Cl元素化合价由0价变化为+1价、-1价,转移电子数目为1,C错误;该反应中,Mn元素的化合价降低,得电子,Cl元素的化合价升高,失去电子,D错误。故选A。
3. D 解析:实验①是将氯水加入蒸馏水将其稀释,后续实验都是在溶液中进行的,这样可以排除实验②③④水稀释的影响,A正确;溶液变为黄色是因为产生溴单质,说明氯气可以将溴单质置换出来,发生的反应为2Br-+Cl2===Br2+2Cl-,B正确;溶液变为棕黄色是因为产生碘单质,说明氯气可以将碘单质置换出来,发生的反应为2I-+Cl2===I2+2Cl-,可以证明氧化性:Cl2>I2,C正确;②反应后的黄色溶液是含有溴单质的溶液,但是不能排除含有氯单质,加入淀粉碘化钾溶液会变蓝,证明产生了碘单质,可能是氯气或是溴单质置换出了碘单质,不能证明氧化性:Br2>I2,D错误。故选D。
4. (1)CuI I2 (2)2Cu+I2===2CuI (3)>
解析:(1)氧化性:Cu2+>I2>Cu+,还原性:Cu>I->Cu+,所以Cu2+和I-反应,Cu2+被还原为Cu+、I-被氧化为I2,Cu+和I-结合生成难溶于水的CuI沉淀,所以反应的产物是CuI、I2。
(2)久置于空气中的HI溶液呈黄色,是因为其中的碘离子被氧化为碘单质,加入金属铜,金属铜可以和碘单质反应生成CuI,反应的化学方程式为2Cu+I2===2CuI。
(3)欲消除HI溶液的黄色,也可向其中通入少量H2S,碘单质可以和硫化氢反应生成单质硫和碘化氢,还原性:H2S>I-。
同课章节目录
