第6讲 晶体结构与性质 配合物 学案(含答案)2026届高三化学一轮总复习
文档属性
| 名称 | 第6讲 晶体结构与性质 配合物 学案(含答案)2026届高三化学一轮总复习 |  | |
| 格式 | doc | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-27 09:27:24 | ||
图片预览



文档简介
第6讲 晶体结构与性质 配合物
复习要求 1. 了解晶体类型及不同类型晶体中微粒间作用力的区别,知道物质的聚集状态会影响物质的性质,通过改变物质的聚集状态可能获得特殊的材料。2. 了解分子晶体、共价晶体、离子晶体、金属晶体的结构与性质的关系。知道金属键的特点与金属某些性质的关系。知道介于典型晶体之间的过渡晶体及混合型晶体是普遍存在的。3. 了解晶胞的概念,能根据晶胞确定晶体的组成并进行相关的计算。4. 认识简单配合物的成键特征,了解配合物的存在与应用。
知识体系
考点一 晶体 晶胞中微粒数的计算
一、 晶体和晶胞
1. 晶体与非晶体的区别
2. 获得晶体的三条途径
(1)熔融态物质凝固。
(2)气态物质冷却不经液态直接凝固(凝华)。
(3)溶质从溶液中析出。
3. 晶胞
(1)概念
晶胞是描述晶体结构的基本单元,是从晶体中“截取”出来具有代表性的最小重复单元。
(2)晶胞形状
常规的晶胞都是__________。
(3)晶体中晶胞的排列——无隙并置
①无隙:相邻晶胞之间没有________。
②并置:所有晶胞________排列、________相同。
【思维拓展】
物质的聚集状态
a. 物质的聚集状态除了固态、液态、气态,还有晶态、非晶态以及介乎晶态和非晶态之间的塑晶态、液晶态等。
b. 等离子体和液晶
概念 主要性能
等离子体 由电子、阳离子和电中性粒子组成的整体上呈电中性的物质聚集体 具有良好的导电性和流动性
液晶 介于液态和晶态之间的物质状态 既具有液体的流动性、黏度、形变性,又具有晶体的导热性、光学性质等
二、 晶胞中微粒数的计算
1. 晶胞中微粒数的计算方法—均摊法
(1)原则
晶胞任意位置上的一个原子如果是被n个晶胞所共有,那么,每个晶胞对这个原子分得的份额就是。
(2)实例
①平行六面体晶胞中不同位置的粒子数的计算
②其他晶体结构的计算(以六棱柱晶体结构为例)
2. 晶胞中粒子配位数的计算
(1)概念:一个粒子周围________的粒子的数目称为配位数。
(2)晶体中原子(或分子)的配位数:若晶体中的微粒为________或________,则某原子(或分子)的配位数指的是该原子(或分子)等距离且紧邻的原子(或分子)的数目。常见晶胞的配位数如表:
晶胞
配位数 6 8 12
(3)离子晶体的配位数:指一个离子周围等距离且紧邻的异种电性离子的数目。
①NaCl晶体中,Cl-的配位数指的是每个Cl-周围等距离且紧邻的Na+的个数,Na+的配位数指的是每个Na+周围等距离且紧邻的Cl-的个数。由图1可知,Cl-的配位数为6,6个Na+所围成的图形为正八面体。Na+的配位数也为6。
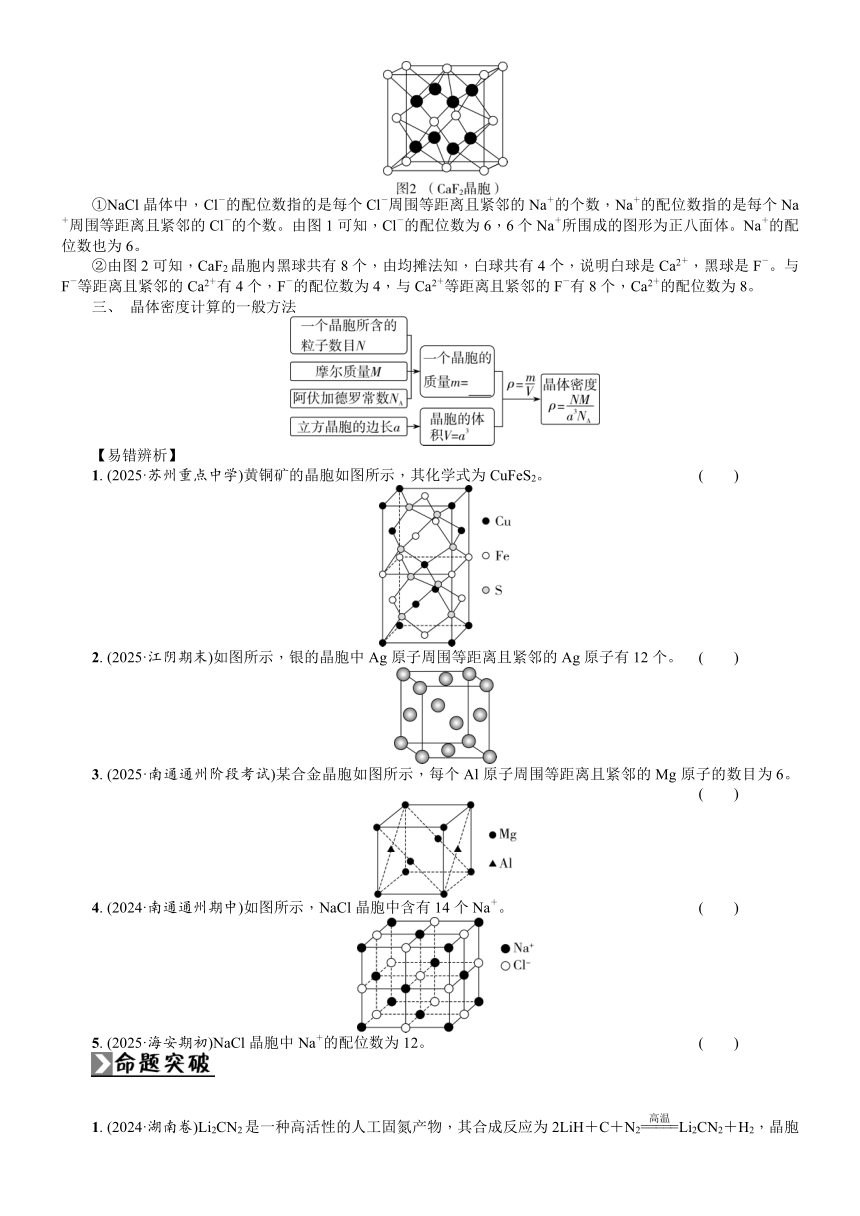
②由图2可知,CaF2晶胞内黑球共有8个,由均摊法知,白球共有4个,说明白球是Ca2+,黑球是F-。与F-等距离且紧邻的Ca2+有4个,F-的配位数为4,与Ca2+等距离且紧邻的F-有8个,Ca2+的配位数为8。
三、 晶体密度计算的一般方法
【易错辨析】
1. (2025·苏州重点中学)黄铜矿的晶胞如图所示,其化学式为CuFeS2。 ( )
2. (2025·江阴期末)如图所示,银的晶胞中Ag原子周围等距离且紧邻的Ag原子有12个。 ( )
3. (2025·南通通州阶段考试)某合金晶胞如图所示,每个Al原子周围等距离且紧邻的Mg原子的数目为6。 ( )
4. (2024·南通通州期中)如图所示,NaCl晶胞中含有14个Na+。 ( )
5. (2025·海安期初)NaCl晶胞中Na+的配位数为12。 ( )
1. (2024·湖南卷)Li2CN2是一种高活性的人工固氮产物,其合成反应为2LiH+C+N2Li2CN2+H2,晶胞如图所示,下列说法错误的是( )
A. 合成反应中,还原剂是LiH和C
B. 晶胞中含有的Li+个数为4
C. 每个CN周围与它最近且距离相等的Li+有8个
D. CN为V型结构
2. (1)FeS2具有良好半导体性能。FeS2的一种晶体与NaCl晶体的结构相似,该FeS2晶体的一个晶胞中S的数目为__________,在FeS2晶体中,每个S原子与三个Fe2+紧邻,且Fe—S间距相等,如下图给出了FeS2晶胞中的Fe2+和位于晶胞体心的S(S中的S—S键位于晶胞体对角线上,晶胞中的其他S已省略)。在图中用“—”将其中一个S原子与紧邻的Fe2+连接起来。
(2)(2024·南京二模)CuS的晶胞如图所示,CuS晶胞中含有________个S2-。
(3)(2024·苏锡常镇二模)钛酸钡晶胞的结构如图所示,其中与Ti4+紧邻的O2-构成的几何构型是________。
(4)(2024·苏北四市一模)SrF2一种晶体的晶胞结构如图所示。由图可知,与一个Sr2+等距离且最近的Sr2+个数为__________。
考点二 晶体类型、结构与性质
一、 四种晶体类型比较
类型比较 分子晶体 共价晶体 金属晶体 离子晶体
构成微粒 ________ ________ 金属阳离子、自由电子 ________
微粒间的相互作用力 ________(某些含氢键) ________ ________ ________
硬度 较小 很大 有的很大,有的很小 较大
熔、沸点 较低 很高 有的很高,有的很低 较高
溶解性 相似相溶 难溶于一般溶剂 一般不溶于水,少数与水反应 大多易溶于水等极性溶剂
导电、导热性 一般不导电,溶于水后有的导电 一般不具有导电性,个别为半导体 电和热的良导体 晶体不导电,水溶液或熔融态导电
物质类别及举例 大多数非金属单质、气态氢化物、酸、非金属氧化物(SiO2除外)、绝大多数有机物(有机盐除外) 金刚石、硅、硼、SiC、SiO2等 金属单质(如Na、Al等) 金属氧化物(如Na2O)、强碱(如KOH)、绝大部分盐(如NaCl)
二、 晶体熔、沸点的比较
1. 不同类型晶体的熔、沸点高低的一般规律
共价晶体>离子晶体>分子晶体。如熔点:SiO2>NaCl>CO2。
2. 同种类型晶体能熔沸点的比较
(1)金属晶体
金属离子半径越小、离子所带电荷数越________,金属键越________,金属的熔、沸点越________,如熔点:Na<Mg<Al。
(2)离子晶体
①一般地说,阴、阳离子的电荷数越多,离子半径越________,则离子间的作用力就越________,其离子晶体的熔、沸点就越________,如熔点:MgO>MgCl2>NaCl>CsCl。
②衡量离子晶体稳定性的物理量是晶格能。晶格能越大,形成的离子晶体越稳定,熔点越高,硬度越大。
(3)共价晶体
原子半径越小,键长越________,键能越________,熔、沸点越________。如熔点:金刚石>碳化硅>硅。
(4)分子晶体
①组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越________;具有分子间氢键的分子晶体的熔、沸点反常的高。如沸点:GeH4>SiH4>CH4,但H2O>H2Se>H2S;NH3>AsH3>PH3、HF>HI>HBr>HCl。
②组成和结构不相似的分子晶体(相对分子质量接近),分子的极性越大,其熔、沸点越高。如沸点:CO>N2。
③同分异构体,支链越多,熔、沸点越低。
常见晶体结构模型
【易错辨析】
1. 分子晶体不导电,溶于水后也都不导电。 ( )
2. 共价晶体的熔点一定比离子晶体的高。 ( )
3. (2024·苏锡常镇一模)固态四乙基铅(熔点为-136 ℃,极易挥发)为离子晶体。 ( )
4. 金属导电是因为在外加电场作用下产生自由电子。 ( )
5. 沸点:HF
(2023·北京卷)中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。
下列关于金刚石、石墨、石墨炔的说法正确的是( )
A. 三种物质中均有碳碳原子间的σ键
B. 三种物质中的碳原子都是sp3杂化
C. 三种物质的晶体类型相同
D. 三种物质均能导电
考点三 配合物
一、 配位键
1. 概念:由一个原子单方面提供________而另一个原子接受________形成的共价键,即“电子对给予—接受”键被称为配位键。
2. 表示方法:常用“→”来表示配位键,箭头指向________孤电子对的原子,如NH可表示为,在NH中,虽然有一个N—H形成过程与其他3个N—H形成过程不同,但是一旦形成之后,4个共价键就完全相同。
二、 配合物
1. 概念:由________________________(称为配位体)与________________________(称为中心原子)以配位键结合形成的化合物。
2. 形成条件
(1)中心离子或原子:有空轨道,一般是带正电的金属离子,特别是过渡金属离子,如Fe3+、Cu2+、Zn2+、Ag+等,但也有电中性的原子等。
(2)配位体:其中的配位原子(配位体中直接同中心离子或原子配合的原子)有孤电子对。配位体可以是分子,如CO、NH3、H2O等,也可以是离子,如F-、Cl-、Br-、I-、CN-、SCN-、OH-等。
【注意】 单核配体的确认要注意是否带有电荷,如F-、Cl-等,如配合物[CoCl(NH3)5]Cl2,中心离子为Co3+,配体是Cl-和NH3,而不是氯原子。
3. 组成(实例)
[Cu(NH3)4]SO4:
(1)配位原子:配位体中提供孤对电子的原子叫配位原子,如:NH3中的N原子。
(2)配位数:作为配位体直接与中心原子结合的离子或分子的数目,即形成的配位键的数目称为配位数。如:[Cu(NH3)4]2+的配位数为4。
(3)内界和外界:配合物分为内界和外界,其中中心离子或原子与配位体组成的部分称为内界,与内界发生电性匹配的阳离子(或阴离子)称为外界,如:[Cu(NH3)4]SO4的内界是[Cu(NH3)4]2+,外界是SO,配合物在水溶液中电离成内界和外界两部分。
即:[Cu(NH3)4]SO4===[Cu(NH3)4]2++SO,而内界很难电离,其电离程度很小,[Cu(NH3)4]2+??Cu2++4NH3。
【思维拓展】
特殊的配位体形成的配合物
1. 螯合配位体:一个配位体中的几个配位原子能直接和同一个金属离子配位,形成具有环状结构的配合物。如EDTA(乙二胺四乙酸或乙二胺四乙酸二钠盐,见图1)配体中有6个配位原子。
2. π键配位体:CO、环戊二烯基(C5H5—)等含有π键的配位体,常和过渡金属结合形成配合物。如金属羰基化合物(见图2)等。
三、 配位数
________总的数目称为配位数,配位数与配离子所带电荷数之间的关系一般如下:
实例 配位数 配离子所带电荷
[Ag(NH3)2]+ ________ ________
[Cu(NH3)4]2+ ________ ________
[Fe(SCN)6]3- ________ ________
[Cu(OH)4]2- ________ ________
四、 配合物的生成实验探究
1. CuSO4溶液Cu(OH)2(蓝色沉淀)[Cu(NH3)4]2+(深蓝色),反应的离子方程式为________________________________________________________________________________________________________________。
2. FeCl3溶液红色溶液,若所得Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数之比1∶1配合所得离子显红色,反应的离子方程式为________________________________。
3. NaCl溶液AgCl(白色沉淀)[Ag(NH3)2]+,反应的离子方程式为________________________________________、________________________________________。
五、 配合物的种类与应用
配合物种类繁多,如叶绿素、血红素和维生素B12都是配合物。如叶绿素中Mg2+为中心离子,大环有机物作配体,配位原子为N。配合物在医药科学、化学催化剂、新型分子材料等领域应用广泛。
【易错辨析】
1. 配离子[Ag(NH3)2]+中提供孤电子对形成配位键的是NH3。 ( )
2. 有配位键的化合物就是配位化合物。 ( )
3. 配位化合物都很稳定。 ( )
4. 在配合物[Co(NH3)5Cl]Cl2中的Cl-均可与AgNO3反应生成AgCl沉淀。 ( )
5. Ni(CO)4是配合物,它是由中心原子与配体构成的。 ( )
(2025·如皋期初检测)许多过渡金属离子对多种配体有很强结合力,能形成种类繁多的配合物,下列说法正确的是( )
A. 1 mol配合物[TiCl(H2O)5]Cl2·H2O不能与AgNO3溶液反应产生白色沉淀
B. 1 mol配合物Ni(CO)4中共有8 mol σ键
C. 配合物[Cu(NH3)4]SO4·H2O的配体为NH3和SO
D. 配合物[Ag(NH3)2]OH的配位数为6
素 养 评 估
1. 储氢合金是一类能够大量吸收氢气,并与氢气结合成金属氢化物的材料,如镧(La)镍(Ni)合金,它吸收氢气可结合成金属氢化物。某镧镍储氢合金晶胞结构如图,该材料中镧、镍、氢的原子个数比为( )
A. 8∶9∶10 B. 1∶5∶6
C. 1∶5∶3 D. 1∶5∶5
2. 有关晶体的结构如图所示,下列说法不正确的是( )
A. 在NaCl晶体中,距Cl-最近的Na+形成正八面体
B. 在CaF2晶体中,每个晶胞平均含有4个Ca2+
C. 冰晶体中每个水分子与另外四个水分子形成四面体结构
D. 该气态团簇分子的分子式为EF
3. (2024·南通如皋三模)黄铁矿是自然界中常见的金属矿物,主要成分为FeS2。FeS2的晶胞如图所示。
下列说法正确的是( )
A. Fe元素位于元素周期表第四周期ⅥB族
B. S的电子式为[S, S, ]2-
C. 晶胞中距离每个S最近的Fe2+可以构成一个正八面体
D. 常温下浓硫酸与铁不反应
4. 下列有关[Ni(NH3)6]SO4的说法正确的是( )
A. 配体为NH3,NH3的空间结构为平面三角形
B. 1 mol [Ni(NH3)6]2+中含有18 mol σ键
C. [Ni(NH3)6]2+中H—N—H的键角大于NH3中的键角
D. 由于[Ni(NH3)6]SO4是配合物,故向其中滴加BaCl2溶液不会生成沉淀
第6讲 晶体结构与性质 配合物
考点一 晶体 晶胞中微粒数的计算
知识归纳
一、 1. 周期性有序 无序 熔点 X射线衍射
3. (2)平行六面体 (3)①任何间隙 ②平行 取向
二、 2. (1)最邻近 (2)同种原子 同种分子
三、
【易错辨析】
1. √ 2. √ 3. × 4. × 5. ×
命题突破
1. D 解析:LiH中H元素为-1价,由图中CN化合价可知,N元素为-3价,C元素为+4价,根据反应2LiH+C+N2Li2CN2+H2可知,H元素由-1价升高到0价,C元素由0价升高到+4价,N元素由0价降低到-3价,由此可知还原剂是LiH和C,故A正确;根据均摊法可知,Li+位于晶胞中的面上,则含有的Li+个数为8×=4,故B正确;观察位于体心的CN可知,与它最近且距离相等的Li+有8个,故C正确;CN的中心原子C原子的价层电子对数为2+×(4+2-3×2)=2,且CN与CO2互为等电子体,可知CN为直线型分子,故D错误。故选D。
2. (1)4 图见解析
(2)6
(3)正八面体形
(4)12
解析:(1)因为FeS2的晶体与NaCl晶体的结构相似,由NaCl晶体结构可知,一个NaCl晶胞含有4个Na+和4个Cl-,则该FeS2晶体的一个晶胞中S的数目也为4;FeS2晶体中,每个S原子与三个Fe2+紧邻,且Fe—S间距相等,根据FeS2晶胞中的Fe2+和S的位置(S中的S—S键位于晶胞体对角线上)可知,每个S原子与S—S键所在体对角线上距离最近的顶点相邻的三个面的面心位置的Fe2+紧邻且间距相等,其中一个S原子与紧邻的Fe2+连接图如:。
(2)CuS晶胞中,Cu2+位于晶胞内部,有6个,则S2-的个数也为6。
(3)由图可知,与Ti4+紧邻的O2-位于棱的中心处,构成的空间结构是正八面体形。
(4)由晶胞结构可知一种微粒位于顶点和面心,每个晶胞均摊4个,内部有8个另一种微粒,所以可知锶离子位于顶点和面心,每个Sr2+周围等距离且最近的Sr2+个数为12个。
考点二 晶体类型、结构与性质
知识归纳
一、 分子 原子 阴、阳离子 范德华力 共价键 金属键 离子键
二、 2. (1)多 强 高 (2)① 小 强 高 (3)短 大 高 (4)①高
【易错辨析】
1. × 2. × 3. × 4. × 5. ×
命题突破
A 解析:原子间优先形成σ键,三种物质中均存在σ键,A项正确;金刚石中所有碳原子均采用sp3杂化,石墨中所有碳原子均采用sp2杂化,石墨炔中苯环上的碳原子采用sp2杂化,碳碳三键上的碳原子采用sp杂化,B项错误;金刚石为共价晶体,石墨炔为分子晶体,石墨为混合晶体,C项错误;金刚石中没有自由移动电子,不能导电,D项错误。故选A。
考点三 配合物
知识归纳
一、1. 孤电子对 孤电子对
2. 接受
二、 1. 提供孤电子对的分子或离子 接受孤电子对的原子或离子
3. 配位原子 配位体 配位数
三、 配位原子 2 +1 4 +2 6 +3 4 +2
四、 1. Cu2++2NH3·H2O===Cu(OH)2↓+2NH Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH-
2. Fe3++SCN-??[Fe(SCN)]2+
3. Cl-+Ag+===AgCl↓ AgCl+2NH3===[Ag(NH3)2]++Cl-
【易错辨析】
1. √ 2. × 3. × 4. × 5. √
命题突破
B 解析:加入足量的AgNO3溶液,外界Cl-离子与Ag+反应形成AgCl沉淀,内界配位离子Cl-与Ag+不能反应,A说法错误;一个CO中有一个σ键,配合物Ni(CO)4中有四个配位键,则1 mol配合物Ni(CO)4中共有8 mol σ键,B说法正确;配合物[Cu(NH3)4]SO4·H2O的配体为NH3,C说法错误;配合物[Ag(NH3)2]OH的配体为NH3,配位数为2,D说法错误。
素养评估
1. B 解析:利用均摊法,La在晶胞的顶角,N(La)=8×=1;Ni在面心和体心,N(Ni)=8×+1=5;氢气在棱上和面心,N(H2)=8×+2×=3;则镧、镍、氢的原子个数比为1∶5∶6。
2. D 解析:氟化钙晶胞中,Ca2+位于顶点和面心,数目为8×+6×=4,B正确;气态团簇分子不同于晶胞,气态团簇分子中含有4个E原子、4个F原子,则分子式为E4F4或F4E4,D错误。
3. C 解析:铁为26号元素,核外电子排布为2、8、14、2,Fe元素位于元素周期表第四周期Ⅷ族,A错误;S中S原子之间以单键结合,电子式为[S, S, ]2-,B错误;根据晶胞结构示意图可知,距离每个S最近的Fe2+有6个:上下各1个,同一平面上的有4个,即距离每个S最近的Fe2+可以构成一个正八面体,C正确;常温下铁在浓硫酸中会钝化,不是不反应,D错误。故选C。
4. C 解析:NH3的空间结构为三角锥形,A错误;1个[Ni(NH3)6]2+中含有18个N—H σ键和6个配位键(也属于σ键),故1 mol [Ni(NH3)6]2+中含有24 mol σ键,B错误;该离子中N原子周围有4个成键电子对,NH3的中心N原子的价层电子对数也为4,但含有1个孤电子对,斥力大,故该离子中H—N—H的键角大于NH3中H—N—H的键角,C正确;[Ni(NH3)6]SO4在溶液中可电离出[Ni(NH3)6]2+和SO,故加入BaCl2溶液后会产生BaSO4沉淀,D错误。故选C。
复习要求 1. 了解晶体类型及不同类型晶体中微粒间作用力的区别,知道物质的聚集状态会影响物质的性质,通过改变物质的聚集状态可能获得特殊的材料。2. 了解分子晶体、共价晶体、离子晶体、金属晶体的结构与性质的关系。知道金属键的特点与金属某些性质的关系。知道介于典型晶体之间的过渡晶体及混合型晶体是普遍存在的。3. 了解晶胞的概念,能根据晶胞确定晶体的组成并进行相关的计算。4. 认识简单配合物的成键特征,了解配合物的存在与应用。
知识体系
考点一 晶体 晶胞中微粒数的计算
一、 晶体和晶胞
1. 晶体与非晶体的区别
2. 获得晶体的三条途径
(1)熔融态物质凝固。
(2)气态物质冷却不经液态直接凝固(凝华)。
(3)溶质从溶液中析出。
3. 晶胞
(1)概念
晶胞是描述晶体结构的基本单元,是从晶体中“截取”出来具有代表性的最小重复单元。
(2)晶胞形状
常规的晶胞都是__________。
(3)晶体中晶胞的排列——无隙并置
①无隙:相邻晶胞之间没有________。
②并置:所有晶胞________排列、________相同。
【思维拓展】
物质的聚集状态
a. 物质的聚集状态除了固态、液态、气态,还有晶态、非晶态以及介乎晶态和非晶态之间的塑晶态、液晶态等。
b. 等离子体和液晶
概念 主要性能
等离子体 由电子、阳离子和电中性粒子组成的整体上呈电中性的物质聚集体 具有良好的导电性和流动性
液晶 介于液态和晶态之间的物质状态 既具有液体的流动性、黏度、形变性,又具有晶体的导热性、光学性质等
二、 晶胞中微粒数的计算
1. 晶胞中微粒数的计算方法—均摊法
(1)原则
晶胞任意位置上的一个原子如果是被n个晶胞所共有,那么,每个晶胞对这个原子分得的份额就是。
(2)实例
①平行六面体晶胞中不同位置的粒子数的计算
②其他晶体结构的计算(以六棱柱晶体结构为例)
2. 晶胞中粒子配位数的计算
(1)概念:一个粒子周围________的粒子的数目称为配位数。
(2)晶体中原子(或分子)的配位数:若晶体中的微粒为________或________,则某原子(或分子)的配位数指的是该原子(或分子)等距离且紧邻的原子(或分子)的数目。常见晶胞的配位数如表:
晶胞
配位数 6 8 12
(3)离子晶体的配位数:指一个离子周围等距离且紧邻的异种电性离子的数目。
①NaCl晶体中,Cl-的配位数指的是每个Cl-周围等距离且紧邻的Na+的个数,Na+的配位数指的是每个Na+周围等距离且紧邻的Cl-的个数。由图1可知,Cl-的配位数为6,6个Na+所围成的图形为正八面体。Na+的配位数也为6。
②由图2可知,CaF2晶胞内黑球共有8个,由均摊法知,白球共有4个,说明白球是Ca2+,黑球是F-。与F-等距离且紧邻的Ca2+有4个,F-的配位数为4,与Ca2+等距离且紧邻的F-有8个,Ca2+的配位数为8。
三、 晶体密度计算的一般方法
【易错辨析】
1. (2025·苏州重点中学)黄铜矿的晶胞如图所示,其化学式为CuFeS2。 ( )
2. (2025·江阴期末)如图所示,银的晶胞中Ag原子周围等距离且紧邻的Ag原子有12个。 ( )
3. (2025·南通通州阶段考试)某合金晶胞如图所示,每个Al原子周围等距离且紧邻的Mg原子的数目为6。 ( )
4. (2024·南通通州期中)如图所示,NaCl晶胞中含有14个Na+。 ( )
5. (2025·海安期初)NaCl晶胞中Na+的配位数为12。 ( )
1. (2024·湖南卷)Li2CN2是一种高活性的人工固氮产物,其合成反应为2LiH+C+N2Li2CN2+H2,晶胞如图所示,下列说法错误的是( )
A. 合成反应中,还原剂是LiH和C
B. 晶胞中含有的Li+个数为4
C. 每个CN周围与它最近且距离相等的Li+有8个
D. CN为V型结构
2. (1)FeS2具有良好半导体性能。FeS2的一种晶体与NaCl晶体的结构相似,该FeS2晶体的一个晶胞中S的数目为__________,在FeS2晶体中,每个S原子与三个Fe2+紧邻,且Fe—S间距相等,如下图给出了FeS2晶胞中的Fe2+和位于晶胞体心的S(S中的S—S键位于晶胞体对角线上,晶胞中的其他S已省略)。在图中用“—”将其中一个S原子与紧邻的Fe2+连接起来。
(2)(2024·南京二模)CuS的晶胞如图所示,CuS晶胞中含有________个S2-。
(3)(2024·苏锡常镇二模)钛酸钡晶胞的结构如图所示,其中与Ti4+紧邻的O2-构成的几何构型是________。
(4)(2024·苏北四市一模)SrF2一种晶体的晶胞结构如图所示。由图可知,与一个Sr2+等距离且最近的Sr2+个数为__________。
考点二 晶体类型、结构与性质
一、 四种晶体类型比较
类型比较 分子晶体 共价晶体 金属晶体 离子晶体
构成微粒 ________ ________ 金属阳离子、自由电子 ________
微粒间的相互作用力 ________(某些含氢键) ________ ________ ________
硬度 较小 很大 有的很大,有的很小 较大
熔、沸点 较低 很高 有的很高,有的很低 较高
溶解性 相似相溶 难溶于一般溶剂 一般不溶于水,少数与水反应 大多易溶于水等极性溶剂
导电、导热性 一般不导电,溶于水后有的导电 一般不具有导电性,个别为半导体 电和热的良导体 晶体不导电,水溶液或熔融态导电
物质类别及举例 大多数非金属单质、气态氢化物、酸、非金属氧化物(SiO2除外)、绝大多数有机物(有机盐除外) 金刚石、硅、硼、SiC、SiO2等 金属单质(如Na、Al等) 金属氧化物(如Na2O)、强碱(如KOH)、绝大部分盐(如NaCl)
二、 晶体熔、沸点的比较
1. 不同类型晶体的熔、沸点高低的一般规律
共价晶体>离子晶体>分子晶体。如熔点:SiO2>NaCl>CO2。
2. 同种类型晶体能熔沸点的比较
(1)金属晶体
金属离子半径越小、离子所带电荷数越________,金属键越________,金属的熔、沸点越________,如熔点:Na<Mg<Al。
(2)离子晶体
①一般地说,阴、阳离子的电荷数越多,离子半径越________,则离子间的作用力就越________,其离子晶体的熔、沸点就越________,如熔点:MgO>MgCl2>NaCl>CsCl。
②衡量离子晶体稳定性的物理量是晶格能。晶格能越大,形成的离子晶体越稳定,熔点越高,硬度越大。
(3)共价晶体
原子半径越小,键长越________,键能越________,熔、沸点越________。如熔点:金刚石>碳化硅>硅。
(4)分子晶体
①组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越________;具有分子间氢键的分子晶体的熔、沸点反常的高。如沸点:GeH4>SiH4>CH4,但H2O>H2Se>H2S;NH3>AsH3>PH3、HF>HI>HBr>HCl。
②组成和结构不相似的分子晶体(相对分子质量接近),分子的极性越大,其熔、沸点越高。如沸点:CO>N2。
③同分异构体,支链越多,熔、沸点越低。
常见晶体结构模型
【易错辨析】
1. 分子晶体不导电,溶于水后也都不导电。 ( )
2. 共价晶体的熔点一定比离子晶体的高。 ( )
3. (2024·苏锡常镇一模)固态四乙基铅(熔点为-136 ℃,极易挥发)为离子晶体。 ( )
4. 金属导电是因为在外加电场作用下产生自由电子。 ( )
5. 沸点:HF
(2023·北京卷)中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。
下列关于金刚石、石墨、石墨炔的说法正确的是( )
A. 三种物质中均有碳碳原子间的σ键
B. 三种物质中的碳原子都是sp3杂化
C. 三种物质的晶体类型相同
D. 三种物质均能导电
考点三 配合物
一、 配位键
1. 概念:由一个原子单方面提供________而另一个原子接受________形成的共价键,即“电子对给予—接受”键被称为配位键。
2. 表示方法:常用“→”来表示配位键,箭头指向________孤电子对的原子,如NH可表示为,在NH中,虽然有一个N—H形成过程与其他3个N—H形成过程不同,但是一旦形成之后,4个共价键就完全相同。
二、 配合物
1. 概念:由________________________(称为配位体)与________________________(称为中心原子)以配位键结合形成的化合物。
2. 形成条件
(1)中心离子或原子:有空轨道,一般是带正电的金属离子,特别是过渡金属离子,如Fe3+、Cu2+、Zn2+、Ag+等,但也有电中性的原子等。
(2)配位体:其中的配位原子(配位体中直接同中心离子或原子配合的原子)有孤电子对。配位体可以是分子,如CO、NH3、H2O等,也可以是离子,如F-、Cl-、Br-、I-、CN-、SCN-、OH-等。
【注意】 单核配体的确认要注意是否带有电荷,如F-、Cl-等,如配合物[CoCl(NH3)5]Cl2,中心离子为Co3+,配体是Cl-和NH3,而不是氯原子。
3. 组成(实例)
[Cu(NH3)4]SO4:
(1)配位原子:配位体中提供孤对电子的原子叫配位原子,如:NH3中的N原子。
(2)配位数:作为配位体直接与中心原子结合的离子或分子的数目,即形成的配位键的数目称为配位数。如:[Cu(NH3)4]2+的配位数为4。
(3)内界和外界:配合物分为内界和外界,其中中心离子或原子与配位体组成的部分称为内界,与内界发生电性匹配的阳离子(或阴离子)称为外界,如:[Cu(NH3)4]SO4的内界是[Cu(NH3)4]2+,外界是SO,配合物在水溶液中电离成内界和外界两部分。
即:[Cu(NH3)4]SO4===[Cu(NH3)4]2++SO,而内界很难电离,其电离程度很小,[Cu(NH3)4]2+??Cu2++4NH3。
【思维拓展】
特殊的配位体形成的配合物
1. 螯合配位体:一个配位体中的几个配位原子能直接和同一个金属离子配位,形成具有环状结构的配合物。如EDTA(乙二胺四乙酸或乙二胺四乙酸二钠盐,见图1)配体中有6个配位原子。
2. π键配位体:CO、环戊二烯基(C5H5—)等含有π键的配位体,常和过渡金属结合形成配合物。如金属羰基化合物(见图2)等。
三、 配位数
________总的数目称为配位数,配位数与配离子所带电荷数之间的关系一般如下:
实例 配位数 配离子所带电荷
[Ag(NH3)2]+ ________ ________
[Cu(NH3)4]2+ ________ ________
[Fe(SCN)6]3- ________ ________
[Cu(OH)4]2- ________ ________
四、 配合物的生成实验探究
1. CuSO4溶液Cu(OH)2(蓝色沉淀)[Cu(NH3)4]2+(深蓝色),反应的离子方程式为________________________________________________________________________________________________________________。
2. FeCl3溶液红色溶液,若所得Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数之比1∶1配合所得离子显红色,反应的离子方程式为________________________________。
3. NaCl溶液AgCl(白色沉淀)[Ag(NH3)2]+,反应的离子方程式为________________________________________、________________________________________。
五、 配合物的种类与应用
配合物种类繁多,如叶绿素、血红素和维生素B12都是配合物。如叶绿素中Mg2+为中心离子,大环有机物作配体,配位原子为N。配合物在医药科学、化学催化剂、新型分子材料等领域应用广泛。
【易错辨析】
1. 配离子[Ag(NH3)2]+中提供孤电子对形成配位键的是NH3。 ( )
2. 有配位键的化合物就是配位化合物。 ( )
3. 配位化合物都很稳定。 ( )
4. 在配合物[Co(NH3)5Cl]Cl2中的Cl-均可与AgNO3反应生成AgCl沉淀。 ( )
5. Ni(CO)4是配合物,它是由中心原子与配体构成的。 ( )
(2025·如皋期初检测)许多过渡金属离子对多种配体有很强结合力,能形成种类繁多的配合物,下列说法正确的是( )
A. 1 mol配合物[TiCl(H2O)5]Cl2·H2O不能与AgNO3溶液反应产生白色沉淀
B. 1 mol配合物Ni(CO)4中共有8 mol σ键
C. 配合物[Cu(NH3)4]SO4·H2O的配体为NH3和SO
D. 配合物[Ag(NH3)2]OH的配位数为6
素 养 评 估
1. 储氢合金是一类能够大量吸收氢气,并与氢气结合成金属氢化物的材料,如镧(La)镍(Ni)合金,它吸收氢气可结合成金属氢化物。某镧镍储氢合金晶胞结构如图,该材料中镧、镍、氢的原子个数比为( )
A. 8∶9∶10 B. 1∶5∶6
C. 1∶5∶3 D. 1∶5∶5
2. 有关晶体的结构如图所示,下列说法不正确的是( )
A. 在NaCl晶体中,距Cl-最近的Na+形成正八面体
B. 在CaF2晶体中,每个晶胞平均含有4个Ca2+
C. 冰晶体中每个水分子与另外四个水分子形成四面体结构
D. 该气态团簇分子的分子式为EF
3. (2024·南通如皋三模)黄铁矿是自然界中常见的金属矿物,主要成分为FeS2。FeS2的晶胞如图所示。
下列说法正确的是( )
A. Fe元素位于元素周期表第四周期ⅥB族
B. S的电子式为[S, S, ]2-
C. 晶胞中距离每个S最近的Fe2+可以构成一个正八面体
D. 常温下浓硫酸与铁不反应
4. 下列有关[Ni(NH3)6]SO4的说法正确的是( )
A. 配体为NH3,NH3的空间结构为平面三角形
B. 1 mol [Ni(NH3)6]2+中含有18 mol σ键
C. [Ni(NH3)6]2+中H—N—H的键角大于NH3中的键角
D. 由于[Ni(NH3)6]SO4是配合物,故向其中滴加BaCl2溶液不会生成沉淀
第6讲 晶体结构与性质 配合物
考点一 晶体 晶胞中微粒数的计算
知识归纳
一、 1. 周期性有序 无序 熔点 X射线衍射
3. (2)平行六面体 (3)①任何间隙 ②平行 取向
二、 2. (1)最邻近 (2)同种原子 同种分子
三、
【易错辨析】
1. √ 2. √ 3. × 4. × 5. ×
命题突破
1. D 解析:LiH中H元素为-1价,由图中CN化合价可知,N元素为-3价,C元素为+4价,根据反应2LiH+C+N2Li2CN2+H2可知,H元素由-1价升高到0价,C元素由0价升高到+4价,N元素由0价降低到-3价,由此可知还原剂是LiH和C,故A正确;根据均摊法可知,Li+位于晶胞中的面上,则含有的Li+个数为8×=4,故B正确;观察位于体心的CN可知,与它最近且距离相等的Li+有8个,故C正确;CN的中心原子C原子的价层电子对数为2+×(4+2-3×2)=2,且CN与CO2互为等电子体,可知CN为直线型分子,故D错误。故选D。
2. (1)4 图见解析
(2)6
(3)正八面体形
(4)12
解析:(1)因为FeS2的晶体与NaCl晶体的结构相似,由NaCl晶体结构可知,一个NaCl晶胞含有4个Na+和4个Cl-,则该FeS2晶体的一个晶胞中S的数目也为4;FeS2晶体中,每个S原子与三个Fe2+紧邻,且Fe—S间距相等,根据FeS2晶胞中的Fe2+和S的位置(S中的S—S键位于晶胞体对角线上)可知,每个S原子与S—S键所在体对角线上距离最近的顶点相邻的三个面的面心位置的Fe2+紧邻且间距相等,其中一个S原子与紧邻的Fe2+连接图如:。
(2)CuS晶胞中,Cu2+位于晶胞内部,有6个,则S2-的个数也为6。
(3)由图可知,与Ti4+紧邻的O2-位于棱的中心处,构成的空间结构是正八面体形。
(4)由晶胞结构可知一种微粒位于顶点和面心,每个晶胞均摊4个,内部有8个另一种微粒,所以可知锶离子位于顶点和面心,每个Sr2+周围等距离且最近的Sr2+个数为12个。
考点二 晶体类型、结构与性质
知识归纳
一、 分子 原子 阴、阳离子 范德华力 共价键 金属键 离子键
二、 2. (1)多 强 高 (2)① 小 强 高 (3)短 大 高 (4)①高
【易错辨析】
1. × 2. × 3. × 4. × 5. ×
命题突破
A 解析:原子间优先形成σ键,三种物质中均存在σ键,A项正确;金刚石中所有碳原子均采用sp3杂化,石墨中所有碳原子均采用sp2杂化,石墨炔中苯环上的碳原子采用sp2杂化,碳碳三键上的碳原子采用sp杂化,B项错误;金刚石为共价晶体,石墨炔为分子晶体,石墨为混合晶体,C项错误;金刚石中没有自由移动电子,不能导电,D项错误。故选A。
考点三 配合物
知识归纳
一、1. 孤电子对 孤电子对
2. 接受
二、 1. 提供孤电子对的分子或离子 接受孤电子对的原子或离子
3. 配位原子 配位体 配位数
三、 配位原子 2 +1 4 +2 6 +3 4 +2
四、 1. Cu2++2NH3·H2O===Cu(OH)2↓+2NH Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH-
2. Fe3++SCN-??[Fe(SCN)]2+
3. Cl-+Ag+===AgCl↓ AgCl+2NH3===[Ag(NH3)2]++Cl-
【易错辨析】
1. √ 2. × 3. × 4. × 5. √
命题突破
B 解析:加入足量的AgNO3溶液,外界Cl-离子与Ag+反应形成AgCl沉淀,内界配位离子Cl-与Ag+不能反应,A说法错误;一个CO中有一个σ键,配合物Ni(CO)4中有四个配位键,则1 mol配合物Ni(CO)4中共有8 mol σ键,B说法正确;配合物[Cu(NH3)4]SO4·H2O的配体为NH3,C说法错误;配合物[Ag(NH3)2]OH的配体为NH3,配位数为2,D说法错误。
素养评估
1. B 解析:利用均摊法,La在晶胞的顶角,N(La)=8×=1;Ni在面心和体心,N(Ni)=8×+1=5;氢气在棱上和面心,N(H2)=8×+2×=3;则镧、镍、氢的原子个数比为1∶5∶6。
2. D 解析:氟化钙晶胞中,Ca2+位于顶点和面心,数目为8×+6×=4,B正确;气态团簇分子不同于晶胞,气态团簇分子中含有4个E原子、4个F原子,则分子式为E4F4或F4E4,D错误。
3. C 解析:铁为26号元素,核外电子排布为2、8、14、2,Fe元素位于元素周期表第四周期Ⅷ族,A错误;S中S原子之间以单键结合,电子式为[S, S, ]2-,B错误;根据晶胞结构示意图可知,距离每个S最近的Fe2+有6个:上下各1个,同一平面上的有4个,即距离每个S最近的Fe2+可以构成一个正八面体,C正确;常温下铁在浓硫酸中会钝化,不是不反应,D错误。故选C。
4. C 解析:NH3的空间结构为三角锥形,A错误;1个[Ni(NH3)6]2+中含有18个N—H σ键和6个配位键(也属于σ键),故1 mol [Ni(NH3)6]2+中含有24 mol σ键,B错误;该离子中N原子周围有4个成键电子对,NH3的中心N原子的价层电子对数也为4,但含有1个孤电子对,斥力大,故该离子中H—N—H的键角大于NH3中H—N—H的键角,C正确;[Ni(NH3)6]SO4在溶液中可电离出[Ni(NH3)6]2+和SO,故加入BaCl2溶液后会产生BaSO4沉淀,D错误。故选C。
同课章节目录
