第8讲 铁及其化合物 学案(含答案)2026届高三化学一轮总复习
文档属性
| 名称 | 第8讲 铁及其化合物 学案(含答案)2026届高三化学一轮总复习 |  | |
| 格式 | doc | ||
| 文件大小 | 741.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-27 09:27:38 | ||
图片预览



文档简介
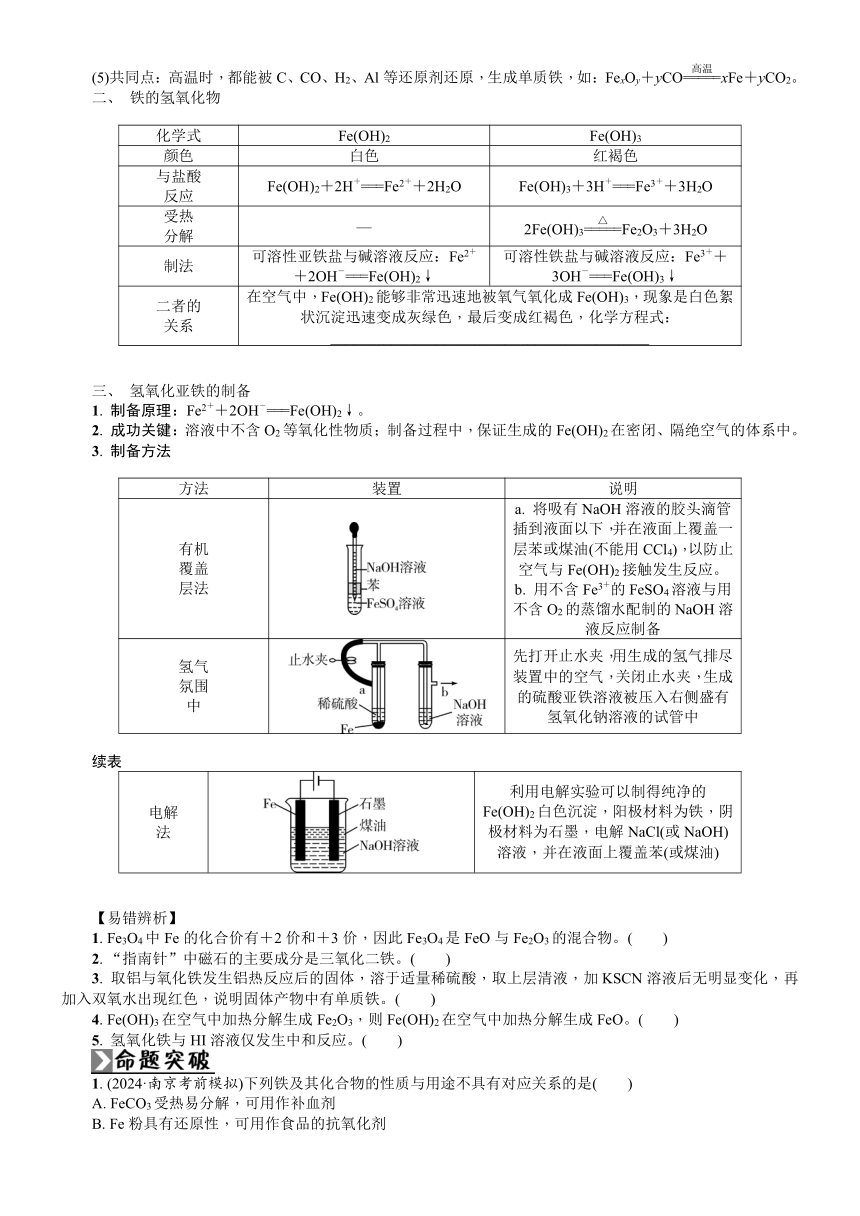
第8讲 铁及其化合物
复习要求 1. 掌握铁的主要性质及应用。2. 不同价态的铁的氧化物的主要性质和用途。3. 掌握Fe(OH)2、Fe(OH)3的性质及Fe(OH)2的制备方法。4. 基于价类二维图理解铁及其化合物的转化关系。5. 了解Fe2+、Fe3+的检验方法及Fe2+、Fe3+的除杂方法。
知识体系
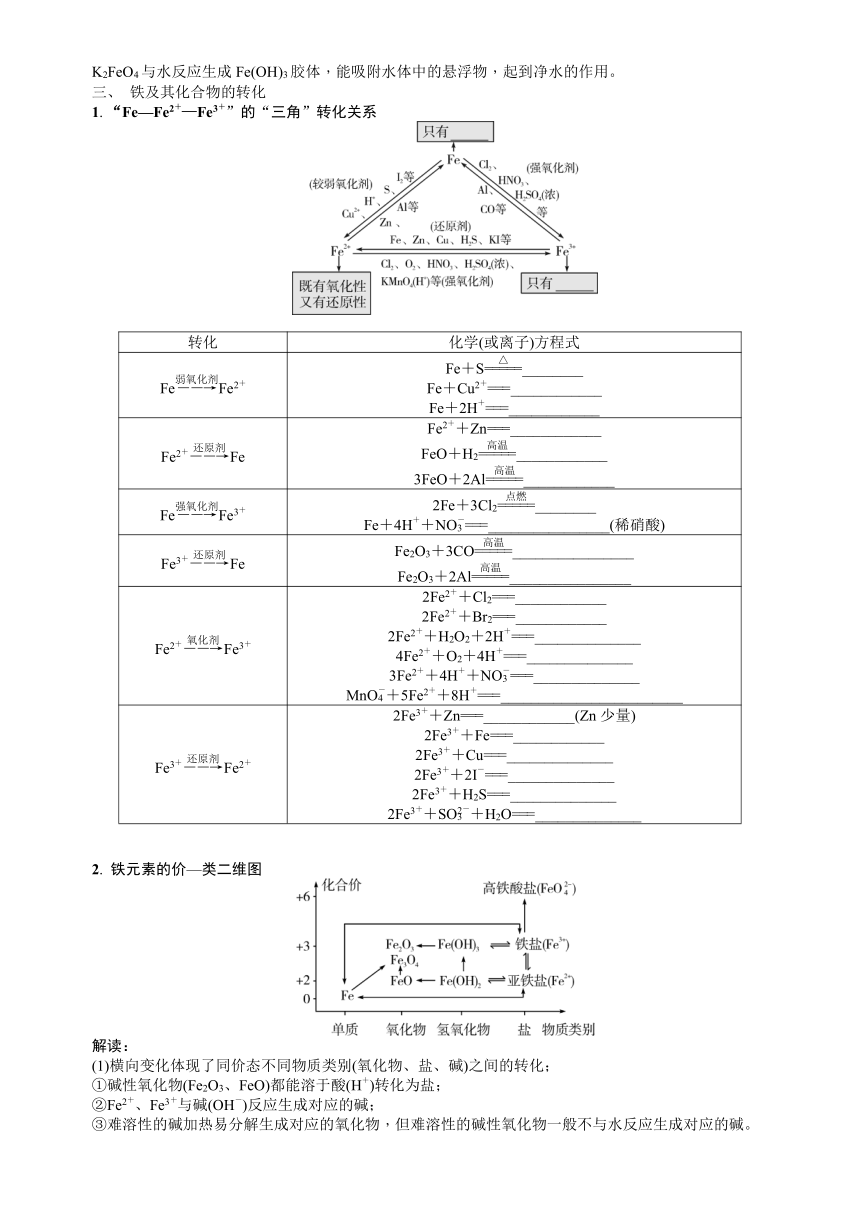
考点一 铁的性质
一、 铁的概述
二、 铁的性质
1. 物理性质与原子结构
铁是________色固体,熔点较高,具有良好的导热、导电、延展性,能被________吸引。其原子结构示意图:。
2. 化学性质
铁元素性质活泼,有较强的还原性,主要化合价为________价和________价。
与非金属单质反应
氧气 4Fe+3O2+2xH2O===____________(现象:在潮湿的空气中生锈,生成____色固体);3Fe+2O2______(现象:火星四射、生成____色固体)
氯气 2Fe+3Cl2______(现象:产生____色烟),无论Fe的量多少,产物都是FeCl3
溴 2Fe+3Br2______
碘 Fe+I2______
硫 Fe+S____(现象:生成黑色固体)
【易错辨析】
1. Fe与足量硫粉混合加热制取Fe2S3。( )
2. Fe分别与Cl2和盐酸反应所得氯化物相同。( )
3. 常温下可用铁质容器储存、运输浓硝酸、浓硫酸,理由是Fe与这两种酸不反应。( )
4. 铁表面自然形成的氧化层能保护内层金属不被空气氧化。( )
5. 制备溴苯时,铁粉与液溴反应生成FeBr2。( )
1. 关于铁及其化合物的说法正确的是( )
A. 铁与氯气不反应,故可用钢瓶储存液氯
B. 铁能与水蒸气反应,钢铁生产中的模具须提前进行干燥处理
C. 氢氧化铁是一种红褐色沉淀,常用作红色颜料
D. 湿法炼铜过程中,铜离子将铁氧化为三价铁
2. (2024·苏锡常镇高三一模)铁及其化合物的转化具有重要应用。下列说法正确的是( )
A. 工业制硫酸涉及的物质转化:FeS2SO3H2SO4
B. 实验室制溴苯涉及的物质转化:FeFeBr2,C6H6C6H5Br
C. 利用高温水蒸气处理铁器的化学方程式:3Fe+4H2O(g)Fe3O4+4H2
D. 利用铁粉从AgCl中获取Ag的离子方程式:Fe+2Ag+===Fe2++2Ag
考点二 铁的氧化物与氢氧化物
一、 铁的氧化物
1. 物理性质
化学式 FeO Fe2O3 Fe3O4
俗名 — 铁红 磁性氧化铁
颜色状态 黑色粉末 红棕色粉末 黑色晶体(有磁性)
续表
水溶性 不溶于水 不溶于水 不溶于水
铁的化合价 +2 +3 +2、+3
2. 化学性质
(1)FeO不稳定,在空气中受热,能迅速被氧化成Fe3O4。
(2)FeO、Fe2O3都属于碱性氧化物,能溶于强酸,分别写出它们溶于盐酸的离子方程式:________________________,________________________。
(3)写出FeO溶于过量稀硝酸的化学方程式:____________________________。
(4)写出Fe2O3溶于过量氢碘酸(HI)的离子方程式:____________________________。
(5)共同点:高温时,都能被C、CO、H2、Al等还原剂还原,生成单质铁,如:FexOy+yCOxFe+yCO2。
二、 铁的氢氧化物
化学式 Fe(OH)2 Fe(OH)3
颜色 白色 红褐色
与盐酸反应 Fe(OH)2+2H+===Fe2++2H2O Fe(OH)3+3H+===Fe3++3H2O
受热分解 — 2Fe(OH)3Fe2O3+3H2O
制法 可溶性亚铁盐与碱溶液反应:Fe2++2OH-===Fe(OH)2↓ 可溶性铁盐与碱溶液反应:Fe3++3OH-===Fe(OH)3↓
二者的关系 在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色絮状沉淀迅速变成灰绿色,最后变成红褐色,化学方程式:__________________________________________
三、 氢氧化亚铁的制备
1. 制备原理:Fe2++2OH-===Fe(OH)2↓。
2. 成功关键:溶液中不含O2等氧化性物质;制备过程中,保证生成的Fe(OH)2在密闭、隔绝空气的体系中。
3. 制备方法
方法 装置 说明
有机覆盖层法 a. 将吸有NaOH溶液的胶头滴管插到液面以下,并在液面上覆盖一层苯或煤油(不能用CCl4),以防止空气与Fe(OH)2接触发生反应。b. 用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备
氢气氛围中 先打开止水夹,用生成的氢气排尽装置中的空气,关闭止水夹,生成的硫酸亚铁溶液被压入右侧盛有氢氧化钠溶液的试管中
续表
电解法 利用电解实验可以制得纯净的Fe(OH)2白色沉淀,阳极材料为铁,阴极材料为石墨,电解NaCl(或NaOH)溶液,并在液面上覆盖苯(或煤油)
【易错辨析】
1. Fe3O4中Fe的化合价有+2价和+3价,因此Fe3O4是FeO与Fe2O3的混合物。( )
2. “指南针”中磁石的主要成分是三氧化二铁。( )
3. 取铝与氧化铁发生铝热反应后的固体,溶于适量稀硫酸,取上层清液,加KSCN溶液后无明显变化,再加入双氧水出现红色,说明固体产物中有单质铁。( )
4. Fe(OH)3在空气中加热分解生成Fe2O3,则Fe(OH)2在空气中加热分解生成FeO。( )
5. 氢氧化铁与HI溶液仅发生中和反应。( )
1. (2024·南京考前模拟)下列铁及其化合物的性质与用途不具有对应关系的是( )
A. FeCO3受热易分解,可用作补血剂
B. Fe粉具有还原性,可用作食品的抗氧化剂
C. Fe3O4质地致密,可用作铁件的防腐保护层
D. K2FeO4具有强氧化性,可用于自来水的杀菌消毒
2. 下列关于铁及其化合物的叙述正确的是( )
A. 氢氧化铁受热分解可制得Fe3O4
B. Fe2O3、Fe3O4都有磁性
C. FeO不稳定,在空气里受热,能迅速氧化成Fe3O4
D. 高温下,铁能与水蒸气反应生成Fe2O3
3. K2FeO4可用作净水剂,K2FeO4在水中不稳定,会生成Fe(OH)3胶体,碱性条件下,KClO的氧化性强于K2FeO4。下列有关铁及其化合物的相关转化,在指定条件下能实现的是( )
A. FeFe2O3Fe
B. FeCl3K2FeO4H2
C. FeCl3(aq)Fe2O3Fe(OH)3
D. FeFeCl3FeCl2
考点三 铁及其化合物的转化 Fe2+、Fe3+的检验
一、 铁盐和亚铁盐
1. 铁盐
(1)氧化性:含有Fe3+的溶液呈棕黄色,Fe3+具有氧化性,Fe3+与Fe、Cu反应的离子方程式分别为:________________________、______________________________。
(2)特性:含有Fe3+的盐溶液遇到KSCN溶液时变成红色。
(3)FeCl3易水解:将其饱和溶液滴入沸水中制备胶体的化学方程式为FeCl3+3H2OFe(OH)3(胶体)+3HCl。
【思维拓展】
①用FeCl3固体配制FeCl3溶液的方法:将氯化铁固体先溶于较浓的盐酸中,然后再稀释至所需浓度。
②工业上常用调节pH的方法除去溶液中的Fe3+,如可通过加入MgO或Mg(OH)2或MgCO3调节pH来除去MgCl2溶液中的Fe3+。
③FeCl3溶液加热蒸干并灼烧,所得固体主要成分为Fe2O3;在HCl气流中加热蒸干FeCl3溶液制备无水FeCl3。
④Fe3+与CO、HCO、AlO等水解呈碱性的离子不能大量共存,混合时会得到Fe(OH)3沉淀。
2. 亚铁盐
(1)Fe2+的氧化性和还原性,含有Fe2+的溶液呈________色,Fe2+处于铁的中间价态,既有氧化性,又有还原性,其中以还原性为主,如遇Br2、Cl2、H2O2、NO(H+)等均表现为还原性。
①Fe2+的酸性溶液与H2O2反应的离子方程式:______________________________。
②FeCl2溶液与HNO3溶液反应的离子方程式:______________________________________。
(2)Fe2+可发生水解反应,Fe(OH)2是弱碱,含Fe2+的盐(如硫酸亚铁)溶液呈酸性。配制硫酸亚铁溶液时常加少量硫酸抑制Fe2+的水解,加少量铁屑防止Fe2+被氧化。
二、 高铁酸盐(以K2FeO4为例)
1. 制备方法
(1)高温熔融反应法
在苛性碱存在的条件下,KNO3或过氧化物等氧化剂在高温下可将铁盐或铁的氧化物氧化成高铁酸盐。如:
Fe2O3+3K2O22K2FeO4+K2O。
(2)次氯酸盐氧化法
在NaOH溶液中,利用NaClO氧化Fe(Ⅲ)化合物,生成Na2FeO4。利用K2FeO4溶解度比Na2FeO4低,向Na2FeO4溶液中加入固体KOH或饱和KOH溶液,使Na2FeO4转化成K2FeO4,并从溶液中析出。
(3)电解法
以铁作阳极,电解高浓度的KOH溶液生成K2FeO4。
2. 性质
酸性条件下,高铁酸盐因氧化性极强而不稳定:4FeO+20H+===4Fe3++3O2↑+10H2O。
3. 在水处理方面的应用
(1)K2FeO4中Fe元素呈________价,具有强氧化性,可用于水体的________、________。
(2)原理:4K2FeO4+10H2O===8KOH+4Fe(OH)3(胶体)+3O2↑。
K2FeO4与水反应生成Fe(OH)3胶体,能吸附水体中的悬浮物,起到净水的作用。
三、 铁及其化合物的转化
1. “Fe—Fe2+—Fe3+”的“三角”转化关系
转化 化学(或离子)方程式
FeFe2+ Fe+S________Fe+Cu2+===____________Fe+2H+===____________
Fe2+Fe Fe2++Zn===____________FeO+H2____________3FeO+2Al____________
FeFe3+ 2Fe+3Cl2________Fe+4H++NO===________________(稀硝酸)
Fe3+Fe Fe2O3+3CO________________Fe2O3+2Al________________
Fe2+Fe3+ 2Fe2++Cl2===____________2Fe2++Br2===____________2Fe2++H2O2+2H+===______________4Fe2++O2+4H+===______________3Fe2++4H++NO===______________MnO+5Fe2++8H+===________________________
Fe3+Fe2+ 2Fe3++Zn===____________(Zn少量)2Fe3++Fe===____________2Fe3++Cu===______________2Fe3++2I-===______________2Fe3++H2S===______________2Fe3++SO+H2O===______________
2. 铁元素的价—类二维图
解读:
(1)横向变化体现了同价态不同物质类别(氧化物、盐、碱)之间的转化;
①碱性氧化物(Fe2O3、FeO)都能溶于酸(H+)转化为盐;
②Fe2+、Fe3+与碱(OH-)反应生成对应的碱;
③难溶性的碱加热易分解生成对应的氧化物,但难溶性的碱性氧化物一般不与水反应生成对应的碱。
(2)纵向变化体现不同价态同物质类别之间的转化,主要体现物质的氧化性或还原性。
(3)斜向变化体现不同价态、不同物质类别之间的转化,主要体现物质的氧化性和还原性。
四、 溶液中Fe2+、Fe3+的检验方法
1.
2.
3. 含Fe2+、Fe3+的混合溶液中Fe2+、Fe3+的检验
溶液变血红色,说明含有Fe3+。
酸性KMnO4溶液紫红色褪去,说明含有Fe2+。
【思维拓展】
与铁相关的除杂方法
主要成分 杂质 所加试剂及离子方程式
FeCl3(aq) FeCl2 Cl2,2Fe2++Cl2===2Cl-+2Fe3+(或H2O2溶液,2Fe2++H2O2+2H+===2Fe3++2H2O)
FeCl2(aq) FeCl3 铁粉,2Fe3++Fe===3Fe2+
FeCl2(aq) CuCl2 铁粉,Cu2++Fe===Cu+Fe2+
Fe2(SO4)3(aq) FeSO4 H2O2溶液,2Fe2++H2O2+2H+===2Fe3++2H2O
Fe Al 过量NaOH溶液,2Al+2OH-+2H2O===2AlO+3H2↑
Fe2O3 Al2O3 过量NaOH溶液,Al2O3+2OH-===2AlO+H2O
【易错辨析】
1. (2025·常熟中学)除去Fe(NO3)3中混有的Fe2+可以通入足量的氯气。( )
2. (2025·常熟抽测)聚合硫酸铁能水解并形成胶体,故可用于自来水的杀菌消毒。( )
3. K2FeO4是新型净水剂,其净水原理与明矾完全相同。 ( )
4. 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变血红,则Fe(NO3)2晶体已氧化变质。( )
5. 向FeCl2溶液中滴加酸性KMnO4溶液,若酸性KMnO4溶液褪色,证明含有Fe2+。( )
(2024·苏锡常镇二模)常温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 实验操作和现象 实验结论
A 将铁锈溶于浓盐酸,再滴入几滴酸性KMnO4溶液,振荡,溶液中未出现红色 铁锈中不含二价铁
B 向FeSO4溶液中滴加几滴新制氯水,振荡,再滴加KSCN溶液,溶液变为血红色 FeSO4溶液已经变质
C 向含有KSCN的Fe2(SO4)3溶液中加入少量K2SO4固体,振荡,溶液颜色未变化 Fe2(SO4)3与KSCN的反应不可逆
D 分别向等浓度的FeSO4和CuSO4溶液中通入H2S气体至饱和,前者无明显现象,后者出现黑色沉淀 Ksp(FeS)>Ksp(CuS)
素 养 评 估
1. 下列对铁元素的认识正确的是( )
A. 铁有两种不溶于水的氢氧化物
B. 铁在自然界中不存在单质形态
C. 铁元素是地壳中含量最多的金属元素
D. 自然界存在的铁元素均显+3价
2. 铁的常见化合价有+2价和+3价。据研究,铁在浓硝酸中发生钝化时,可生成一种化学式为Fe8O11的化合物,它可以表示为FeO和Fe2O3组成的复杂氧化物。该化合物为( )
A. FeO·3Fe2O3 B. FeO·2Fe2O3
C. 2FeO·3Fe2O3 D. 2FeO·Fe2O3
3. (2024·南通高三模拟)如图所示装置,可用以制取Fe(OH)2且观察其在空气中被氧化时颜色的变化。下列说法错误的是( )
A. 实验前,应先煮沸溶液除去溶解氧
B. 装置Ⅰ可制取FeSO4溶液并排尽装置内空气
C. 关闭止水夹可观察到装置Ⅱ中溶液进入装置Ⅰ中
D. 取下装置Ⅱ的橡皮塞可观察沉淀颜色变化
4. 下列离子的检验方法合理的是( )
A. 向某溶液中滴入KSCN溶液呈血红色,说明不含Fe2+
B. 向某溶液中通入Cl2,然后再加入KSCN溶液变血红色,说明原溶液中含有Fe2+
C. 向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有Fe3+
D. 向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+
第8讲 铁及其化合物
考点一 铁的性质
知识归纳
一、 四 化合态 陨铁 3d64s2 Ⅷ +2、+3
二、 1. 银白 磁铁
2. +2 +3 2(Fe2O3·xH2O) 红棕 Fe3O4 黑 2FeCl3 棕褐 2FeBr3
FeI2 FeS FeSO4+H2↑ Fe(NO3)3+NO↑+2H2O 3Fe(NO3)2+2NO↑+4H2O Fe3O4+4H2 3FeCl2 FeSO4+Cu
【易错辨析】
1. × 2. × 3. × 4. × 5. ×
命题突破
1. B 解析:铁与氯气在常温下不反应,因此可以用钢瓶储存液氯,铁与氯气在点燃条件下可以反应,A错误;铁能与水蒸气反应生成四氧化三铁和氢气,钢铁生产中的模具须提前进行干燥处理,以免发生危险,B正确;Fe2O3是红色的,常用作红色颜料,C错误;湿法炼铜过程中发生反应:Fe+Cu2+===Cu+Fe2+,铜离子将铁氧化为二价铁,D错误。故选B。
2. C 解析:FeS2高温下与氧气反应生成SO2,不能一步生成SO3,转化错误,故A错误;FeFeBr3,故B错误;高温水蒸气与铁反应的化学方程式为:3Fe+4H2O(g)Fe3O4+4H2,故C正确;利用铁粉从AgCl中获取Ag的离子方程式为:Fe+2AgCl===Fe2++2Ag+2Cl-,故D错误。
考点二 铁的氧化物与氢氧化物
知识归纳
一、 2. (2)FeO+2H+===Fe2++H2O Fe2O3+6H+===2Fe3++3H2O (3)3FeO+10HNO3===3Fe(NO3)3+NO↑+5H2O (4)Fe2O3+2I-+6H+===2Fe2++I2+3H2O
二、 4Fe(OH)2+O2+2H2O===4Fe(OH)3
【易错辨析】
1. × 2. × 3. × 4. × 5. ×
命题突破
1. A 解析:FeCO3作为补铁剂因为其含有+2价铁元素,A项不具有对应关系;铁粉具有还原性,可与O2发生反应,所以它作为抗氧化剂,B项具有对应关系;Fe3O4质地致密可阻止其他物质与铁反应,可用作铁件的防腐保护层,C项具有对应关系;K2FeO4具有强氧化性可对水进行消毒,同时产生的Fe3+水解产生Fe(OH)3胶体具有吸附水中悬浮杂质的作用,D项具有对应关系。
2. C 解析:氢氧化铁受热分解生成Fe2O3和水,即2Fe(OH)3Fe2O3+3H2O,可制得Fe2O3,A错误;Fe2O3无磁性,Fe3O4具有磁性,B错误;FeO不稳定,在空气里受热发生反应:6FeO+O22Fe3O4,能迅速被氧化为Fe3O4,C正确;高温下,铁能与水蒸气反应:3Fe+4H2O(g)(g)Fe3O4+4H2,即反应生成Fe3O4,D错误。故选C。
3. D 解析:Fe与水蒸气反应的固体产物是Fe3O4,A错误;K2FeO4具有强氧化性,不能作还原剂,故其不能与水反应产生H2,B错误;Fe2O3与水不反应,C错误。
考点三 铁及其化合物的转化 Fe2+、Fe3+的检验
知识归纳
一、 1. (1)2Fe3++Fe===3Fe2+ 2Fe3++Cu===2Fe2++Cu2+
2. (1)浅绿 ①2Fe2++H2O2+2H+===2Fe3++2H2O ②3Fe2++NO+4H+===3Fe3++NO↑+2H2O
二、 3. (1)+6 杀菌 消毒
三、 1. 还原性 氧化性 ①FeS ②Fe2++Cu Fe2++H2↑ Fe+Zn2+ Fe+H2O 3Fe+Al2O3 2FeCl3 Fe3++NO↑+2H2O 2Fe+3CO2 2Fe+Al2O3
2Fe3++2Cl- 2Fe3++2Br- 2Fe3++2H2O 4Fe3++2H2O 3Fe3++NO↑+2H2O 5Fe3++Mn2++4H2O 2Fe2++Zn2+ 3Fe2+ 2Fe2++Cu2+ 2Fe2++I2
2Fe2++S↓+2H+ 2Fe2++SO+2H+
四、 1. 变血红 灰绿 红褐 K++Fe2++[Fe(CN)6]3-===KFe[Fe(CN)6]↓
2. 血红 红褐色 紫
【易错辨析】
1. × 2. × 3. × 4. × 5. ×
命题突破
D 解析:浓盐酸也能与KMnO4发生反应,使溶液紫色褪去,不出现红色,A错误;向FeSO4溶液中滴入新制氯水,再滴加KSCN溶液时溶液变血红色,说明有Fe3+,但可能是变质产生的Fe3+,也有可能是原溶液中存在的Fe2+被氧化成Fe3+,B错误;溶液变成红色的原因,Fe3++3SCN-??Fe(SCN)3,与SO和K+无关,C错误;FeSO4和CuSO4组成相似,Ksp越小越容易产生沉淀,则根据选项的实验事实可得出溶度积常数:Ksp(FeS)>Ksp(CuS),D正确。故选D。
素养评估
1. A 解析:铁的氢氧化物有Fe(OH)3和Fe(OH)2,二者均为不溶于水的沉淀,A正确;陨铁中的铁以单质形态存在,B错误;铝元素是地壳中含量最多的金属元素,C错误;自然界存在的铁元素不一定显+3价,如磁铁矿石(主要成分为Fe3O4)中含有+3和+2价的铁,硫铁矿(FeS2)中的铁为+2价,D错误。故选A。
2. C 解析:FeO·3Fe2O3中铁原子和氧原子的个数比为7∶10,不符合8∶11,A不符合题意;FeO·2Fe2O3中铁原子和氧原子的个数比为5∶7,不符合8∶11,B不符合题意;2FeO·3Fe2O3中铁原子和氧原子的个数比为8∶11,C符合题意;2FeO·Fe2O3中铁原子和氧原子的个数比为4∶5,不符合8∶11,D不符合题意。故选C。
3. C 解析:溶液中会溶解少量氧气,氢氧化亚铁易被氧气氧化,所以实验前,应先煮沸溶液除去溶解氧,A正确;铁和稀H2SO4反应生成FeSO4和H2,H2能排尽装置内的空气,B正确;关闭止水夹可观察到装置Ⅰ中溶液进入装置Ⅱ中,C错误;氢氧化亚铁具有还原性,能够被氧气氧化,所以取下装置Ⅱ的橡皮塞可观察沉淀颜色变化,D正确。故选C。
4. C 解析:A项中只能说明含有Fe3+,不能说明不含Fe2+;B项原溶液中也可能只有Fe3+而没有Fe2+;D项中氧化后生成的红褐色沉淀Fe(OH)3也可能掩盖了生成的白色沉淀Mg(OH)2。故选C。
复习要求 1. 掌握铁的主要性质及应用。2. 不同价态的铁的氧化物的主要性质和用途。3. 掌握Fe(OH)2、Fe(OH)3的性质及Fe(OH)2的制备方法。4. 基于价类二维图理解铁及其化合物的转化关系。5. 了解Fe2+、Fe3+的检验方法及Fe2+、Fe3+的除杂方法。
知识体系
考点一 铁的性质
一、 铁的概述
二、 铁的性质
1. 物理性质与原子结构
铁是________色固体,熔点较高,具有良好的导热、导电、延展性,能被________吸引。其原子结构示意图:。
2. 化学性质
铁元素性质活泼,有较强的还原性,主要化合价为________价和________价。
与非金属单质反应
氧气 4Fe+3O2+2xH2O===____________(现象:在潮湿的空气中生锈,生成____色固体);3Fe+2O2______(现象:火星四射、生成____色固体)
氯气 2Fe+3Cl2______(现象:产生____色烟),无论Fe的量多少,产物都是FeCl3
溴 2Fe+3Br2______
碘 Fe+I2______
硫 Fe+S____(现象:生成黑色固体)
【易错辨析】
1. Fe与足量硫粉混合加热制取Fe2S3。( )
2. Fe分别与Cl2和盐酸反应所得氯化物相同。( )
3. 常温下可用铁质容器储存、运输浓硝酸、浓硫酸,理由是Fe与这两种酸不反应。( )
4. 铁表面自然形成的氧化层能保护内层金属不被空气氧化。( )
5. 制备溴苯时,铁粉与液溴反应生成FeBr2。( )
1. 关于铁及其化合物的说法正确的是( )
A. 铁与氯气不反应,故可用钢瓶储存液氯
B. 铁能与水蒸气反应,钢铁生产中的模具须提前进行干燥处理
C. 氢氧化铁是一种红褐色沉淀,常用作红色颜料
D. 湿法炼铜过程中,铜离子将铁氧化为三价铁
2. (2024·苏锡常镇高三一模)铁及其化合物的转化具有重要应用。下列说法正确的是( )
A. 工业制硫酸涉及的物质转化:FeS2SO3H2SO4
B. 实验室制溴苯涉及的物质转化:FeFeBr2,C6H6C6H5Br
C. 利用高温水蒸气处理铁器的化学方程式:3Fe+4H2O(g)Fe3O4+4H2
D. 利用铁粉从AgCl中获取Ag的离子方程式:Fe+2Ag+===Fe2++2Ag
考点二 铁的氧化物与氢氧化物
一、 铁的氧化物
1. 物理性质
化学式 FeO Fe2O3 Fe3O4
俗名 — 铁红 磁性氧化铁
颜色状态 黑色粉末 红棕色粉末 黑色晶体(有磁性)
续表
水溶性 不溶于水 不溶于水 不溶于水
铁的化合价 +2 +3 +2、+3
2. 化学性质
(1)FeO不稳定,在空气中受热,能迅速被氧化成Fe3O4。
(2)FeO、Fe2O3都属于碱性氧化物,能溶于强酸,分别写出它们溶于盐酸的离子方程式:________________________,________________________。
(3)写出FeO溶于过量稀硝酸的化学方程式:____________________________。
(4)写出Fe2O3溶于过量氢碘酸(HI)的离子方程式:____________________________。
(5)共同点:高温时,都能被C、CO、H2、Al等还原剂还原,生成单质铁,如:FexOy+yCOxFe+yCO2。
二、 铁的氢氧化物
化学式 Fe(OH)2 Fe(OH)3
颜色 白色 红褐色
与盐酸反应 Fe(OH)2+2H+===Fe2++2H2O Fe(OH)3+3H+===Fe3++3H2O
受热分解 — 2Fe(OH)3Fe2O3+3H2O
制法 可溶性亚铁盐与碱溶液反应:Fe2++2OH-===Fe(OH)2↓ 可溶性铁盐与碱溶液反应:Fe3++3OH-===Fe(OH)3↓
二者的关系 在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色絮状沉淀迅速变成灰绿色,最后变成红褐色,化学方程式:__________________________________________
三、 氢氧化亚铁的制备
1. 制备原理:Fe2++2OH-===Fe(OH)2↓。
2. 成功关键:溶液中不含O2等氧化性物质;制备过程中,保证生成的Fe(OH)2在密闭、隔绝空气的体系中。
3. 制备方法
方法 装置 说明
有机覆盖层法 a. 将吸有NaOH溶液的胶头滴管插到液面以下,并在液面上覆盖一层苯或煤油(不能用CCl4),以防止空气与Fe(OH)2接触发生反应。b. 用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备
氢气氛围中 先打开止水夹,用生成的氢气排尽装置中的空气,关闭止水夹,生成的硫酸亚铁溶液被压入右侧盛有氢氧化钠溶液的试管中
续表
电解法 利用电解实验可以制得纯净的Fe(OH)2白色沉淀,阳极材料为铁,阴极材料为石墨,电解NaCl(或NaOH)溶液,并在液面上覆盖苯(或煤油)
【易错辨析】
1. Fe3O4中Fe的化合价有+2价和+3价,因此Fe3O4是FeO与Fe2O3的混合物。( )
2. “指南针”中磁石的主要成分是三氧化二铁。( )
3. 取铝与氧化铁发生铝热反应后的固体,溶于适量稀硫酸,取上层清液,加KSCN溶液后无明显变化,再加入双氧水出现红色,说明固体产物中有单质铁。( )
4. Fe(OH)3在空气中加热分解生成Fe2O3,则Fe(OH)2在空气中加热分解生成FeO。( )
5. 氢氧化铁与HI溶液仅发生中和反应。( )
1. (2024·南京考前模拟)下列铁及其化合物的性质与用途不具有对应关系的是( )
A. FeCO3受热易分解,可用作补血剂
B. Fe粉具有还原性,可用作食品的抗氧化剂
C. Fe3O4质地致密,可用作铁件的防腐保护层
D. K2FeO4具有强氧化性,可用于自来水的杀菌消毒
2. 下列关于铁及其化合物的叙述正确的是( )
A. 氢氧化铁受热分解可制得Fe3O4
B. Fe2O3、Fe3O4都有磁性
C. FeO不稳定,在空气里受热,能迅速氧化成Fe3O4
D. 高温下,铁能与水蒸气反应生成Fe2O3
3. K2FeO4可用作净水剂,K2FeO4在水中不稳定,会生成Fe(OH)3胶体,碱性条件下,KClO的氧化性强于K2FeO4。下列有关铁及其化合物的相关转化,在指定条件下能实现的是( )
A. FeFe2O3Fe
B. FeCl3K2FeO4H2
C. FeCl3(aq)Fe2O3Fe(OH)3
D. FeFeCl3FeCl2
考点三 铁及其化合物的转化 Fe2+、Fe3+的检验
一、 铁盐和亚铁盐
1. 铁盐
(1)氧化性:含有Fe3+的溶液呈棕黄色,Fe3+具有氧化性,Fe3+与Fe、Cu反应的离子方程式分别为:________________________、______________________________。
(2)特性:含有Fe3+的盐溶液遇到KSCN溶液时变成红色。
(3)FeCl3易水解:将其饱和溶液滴入沸水中制备胶体的化学方程式为FeCl3+3H2OFe(OH)3(胶体)+3HCl。
【思维拓展】
①用FeCl3固体配制FeCl3溶液的方法:将氯化铁固体先溶于较浓的盐酸中,然后再稀释至所需浓度。
②工业上常用调节pH的方法除去溶液中的Fe3+,如可通过加入MgO或Mg(OH)2或MgCO3调节pH来除去MgCl2溶液中的Fe3+。
③FeCl3溶液加热蒸干并灼烧,所得固体主要成分为Fe2O3;在HCl气流中加热蒸干FeCl3溶液制备无水FeCl3。
④Fe3+与CO、HCO、AlO等水解呈碱性的离子不能大量共存,混合时会得到Fe(OH)3沉淀。
2. 亚铁盐
(1)Fe2+的氧化性和还原性,含有Fe2+的溶液呈________色,Fe2+处于铁的中间价态,既有氧化性,又有还原性,其中以还原性为主,如遇Br2、Cl2、H2O2、NO(H+)等均表现为还原性。
①Fe2+的酸性溶液与H2O2反应的离子方程式:______________________________。
②FeCl2溶液与HNO3溶液反应的离子方程式:______________________________________。
(2)Fe2+可发生水解反应,Fe(OH)2是弱碱,含Fe2+的盐(如硫酸亚铁)溶液呈酸性。配制硫酸亚铁溶液时常加少量硫酸抑制Fe2+的水解,加少量铁屑防止Fe2+被氧化。
二、 高铁酸盐(以K2FeO4为例)
1. 制备方法
(1)高温熔融反应法
在苛性碱存在的条件下,KNO3或过氧化物等氧化剂在高温下可将铁盐或铁的氧化物氧化成高铁酸盐。如:
Fe2O3+3K2O22K2FeO4+K2O。
(2)次氯酸盐氧化法
在NaOH溶液中,利用NaClO氧化Fe(Ⅲ)化合物,生成Na2FeO4。利用K2FeO4溶解度比Na2FeO4低,向Na2FeO4溶液中加入固体KOH或饱和KOH溶液,使Na2FeO4转化成K2FeO4,并从溶液中析出。
(3)电解法
以铁作阳极,电解高浓度的KOH溶液生成K2FeO4。
2. 性质
酸性条件下,高铁酸盐因氧化性极强而不稳定:4FeO+20H+===4Fe3++3O2↑+10H2O。
3. 在水处理方面的应用
(1)K2FeO4中Fe元素呈________价,具有强氧化性,可用于水体的________、________。
(2)原理:4K2FeO4+10H2O===8KOH+4Fe(OH)3(胶体)+3O2↑。
K2FeO4与水反应生成Fe(OH)3胶体,能吸附水体中的悬浮物,起到净水的作用。
三、 铁及其化合物的转化
1. “Fe—Fe2+—Fe3+”的“三角”转化关系
转化 化学(或离子)方程式
FeFe2+ Fe+S________Fe+Cu2+===____________Fe+2H+===____________
Fe2+Fe Fe2++Zn===____________FeO+H2____________3FeO+2Al____________
FeFe3+ 2Fe+3Cl2________Fe+4H++NO===________________(稀硝酸)
Fe3+Fe Fe2O3+3CO________________Fe2O3+2Al________________
Fe2+Fe3+ 2Fe2++Cl2===____________2Fe2++Br2===____________2Fe2++H2O2+2H+===______________4Fe2++O2+4H+===______________3Fe2++4H++NO===______________MnO+5Fe2++8H+===________________________
Fe3+Fe2+ 2Fe3++Zn===____________(Zn少量)2Fe3++Fe===____________2Fe3++Cu===______________2Fe3++2I-===______________2Fe3++H2S===______________2Fe3++SO+H2O===______________
2. 铁元素的价—类二维图
解读:
(1)横向变化体现了同价态不同物质类别(氧化物、盐、碱)之间的转化;
①碱性氧化物(Fe2O3、FeO)都能溶于酸(H+)转化为盐;
②Fe2+、Fe3+与碱(OH-)反应生成对应的碱;
③难溶性的碱加热易分解生成对应的氧化物,但难溶性的碱性氧化物一般不与水反应生成对应的碱。
(2)纵向变化体现不同价态同物质类别之间的转化,主要体现物质的氧化性或还原性。
(3)斜向变化体现不同价态、不同物质类别之间的转化,主要体现物质的氧化性和还原性。
四、 溶液中Fe2+、Fe3+的检验方法
1.
2.
3. 含Fe2+、Fe3+的混合溶液中Fe2+、Fe3+的检验
溶液变血红色,说明含有Fe3+。
酸性KMnO4溶液紫红色褪去,说明含有Fe2+。
【思维拓展】
与铁相关的除杂方法
主要成分 杂质 所加试剂及离子方程式
FeCl3(aq) FeCl2 Cl2,2Fe2++Cl2===2Cl-+2Fe3+(或H2O2溶液,2Fe2++H2O2+2H+===2Fe3++2H2O)
FeCl2(aq) FeCl3 铁粉,2Fe3++Fe===3Fe2+
FeCl2(aq) CuCl2 铁粉,Cu2++Fe===Cu+Fe2+
Fe2(SO4)3(aq) FeSO4 H2O2溶液,2Fe2++H2O2+2H+===2Fe3++2H2O
Fe Al 过量NaOH溶液,2Al+2OH-+2H2O===2AlO+3H2↑
Fe2O3 Al2O3 过量NaOH溶液,Al2O3+2OH-===2AlO+H2O
【易错辨析】
1. (2025·常熟中学)除去Fe(NO3)3中混有的Fe2+可以通入足量的氯气。( )
2. (2025·常熟抽测)聚合硫酸铁能水解并形成胶体,故可用于自来水的杀菌消毒。( )
3. K2FeO4是新型净水剂,其净水原理与明矾完全相同。 ( )
4. 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变血红,则Fe(NO3)2晶体已氧化变质。( )
5. 向FeCl2溶液中滴加酸性KMnO4溶液,若酸性KMnO4溶液褪色,证明含有Fe2+。( )
(2024·苏锡常镇二模)常温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 实验操作和现象 实验结论
A 将铁锈溶于浓盐酸,再滴入几滴酸性KMnO4溶液,振荡,溶液中未出现红色 铁锈中不含二价铁
B 向FeSO4溶液中滴加几滴新制氯水,振荡,再滴加KSCN溶液,溶液变为血红色 FeSO4溶液已经变质
C 向含有KSCN的Fe2(SO4)3溶液中加入少量K2SO4固体,振荡,溶液颜色未变化 Fe2(SO4)3与KSCN的反应不可逆
D 分别向等浓度的FeSO4和CuSO4溶液中通入H2S气体至饱和,前者无明显现象,后者出现黑色沉淀 Ksp(FeS)>Ksp(CuS)
素 养 评 估
1. 下列对铁元素的认识正确的是( )
A. 铁有两种不溶于水的氢氧化物
B. 铁在自然界中不存在单质形态
C. 铁元素是地壳中含量最多的金属元素
D. 自然界存在的铁元素均显+3价
2. 铁的常见化合价有+2价和+3价。据研究,铁在浓硝酸中发生钝化时,可生成一种化学式为Fe8O11的化合物,它可以表示为FeO和Fe2O3组成的复杂氧化物。该化合物为( )
A. FeO·3Fe2O3 B. FeO·2Fe2O3
C. 2FeO·3Fe2O3 D. 2FeO·Fe2O3
3. (2024·南通高三模拟)如图所示装置,可用以制取Fe(OH)2且观察其在空气中被氧化时颜色的变化。下列说法错误的是( )
A. 实验前,应先煮沸溶液除去溶解氧
B. 装置Ⅰ可制取FeSO4溶液并排尽装置内空气
C. 关闭止水夹可观察到装置Ⅱ中溶液进入装置Ⅰ中
D. 取下装置Ⅱ的橡皮塞可观察沉淀颜色变化
4. 下列离子的检验方法合理的是( )
A. 向某溶液中滴入KSCN溶液呈血红色,说明不含Fe2+
B. 向某溶液中通入Cl2,然后再加入KSCN溶液变血红色,说明原溶液中含有Fe2+
C. 向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有Fe3+
D. 向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+
第8讲 铁及其化合物
考点一 铁的性质
知识归纳
一、 四 化合态 陨铁 3d64s2 Ⅷ +2、+3
二、 1. 银白 磁铁
2. +2 +3 2(Fe2O3·xH2O) 红棕 Fe3O4 黑 2FeCl3 棕褐 2FeBr3
FeI2 FeS FeSO4+H2↑ Fe(NO3)3+NO↑+2H2O 3Fe(NO3)2+2NO↑+4H2O Fe3O4+4H2 3FeCl2 FeSO4+Cu
【易错辨析】
1. × 2. × 3. × 4. × 5. ×
命题突破
1. B 解析:铁与氯气在常温下不反应,因此可以用钢瓶储存液氯,铁与氯气在点燃条件下可以反应,A错误;铁能与水蒸气反应生成四氧化三铁和氢气,钢铁生产中的模具须提前进行干燥处理,以免发生危险,B正确;Fe2O3是红色的,常用作红色颜料,C错误;湿法炼铜过程中发生反应:Fe+Cu2+===Cu+Fe2+,铜离子将铁氧化为二价铁,D错误。故选B。
2. C 解析:FeS2高温下与氧气反应生成SO2,不能一步生成SO3,转化错误,故A错误;FeFeBr3,故B错误;高温水蒸气与铁反应的化学方程式为:3Fe+4H2O(g)Fe3O4+4H2,故C正确;利用铁粉从AgCl中获取Ag的离子方程式为:Fe+2AgCl===Fe2++2Ag+2Cl-,故D错误。
考点二 铁的氧化物与氢氧化物
知识归纳
一、 2. (2)FeO+2H+===Fe2++H2O Fe2O3+6H+===2Fe3++3H2O (3)3FeO+10HNO3===3Fe(NO3)3+NO↑+5H2O (4)Fe2O3+2I-+6H+===2Fe2++I2+3H2O
二、 4Fe(OH)2+O2+2H2O===4Fe(OH)3
【易错辨析】
1. × 2. × 3. × 4. × 5. ×
命题突破
1. A 解析:FeCO3作为补铁剂因为其含有+2价铁元素,A项不具有对应关系;铁粉具有还原性,可与O2发生反应,所以它作为抗氧化剂,B项具有对应关系;Fe3O4质地致密可阻止其他物质与铁反应,可用作铁件的防腐保护层,C项具有对应关系;K2FeO4具有强氧化性可对水进行消毒,同时产生的Fe3+水解产生Fe(OH)3胶体具有吸附水中悬浮杂质的作用,D项具有对应关系。
2. C 解析:氢氧化铁受热分解生成Fe2O3和水,即2Fe(OH)3Fe2O3+3H2O,可制得Fe2O3,A错误;Fe2O3无磁性,Fe3O4具有磁性,B错误;FeO不稳定,在空气里受热发生反应:6FeO+O22Fe3O4,能迅速被氧化为Fe3O4,C正确;高温下,铁能与水蒸气反应:3Fe+4H2O(g)(g)Fe3O4+4H2,即反应生成Fe3O4,D错误。故选C。
3. D 解析:Fe与水蒸气反应的固体产物是Fe3O4,A错误;K2FeO4具有强氧化性,不能作还原剂,故其不能与水反应产生H2,B错误;Fe2O3与水不反应,C错误。
考点三 铁及其化合物的转化 Fe2+、Fe3+的检验
知识归纳
一、 1. (1)2Fe3++Fe===3Fe2+ 2Fe3++Cu===2Fe2++Cu2+
2. (1)浅绿 ①2Fe2++H2O2+2H+===2Fe3++2H2O ②3Fe2++NO+4H+===3Fe3++NO↑+2H2O
二、 3. (1)+6 杀菌 消毒
三、 1. 还原性 氧化性 ①FeS ②Fe2++Cu Fe2++H2↑ Fe+Zn2+ Fe+H2O 3Fe+Al2O3 2FeCl3 Fe3++NO↑+2H2O 2Fe+3CO2 2Fe+Al2O3
2Fe3++2Cl- 2Fe3++2Br- 2Fe3++2H2O 4Fe3++2H2O 3Fe3++NO↑+2H2O 5Fe3++Mn2++4H2O 2Fe2++Zn2+ 3Fe2+ 2Fe2++Cu2+ 2Fe2++I2
2Fe2++S↓+2H+ 2Fe2++SO+2H+
四、 1. 变血红 灰绿 红褐 K++Fe2++[Fe(CN)6]3-===KFe[Fe(CN)6]↓
2. 血红 红褐色 紫
【易错辨析】
1. × 2. × 3. × 4. × 5. ×
命题突破
D 解析:浓盐酸也能与KMnO4发生反应,使溶液紫色褪去,不出现红色,A错误;向FeSO4溶液中滴入新制氯水,再滴加KSCN溶液时溶液变血红色,说明有Fe3+,但可能是变质产生的Fe3+,也有可能是原溶液中存在的Fe2+被氧化成Fe3+,B错误;溶液变成红色的原因,Fe3++3SCN-??Fe(SCN)3,与SO和K+无关,C错误;FeSO4和CuSO4组成相似,Ksp越小越容易产生沉淀,则根据选项的实验事实可得出溶度积常数:Ksp(FeS)>Ksp(CuS),D正确。故选D。
素养评估
1. A 解析:铁的氢氧化物有Fe(OH)3和Fe(OH)2,二者均为不溶于水的沉淀,A正确;陨铁中的铁以单质形态存在,B错误;铝元素是地壳中含量最多的金属元素,C错误;自然界存在的铁元素不一定显+3价,如磁铁矿石(主要成分为Fe3O4)中含有+3和+2价的铁,硫铁矿(FeS2)中的铁为+2价,D错误。故选A。
2. C 解析:FeO·3Fe2O3中铁原子和氧原子的个数比为7∶10,不符合8∶11,A不符合题意;FeO·2Fe2O3中铁原子和氧原子的个数比为5∶7,不符合8∶11,B不符合题意;2FeO·3Fe2O3中铁原子和氧原子的个数比为8∶11,C符合题意;2FeO·Fe2O3中铁原子和氧原子的个数比为4∶5,不符合8∶11,D不符合题意。故选C。
3. C 解析:溶液中会溶解少量氧气,氢氧化亚铁易被氧气氧化,所以实验前,应先煮沸溶液除去溶解氧,A正确;铁和稀H2SO4反应生成FeSO4和H2,H2能排尽装置内的空气,B正确;关闭止水夹可观察到装置Ⅰ中溶液进入装置Ⅱ中,C错误;氢氧化亚铁具有还原性,能够被氧气氧化,所以取下装置Ⅱ的橡皮塞可观察沉淀颜色变化,D正确。故选C。
4. C 解析:A项中只能说明含有Fe3+,不能说明不含Fe2+;B项原溶液中也可能只有Fe3+而没有Fe2+;D项中氧化后生成的红褐色沉淀Fe(OH)3也可能掩盖了生成的白色沉淀Mg(OH)2。故选C。
同课章节目录
