第12讲 氮及其化合物 学案(含答案)2026届高三化学一轮总复习
文档属性
| 名称 | 第12讲 氮及其化合物 学案(含答案)2026届高三化学一轮总复习 |  | |
| 格式 | doc | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-27 09:27:47 | ||
图片预览


文档简介
第12讲 氮及其化合物
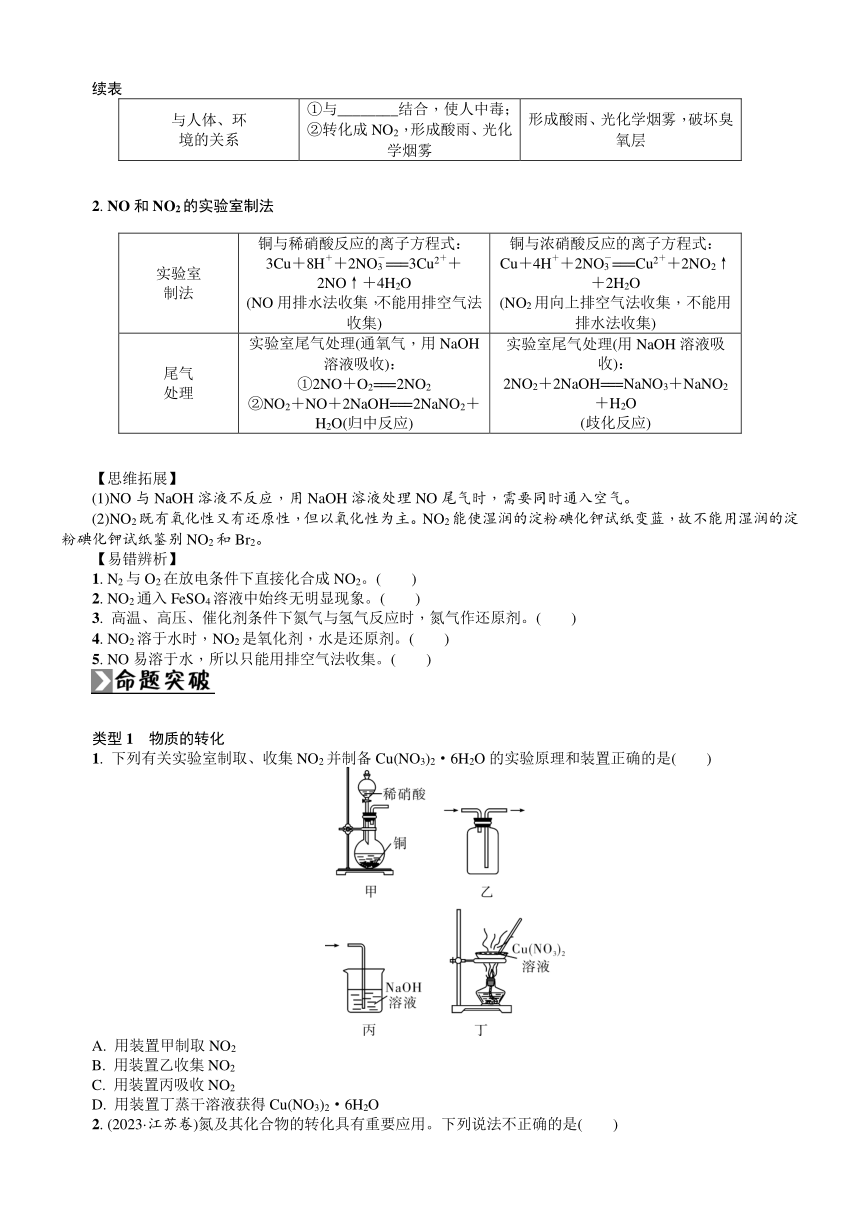
复习要求 1. 了解氮及其氧化物的主要性质及应用。2. 了解氮循环对生态平衡的重要作用。3. 掌握NH3及铵盐的性质与用途。4. 掌握喷泉实验、NH3的实验室制法的原理及操作。5. 了解浓硝酸、稀硝酸的性质,了解工业上生产硝酸的原理。6. 从含氮物质的性质及转化的视角分析酸雨和雾霾的成因、危害与防治。
知识体系
考点一 氮及其氧化物
一、 自然界中氮元素的存在和氮的固定
“固氮”:将________态氮(即N2)转化为________态氮的过程。
二、 氮气
1. N2的结构
电子式:________,结构式:________,N2分子中有1个σ键、2个π键。
2. 物理性质
氮气是________色、________味、________溶于水的气体。
3. 化学性质
三、 氮的氧化物
1. 氮的多种氧化物:2O、O、2O3、O2、2O4、2O5。
(1)N2O俗称笑气,可以致人发笑,有轻微麻醉作用。
(2)N2O3、N2O5是HNO2、HNO3对应的酸性氧化物(或酸酐)。
(3)NO2与N2O4可相互转化2NO2??N2O4。
(4)NO与NO2的比较
NO NO2
颜色 无色 ________色
毒性 有毒 有毒
溶解性 不溶于水 易溶于水
与O2或与H2O反应 ______________________________ ________________________________
收集方法 ________ ____________
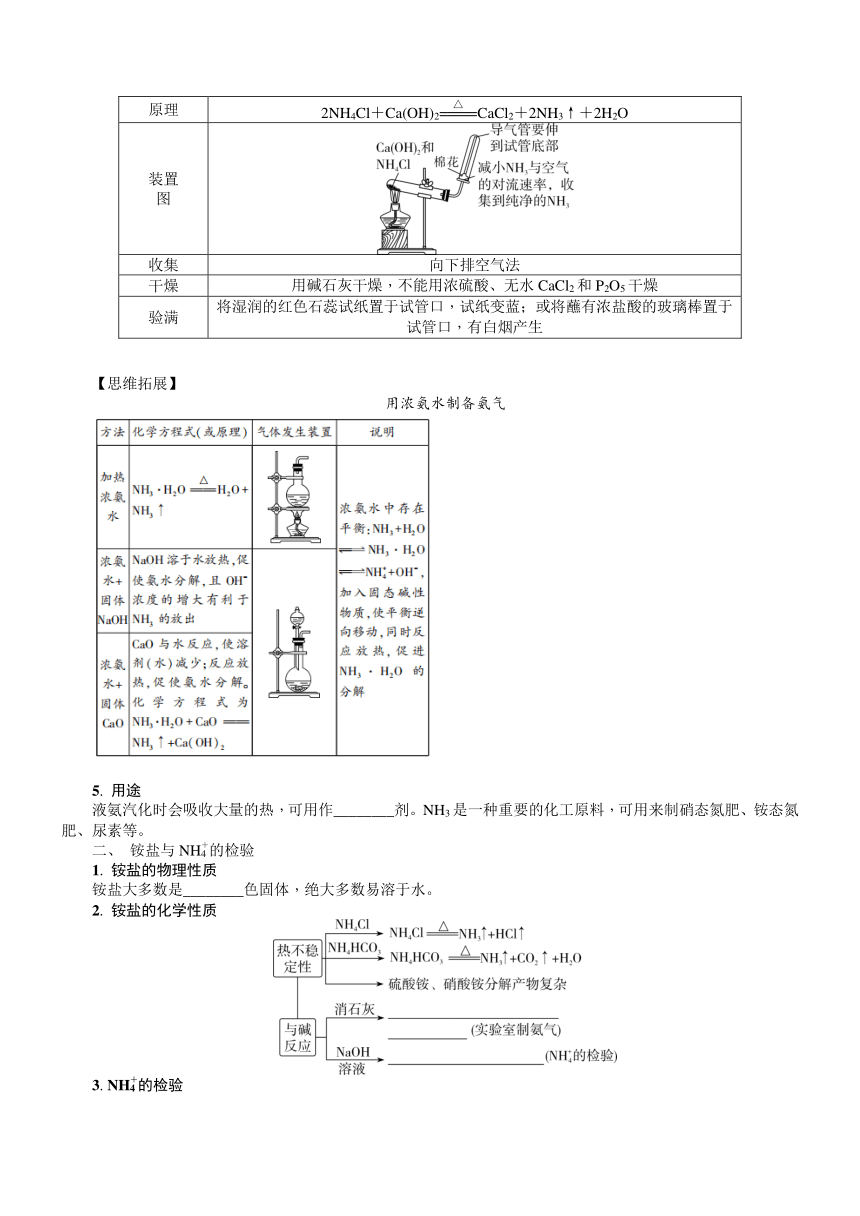
续表
与人体、环境的关系 ①与________结合,使人中毒;②转化成NO2,形成酸雨、光化学烟雾 形成酸雨、光化学烟雾,破坏臭氧层
2. NO和NO2的实验室制法
实验室制法 铜与稀硝酸反应的离子方程式:3Cu+8H++2NO===3Cu2++2NO↑+4H2O(NO用排水法收集,不能用排空气法收集) 铜与浓硝酸反应的离子方程式:Cu+4H++2NO===Cu2++2NO2↑+2H2O(NO2用向上排空气法收集,不能用排水法收集)
尾气处理 实验室尾气处理(通氧气,用NaOH溶液吸收):①2NO+O2===2NO2②NO2+NO+2NaOH===2NaNO2+H2O(归中反应) 实验室尾气处理(用NaOH溶液吸收):2NO2+2NaOH===NaNO3+NaNO2+H2O(歧化反应)
【思维拓展】
(1)NO与NaOH溶液不反应,用NaOH溶液处理NO尾气时,需要同时通入空气。
(2)NO2既有氧化性又有还原性,但以氧化性为主。NO2能使湿润的淀粉碘化钾试纸变蓝,故不能用湿润的淀粉碘化钾试纸鉴别NO2和Br2。
【易错辨析】
1. N2与O2在放电条件下直接化合成NO2。( )
2. NO2通入FeSO4溶液中始终无明显现象。( )
3. 高温、高压、催化剂条件下氮气与氢气反应时,氮气作还原剂。( )
4. NO2溶于水时,NO2是氧化剂,水是还原剂。( )
5. NO易溶于水,所以只能用排空气法收集。( )
类型1 物质的转化
1. 下列有关实验室制取、收集NO2并制备Cu(NO3)2·6H2O的实验原理和装置正确的是( )
A. 用装置甲制取NO2
B. 用装置乙收集NO2
C. 用装置丙吸收NO2
D. 用装置丁蒸干溶液获得Cu(NO3)2·6H2O
2. (2023·江苏卷)氮及其化合物的转化具有重要应用。下列说法不正确的是( )
A. 实验室探究稀硝酸与铜反应的气态产物:HNO3(稀)NONO2
B. 工业制硝酸过程中的物质转化:N2NOHNO3
C. 汽车尾气催化转化器中发生的主要反应:2NO+2CON2+2CO2
D. 实验室制备少量NH3的原理:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
类型2 微工艺流程
3. 用石灰乳吸收硝酸工业的尾气(含NO、NO2)可获得Ca(NO2)2,其部分工艺流程如下。下列说法不正确的是( )
A. 吸收时主要反应的化学方程式为NO+NO2+Ca(OH)2===Ca(NO2)2+H2O
B. 将石灰乳改为澄清石灰水吸收效率将会增大
C. 采用气液逆流接触有利于尾气中NO、NO2的充分吸收
D. 若尾气中n(NO2)∶n(NO)<1∶1,吸收后排放的气体中NO含量升高
考点二 氨和铵盐
一、 氨气
1. 分子结构
(1)NH3分子中氮原子的杂化类型为sp3。
(2)H—N—H的键角为107°(人教版)或107°18′(苏教版)。
(3)氨气的电子式为HN,H H。
(4)氨气分子中,氮原子上有一个孤电子对,故氨气分子常作为配合物的配体。
(5)氨气是极性分子,属于分子晶体。
2. 物理性质
氨气是一种无色、________气味的气体,密度比空气小,熔、沸点低,易液化。氨气分子间能形成氢键,氨气分子与水分子间也能形成氢键,故氨气________溶于水,1体积水可溶解700体积的氨气。
3. 化学性质
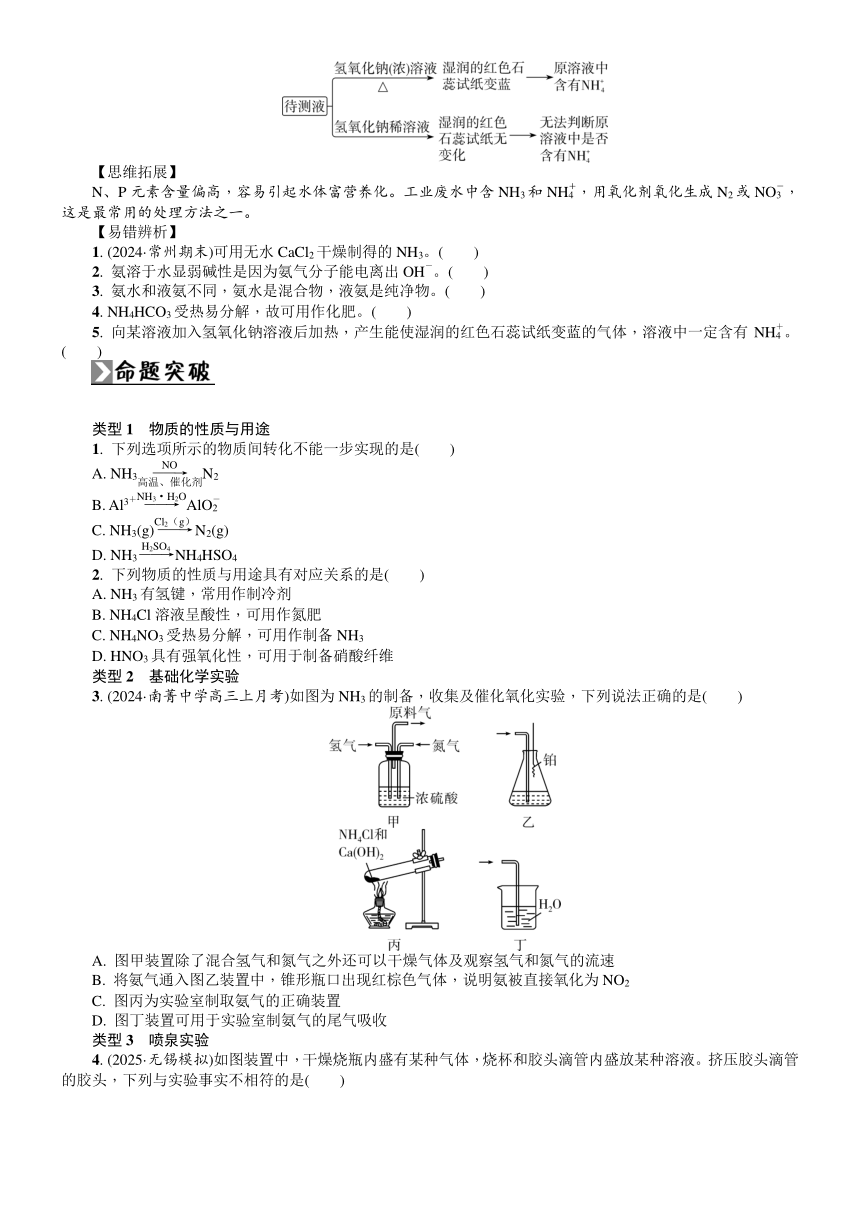
4. 实验室制法(固体+固体气体)
原理 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
装置图
收集 向下排空气法
干燥 用碱石灰干燥,不能用浓硫酸、无水CaCl2和P2O5干燥
验满 将湿润的红色石蕊试纸置于试管口,试纸变蓝;或将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生
【思维拓展】
用浓氨水制备氨气
5. 用途
液氨汽化时会吸收大量的热,可用作________剂。NH3是一种重要的化工原料,可用来制硝态氮肥、铵态氮肥、尿素等。
二、 铵盐与NH的检验
1. 铵盐的物理性质
铵盐大多数是________色固体,绝大多数易溶于水。
2. 铵盐的化学性质
3. NH的检验
【思维拓展】
N、P元素含量偏高,容易引起水体富营养化。工业废水中含NH3和NH,用氧化剂氧化生成N2或NO,这是最常用的处理方法之一。
【易错辨析】
1. (2024·常州期末)可用无水CaCl2干燥制得的NH3。( )
2. 氨溶于水显弱碱性是因为氨气分子能电离出OH-。( )
3. 氨水和液氨不同,氨水是混合物,液氨是纯净物。( )
4. NH4HCO3受热易分解,故可用作化肥。( )
5. 向某溶液加入氢氧化钠溶液后加热,产生能使湿润的红色石蕊试纸变蓝的气体,溶液中一定含有NH。( )
类型1 物质的性质与用途
1. 下列选项所示的物质间转化不能一步实现的是( )
A. NH3N2
B. Al3+AlO
C. NH3(g)N2(g)
D. NH3NH4HSO4
2. 下列物质的性质与用途具有对应关系的是( )
A. NH3有氢键,常用作制冷剂
B. NH4Cl溶液呈酸性,可用作氮肥
C. NH4NO3受热易分解,可用作制备NH3
D. HNO3具有强氧化性,可用于制备硝酸纤维
类型2 基础化学实验
3. (2024·南菁中学高三上月考)如图为NH3的制备,收集及催化氧化实验,下列说法正确的是( )
A. 图甲装置除了混合氢气和氮气之外还可以干燥气体及观察氢气和氮气的流速
B. 将氨气通入图乙装置中,锥形瓶口出现红棕色气体,说明氨被直接氧化为NO2
C. 图丙为实验室制取氨气的正确装置
D. 图丁装置可用于实验室制氨气的尾气吸收
类型3 喷泉实验
4. (2025·无锡模拟)如图装置中,干燥烧瓶内盛有某种气体,烧杯和胶头滴管内盛放某种溶液。挤压胶头滴管的胶头,下列与实验事实不相符的是( )
A. CO2(NaHCO3溶液)/无色喷泉
B. NH3(H2O中含酚酞)/红色喷泉
C. NH3(H2O中含甲基橙)/黄色喷泉
D. HCl(AgNO3溶液)/白色喷泉
考点三 硝酸
一、 物理性质
纯硝酸和浓硝酸(质量分数为69%)均是________色透明液体,有________气味,________挥发。HNO3可以形成分子内氢键,硝酸与水分子间也可形成氢键,二者可以任意比例混溶。
二、 化学性质
(1)不稳定性
反应:____________________________________。
(2)强氧化性
硝酸无论浓、稀都具有强氧化性,而且浓度越大,氧化性越强。
①与金属反应
稀硝酸与铜反应的化学方程式:________________________________;
浓硝酸与铜反应的化学方程式:________________________________。
②与非金属反应
浓硝酸与C反应的化学方程式:________________________________。
③与还原性化合物反应
硝酸可氧化H2S、SO2、Na2SO3、HI、Fe2+等还原性物质。
稀硝酸与FeSO4溶液反应的离子方程式:________________________________。
(3)与有机物反应
①硝化反应(与反应):________________________________________________。
②颜色反应:含有苯环的蛋白质遇到浓硝酸加热后变黄色。
【思维拓展】
a. 非金属单质+浓硝酸―→最高价氧化物或其含氧酸+NO2+H2O。
b. 由于硝酸能氧化HI、HBr、SO2,故不能用硝酸制备HI、HBr、SO2气体。
c. 由于S2-、HS-、SO、HSO、I-、Fe2+等均能被HNO3氧化,故在酸性条件下,NO不能与上述还原性离子共存。
三、 工业生产中的物质转化
工业生产中的物质转化 主要原料 主要原理 尾气处理
NH3→NO→NO2→HNO3 氨气、空气、水 ①4NH3+5O2 4NO+6H2O②2NO+O2===2NO2③3NO2+H2O===2HNO3+NO 用NaOH等碱液吸收
【思维拓展】
(1)金属与硝酸反应计算的思维流程
(2)金属与硝酸反应的规律
本质 HNO3中+5价氮元素具有很强的得电子能力
规律 硝酸的浓度越大,反应温度越高,氧化性越强
续表
【易错辨析】
1. (2025·扬州中学)用蘸有浓氨水的玻璃棒靠近试剂瓶瓶口,试剂瓶瓶口有白烟生成,该试剂瓶中盛装的是浓硝酸。( )
2. 常温下,铁、铝在浓硝酸中的钝化为化学变化。( )
3. 实验室可用活泼金属与硝酸反应制取氢气。( )
4. 浓HNO3溅到皮肤上,皮肤会变黄。( )
5. (2024·苏北四市一模)将灼热的木炭加入浓硝酸中,有红棕色气体产生,说明木炭在加热条件下能与浓硝酸反应。( )
类型1 物质的转化
1. 在指定条件下,下列选项所示的物质间转化能实现的是( )
A. NO(g)HNO3(aq)
B. 稀HNO3(aq)NO2
C. NO2(g)N2(g)
D. NO(aq)NO(aq)
类型2 硝酸的性质
2. 下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
① ② ③
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 由②中的红棕色气体不能表明木炭与浓硝酸发生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
类型3 物质的性质与用途
3. (2024·江苏各地模拟重组)下列氮及其化合物的性质与用途具有对应关系的是( )
A. HNO3易挥发,可用来制备硝酸纤维
B. HNO3有酸性,可用于洗涤附有银镜的试管
C. HNO3具有强氧化性,可用于制备硝酸铵
D. NH3具有还原性,可用作制备NF3
素 养 评 估
1. 选择性催化还原技术是一种以NH3作为还原剂,将烟气中NOx分解成无害的N2和H2O的干法脱硝技术,反应原理为
①6NO+4NH35N2+6H2O;
②6NO2+8NH37N2+12H2O;
③NO+NO2+2NH3===2N2+3H2O。
下列说法正确的是( )
A. NO2为酸性氧化物
B. 氮气性质不活泼,其原因是氮元素的非金属性较弱
C. 反应③中标准状况下每生成22.4 L N2,转移电子数为1.5NA
D. NO→NO2→HNO3,以上各步变化均能通过一步完成
2. 如图所示,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。表中对应的实验现象及解释正确的是( )
选项 实验现象 解释
A 浓盐酸附近产生白烟 NH3与浓盐酸挥发出的HCl反应产生了NH4Cl固体
B 浓硫酸附近无明显现象 NH3与浓硫酸不发生反应
C 氯化铝溶液先浑浊再澄清 氢氧化铝沉淀溶解
D 干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝 氨气属于碱
3. “封管实验”具有简易、方便、节约、绿色等优点,关于如图所示三个“封管实验”(夹持装置未画出)的说法正确的是( )
A. 加热时,①中试管上部汇集了固体
B. 加热时,②中溶液变红,冷却后又变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红
D. 三个“封管实验”中所发生的化学反应都是可逆反应
4. 硝酸被称为“国防工业之母”,是因为它是制取炸药的重要原料。下列实验事实与硝酸的性质不相对应的是( )
A. 浓硝酸使紫色石蕊溶液先变红后褪色——酸性和强氧化性
B. 不能用稀硝酸与锌反应制氢气——强氧化性
C. 要用棕色瓶盛装浓硝酸——不稳定性
D. 能使滴有酚酞的氢氧化钠溶液的红色褪去——强氧化性
第12讲 氮及其化合物
考点一 氮及其氧化物
知识归纳
一、 游离 化合 游离 自然 人工 化合
二、 1. NN NN
2. 无 无 难
三、 1. (4)红棕 2NO+O2===2NO2 3NO2+H2O===2HNO3+NO 排水法 向上排空气法 ①血红蛋白
【易错辨析】
1. × 2. × 3. × 4. × 5. ×
命题突破
1. C 解析:稀硝酸与铜反应生成硝酸铜、一氧化氮和水,不可能生成二氧化氮,故A错误;二氧化氮的密度大于空气,应从长导气管通入,故B错误;二氧化氮与氢氧化钠溶液反应生成硝酸钠、亚硝酸钠和水,则用氢氧化钠溶液能吸收二氧化氮,防止污染空气,故C正确;硝酸铜是强酸弱碱盐,溶液蒸干时铜离子水解、硝酸挥发和分解导致无法制得六水硝酸铜,故D错误。
2. B 解析:Cu与稀硝酸的反应产物之一为NO,NO与氧气发生反应2NO+O2===2NO2生成NO2,A正确;氮气与氧气在高温条件下生成NO,但NO无法与水发生化学反应,B错误;汽车尾气催化转化器主要将污染气体NO、CO转化为无污染的气体,故该反应方程式为2NO+2CON2+2CO2,C正确;实验室利用熟石灰和氯化铵制备少量NH3,化学方程式为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O,D正确。
3. B 解析:该工艺中NO和NO2物质的量之比接近1∶1,原理为:NO+NO2+Ca(OH)2===Ca(NO2)2+H2O;若n(NO)∶n(NO2)>1∶1,发生反应NO+NO2+Ca(OH)2===Ca(NO2)2+H2O,多余的NO无法被Ca(OH)2吸收,造成排放气体中NO含量升高;若n(NO)∶n(NO2)<1∶1,二氧化氮过量,被Ca(OH)2吸收,则发生了4NO2+2Ca(OH)2===Ca(NO3)2+Ca(NO2)2+2H2O,产品中Ca(NO3)2含量升高。根据分析过程,该工艺中NO和NO2物质的量之比接近1∶1,可以提高Ca(NO2)2的产率及纯度,吸收时主要反应的化学方程式为NO+NO2+Ca(OH)2===Ca(NO2)2+H2O,故A正确;石灰乳更利于气体附着,改为澄清石灰水吸收效率将会降低,故B错误;采用气液逆流接触,增大了气体和石灰乳的接触面积,有利于尾气中NO、NO2的充分吸收,故C正确;尾气中n(NO2)∶n(NO)<1∶1,发生反应NO+NO2+Ca(OH)2===Ca(NO2)2+H2O,多余的NO无法被Ca(OH)2吸收,造成排放气体中NO含量升高,故D正确。
考点二 氨和铵盐
知识归纳
一、 2. 有刺激性 极易
3. Al(OH)3↓+3NH 4NH3+5O24NO+6H2O 2NH3+3CuO3Cu+N2+3H2O
5. 制冷
二、 1. 白
2. 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O NH+OH-NH3↑+H2O
【易错辨析】
1. × 2. × 3. √ 4. × 5. √
命题突破
1. B 解析:Al(OH)3不溶于氨水,故Al3+与氨水反应不能一步生成AlO,B符合题意。
2. A 解析:NH3分子间形成氢键,沸点较高,氨气易液化,液氨汽化时吸热常用作制冷剂,A符合题意;NH4Cl中含有植物所需的N元素,可用作氮肥,与其酸性无关,B不符合题意;NH4NO3受热易发生爆炸,且分解产物不一定产生氨气,一般不用作制氨气,C不符合题意;HNO3与纤维素能发生酯化反应生成硝酸纤维,与其强氧化性无关,D不符合题意。
3. A 解析:浓硫酸有吸水性,可干燥氢气和氮气,同时可由气体经过液体产生的气泡快慢来观察气体流速,A正确;瓶口出现红棕色气体,为NO被氧气氧化为NO2,不是直接产生的,B错误;加热固体药品时,试管口应略向下,C错误;氨气极易溶于水,发生倒吸,造成实验安全问题,D错误。
4. A 解析:因NaHCO3溶液抑制CO2的溶解,则挤压胶头滴管,气压变化不明显,则不会形成喷泉,故A错误;因氨极易溶于水,则挤压胶头滴管,使烧瓶中的气压减小,且小于外界大气压,又因氨水显碱性,酚酞遇碱变红,甲基橙遇碱变黄,故B中形成红色喷泉,C中形成黄色喷泉,故B、C正确;因HCl与AgNO3溶液反应生成白色的AgCl沉淀,则挤压胶头滴管,使烧瓶中的气压减小,且小于外界大气压,形成白色喷泉,故D正确。
考点三 硝酸
知识归纳
一、 无 刺激性 易
二、 (1)4HNO32H2O+4NO2↑+O2↑ (2)①3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O ②C+4HNO3(浓)CO2↑+4NO2↑+2H2O ③3Fe2++4H++NO===3Fe3++NO↑+2H2O
(3)①+HNO3NO2+H2O
【易错辨析】
1. × 2. √ 3. × 4. √ 5. ×
命题突破
1. C 解析:NO不与H2O反应,A不符合题意;稀HNO3与Cu反应生成NO,3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O,B不符合题意;发生反应为6NO2+8NH3===7N2+12H2O,能实现转化,C符合题意;NO中的N为最高价+5价,O3为氧化剂,因此不能生成N2,D不符合题意。
2. D 解析:①中的红棕色气体是NO2,N元素化合价降低,根据氧化还原反应规律,一定有元素化合价升高,推断产生的气体中还一定有O2,故A正确;浓硝酸受热易分解,②中的红棕色气体可能是硝酸分解产生,不能说明木炭与浓硝酸发生了反应,故B正确;硝酸中N元素化合价为+5价,生成二氧化氮中N元素化合价为+4价,化合价降低,所以生成的红棕色气体为还原产物,故C正确;③的气体产物中检测出CO2,CO2可能是C和氧气反应生成的产物,故D错误。故选D。
3. D 解析:HNO3能与纤维素发生酯化反应,可用来制备硝酸纤维,与其挥发性无关,A错误;HNO3有氧化性,可用于洗涤附有银镜的试管,与其酸性无关,B错误;HNO3与NH3反应制备NH4NO3的反应是非氧化还原反应,与HNO3的强氧化性无关,C错误;NH3中N元素为-3价,NF3中N元素为+3价,N元素被氧化,NH3具有还原性,可用作制备NF3,D正确。
素养评估
1. D 解析:NO2和氢氧化钠反应生成硝酸钠、亚硝酸钠和水,NO2不是酸性氧化物,A错误;氮气性质不活泼,其原因是氮气分子中含有氮氮三键,B错误;反应③中生成2 mol N2转移6 mol电子,标准状况下每生成22.4 L N2,转移电子数为3NA,C错误;NO→NO2→HNO3,NO和O2反应生成NO2,NO2和水反应生成HNO3和NO,D正确。故选D。
2. A 解析:NaOH固体溶于水放热,氨水易挥发,实验时向NaOH固体上滴几滴浓氨水,会产生氨气,与浓盐酸挥发出的HCl反应生成氯化铵固体,反应现象是产生白烟,A正确;氨气为碱性气体,与浓硫酸发生反应生成硫酸铵,由于浓硫酸不挥发,该反应无明显现象,B错误;氨气溶于水形成NH3·H2O,NH3·H2O与氯化铝在溶液中发生复分解反应生成氢氧化铝和NH4Cl,NH3·H2O为弱碱,不能溶解氢氧化铝沉淀,故氯化铝溶液变浑浊后不会变澄清,C错误;氨气使湿润的红色石蕊试纸变蓝的原因是氨气与水反应生成NH3·H2O,NH3·H2O电离出OH-,使溶液呈碱性,氨气为非电解质,不属于碱,D错误。故选A。
3. A 解析:加热氯化铵分解,在①中试管上部HCl与氨气化合生成氯化铵,A正确;氨气的水溶液显碱性,加热时氨气逸出,酚酞溶液褪色,冷却时氨气溶于酚酞溶液,溶液显红色,B错误;二氧化硫可使品红褪色,化合生成无色物质,加热可分解,则加热时,③中溶液变红,冷却后红色褪去,C错误;可逆反应应在同一条件下进行,题中实验分别在加热条件下和冷却后进行,不是可逆反应,D错误。故选A。
4. D 解析:向滴有酚酞的NaOH溶液中滴入硝酸,溶液红色褪去,可能利用的是硝酸的酸性,也可能是强氧化性。故选D。
复习要求 1. 了解氮及其氧化物的主要性质及应用。2. 了解氮循环对生态平衡的重要作用。3. 掌握NH3及铵盐的性质与用途。4. 掌握喷泉实验、NH3的实验室制法的原理及操作。5. 了解浓硝酸、稀硝酸的性质,了解工业上生产硝酸的原理。6. 从含氮物质的性质及转化的视角分析酸雨和雾霾的成因、危害与防治。
知识体系
考点一 氮及其氧化物
一、 自然界中氮元素的存在和氮的固定
“固氮”:将________态氮(即N2)转化为________态氮的过程。
二、 氮气
1. N2的结构
电子式:________,结构式:________,N2分子中有1个σ键、2个π键。
2. 物理性质
氮气是________色、________味、________溶于水的气体。
3. 化学性质
三、 氮的氧化物
1. 氮的多种氧化物:2O、O、2O3、O2、2O4、2O5。
(1)N2O俗称笑气,可以致人发笑,有轻微麻醉作用。
(2)N2O3、N2O5是HNO2、HNO3对应的酸性氧化物(或酸酐)。
(3)NO2与N2O4可相互转化2NO2??N2O4。
(4)NO与NO2的比较
NO NO2
颜色 无色 ________色
毒性 有毒 有毒
溶解性 不溶于水 易溶于水
与O2或与H2O反应 ______________________________ ________________________________
收集方法 ________ ____________
续表
与人体、环境的关系 ①与________结合,使人中毒;②转化成NO2,形成酸雨、光化学烟雾 形成酸雨、光化学烟雾,破坏臭氧层
2. NO和NO2的实验室制法
实验室制法 铜与稀硝酸反应的离子方程式:3Cu+8H++2NO===3Cu2++2NO↑+4H2O(NO用排水法收集,不能用排空气法收集) 铜与浓硝酸反应的离子方程式:Cu+4H++2NO===Cu2++2NO2↑+2H2O(NO2用向上排空气法收集,不能用排水法收集)
尾气处理 实验室尾气处理(通氧气,用NaOH溶液吸收):①2NO+O2===2NO2②NO2+NO+2NaOH===2NaNO2+H2O(归中反应) 实验室尾气处理(用NaOH溶液吸收):2NO2+2NaOH===NaNO3+NaNO2+H2O(歧化反应)
【思维拓展】
(1)NO与NaOH溶液不反应,用NaOH溶液处理NO尾气时,需要同时通入空气。
(2)NO2既有氧化性又有还原性,但以氧化性为主。NO2能使湿润的淀粉碘化钾试纸变蓝,故不能用湿润的淀粉碘化钾试纸鉴别NO2和Br2。
【易错辨析】
1. N2与O2在放电条件下直接化合成NO2。( )
2. NO2通入FeSO4溶液中始终无明显现象。( )
3. 高温、高压、催化剂条件下氮气与氢气反应时,氮气作还原剂。( )
4. NO2溶于水时,NO2是氧化剂,水是还原剂。( )
5. NO易溶于水,所以只能用排空气法收集。( )
类型1 物质的转化
1. 下列有关实验室制取、收集NO2并制备Cu(NO3)2·6H2O的实验原理和装置正确的是( )
A. 用装置甲制取NO2
B. 用装置乙收集NO2
C. 用装置丙吸收NO2
D. 用装置丁蒸干溶液获得Cu(NO3)2·6H2O
2. (2023·江苏卷)氮及其化合物的转化具有重要应用。下列说法不正确的是( )
A. 实验室探究稀硝酸与铜反应的气态产物:HNO3(稀)NONO2
B. 工业制硝酸过程中的物质转化:N2NOHNO3
C. 汽车尾气催化转化器中发生的主要反应:2NO+2CON2+2CO2
D. 实验室制备少量NH3的原理:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
类型2 微工艺流程
3. 用石灰乳吸收硝酸工业的尾气(含NO、NO2)可获得Ca(NO2)2,其部分工艺流程如下。下列说法不正确的是( )
A. 吸收时主要反应的化学方程式为NO+NO2+Ca(OH)2===Ca(NO2)2+H2O
B. 将石灰乳改为澄清石灰水吸收效率将会增大
C. 采用气液逆流接触有利于尾气中NO、NO2的充分吸收
D. 若尾气中n(NO2)∶n(NO)<1∶1,吸收后排放的气体中NO含量升高
考点二 氨和铵盐
一、 氨气
1. 分子结构
(1)NH3分子中氮原子的杂化类型为sp3。
(2)H—N—H的键角为107°(人教版)或107°18′(苏教版)。
(3)氨气的电子式为HN,H H。
(4)氨气分子中,氮原子上有一个孤电子对,故氨气分子常作为配合物的配体。
(5)氨气是极性分子,属于分子晶体。
2. 物理性质
氨气是一种无色、________气味的气体,密度比空气小,熔、沸点低,易液化。氨气分子间能形成氢键,氨气分子与水分子间也能形成氢键,故氨气________溶于水,1体积水可溶解700体积的氨气。
3. 化学性质
4. 实验室制法(固体+固体气体)
原理 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
装置图
收集 向下排空气法
干燥 用碱石灰干燥,不能用浓硫酸、无水CaCl2和P2O5干燥
验满 将湿润的红色石蕊试纸置于试管口,试纸变蓝;或将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生
【思维拓展】
用浓氨水制备氨气
5. 用途
液氨汽化时会吸收大量的热,可用作________剂。NH3是一种重要的化工原料,可用来制硝态氮肥、铵态氮肥、尿素等。
二、 铵盐与NH的检验
1. 铵盐的物理性质
铵盐大多数是________色固体,绝大多数易溶于水。
2. 铵盐的化学性质
3. NH的检验
【思维拓展】
N、P元素含量偏高,容易引起水体富营养化。工业废水中含NH3和NH,用氧化剂氧化生成N2或NO,这是最常用的处理方法之一。
【易错辨析】
1. (2024·常州期末)可用无水CaCl2干燥制得的NH3。( )
2. 氨溶于水显弱碱性是因为氨气分子能电离出OH-。( )
3. 氨水和液氨不同,氨水是混合物,液氨是纯净物。( )
4. NH4HCO3受热易分解,故可用作化肥。( )
5. 向某溶液加入氢氧化钠溶液后加热,产生能使湿润的红色石蕊试纸变蓝的气体,溶液中一定含有NH。( )
类型1 物质的性质与用途
1. 下列选项所示的物质间转化不能一步实现的是( )
A. NH3N2
B. Al3+AlO
C. NH3(g)N2(g)
D. NH3NH4HSO4
2. 下列物质的性质与用途具有对应关系的是( )
A. NH3有氢键,常用作制冷剂
B. NH4Cl溶液呈酸性,可用作氮肥
C. NH4NO3受热易分解,可用作制备NH3
D. HNO3具有强氧化性,可用于制备硝酸纤维
类型2 基础化学实验
3. (2024·南菁中学高三上月考)如图为NH3的制备,收集及催化氧化实验,下列说法正确的是( )
A. 图甲装置除了混合氢气和氮气之外还可以干燥气体及观察氢气和氮气的流速
B. 将氨气通入图乙装置中,锥形瓶口出现红棕色气体,说明氨被直接氧化为NO2
C. 图丙为实验室制取氨气的正确装置
D. 图丁装置可用于实验室制氨气的尾气吸收
类型3 喷泉实验
4. (2025·无锡模拟)如图装置中,干燥烧瓶内盛有某种气体,烧杯和胶头滴管内盛放某种溶液。挤压胶头滴管的胶头,下列与实验事实不相符的是( )
A. CO2(NaHCO3溶液)/无色喷泉
B. NH3(H2O中含酚酞)/红色喷泉
C. NH3(H2O中含甲基橙)/黄色喷泉
D. HCl(AgNO3溶液)/白色喷泉
考点三 硝酸
一、 物理性质
纯硝酸和浓硝酸(质量分数为69%)均是________色透明液体,有________气味,________挥发。HNO3可以形成分子内氢键,硝酸与水分子间也可形成氢键,二者可以任意比例混溶。
二、 化学性质
(1)不稳定性
反应:____________________________________。
(2)强氧化性
硝酸无论浓、稀都具有强氧化性,而且浓度越大,氧化性越强。
①与金属反应
稀硝酸与铜反应的化学方程式:________________________________;
浓硝酸与铜反应的化学方程式:________________________________。
②与非金属反应
浓硝酸与C反应的化学方程式:________________________________。
③与还原性化合物反应
硝酸可氧化H2S、SO2、Na2SO3、HI、Fe2+等还原性物质。
稀硝酸与FeSO4溶液反应的离子方程式:________________________________。
(3)与有机物反应
①硝化反应(与反应):________________________________________________。
②颜色反应:含有苯环的蛋白质遇到浓硝酸加热后变黄色。
【思维拓展】
a. 非金属单质+浓硝酸―→最高价氧化物或其含氧酸+NO2+H2O。
b. 由于硝酸能氧化HI、HBr、SO2,故不能用硝酸制备HI、HBr、SO2气体。
c. 由于S2-、HS-、SO、HSO、I-、Fe2+等均能被HNO3氧化,故在酸性条件下,NO不能与上述还原性离子共存。
三、 工业生产中的物质转化
工业生产中的物质转化 主要原料 主要原理 尾气处理
NH3→NO→NO2→HNO3 氨气、空气、水 ①4NH3+5O2 4NO+6H2O②2NO+O2===2NO2③3NO2+H2O===2HNO3+NO 用NaOH等碱液吸收
【思维拓展】
(1)金属与硝酸反应计算的思维流程
(2)金属与硝酸反应的规律
本质 HNO3中+5价氮元素具有很强的得电子能力
规律 硝酸的浓度越大,反应温度越高,氧化性越强
续表
【易错辨析】
1. (2025·扬州中学)用蘸有浓氨水的玻璃棒靠近试剂瓶瓶口,试剂瓶瓶口有白烟生成,该试剂瓶中盛装的是浓硝酸。( )
2. 常温下,铁、铝在浓硝酸中的钝化为化学变化。( )
3. 实验室可用活泼金属与硝酸反应制取氢气。( )
4. 浓HNO3溅到皮肤上,皮肤会变黄。( )
5. (2024·苏北四市一模)将灼热的木炭加入浓硝酸中,有红棕色气体产生,说明木炭在加热条件下能与浓硝酸反应。( )
类型1 物质的转化
1. 在指定条件下,下列选项所示的物质间转化能实现的是( )
A. NO(g)HNO3(aq)
B. 稀HNO3(aq)NO2
C. NO2(g)N2(g)
D. NO(aq)NO(aq)
类型2 硝酸的性质
2. 下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
① ② ③
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 由②中的红棕色气体不能表明木炭与浓硝酸发生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
类型3 物质的性质与用途
3. (2024·江苏各地模拟重组)下列氮及其化合物的性质与用途具有对应关系的是( )
A. HNO3易挥发,可用来制备硝酸纤维
B. HNO3有酸性,可用于洗涤附有银镜的试管
C. HNO3具有强氧化性,可用于制备硝酸铵
D. NH3具有还原性,可用作制备NF3
素 养 评 估
1. 选择性催化还原技术是一种以NH3作为还原剂,将烟气中NOx分解成无害的N2和H2O的干法脱硝技术,反应原理为
①6NO+4NH35N2+6H2O;
②6NO2+8NH37N2+12H2O;
③NO+NO2+2NH3===2N2+3H2O。
下列说法正确的是( )
A. NO2为酸性氧化物
B. 氮气性质不活泼,其原因是氮元素的非金属性较弱
C. 反应③中标准状况下每生成22.4 L N2,转移电子数为1.5NA
D. NO→NO2→HNO3,以上各步变化均能通过一步完成
2. 如图所示,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。表中对应的实验现象及解释正确的是( )
选项 实验现象 解释
A 浓盐酸附近产生白烟 NH3与浓盐酸挥发出的HCl反应产生了NH4Cl固体
B 浓硫酸附近无明显现象 NH3与浓硫酸不发生反应
C 氯化铝溶液先浑浊再澄清 氢氧化铝沉淀溶解
D 干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝 氨气属于碱
3. “封管实验”具有简易、方便、节约、绿色等优点,关于如图所示三个“封管实验”(夹持装置未画出)的说法正确的是( )
A. 加热时,①中试管上部汇集了固体
B. 加热时,②中溶液变红,冷却后又变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红
D. 三个“封管实验”中所发生的化学反应都是可逆反应
4. 硝酸被称为“国防工业之母”,是因为它是制取炸药的重要原料。下列实验事实与硝酸的性质不相对应的是( )
A. 浓硝酸使紫色石蕊溶液先变红后褪色——酸性和强氧化性
B. 不能用稀硝酸与锌反应制氢气——强氧化性
C. 要用棕色瓶盛装浓硝酸——不稳定性
D. 能使滴有酚酞的氢氧化钠溶液的红色褪去——强氧化性
第12讲 氮及其化合物
考点一 氮及其氧化物
知识归纳
一、 游离 化合 游离 自然 人工 化合
二、 1. NN NN
2. 无 无 难
三、 1. (4)红棕 2NO+O2===2NO2 3NO2+H2O===2HNO3+NO 排水法 向上排空气法 ①血红蛋白
【易错辨析】
1. × 2. × 3. × 4. × 5. ×
命题突破
1. C 解析:稀硝酸与铜反应生成硝酸铜、一氧化氮和水,不可能生成二氧化氮,故A错误;二氧化氮的密度大于空气,应从长导气管通入,故B错误;二氧化氮与氢氧化钠溶液反应生成硝酸钠、亚硝酸钠和水,则用氢氧化钠溶液能吸收二氧化氮,防止污染空气,故C正确;硝酸铜是强酸弱碱盐,溶液蒸干时铜离子水解、硝酸挥发和分解导致无法制得六水硝酸铜,故D错误。
2. B 解析:Cu与稀硝酸的反应产物之一为NO,NO与氧气发生反应2NO+O2===2NO2生成NO2,A正确;氮气与氧气在高温条件下生成NO,但NO无法与水发生化学反应,B错误;汽车尾气催化转化器主要将污染气体NO、CO转化为无污染的气体,故该反应方程式为2NO+2CON2+2CO2,C正确;实验室利用熟石灰和氯化铵制备少量NH3,化学方程式为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O,D正确。
3. B 解析:该工艺中NO和NO2物质的量之比接近1∶1,原理为:NO+NO2+Ca(OH)2===Ca(NO2)2+H2O;若n(NO)∶n(NO2)>1∶1,发生反应NO+NO2+Ca(OH)2===Ca(NO2)2+H2O,多余的NO无法被Ca(OH)2吸收,造成排放气体中NO含量升高;若n(NO)∶n(NO2)<1∶1,二氧化氮过量,被Ca(OH)2吸收,则发生了4NO2+2Ca(OH)2===Ca(NO3)2+Ca(NO2)2+2H2O,产品中Ca(NO3)2含量升高。根据分析过程,该工艺中NO和NO2物质的量之比接近1∶1,可以提高Ca(NO2)2的产率及纯度,吸收时主要反应的化学方程式为NO+NO2+Ca(OH)2===Ca(NO2)2+H2O,故A正确;石灰乳更利于气体附着,改为澄清石灰水吸收效率将会降低,故B错误;采用气液逆流接触,增大了气体和石灰乳的接触面积,有利于尾气中NO、NO2的充分吸收,故C正确;尾气中n(NO2)∶n(NO)<1∶1,发生反应NO+NO2+Ca(OH)2===Ca(NO2)2+H2O,多余的NO无法被Ca(OH)2吸收,造成排放气体中NO含量升高,故D正确。
考点二 氨和铵盐
知识归纳
一、 2. 有刺激性 极易
3. Al(OH)3↓+3NH 4NH3+5O24NO+6H2O 2NH3+3CuO3Cu+N2+3H2O
5. 制冷
二、 1. 白
2. 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O NH+OH-NH3↑+H2O
【易错辨析】
1. × 2. × 3. √ 4. × 5. √
命题突破
1. B 解析:Al(OH)3不溶于氨水,故Al3+与氨水反应不能一步生成AlO,B符合题意。
2. A 解析:NH3分子间形成氢键,沸点较高,氨气易液化,液氨汽化时吸热常用作制冷剂,A符合题意;NH4Cl中含有植物所需的N元素,可用作氮肥,与其酸性无关,B不符合题意;NH4NO3受热易发生爆炸,且分解产物不一定产生氨气,一般不用作制氨气,C不符合题意;HNO3与纤维素能发生酯化反应生成硝酸纤维,与其强氧化性无关,D不符合题意。
3. A 解析:浓硫酸有吸水性,可干燥氢气和氮气,同时可由气体经过液体产生的气泡快慢来观察气体流速,A正确;瓶口出现红棕色气体,为NO被氧气氧化为NO2,不是直接产生的,B错误;加热固体药品时,试管口应略向下,C错误;氨气极易溶于水,发生倒吸,造成实验安全问题,D错误。
4. A 解析:因NaHCO3溶液抑制CO2的溶解,则挤压胶头滴管,气压变化不明显,则不会形成喷泉,故A错误;因氨极易溶于水,则挤压胶头滴管,使烧瓶中的气压减小,且小于外界大气压,又因氨水显碱性,酚酞遇碱变红,甲基橙遇碱变黄,故B中形成红色喷泉,C中形成黄色喷泉,故B、C正确;因HCl与AgNO3溶液反应生成白色的AgCl沉淀,则挤压胶头滴管,使烧瓶中的气压减小,且小于外界大气压,形成白色喷泉,故D正确。
考点三 硝酸
知识归纳
一、 无 刺激性 易
二、 (1)4HNO32H2O+4NO2↑+O2↑ (2)①3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O ②C+4HNO3(浓)CO2↑+4NO2↑+2H2O ③3Fe2++4H++NO===3Fe3++NO↑+2H2O
(3)①+HNO3NO2+H2O
【易错辨析】
1. × 2. √ 3. × 4. √ 5. ×
命题突破
1. C 解析:NO不与H2O反应,A不符合题意;稀HNO3与Cu反应生成NO,3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O,B不符合题意;发生反应为6NO2+8NH3===7N2+12H2O,能实现转化,C符合题意;NO中的N为最高价+5价,O3为氧化剂,因此不能生成N2,D不符合题意。
2. D 解析:①中的红棕色气体是NO2,N元素化合价降低,根据氧化还原反应规律,一定有元素化合价升高,推断产生的气体中还一定有O2,故A正确;浓硝酸受热易分解,②中的红棕色气体可能是硝酸分解产生,不能说明木炭与浓硝酸发生了反应,故B正确;硝酸中N元素化合价为+5价,生成二氧化氮中N元素化合价为+4价,化合价降低,所以生成的红棕色气体为还原产物,故C正确;③的气体产物中检测出CO2,CO2可能是C和氧气反应生成的产物,故D错误。故选D。
3. D 解析:HNO3能与纤维素发生酯化反应,可用来制备硝酸纤维,与其挥发性无关,A错误;HNO3有氧化性,可用于洗涤附有银镜的试管,与其酸性无关,B错误;HNO3与NH3反应制备NH4NO3的反应是非氧化还原反应,与HNO3的强氧化性无关,C错误;NH3中N元素为-3价,NF3中N元素为+3价,N元素被氧化,NH3具有还原性,可用作制备NF3,D正确。
素养评估
1. D 解析:NO2和氢氧化钠反应生成硝酸钠、亚硝酸钠和水,NO2不是酸性氧化物,A错误;氮气性质不活泼,其原因是氮气分子中含有氮氮三键,B错误;反应③中生成2 mol N2转移6 mol电子,标准状况下每生成22.4 L N2,转移电子数为3NA,C错误;NO→NO2→HNO3,NO和O2反应生成NO2,NO2和水反应生成HNO3和NO,D正确。故选D。
2. A 解析:NaOH固体溶于水放热,氨水易挥发,实验时向NaOH固体上滴几滴浓氨水,会产生氨气,与浓盐酸挥发出的HCl反应生成氯化铵固体,反应现象是产生白烟,A正确;氨气为碱性气体,与浓硫酸发生反应生成硫酸铵,由于浓硫酸不挥发,该反应无明显现象,B错误;氨气溶于水形成NH3·H2O,NH3·H2O与氯化铝在溶液中发生复分解反应生成氢氧化铝和NH4Cl,NH3·H2O为弱碱,不能溶解氢氧化铝沉淀,故氯化铝溶液变浑浊后不会变澄清,C错误;氨气使湿润的红色石蕊试纸变蓝的原因是氨气与水反应生成NH3·H2O,NH3·H2O电离出OH-,使溶液呈碱性,氨气为非电解质,不属于碱,D错误。故选A。
3. A 解析:加热氯化铵分解,在①中试管上部HCl与氨气化合生成氯化铵,A正确;氨气的水溶液显碱性,加热时氨气逸出,酚酞溶液褪色,冷却时氨气溶于酚酞溶液,溶液显红色,B错误;二氧化硫可使品红褪色,化合生成无色物质,加热可分解,则加热时,③中溶液变红,冷却后红色褪去,C错误;可逆反应应在同一条件下进行,题中实验分别在加热条件下和冷却后进行,不是可逆反应,D错误。故选A。
4. D 解析:向滴有酚酞的NaOH溶液中滴入硝酸,溶液红色褪去,可能利用的是硝酸的酸性,也可能是强氧化性。故选D。
同课章节目录
