2.3.1离子键、配位键与金属键 同步课时作业(含答案)高二化学鲁科版(2019)选择性必修二
文档属性
| 名称 | 2.3.1离子键、配位键与金属键 同步课时作业(含答案)高二化学鲁科版(2019)选择性必修二 |  | |
| 格式 | docx | ||
| 文件大小 | 310.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-27 11:09:14 | ||
图片预览


文档简介
(12)2.3.1离子键、配位键与金属键——高二化学鲁科版(2019)选择性必修二同步课时作业
1.下列说法不正确的是( )
A.离子键没有方向性和饱和性
B.并不是只有活泼的金属和非金属化合才能形成离子键
C.离子键的实质是阴离子和阳离子之间的静电作用
D.阴离子和阳离子之间的静电作用只有静电引力
2.下列叙述错误的是( )
A.阴离子和阳离子之间强烈的相互吸引称为离子键
B.金属元素与非金属元素化合时,不一定形成离子键
C.ⅠA族的原子跟卤素原子结合形成的化学键不一定是离子键
D.非金属原子间可能形成离子键
3.下列关于离子键的说法中不正确的是( )
A.离子键就是阴、阳离子间强烈的相互作用
B.非金属元素形成的化合物中不可能存在离 子键
C.离子键不可能存在于单质分子中
D.活泼金属和活泼非金属化合时能形成离子键
4.下列原子序数所对应的元素组中,两者可形成离子键的是( )
A.1和17 B.12和9 C.14和6 D.15和8
5.下列说法正确的是( )
A.分子的空间构型是直线型
B.分子中所有原子最外电子层都具有8电子的稳定结构
C.非极性键不仅存在于双原子的单质分子中,还可能存在于化合物中
D.离子键是阴、阳离子之间通过静电吸引作用形成的
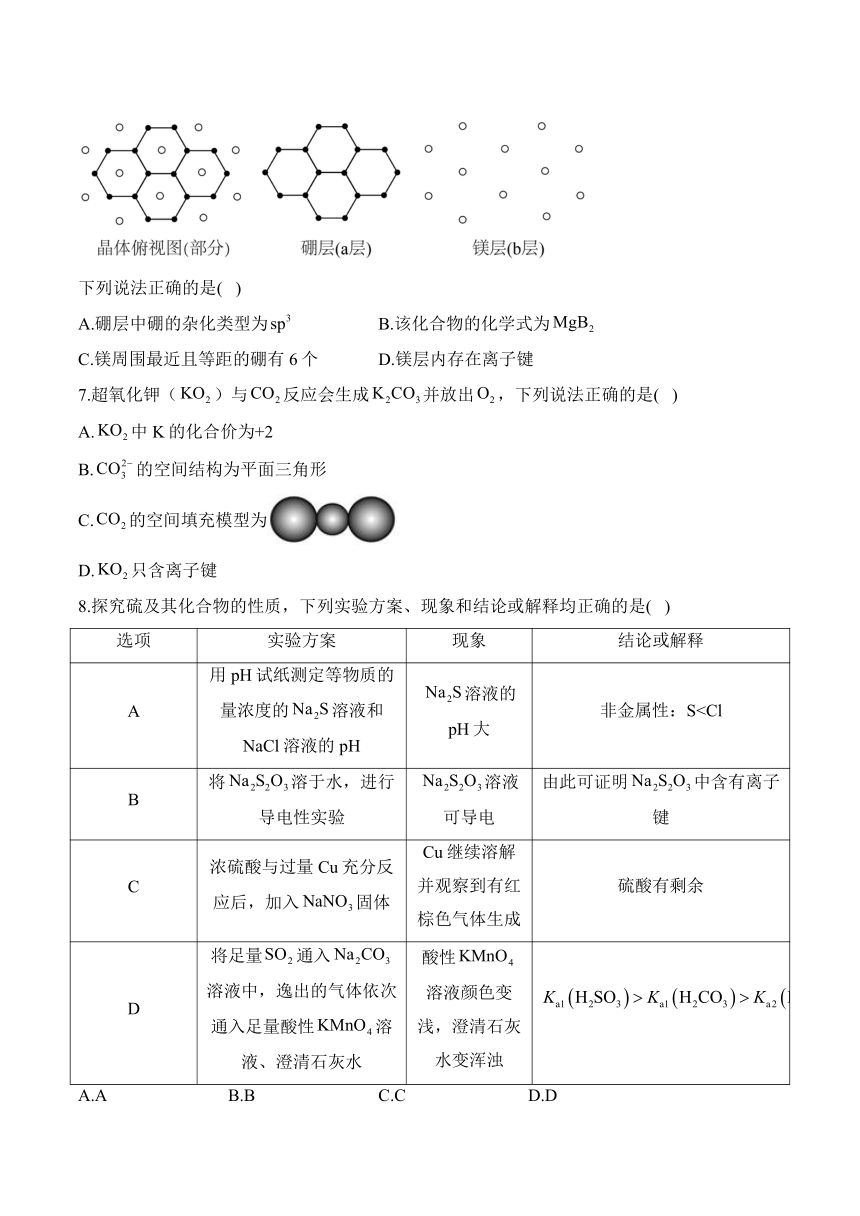
6.一种由硼镁元素组成的离子化合物具有超导性能。该化合物晶体中硼通过共价键形成平面a层,镁形成平面b层,a层和b层等距交错排列,俯视图(部分)如图。
下列说法正确的是( )
A.硼层中硼的杂化类型为 B.该化合物的化学式为
C.镁周围最近且等距的硼有6个 D.镁层内存在离子键
7.超氧化钾()与反应会生成并放出,下列说法正确的是( )
A.中K的化合价为+2
B.的空间结构为平面三角形
C.的空间填充模型为
D.只含离子键
8.探究硫及其化合物的性质,下列实验方案、现象和结论或解释均正确的是( )
选项 实验方案 现象 结论或解释
A 用pH试纸测定等物质的量浓度的溶液和NaCl溶液的pH 溶液的pH大 非金属性:SB 将溶于水,进行导电性实验 溶液可导电 由此可证明中含有离子键
C 浓硫酸与过量Cu充分反应后,加入固体 Cu继续溶解并观察到有红棕色气体生成 硫酸有剩余
D 将足量通入溶液中,逸出的气体依次通入足量酸性溶液、澄清石灰水 酸性溶液颜色变浅,澄清石灰水变浑浊
A.A B.B C.C D.D
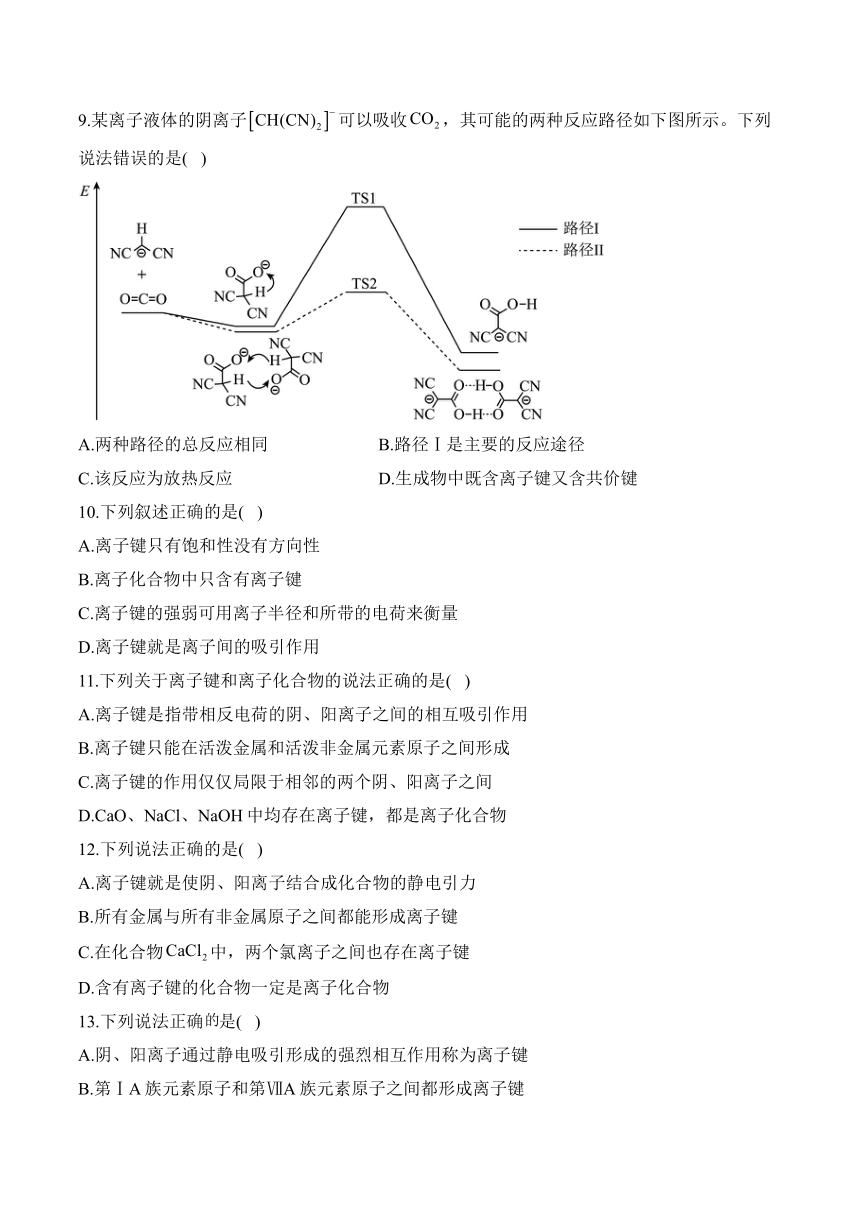
9.某离子液体的阴离子可以吸收,其可能的两种反应路径如下图所示。下列说法错误的是( )
A.两种路径的总反应相同 B.路径Ⅰ是主要的反应途径
C.该反应为放热反应 D.生成物中既含离子键又含共价键
10.下列叙述正确的是( )
A.离子键只有饱和性没有方向性
B.离子化合物中只含有离子键
C.离子键的强弱可用离子半径和所带的电荷来衡量
D.离子键就是离子间的吸引作用
11.下列关于离子键和离子化合物的说法正确的是( )
A.离子键是指带相反电荷的阴、阳离子之间的相互吸引作用
B.离子键只能在活泼金属和活泼非金属元素原子之间形成
C.离子键的作用仅仅局限于相邻的两个阴、阳离子之间
D.CaO、NaCl、NaOH中均存在离子键,都是离子化合物
12.下列说法正确的是( )
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物中,两个氯离子之间也存在离子键
D.含有离子键的化合物一定是离子化合物
13.下列说法正确是( )
A.阴、阳离子通过静电吸引形成的强烈相互作用称为离子键
B.第ⅠA族元素原子和第ⅦA族元素原子之间都形成离子键
C.元素周期表中第一周期元素间不能形成离子键
D.元素周期表中第ⅠA族元素间不可能形成离子键
14.(1)在①NaCl、②NaOH、③、④、⑤、⑥中,只含有离子键的是__________;只含有极性键的是__________;只含有非极性键的是__________;既含有离子键,又含有极性键的是__________;既含有离子键,又含有非极性键的是__________。
(2)请用电子式表示NaCl的形成过程:__________。
(3)的结构式为:__________;的结构式为:__________。
15.现有下列物质:①、②、③HCl、④NaClO、⑤、⑥、⑦。
(1)上述物质中所含化学键只有离子键的是_________(填序号,下同)。
(2)上述物质中所含化学键为极性键和非极性键的是___________。
(3)上述物质中所含化学键为离子键和极性键的是_________。
(4)③溶于水时破坏_______(填“离子键”或“共价键”,下同);⑥熔化时破坏____________。
答案以及解析
1.答案:D
解析:离子键是阴、阳离子之间的静电作用,包括静电吸引和静电排斥,且一个离子同时吸引多个带相反电荷的离子,故离子键无方向性和饱和性;非金属元素也可形成离子键,如中与之间存在离子键。故选D。
2.答案:A
解析:离子键的实质是阴、阳离子之间的静电作用,包括静电吸引和静电排斥,A错误;如是共价化合物,不存在离子键,B正确;如HCl是共价化合物,不存在离子键,C正确;如中与之间存在离子键,D正确。
3.答案:B
解析:氯化铵是只由非金属元素组成的离子化合物,故B错误。
4.答案:B
解析:离子键的形成活泼金属和非活泼金属,一般是IA、IIA金属元素与VIA、VIIA非金属形成离子键,A、生成HCl形成共价键,故不符合题意;B、生成形成离子键,故符合题意;C、生成SiC形成共价键,故不符合题意;D、生成形成共价键,故不符合题意。
5.答案:C
解析:A.分子中O原子的价层电子对个数为且含有2个孤电子对,则该分子空间构型为V形,故A错误;B.分子中中心原子B原子最外层3个电子,该分子中形成3个共价键,所以B原子的最外层电子数与其形成的共价键个数之和不等于8,则该分子中B原子最外层没有达到8电子结构,故B错误;C.同种非金属元素的原子之间易形成非极性键,非极性键不仅存在于双原子的单质分子中,如:分子中H-H为非极性键,还可能存在于化合物中,如:中存在O-O非极性键,故C正确;D.离子键是阴阳离子之间通过静电作用形成的,静电作用包含静电吸引力和排斥力,故D错误;故选:C。
6.答案:B
解析:A.由投影图可知,硼层中硼原子连接3个σ键,B原子价电子有3个,全部用于形成σ键,无孤电子对,价层电子对数为3+0=3,杂化类型为sp2,故A错误;
B.由投影图可知,每个镁原子上层距离其最近的硼原子有6个,下层距离其最近的硼原子也有6个,共12个,每个硼原子上层距离其最近的镁原子有3个,下层距离其最近的镁原子也有3个,共6个,则Mg、B原子个数比为1∶2,化学式为,故B正确;
C.由投影图可知,每个镁原子上层距离其最近的硼原子有6个,下层距离其最近的硼原子也有6个,共12个,故C错误;
D.Mg层内存在金属键,不存在离子键,故D错误;故选B。
7.答案:B
解析:A.K是碱金属,中K的化合价为+1,故A错误;
B.中心原子价层电子对数为3+=3,且没有孤电子对,空间结构为平面三角形,故B正确;
C.碳原子半径大于氧原子半径,的空间填充模型为:,故C错误;
D.是离子化合物,含有离子键,O中含有非极性共价键,故D错误;
故选B。
8.答案:C
解析:
选项 明确实验目的 明确原理、判断实验方案合理性 分析现象或结论正误
A 判断元素的非金属性 元素的非金属性强弱与其最高价含氧酸的酸性强弱相对应,用pH试纸测定等物质的量浓度的溶液和NaCl溶液的pH,溶液的pH大,说明酸性,不能证明非金属性SB 判断中含有离子键 在熔融状态能导电说明电离出阴、阳离子,一定存在离子键,故将溶于水,进行导电性实验,方案不合理 _
C 判断硫酸是否剩余 浓硫酸与过量Cu充分反应后,生成硫酸铜、二氧化硫和水,随着反应进行,硫酸浓度减小,Cu与稀硫酸不反应,再加入固体,与未反应的硫酸结合成,与Cu继续反应,方案合理 Cu继续溶解并观察到有红棕色气体生成,现象正确;硫酸有剩余,结论正确
D 比较各物质电离平衡常数大小 将足量通入溶液中,生成的气体中混有,通入足量酸性溶液除去,继续通入澄清石灰水,石灰水变浑浊说明生成了,则证明,无法证明与的大小关系,方案不合理 _
9.答案:B
解析:A.反应物相同,经过不同的反应路径,最终生成物相同,均为,总反应均为,A正确;
B.路径Ⅱ活化能小,反应速率快,故路径Ⅱ是主要的反应途径,B错误;
C.该反应的反应物总能量高于生成物总能量,则该反应为放热反应,C正确;
D.生成物为,其内部含有共价键,离子液体中呈电中性,故离子液体中还含有阳离子,与之间存在离子键,D正确;
故答案为:B。
10.答案:C
解析:A.离子键是带相反电荷的离子之间的相互作用,它是一种静电作用,没有方向性和饱和性,A错误;
B.离子化合物也可含有共价键,如氢氧化钠中含H—O共价键,B错误;
C.离子键的强弱可以用离子半径以及所带的电荷来衡量,离子半径越小,所带电荷越多,离子键越强,C正确;
D.离子键不仅仅是吸引作用也有排斥作用,D错误;
故选C。
11.答案:D
解析:A.离子键是指阴、阳离子之间的静电作用,包括引力和斥力,A错误;
B.不是只有活泼的金属元素和活泼的非金属元素之间才能形成离子键,如铵离子与氯离子也能形成离子键,B错误;
C.离子键的作用不仅局限于相邻的两个阴、阳离子之间,还存在于原子核和电子之间,C错误;
D.CaO、NaCl、NaOH都是由活泼金属阳离子与阴离子构成的,均存在离子键,都是离子化合物,D正确;
故选D。
12.答案:D
解析:A.离子键是阴、阳离子之间强烈的相互作用,既有静电引力也有静电斥力,A不正确;
B.活泼非金属原子与活泼金属原子得失电子后能形成离子键,但若金属或非金属不活泼,也可能形成共价键,如中Al与Cl原子间就形成共价键,B不正确;
C.在化合物中,Ca失去的2个电子分给了2个Cl,每个Cl得到1个电子后,最外层达到了8电子相对稳定结构,所以两个氯离子之间不存在共价键,两个阴离子之间不可能形成离子键,C不正确;
D.离子键在阴、阳离子间形成,则含有离子键的化合物中含有阴离子和阳离子,所以一定是离子化合物,D正确;
故选D。
13.答案:C
解析:A.阴、阳离子通过静电作用所形成的强烈相互作用称为离子键,静电作用包括静电吸引和静电排斥两种作用,A错误;B.第IA族元素包括H和碱金属元素,H元素的原子和第VIA族元素原子之间通过共价键结合形成共价化合物,如HCl分子中存在共价键;而Na等碱金属与第ⅦA族元素原子之间通过电子得失形成阴、阳离子,离子之间通过离子键结合形成离子化合物,B错误;C.元素周期表中第一周期元素包括H、He,H原子与He原子之间不能形成离子键,C正确;D.元素周期表中第IA族元素间可能形成离子键,如NaH为离子化合物,与之间通过离子键结合形成离子化合物,D错误:故合理选项是C。
14.答案:(1)①;⑤;④;②;③
(2)
(3);H—O—O—H
解析:(1)NaCl中钠离子和氯离子之间只存在离子键;NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在极性共价键;中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在非极性共价键;中N原子之间只存在非极性共价键;是共价化合物,S原子与H原子间存在极性共价键;中H原子和O原子之间存在极性共价键,O与O原子之间为非极性键;故答案为:①;⑤;④;②;③;
(2)氯化钠形成过程中,钠原子失去1个电子形成钠离子,氯原子得到1个电子形成氯离子,阴阳离子间通过离子键结合,用电子式表示为:;
(3)氮气分子中氮原子间通过氮氮三键结合,结构式为:;双氧水分子中氧原子与氢原子间均以共价键结合,结构式为:H—O—O—H。
15.答案:(1)⑤
(2)⑦
(3)④⑥
(4)共价键;离子键
解析:(4)①是非金属单质,只含有非极性键;②是离子化合物,其含有离子键和非极性键;③HCl是共价化合物,分子中只含有极性键;④NaClO是离子化合物,其含有离子键和极性键;⑤是离子化合物,其含有离子键;⑥是离子化合物,其含有离子键和极性键;⑦是共价化合物,分子中含有极性键和非极性键。氯化氢溶于水得到盐酸,氯化氢在水分子作用下破坏共价键:硫酸氢钠在熔化时只破坏离子键。
1.下列说法不正确的是( )
A.离子键没有方向性和饱和性
B.并不是只有活泼的金属和非金属化合才能形成离子键
C.离子键的实质是阴离子和阳离子之间的静电作用
D.阴离子和阳离子之间的静电作用只有静电引力
2.下列叙述错误的是( )
A.阴离子和阳离子之间强烈的相互吸引称为离子键
B.金属元素与非金属元素化合时,不一定形成离子键
C.ⅠA族的原子跟卤素原子结合形成的化学键不一定是离子键
D.非金属原子间可能形成离子键
3.下列关于离子键的说法中不正确的是( )
A.离子键就是阴、阳离子间强烈的相互作用
B.非金属元素形成的化合物中不可能存在离 子键
C.离子键不可能存在于单质分子中
D.活泼金属和活泼非金属化合时能形成离子键
4.下列原子序数所对应的元素组中,两者可形成离子键的是( )
A.1和17 B.12和9 C.14和6 D.15和8
5.下列说法正确的是( )
A.分子的空间构型是直线型
B.分子中所有原子最外电子层都具有8电子的稳定结构
C.非极性键不仅存在于双原子的单质分子中,还可能存在于化合物中
D.离子键是阴、阳离子之间通过静电吸引作用形成的
6.一种由硼镁元素组成的离子化合物具有超导性能。该化合物晶体中硼通过共价键形成平面a层,镁形成平面b层,a层和b层等距交错排列,俯视图(部分)如图。
下列说法正确的是( )
A.硼层中硼的杂化类型为 B.该化合物的化学式为
C.镁周围最近且等距的硼有6个 D.镁层内存在离子键
7.超氧化钾()与反应会生成并放出,下列说法正确的是( )
A.中K的化合价为+2
B.的空间结构为平面三角形
C.的空间填充模型为
D.只含离子键
8.探究硫及其化合物的性质,下列实验方案、现象和结论或解释均正确的是( )
选项 实验方案 现象 结论或解释
A 用pH试纸测定等物质的量浓度的溶液和NaCl溶液的pH 溶液的pH大 非金属性:S
C 浓硫酸与过量Cu充分反应后,加入固体 Cu继续溶解并观察到有红棕色气体生成 硫酸有剩余
D 将足量通入溶液中,逸出的气体依次通入足量酸性溶液、澄清石灰水 酸性溶液颜色变浅,澄清石灰水变浑浊
A.A B.B C.C D.D
9.某离子液体的阴离子可以吸收,其可能的两种反应路径如下图所示。下列说法错误的是( )
A.两种路径的总反应相同 B.路径Ⅰ是主要的反应途径
C.该反应为放热反应 D.生成物中既含离子键又含共价键
10.下列叙述正确的是( )
A.离子键只有饱和性没有方向性
B.离子化合物中只含有离子键
C.离子键的强弱可用离子半径和所带的电荷来衡量
D.离子键就是离子间的吸引作用
11.下列关于离子键和离子化合物的说法正确的是( )
A.离子键是指带相反电荷的阴、阳离子之间的相互吸引作用
B.离子键只能在活泼金属和活泼非金属元素原子之间形成
C.离子键的作用仅仅局限于相邻的两个阴、阳离子之间
D.CaO、NaCl、NaOH中均存在离子键,都是离子化合物
12.下列说法正确的是( )
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物中,两个氯离子之间也存在离子键
D.含有离子键的化合物一定是离子化合物
13.下列说法正确是( )
A.阴、阳离子通过静电吸引形成的强烈相互作用称为离子键
B.第ⅠA族元素原子和第ⅦA族元素原子之间都形成离子键
C.元素周期表中第一周期元素间不能形成离子键
D.元素周期表中第ⅠA族元素间不可能形成离子键
14.(1)在①NaCl、②NaOH、③、④、⑤、⑥中,只含有离子键的是__________;只含有极性键的是__________;只含有非极性键的是__________;既含有离子键,又含有极性键的是__________;既含有离子键,又含有非极性键的是__________。
(2)请用电子式表示NaCl的形成过程:__________。
(3)的结构式为:__________;的结构式为:__________。
15.现有下列物质:①、②、③HCl、④NaClO、⑤、⑥、⑦。
(1)上述物质中所含化学键只有离子键的是_________(填序号,下同)。
(2)上述物质中所含化学键为极性键和非极性键的是___________。
(3)上述物质中所含化学键为离子键和极性键的是_________。
(4)③溶于水时破坏_______(填“离子键”或“共价键”,下同);⑥熔化时破坏____________。
答案以及解析
1.答案:D
解析:离子键是阴、阳离子之间的静电作用,包括静电吸引和静电排斥,且一个离子同时吸引多个带相反电荷的离子,故离子键无方向性和饱和性;非金属元素也可形成离子键,如中与之间存在离子键。故选D。
2.答案:A
解析:离子键的实质是阴、阳离子之间的静电作用,包括静电吸引和静电排斥,A错误;如是共价化合物,不存在离子键,B正确;如HCl是共价化合物,不存在离子键,C正确;如中与之间存在离子键,D正确。
3.答案:B
解析:氯化铵是只由非金属元素组成的离子化合物,故B错误。
4.答案:B
解析:离子键的形成活泼金属和非活泼金属,一般是IA、IIA金属元素与VIA、VIIA非金属形成离子键,A、生成HCl形成共价键,故不符合题意;B、生成形成离子键,故符合题意;C、生成SiC形成共价键,故不符合题意;D、生成形成共价键,故不符合题意。
5.答案:C
解析:A.分子中O原子的价层电子对个数为且含有2个孤电子对,则该分子空间构型为V形,故A错误;B.分子中中心原子B原子最外层3个电子,该分子中形成3个共价键,所以B原子的最外层电子数与其形成的共价键个数之和不等于8,则该分子中B原子最外层没有达到8电子结构,故B错误;C.同种非金属元素的原子之间易形成非极性键,非极性键不仅存在于双原子的单质分子中,如:分子中H-H为非极性键,还可能存在于化合物中,如:中存在O-O非极性键,故C正确;D.离子键是阴阳离子之间通过静电作用形成的,静电作用包含静电吸引力和排斥力,故D错误;故选:C。
6.答案:B
解析:A.由投影图可知,硼层中硼原子连接3个σ键,B原子价电子有3个,全部用于形成σ键,无孤电子对,价层电子对数为3+0=3,杂化类型为sp2,故A错误;
B.由投影图可知,每个镁原子上层距离其最近的硼原子有6个,下层距离其最近的硼原子也有6个,共12个,每个硼原子上层距离其最近的镁原子有3个,下层距离其最近的镁原子也有3个,共6个,则Mg、B原子个数比为1∶2,化学式为,故B正确;
C.由投影图可知,每个镁原子上层距离其最近的硼原子有6个,下层距离其最近的硼原子也有6个,共12个,故C错误;
D.Mg层内存在金属键,不存在离子键,故D错误;故选B。
7.答案:B
解析:A.K是碱金属,中K的化合价为+1,故A错误;
B.中心原子价层电子对数为3+=3,且没有孤电子对,空间结构为平面三角形,故B正确;
C.碳原子半径大于氧原子半径,的空间填充模型为:,故C错误;
D.是离子化合物,含有离子键,O中含有非极性共价键,故D错误;
故选B。
8.答案:C
解析:
选项 明确实验目的 明确原理、判断实验方案合理性 分析现象或结论正误
A 判断元素的非金属性 元素的非金属性强弱与其最高价含氧酸的酸性强弱相对应,用pH试纸测定等物质的量浓度的溶液和NaCl溶液的pH,溶液的pH大,说明酸性,不能证明非金属性S
C 判断硫酸是否剩余 浓硫酸与过量Cu充分反应后,生成硫酸铜、二氧化硫和水,随着反应进行,硫酸浓度减小,Cu与稀硫酸不反应,再加入固体,与未反应的硫酸结合成,与Cu继续反应,方案合理 Cu继续溶解并观察到有红棕色气体生成,现象正确;硫酸有剩余,结论正确
D 比较各物质电离平衡常数大小 将足量通入溶液中,生成的气体中混有,通入足量酸性溶液除去,继续通入澄清石灰水,石灰水变浑浊说明生成了,则证明,无法证明与的大小关系,方案不合理 _
9.答案:B
解析:A.反应物相同,经过不同的反应路径,最终生成物相同,均为,总反应均为,A正确;
B.路径Ⅱ活化能小,反应速率快,故路径Ⅱ是主要的反应途径,B错误;
C.该反应的反应物总能量高于生成物总能量,则该反应为放热反应,C正确;
D.生成物为,其内部含有共价键,离子液体中呈电中性,故离子液体中还含有阳离子,与之间存在离子键,D正确;
故答案为:B。
10.答案:C
解析:A.离子键是带相反电荷的离子之间的相互作用,它是一种静电作用,没有方向性和饱和性,A错误;
B.离子化合物也可含有共价键,如氢氧化钠中含H—O共价键,B错误;
C.离子键的强弱可以用离子半径以及所带的电荷来衡量,离子半径越小,所带电荷越多,离子键越强,C正确;
D.离子键不仅仅是吸引作用也有排斥作用,D错误;
故选C。
11.答案:D
解析:A.离子键是指阴、阳离子之间的静电作用,包括引力和斥力,A错误;
B.不是只有活泼的金属元素和活泼的非金属元素之间才能形成离子键,如铵离子与氯离子也能形成离子键,B错误;
C.离子键的作用不仅局限于相邻的两个阴、阳离子之间,还存在于原子核和电子之间,C错误;
D.CaO、NaCl、NaOH都是由活泼金属阳离子与阴离子构成的,均存在离子键,都是离子化合物,D正确;
故选D。
12.答案:D
解析:A.离子键是阴、阳离子之间强烈的相互作用,既有静电引力也有静电斥力,A不正确;
B.活泼非金属原子与活泼金属原子得失电子后能形成离子键,但若金属或非金属不活泼,也可能形成共价键,如中Al与Cl原子间就形成共价键,B不正确;
C.在化合物中,Ca失去的2个电子分给了2个Cl,每个Cl得到1个电子后,最外层达到了8电子相对稳定结构,所以两个氯离子之间不存在共价键,两个阴离子之间不可能形成离子键,C不正确;
D.离子键在阴、阳离子间形成,则含有离子键的化合物中含有阴离子和阳离子,所以一定是离子化合物,D正确;
故选D。
13.答案:C
解析:A.阴、阳离子通过静电作用所形成的强烈相互作用称为离子键,静电作用包括静电吸引和静电排斥两种作用,A错误;B.第IA族元素包括H和碱金属元素,H元素的原子和第VIA族元素原子之间通过共价键结合形成共价化合物,如HCl分子中存在共价键;而Na等碱金属与第ⅦA族元素原子之间通过电子得失形成阴、阳离子,离子之间通过离子键结合形成离子化合物,B错误;C.元素周期表中第一周期元素包括H、He,H原子与He原子之间不能形成离子键,C正确;D.元素周期表中第IA族元素间可能形成离子键,如NaH为离子化合物,与之间通过离子键结合形成离子化合物,D错误:故合理选项是C。
14.答案:(1)①;⑤;④;②;③
(2)
(3);H—O—O—H
解析:(1)NaCl中钠离子和氯离子之间只存在离子键;NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在极性共价键;中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在非极性共价键;中N原子之间只存在非极性共价键;是共价化合物,S原子与H原子间存在极性共价键;中H原子和O原子之间存在极性共价键,O与O原子之间为非极性键;故答案为:①;⑤;④;②;③;
(2)氯化钠形成过程中,钠原子失去1个电子形成钠离子,氯原子得到1个电子形成氯离子,阴阳离子间通过离子键结合,用电子式表示为:;
(3)氮气分子中氮原子间通过氮氮三键结合,结构式为:;双氧水分子中氧原子与氢原子间均以共价键结合,结构式为:H—O—O—H。
15.答案:(1)⑤
(2)⑦
(3)④⑥
(4)共价键;离子键
解析:(4)①是非金属单质,只含有非极性键;②是离子化合物,其含有离子键和非极性键;③HCl是共价化合物,分子中只含有极性键;④NaClO是离子化合物,其含有离子键和极性键;⑤是离子化合物,其含有离子键;⑥是离子化合物,其含有离子键和极性键;⑦是共价化合物,分子中含有极性键和非极性键。氯化氢溶于水得到盐酸,氯化氢在水分子作用下破坏共价键:硫酸氢钠在熔化时只破坏离子键。
