2.1原子核外电子的运动 同步课时作业(含答案)高二化学苏教版(2019)选择性必修二
文档属性
| 名称 | 2.1原子核外电子的运动 同步课时作业(含答案)高二化学苏教版(2019)选择性必修二 |
|
|
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-27 00:00:00 | ||
图片预览




文档简介
(4)2.1原子核外电子的运动——高二化学苏教版(2019)选择性必修二同步课时作业
1.人们对原子结构的认识有一个不断深化的过程,下列先后顺序中符合史实的是( )
①道尔顿提出的原子论;②卢瑟福的原子结构行星模型;
③玻尔的原子轨道模型;④汤姆生提出的葡萄干面包原子模型。
A.①④②③ B.③①④② C.③②①④ D.③①②④
2.下列各组多电子原子的原子轨道能量高低比较中,错误的是( )
A.2s<2p B.3px<3py C.3s<3d D.4s<4p
3.若将原子的电子排布式写成,它违背了( )
A.能量守恒原理 B.泡利原理 C.能量最低原理 D.洪特规则
4.下列叙述中,正确的是
A.S、D、d能级所含有的原子轨道数分别为1、3、5
B.各电子层的能级都是从S能级开始,到f能级结束
C.不同的电子层所含的S能级的原子轨道数是不同的
D.各电子层含有的原子轨道数为
5.下列化学用语表述正确的是( )
A.的电子式:
B.p能级的电子云轮廓图:
C.基态锗(Ge)原子的简化电子排布式:
D.基态As原子的价层电子轨道表示式:
6.下列化学用语表述正确的是( )
A.镁原子由时,原子释放能量,由激发态转化成基态
B.基态Se的外围电子排布式:
C.基态铍原子最外层电子的电子云图为:
D.电子仅在激发态跃迁到基态时才会产生原子光谱
7.下列对电子排布式或轨道表示式的书写评价正确的是( )
选项 电子排布式或轨道表示式 评价
A 原子的电子排布式: 正确
B N原子的轨道表示式: 错误;违反洪特规则
C O原子的轨道表示式: 错误;违反泡利原理
D 的电子排布式: 正确
A.A B.B C.C D.D
8.若某基态原子的外围电子排布为,则下列说法正确的是( )
A.该元素原子最外层共有3个电子
B.该元素原子M能层共有8个电子
C.该元素位于周期表第4周期第ⅠB族
D.该元素原子处于能量最低状态时,原子中共有1个未成对电子
9.以炼锌厂的烟道灰(主要成分为,含少量的、、)为原料可生产草酸锌晶体(),下列说法正确的是( )
A.所在周期的元素中,未成对电子数最多的是
B.基态的核外电子空间运动状态有24种
C.基态原子的核外电子排布符合构造原理
D.基态和的d轨道都处于半充满状态
10.下列说法正确的是( )
A.原子的核外电子排布式是:
B.最外层电子排布式为的基态原子所对应元素一定是金属元素
C.原子核外电子填充3p、3d、4s能级的顺序为3p→4s→3d
D.轨道能量不相同
11.下列基态原子的电子排布式、价电子排布式或排布图不正确的是( )
A. B.
C. D.
12.下列各项叙述中正确的是( )
A.镁原子由时,原子释放能量,由基态转化成激发态
B.第四能层有4个能级,最多容纳36个电子
C.所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同
D.基态的电子排布式是
13.元素X、Y、Z在周期表中的相对位置如图所示。已知Y元素原子的价电子排布式为,则下列说法不正确的是( )
X
Y
Z
A.Y元素原子的价电子排布式为
B.Y元素在周期表的第三周期ⅥA族
C.X元素所在周期中所含非金属元素最多
D.Z元素原子的核外电子排布式为
14.按照下列元素基态原子的电子排布特征回答问题:A元素的原子中只有一个能层且只含1个电子;B元素的原子3p轨道上得到1个电子后不能再容纳电子;C元素的原子2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反;D元素的原子第三能层上有8个电子,第四能层上只有1个电子;E元素的原子最外层电子排布式为;F为金属元素且原子核外p电子数和s电子数相等。
(1)写出由A、B、C、D中的三种元素组成的化合物的化学式:______(至少写出5个)。
(2)写出E元素基态原子的核外电子排布式______;F元素基态原子的核外电子轨道表示式为______。
(3)写出用上述元素组成的物质制得A的单质的化学方程式:______、______(至少写出2个)。
(4)检验某溶液中是否含有,可通过______试验来实现;检验某溶液中是否含有,通常所用的试剂是______和______。
15.在传统克劳斯工艺制备的基础上,科研工作者提出分解制备同时获取的新方法,反应如下:
反应1:
反应2:
(1)传统克劳斯工艺反应如下,则________。
(2)按照新方法,向恒容容器中通入混合气体。的转化率与温度关系曲线如图1所示,三条曲线分别代表平衡转化率及相同反应时间内有、无催化剂的转化率。
①代表平衡转化率的曲线是________(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
②________0(填“<”“=”或“>”);新方法加入部分,而未采用直接分解法的原因是________。
③P点,此时________,反应2的平衡常数________。
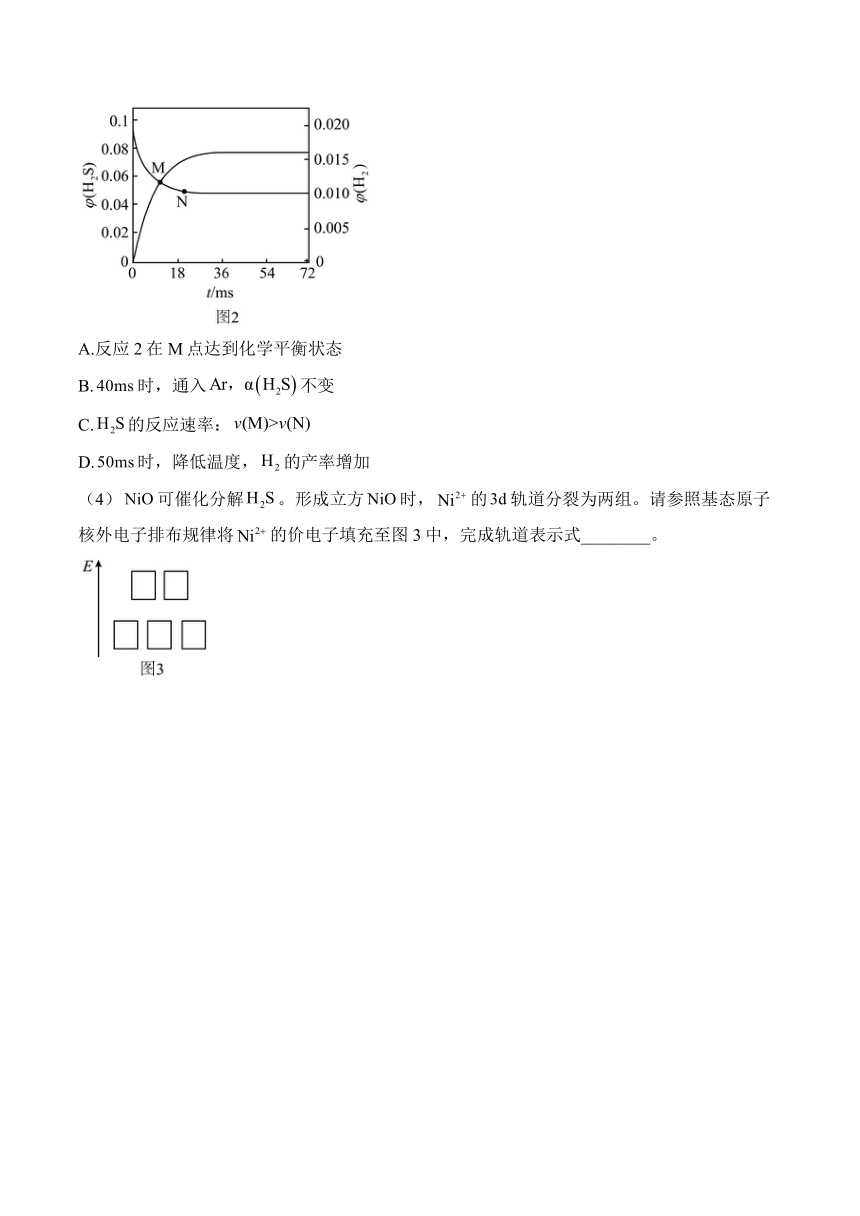
(3)时,恒容容器中发生反应2,和的体积分数随时间变化曲线如图2所示。下列说法正确的是_______。
A.反应2在M点达到化学平衡状态
B.时,通入不变
C.的反应速率:
D.时,降低温度,的产率增加
(4)可催化分解。形成立方时,的轨道分裂为两组。请参照基态原子核外电子排布规律将的价电子填充至图3中,完成轨道表示式________。
答案以及解析
1.答案:A
解析:①1808年,英国科学家道尔顿提出了原子论;
②1911年卢瑟福提出了原子结构行星模型;
③1913年波尔提出了原子轨道模型;
④1904年汤姆孙提出了葡萄干面包原子模型;
故先后顺序为①④②③,答案选A。
2.答案:B
解析:同一电子层上原子轨道的能量高低为ns3.答案:D
解析:D项,洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同,该电子排布式中P轨道有自旋方向相反的电子存在,违反了洪特规则,故D项正确;A项,能量守恒原理是指能量既不会无中生有,也不会自行消灭,只会从一种形式转化为另一种形式,而转化时总能量是恒定的,与原子的电子排布无关,故A项错误;B项,泡利不相容原理是指一个轨道中最多容纳2个电子,且自旋方向相反,该原子排布式没有违背泡利不相容原理,故B项错误;C项,在不违背泡利不相容原理的前提下,核外电子总是尽先占有能量最低的轨道,只有当能量最低的轨道占满后,电子才依次进入能量较高的轨道,也就是尽可能使体系能量最低,该原子排布式没有违背能量最低原理,故C项错误。综上所述,本题正确答案为D。
4.答案:A
解析:各能级的原子轨道数按s、p、d的顺序依次为1、3、5,A项正确;各电子层的能级都是从s能级开始,每个电子层上能级数与电子层数相等,所以有的电子层不含f能级,B项错误;s能级在不同的电子层中所含的原子轨道数都为1,C项错误:各电子层含有的原子轨道数为,D项错误。
5.答案:B
解析:A.为共价型化合物,电子式为,A错误;
B.p能级有3个相互垂直的电子云,分别为px、py、pz,p电子云轮廓图为哑铃形,则p能级的电子云轮廓图:,B正确;
C.基态锗(Ge)原子的电子排布式为,C错误;
D.基态As原子的价层电子排布式为,价层电子轨道表示式为,D错误;
故答案为:B。
6.答案:A
解析:镁原子由时,原子释放能量,由激发态转化成基态,A正确;
基态Se的外围电子排布式为,B错误;
基态Be的最外层电子排布式为,则基态铍原子最外层电子的电子云轮廓图为球形,C错误;
原子光谱分为吸收光谱和发射光谱,电子由基态跃迁到激发态,或由激发态跃迁到基态,都会产生原子光谱,D错误。
7.答案:A
解析:A.基态原子的电子排布式:,遵循构造原理,A正确;
B.相同轨道中的两个电子运动方向相反,违反了泡利不相容原理,B错误;
C.电子应先充满同能级的轨道,违反了洪特规则,C错误;
D.Br-的电子排布式:,D错误;
故选A。
8.答案:D
解析:A.由基态原子的外围电子排布可知该元素最外层是第4层,共有2个电子,故A错误;B.M层能级有3s、3p、3d,该元素原子M层上共有9个电子,故B错误;C.该元素位于第四周期第IB族,故C错误;D.该元素原子处于能量最低状态时,原子中共有1个未成对电子,为3,故D正确。故选:D。
9.答案:A
解析:A.所在周期为第四周期,其中基态Cr原子价电子排布为3d54s1,该周期中未成对电子数最多的是,故A正确;
B.把电子在原子核外的一个空间运动状态称为一个原子轨道,因而空间运动状态个数等于轨道数;基态原子核外电子排布为,核外电子空间运动状态有14种,B错误;
C.原子中不同能级电子能量从小到大顺序是1s、2s、2p、3s、3p、4s、3d;基态Cu原子核外电子排布为,是因为3d处于全满较稳定状态,不符合构造原理,C错误;
D.基态原子核外电子排布为,处于半充满状态;基态原子核外电子排布为,处于全满状态,D错误;
故选A。
10.答案:C
解析:A.原子根据半充满稳定性更好,其核外电子排布式是:,A错误;
B.最外层电子排布式为的基态原子可能是氢元素,也可能是金属元素,B错误;
C.根据能量最低原理,原子核外电子填充3p、3d、4s能级的顺序为3p→4s→3d,C正确;
D.轨道为简并轨道,能量相同,只是伸展方向不同,D错误;
故选C。
11.答案:B
解析:A.Al原子的最外电子层为第三层,含有3个电子,则Al的基态原子的价电子排布式,故A正确;
B.As原子核外有33个电子,电子排布式为或,故B错误;
C.Ar原子的最外电子层为第三层,含有8个电子,Ar的价电子排布式为,故C正确;
D.Ni的核外有28个电子,4s轨道有2个电子,3d轨道有8个电子,Ni原子的价电子排布式为,价电子排布图为,故D正确。
故选B。
12.答案:C
解析:A.镁原子由基态转化为激发态,要吸收能量,A错误;
B.第四能层有4个能级,排满状态为,最多容纳32个电子,B错误;
C.s轨道的形状为球形,但电子层不同,则半径不同,C正确;
D.原子轨道处于全空、全满或半充满状态时,能量最低,基态(24号元素)的核外电子排布式应是,D错误;
故选C。
13.答案:A
解析:s能级最多只能容纳2个电子,故,n=3,Y元素原子的价层电子排布为,Y为S元素,则X为F元素,Z为As元素。S元素原子的价层电子排布为,A错误;S元素位于元素周期表中第三周期第ⅠA族,B正确;X为F元素,处于第二周期,含有6种非金属元素,所含非金属元素最多,C正确;Z是33号元素As,核外电子排布式为,D正确。
14.答案:(1)、、、、
(2);
(3);
(4)焰色;溶液;稀硝酸
解析:A元素的原子中只有一个能层且只含1个电子,故A为H;B元素的原子3p轨道上得到1个电子后不能再容纳外来电子,所以B为Cl;C元素的原子2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反,所以C为O;D元素的原子第三能层上有8个电子,第四能层上只有1个电子,所以D为K;E元素的原子最外层电子排布式为,所以E为Ar;F为金属元素且原子核外p电子数和s电子数相等,则F为Mg,据此解题。
(1)由A、B、C、D中的三种元素组成的化合物的化学式为、、、、等;故答案为:、、、、。
(2)Ar基态原子的核外电子排布式为:;Mg基态原子的核外电子轨道表示式为:;故答案为:;。
(3)利用上述元素组成的物质制备氢气的化学方程式有,;
故答案为:;。
(4)检验某溶液中是否含有,可以通过焰色试验来实现;检验某溶液中是否含有,通常使用的试剂是溶液和稀硝酸;故答案为:焰色;溶液;稀硝酸。
15.答案:(1)
(2)Ⅲ;>;使与反应生成水,减小的浓度,使反应2平衡正向移动;;
(3)BC
(4)
解析:(1)根据盖斯定律(④+③)得,;
(2)①催化剂不影响转化率,只影响速率,相同反应时间有、无催化剂的转化率的曲线最终会重叠,故平衡转化率曲线是Ⅲ;
③向恒容容器中通入混合气体,则,,设生成了2xmol和2ymol,,,P点的转化率50%,,,解得y=,x=,;;
(3)A.化学平衡状态是指各组分浓度不再变化,反应2在M点未达到平衡,因在M点后体积分数依然在改变,A错误;
B.恒容容器中,时已达到平衡,通入不影响平衡移动,故不变,B正确;
C.M点的的浓度高于N点,故反应速率:,C正确;
D.时,反应2为吸热反应,降低温度平衡向放热方向移动,平衡逆向移动,的产率减小,D错误;
故选BC;
(4)的价层电子排布式为,原子核外电子排布先排能量低再排能量高,且根据泡利不相容原理轨道表示式。
1.人们对原子结构的认识有一个不断深化的过程,下列先后顺序中符合史实的是( )
①道尔顿提出的原子论;②卢瑟福的原子结构行星模型;
③玻尔的原子轨道模型;④汤姆生提出的葡萄干面包原子模型。
A.①④②③ B.③①④② C.③②①④ D.③①②④
2.下列各组多电子原子的原子轨道能量高低比较中,错误的是( )
A.2s<2p B.3px<3py C.3s<3d D.4s<4p
3.若将原子的电子排布式写成,它违背了( )
A.能量守恒原理 B.泡利原理 C.能量最低原理 D.洪特规则
4.下列叙述中,正确的是
A.S、D、d能级所含有的原子轨道数分别为1、3、5
B.各电子层的能级都是从S能级开始,到f能级结束
C.不同的电子层所含的S能级的原子轨道数是不同的
D.各电子层含有的原子轨道数为
5.下列化学用语表述正确的是( )
A.的电子式:
B.p能级的电子云轮廓图:
C.基态锗(Ge)原子的简化电子排布式:
D.基态As原子的价层电子轨道表示式:
6.下列化学用语表述正确的是( )
A.镁原子由时,原子释放能量,由激发态转化成基态
B.基态Se的外围电子排布式:
C.基态铍原子最外层电子的电子云图为:
D.电子仅在激发态跃迁到基态时才会产生原子光谱
7.下列对电子排布式或轨道表示式的书写评价正确的是( )
选项 电子排布式或轨道表示式 评价
A 原子的电子排布式: 正确
B N原子的轨道表示式: 错误;违反洪特规则
C O原子的轨道表示式: 错误;违反泡利原理
D 的电子排布式: 正确
A.A B.B C.C D.D
8.若某基态原子的外围电子排布为,则下列说法正确的是( )
A.该元素原子最外层共有3个电子
B.该元素原子M能层共有8个电子
C.该元素位于周期表第4周期第ⅠB族
D.该元素原子处于能量最低状态时,原子中共有1个未成对电子
9.以炼锌厂的烟道灰(主要成分为,含少量的、、)为原料可生产草酸锌晶体(),下列说法正确的是( )
A.所在周期的元素中,未成对电子数最多的是
B.基态的核外电子空间运动状态有24种
C.基态原子的核外电子排布符合构造原理
D.基态和的d轨道都处于半充满状态
10.下列说法正确的是( )
A.原子的核外电子排布式是:
B.最外层电子排布式为的基态原子所对应元素一定是金属元素
C.原子核外电子填充3p、3d、4s能级的顺序为3p→4s→3d
D.轨道能量不相同
11.下列基态原子的电子排布式、价电子排布式或排布图不正确的是( )
A. B.
C. D.
12.下列各项叙述中正确的是( )
A.镁原子由时,原子释放能量,由基态转化成激发态
B.第四能层有4个能级,最多容纳36个电子
C.所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同
D.基态的电子排布式是
13.元素X、Y、Z在周期表中的相对位置如图所示。已知Y元素原子的价电子排布式为,则下列说法不正确的是( )
X
Y
Z
A.Y元素原子的价电子排布式为
B.Y元素在周期表的第三周期ⅥA族
C.X元素所在周期中所含非金属元素最多
D.Z元素原子的核外电子排布式为
14.按照下列元素基态原子的电子排布特征回答问题:A元素的原子中只有一个能层且只含1个电子;B元素的原子3p轨道上得到1个电子后不能再容纳电子;C元素的原子2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反;D元素的原子第三能层上有8个电子,第四能层上只有1个电子;E元素的原子最外层电子排布式为;F为金属元素且原子核外p电子数和s电子数相等。
(1)写出由A、B、C、D中的三种元素组成的化合物的化学式:______(至少写出5个)。
(2)写出E元素基态原子的核外电子排布式______;F元素基态原子的核外电子轨道表示式为______。
(3)写出用上述元素组成的物质制得A的单质的化学方程式:______、______(至少写出2个)。
(4)检验某溶液中是否含有,可通过______试验来实现;检验某溶液中是否含有,通常所用的试剂是______和______。
15.在传统克劳斯工艺制备的基础上,科研工作者提出分解制备同时获取的新方法,反应如下:
反应1:
反应2:
(1)传统克劳斯工艺反应如下,则________。
(2)按照新方法,向恒容容器中通入混合气体。的转化率与温度关系曲线如图1所示,三条曲线分别代表平衡转化率及相同反应时间内有、无催化剂的转化率。
①代表平衡转化率的曲线是________(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
②________0(填“<”“=”或“>”);新方法加入部分,而未采用直接分解法的原因是________。
③P点,此时________,反应2的平衡常数________。
(3)时,恒容容器中发生反应2,和的体积分数随时间变化曲线如图2所示。下列说法正确的是_______。
A.反应2在M点达到化学平衡状态
B.时,通入不变
C.的反应速率:
D.时,降低温度,的产率增加
(4)可催化分解。形成立方时,的轨道分裂为两组。请参照基态原子核外电子排布规律将的价电子填充至图3中,完成轨道表示式________。
答案以及解析
1.答案:A
解析:①1808年,英国科学家道尔顿提出了原子论;
②1911年卢瑟福提出了原子结构行星模型;
③1913年波尔提出了原子轨道模型;
④1904年汤姆孙提出了葡萄干面包原子模型;
故先后顺序为①④②③,答案选A。
2.答案:B
解析:同一电子层上原子轨道的能量高低为ns
解析:D项,洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同,该电子排布式中P轨道有自旋方向相反的电子存在,违反了洪特规则,故D项正确;A项,能量守恒原理是指能量既不会无中生有,也不会自行消灭,只会从一种形式转化为另一种形式,而转化时总能量是恒定的,与原子的电子排布无关,故A项错误;B项,泡利不相容原理是指一个轨道中最多容纳2个电子,且自旋方向相反,该原子排布式没有违背泡利不相容原理,故B项错误;C项,在不违背泡利不相容原理的前提下,核外电子总是尽先占有能量最低的轨道,只有当能量最低的轨道占满后,电子才依次进入能量较高的轨道,也就是尽可能使体系能量最低,该原子排布式没有违背能量最低原理,故C项错误。综上所述,本题正确答案为D。
4.答案:A
解析:各能级的原子轨道数按s、p、d的顺序依次为1、3、5,A项正确;各电子层的能级都是从s能级开始,每个电子层上能级数与电子层数相等,所以有的电子层不含f能级,B项错误;s能级在不同的电子层中所含的原子轨道数都为1,C项错误:各电子层含有的原子轨道数为,D项错误。
5.答案:B
解析:A.为共价型化合物,电子式为,A错误;
B.p能级有3个相互垂直的电子云,分别为px、py、pz,p电子云轮廓图为哑铃形,则p能级的电子云轮廓图:,B正确;
C.基态锗(Ge)原子的电子排布式为,C错误;
D.基态As原子的价层电子排布式为,价层电子轨道表示式为,D错误;
故答案为:B。
6.答案:A
解析:镁原子由时,原子释放能量,由激发态转化成基态,A正确;
基态Se的外围电子排布式为,B错误;
基态Be的最外层电子排布式为,则基态铍原子最外层电子的电子云轮廓图为球形,C错误;
原子光谱分为吸收光谱和发射光谱,电子由基态跃迁到激发态,或由激发态跃迁到基态,都会产生原子光谱,D错误。
7.答案:A
解析:A.基态原子的电子排布式:,遵循构造原理,A正确;
B.相同轨道中的两个电子运动方向相反,违反了泡利不相容原理,B错误;
C.电子应先充满同能级的轨道,违反了洪特规则,C错误;
D.Br-的电子排布式:,D错误;
故选A。
8.答案:D
解析:A.由基态原子的外围电子排布可知该元素最外层是第4层,共有2个电子,故A错误;B.M层能级有3s、3p、3d,该元素原子M层上共有9个电子,故B错误;C.该元素位于第四周期第IB族,故C错误;D.该元素原子处于能量最低状态时,原子中共有1个未成对电子,为3,故D正确。故选:D。
9.答案:A
解析:A.所在周期为第四周期,其中基态Cr原子价电子排布为3d54s1,该周期中未成对电子数最多的是,故A正确;
B.把电子在原子核外的一个空间运动状态称为一个原子轨道,因而空间运动状态个数等于轨道数;基态原子核外电子排布为,核外电子空间运动状态有14种,B错误;
C.原子中不同能级电子能量从小到大顺序是1s、2s、2p、3s、3p、4s、3d;基态Cu原子核外电子排布为,是因为3d处于全满较稳定状态,不符合构造原理,C错误;
D.基态原子核外电子排布为,处于半充满状态;基态原子核外电子排布为,处于全满状态,D错误;
故选A。
10.答案:C
解析:A.原子根据半充满稳定性更好,其核外电子排布式是:,A错误;
B.最外层电子排布式为的基态原子可能是氢元素,也可能是金属元素,B错误;
C.根据能量最低原理,原子核外电子填充3p、3d、4s能级的顺序为3p→4s→3d,C正确;
D.轨道为简并轨道,能量相同,只是伸展方向不同,D错误;
故选C。
11.答案:B
解析:A.Al原子的最外电子层为第三层,含有3个电子,则Al的基态原子的价电子排布式,故A正确;
B.As原子核外有33个电子,电子排布式为或,故B错误;
C.Ar原子的最外电子层为第三层,含有8个电子,Ar的价电子排布式为,故C正确;
D.Ni的核外有28个电子,4s轨道有2个电子,3d轨道有8个电子,Ni原子的价电子排布式为,价电子排布图为,故D正确。
故选B。
12.答案:C
解析:A.镁原子由基态转化为激发态,要吸收能量,A错误;
B.第四能层有4个能级,排满状态为,最多容纳32个电子,B错误;
C.s轨道的形状为球形,但电子层不同,则半径不同,C正确;
D.原子轨道处于全空、全满或半充满状态时,能量最低,基态(24号元素)的核外电子排布式应是,D错误;
故选C。
13.答案:A
解析:s能级最多只能容纳2个电子,故,n=3,Y元素原子的价层电子排布为,Y为S元素,则X为F元素,Z为As元素。S元素原子的价层电子排布为,A错误;S元素位于元素周期表中第三周期第ⅠA族,B正确;X为F元素,处于第二周期,含有6种非金属元素,所含非金属元素最多,C正确;Z是33号元素As,核外电子排布式为,D正确。
14.答案:(1)、、、、
(2);
(3);
(4)焰色;溶液;稀硝酸
解析:A元素的原子中只有一个能层且只含1个电子,故A为H;B元素的原子3p轨道上得到1个电子后不能再容纳外来电子,所以B为Cl;C元素的原子2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反,所以C为O;D元素的原子第三能层上有8个电子,第四能层上只有1个电子,所以D为K;E元素的原子最外层电子排布式为,所以E为Ar;F为金属元素且原子核外p电子数和s电子数相等,则F为Mg,据此解题。
(1)由A、B、C、D中的三种元素组成的化合物的化学式为、、、、等;故答案为:、、、、。
(2)Ar基态原子的核外电子排布式为:;Mg基态原子的核外电子轨道表示式为:;故答案为:;。
(3)利用上述元素组成的物质制备氢气的化学方程式有,;
故答案为:;。
(4)检验某溶液中是否含有,可以通过焰色试验来实现;检验某溶液中是否含有,通常使用的试剂是溶液和稀硝酸;故答案为:焰色;溶液;稀硝酸。
15.答案:(1)
(2)Ⅲ;>;使与反应生成水,减小的浓度,使反应2平衡正向移动;;
(3)BC
(4)
解析:(1)根据盖斯定律(④+③)得,;
(2)①催化剂不影响转化率,只影响速率,相同反应时间有、无催化剂的转化率的曲线最终会重叠,故平衡转化率曲线是Ⅲ;
③向恒容容器中通入混合气体,则,,设生成了2xmol和2ymol,,,P点的转化率50%,,,解得y=,x=,;;
(3)A.化学平衡状态是指各组分浓度不再变化,反应2在M点未达到平衡,因在M点后体积分数依然在改变,A错误;
B.恒容容器中,时已达到平衡,通入不影响平衡移动,故不变,B正确;
C.M点的的浓度高于N点,故反应速率:,C正确;
D.时,反应2为吸热反应,降低温度平衡向放热方向移动,平衡逆向移动,的产率减小,D错误;
故选BC;
(4)的价层电子排布式为,原子核外电子排布先排能量低再排能量高,且根据泡利不相容原理轨道表示式。
