江苏省盐城市三校联考2024-2025学年高一下学期4月期中化学(选修)试题(含答案)
文档属性
| 名称 | 江苏省盐城市三校联考2024-2025学年高一下学期4月期中化学(选修)试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 743.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-26 12:40:13 | ||
图片预览


文档简介
2024-2025学年第二学期高一年级期中考试
化学试题
命题: 审核:
注意事项:
1.本试卷分选择题和非选择题两部分,共100分。考试时间75分钟。
2.可能用到的相对原子质量:H-1 C-12 O-16
3.答案一律填涂到答题纸指定的区域,否则答题无效。
一、选择题:(本大题共13小题,每小题3分,共39分。每小题只有一个选项符合题意。)
1.今年世界环境日的主题是“共建清洁美丽世界”。下列做法不应提倡的是
A. 秸秆就地焚烧,增强土壤肥效 B. 拒绝露天烧烤,合理健康饮食
C. 推广电动汽车,践行绿色交通 D. 净化工业尾气,减少雾霾生成
2.反应2NH3+NaClO=N2H4+NaCl+H2O可用于制备火箭推进剂的燃料N2H4。下列有关说法正确的是
A. 中子数为8的氮原子可表示为:N B. Cl-的结构示意图:
C. NaCl的电子式为: D. N2H4的结构式为:
3.实验是学习和研究化学的重要手段,下列实验原理和装置均正确的是
A.制取 B.制取NH3
C.验证漂白性 D.配制NaOH溶液
阅读下列材料,完成下面4-6小题:氮的常见氢化物有氨(NH3)和肼(N2H4)。氨用于生产硝酸、铵盐、纯碱等;Mg3N2与水反应生成NH3,液氨发生微弱电离产生NH,液氨能与碱金属(如Na、K)反应产生氢气。肼具有强还原性,是一种常用的火箭推进剂的燃料,其标准燃烧热为-624kJ/mol。工业上常用尿素CO(NH2)2、NaClO和NaOH溶液一起反应制得N2H4。
4.氮及其化合物的转化具有重要应用。下列说法不正确的是
A. 自然固氮、人工固氮都是N2转化为NH3
B. NH3具有还原性,用浓氨水检验氯气管道是否泄漏
C. 工业上通过NH3催化氧化等反应生产HNO3
D. 多种形态的氮及其化合物间的转化形成了自然界的“氮循环”
5.下列化学反应表示正确的是
A. 金属钠和液氨反应:2NH3+2Na=2NaNH2+H2↑
B. 氨水和过量SO2反应:SO2+2NH3·H2O=(NH4)2SO3+H2O
C. N2H4的燃烧热热化学方程为:N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-624 kJ mol-1
D. 尿素、NaClO和NaOH溶液制得N2H4:CO(NH2)2+ClO-=N2H4+CO2+Cl-
6.下列说法正确的是
A. 向氨饱和的食盐水中通入CO2气体可得到纯碱沉淀
B. 制取肼时,应向溶液中滴加尿素和的混合溶液
C. Mg3N2与水反应生成NH3和MgO
D. 将蘸有浓氨水与浓盐酸的玻璃棒相互靠近时会有白烟生成
7.为了探究反应的能量变化情况,某同学设计了
以下实验装置(如图),当将A、B两试剂混合时,现象为:看到U形管
中左侧液面下降,右侧液面上升。
下列有关说法正确的是
A.装置中的试剂:A为稀硫酸,B为锌粒
B.根据现象判断,该反应为吸热反应
C.反应物化学键键能总和小于生成物化学键键能总和
D.实验过程中,参加反应的和具有的总能量低于生成的和具有的总能量
将1 mol氨基甲酸铵(H2NCOONH4)置于密闭容器中(假设容器体积不变,固体试样体积忽略不计)。在恒定温度下使其分解达到平衡:H2NCOONH4(s)2NH3(g)+CO2(g)。
下列能说明该化学反应达到平衡状态的是
A.反应开始时正反应速率大于逆反应速率 B.体系压强保持不变
C.c(NH3)∶c(CO2)=2∶1 D.CO2的体积分数保持不变
9.碱性锌锰电池的总反应为,
电池构造示意图如图所示。下列有关说法不正确的是
A. 电池工作时,MnO2发生还原反应
B. 电池工作时,OH-通过隔膜向负极移动
C. 反应中每生成1molMnOOH,转移电子数为6.02×1023
D. 将该电池的正极与惰性电极相连,负极与钢铁件相连,将两极
放于食盐水中,进行模拟牺牲阳极的阴极保护法实验
10.二氧化碳加氢制甲醇的总反应可表示为
CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H,
认为通过如下步骤来实现:
①CO2(g)+H2(g)CO(g)+H2O(g) △H1
②CO(g)+2H2(g)CH3OH(g) △H2
体系能量变化如图所示。下列有关说法不正确的是
A. △H1>△H2
B. 反应②逆反应的活化能大于反应①逆反应的活化能
C. 总反应的△H>0
D. 二氧化碳加氢制甲醇的反应有利于实现“碳中和”
11. 室温下,根据下列实验过程及现象,能验证相应实验结论的是
选项 实验过程及现象 实验结论
A 往某溶液中加入盐酸产生无色气体 该溶液一定含有
B 将湿润的有色布条放入干燥的氯气,布条褪色 氯气具有漂白性
C 用洁净的铂丝蘸取某溶液灼烧,火焰呈黄色 溶液中不含钾元素
D 向蔗糖中滴加几滴蒸馏水,再加入浓硫酸,产生海绵状黑色物质,并产生刺激性气味气体 浓硫酸体现了吸水性、脱水性和强氧化性
A. A B. B C. C D. D
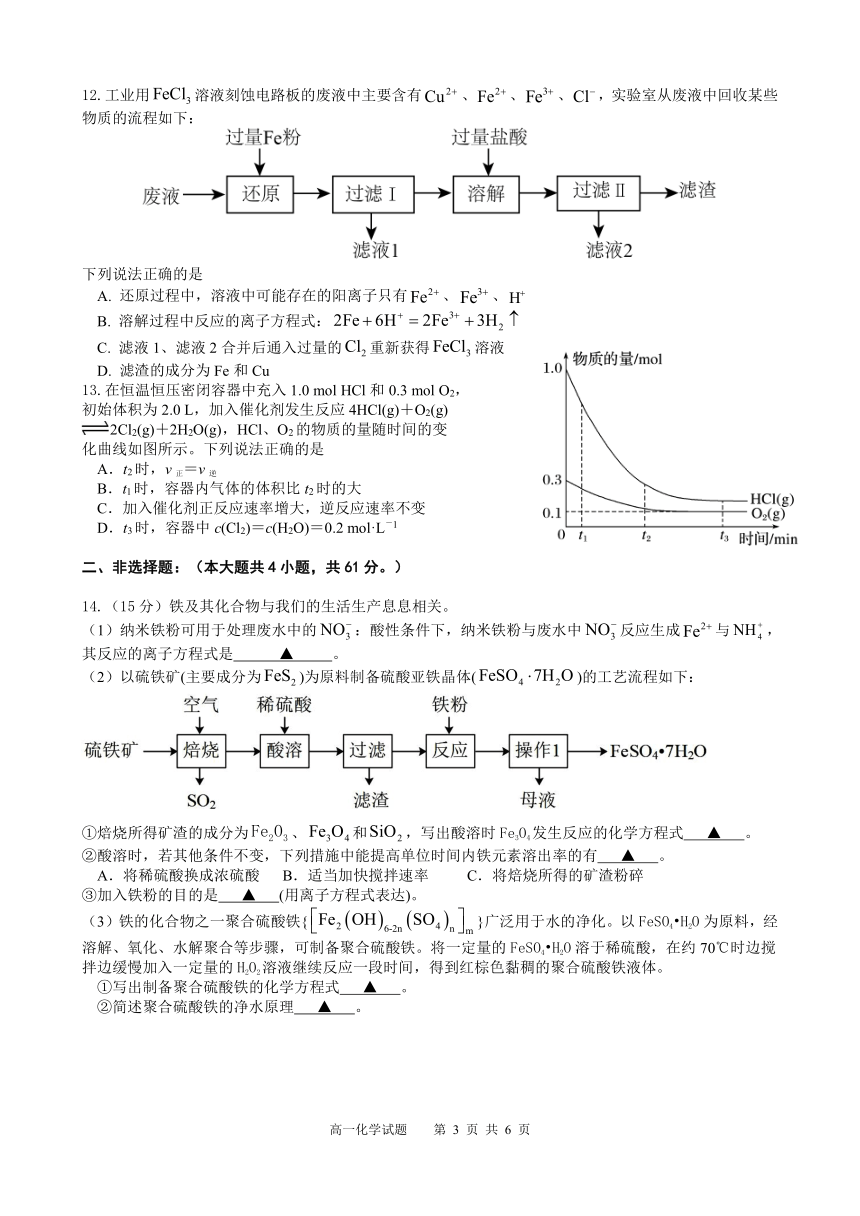
12.工业用溶液刻蚀电路板的废液中主要含有、、、,实验室从废液中回收某些物质的流程如下:
下列说法正确的是
A. 还原过程中,溶液中可能存在的阳离子只有、、
B. 溶解过程中反应的离子方程式:
C. 滤液1、滤液2合并后通入过量的重新获得溶液
D. 滤渣的成分为Fe和Cu
13.在恒温恒压密闭容器中充入1.0 mol HCl和0.3 mol O2,
初始体积为2.0 L,加入催化剂发生反应4HCl(g)+O2(g)
2Cl2(g)+2H2O(g),HCl、O2的物质的量随时间的变
化曲线如图所示。下列说法正确的是
A.t2时,v正=v逆
B.t1时,容器内气体的体积比t2时的大
C.加入催化剂正反应速率增大,逆反应速率不变
D.t3时,容器中c(Cl2)=c(H2O)=0.2 mol·L-1
二、非选择题:(本大题共4小题,共61分。)
14.(15分)铁及其化合物与我们的生活生产息息相关。
(1)纳米铁粉可用于处理废水中的:酸性条件下,纳米铁粉与废水中反应生成与,其反应的离子方程式是 ▲ 。
(2)以硫铁矿(主要成分为)为原料制备硫酸亚铁晶体()的工艺流程如下:
①焙烧所得矿渣的成分为、和,写出酸溶时Fe3O4发生反应的化学方程式 ▲ 。
②酸溶时,若其他条件不变,下列措施中能提高单位时间内铁元素溶出率的有 ▲ 。
A.将稀硫酸换成浓硫酸 B.适当加快搅拌速率 C.将焙烧所得的矿渣粉碎
③加入铁粉的目的是 ▲ (用离子方程式表达)。
(3)铁的化合物之一聚合硫酸铁{}广泛用于水的净化。以FeSO4 H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。将一定量的FeSO4 H2O溶于稀硫酸,在约70℃时边搅拌边缓慢加入一定量的H2O2溶液继续反应一段时间,得到红棕色黏稠的聚合硫酸铁液体。
①写出制备聚合硫酸铁的化学方程式 ▲ 。
②简述聚合硫酸铁的净水原理 ▲ 。
15.(15分)空气中含量的控制和资源利用具有重要意义。合成尿素[]是利用的途径之一。尿素合成主要通过下列反应实现:
反应Ⅰ:2NH3(g) + CO2(g)H2NCOONH4(s) 氨基甲酸铵 ΔH1=-272
反应Ⅱ:H2NCOONH4(s) CO(NH2)2(s)+H2O(g) ΔH2=
总反应III:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g) H3
(1)该反应的H3 = ▲ 。
(2)研究反应Ⅰ的逆反应对提高尿素产率有重要意义。某研究学习小组把一定量的氨基甲酸铵固体放入容积为2 L的密闭容器中,在T℃下分解:NH2COONH4(s)2NH3(g) + CO2(g),t1时达到化学平衡。c(CO2)随时间t变化曲线如图中曲线①所示。
①在0~t1时间内该化学反应速率v (NH3) = ▲ 。
②请在图中画出0~t2时间内c(NH3)随时间t变化的曲线。
③利用电解装置可以将尾气中的NO转化为尿素[尿素的
化学式为CO(NH2)2,其中碳的化合价为+4价,属于非电解
质],工作原理如图。
ⅰ.a电极的名称为 ▲ 。
ⅱ.该电解反应的化学方程式为 ▲ 。
16.(15分)浩瀚的大海中蕴藏着丰富的化学资源。
(1)“吹出法”是工业上常用的一种海水提溴技术,该技术主要流程如下:
①热空气吹出溴是利用了 ▲ (填溴的一种物理性质)。
②写出“吸收”步骤中反应的化学方程式: ▲ 。
③“分离”操作名称为 ▲ 。
“吹出法”中的“吸收”及后续步骤的工艺也可采用如下流程:
写出步骤②中反应的离子方程式: ▲ 。
(3)溴量法测定废水中苯酚()含量(每升水中含苯酚的质量,单位)的过程如下(废水中不含干扰测定的物质)。
步骤1 向盛有溶液的锥形瓶中加入过量,加酸化一段时间:
步骤2 加入废水,充分反应;
步骤3 向锥形瓶中加入过量,生成的恰好和反应。
计算该废水中苯酚的含量(写出计算过程) ▲ (己知:)。
(16分)有效去除大气中的氮氧化物(NOx)和水体中
的氮是环境保护的重要课题。
(1)乙烯还原法。目前,科学家在研究一种以乙烯作为还
原剂的脱硝(NO)原理,其脱硝机理示意图如图1所示。
写出该脱硝原理总反应的化学方程式: ▲ ;
NaClO2氧化法。按一定流速将含NO的废气通过
碱性NaClO2溶液中,NO可转化成被吸收。
请写出NO与反应的离子方程式 ▲ ;
(3)氢气催化还原法。
主反应:2NO(g) +2 H2(g)N2 (g)+ 2H2O(g) ΔH1= a
副反应:2NO(g) + H2(g)N2O (g)+ H2O(g) ΔH2= b
①则反应:2NO(g)+N2(g) 2N2O(g) = ▲ 。
②某温度下的体积分数对还原NO反应的影响如图2所示。当的体积分数大于时,的体积分数呈下降趋势,原因是 ▲ ;
(4)煤焦吸附还原法。煤焦吸附还原含NO烟气,将原煤经热解、冷却得到煤焦,NO的脱除主要含吸附和化学还原两个过程,煤焦表面存在的官能团有利于NO的吸附,其数量与煤焦中氢碳质量比的值密切相关。热解温度为500℃、900℃得到的煤焦分别用S-500、S-900表示,相关信息如表:
煤焦 元素分析(%)
C H
S-500 80.79 2.76
S-900 84.26 0.82
则相同温度下,S-900对NO的脱除率比S-500的低,可能的原因是 ▲ ;
(5)有人研究了用纳米零价铁去除水体中。控制其他条件不变,用纳米零价铁还原水体中的,测得溶液中、、浓度随时间变化如图4所示。与初始溶液中氮浓度相比,反应过程中溶液中的总氮(、、)浓度减少,其可能原因是 ▲ 。
2024-2025学年第二学期高一年级期中考试
化学参考答案
一.选择题(每小题3分,共39分)
1.A 2.B 3.B 4.A 5.A 6.D 7.C 8.B 9.D 10.C 11.D 12.C 13.B
二.非选择题(共61分)
14.(15分)(1) (3分)
(2)① Fe3O4+4H2SO4 = FeSO4 + Fe2(SO4)3 + 4H2O (3分)
②. BC (2分)
③. (2分)
(3)①.2mFeSO4 H2O + (n–2)mH2SO4 + mH2O2 [Fe2(OH)6-2n(SO4)n]m + 2m(n–1)H2O(3分)
②.聚合硫酸铁溶于水形成胶体,胶体中的胶粒比表面积较大,具有吸附性,能吸附水中的悬浮颗粒物并沉降。(2分)
15.(15分)(1) -134 (3分)
(2) ①. 0.10/t1 mol·L-1·s-1 (3分)
②. (3分)
③ ⅰ. 阴极 (3分)
ⅱ. CO2+2NO+5H2 CO(NH2)2+3H2O (3分)
16.(15分)
(1)①. 溴易挥发 (2分)
②. (3分)
③. 蒸馏 (2分)
(2) (3分)
(3) (5分)
n(Na2S2O3)=4.80×10-3 L × 0.001 mol L-1 = 4.8×10-6 mol
n(I2) = 2.4×10-6 mol (1分)
n(KBrO3)=5.00×10-3 L × 0.0002 mol L-1 = 1×10-6 mol
n(Br2)总 = 3×10-6 mol (1分)
与苯酚反应的溴物质的量:
n(Br2) = 3×10-6 mol- 2.4×10-6 mol = 0.6×10-6 mol (1分)
n(C6H6O) = 0.2×10-6 mol (1分)
m(C6H6O) = 0.2×10-6 mol ×94g/ mol = 18.8×10-6 g
苯酚的含量: 0.376 mg/L (1分)
17.(16分)(1) (3分)
(2)4NO+3ClO2-+4OH- = 4NO3-+3Cl-+2H2O (3分)
①. 2b-a kJ mol-1 (2分)
②. 过量氢气与氮气反应生成了氨气 (2分)
(4)S-900热解温度更高,煤焦中氢碳质量比的值小,表面官能团数量减少,不利于吸附 (3分)
(5) 部分硝酸根被还原为氮气或一氧化氮逸出水体 (3分)
说明:化学方程式或离子方程式书写反应物生成物化学式正确,配平或条件不正确扣1分;
计算和文字表述答案合理同样给分;其它按答案给分。
化学试题
命题: 审核:
注意事项:
1.本试卷分选择题和非选择题两部分,共100分。考试时间75分钟。
2.可能用到的相对原子质量:H-1 C-12 O-16
3.答案一律填涂到答题纸指定的区域,否则答题无效。
一、选择题:(本大题共13小题,每小题3分,共39分。每小题只有一个选项符合题意。)
1.今年世界环境日的主题是“共建清洁美丽世界”。下列做法不应提倡的是
A. 秸秆就地焚烧,增强土壤肥效 B. 拒绝露天烧烤,合理健康饮食
C. 推广电动汽车,践行绿色交通 D. 净化工业尾气,减少雾霾生成
2.反应2NH3+NaClO=N2H4+NaCl+H2O可用于制备火箭推进剂的燃料N2H4。下列有关说法正确的是
A. 中子数为8的氮原子可表示为:N B. Cl-的结构示意图:
C. NaCl的电子式为: D. N2H4的结构式为:
3.实验是学习和研究化学的重要手段,下列实验原理和装置均正确的是
A.制取 B.制取NH3
C.验证漂白性 D.配制NaOH溶液
阅读下列材料,完成下面4-6小题:氮的常见氢化物有氨(NH3)和肼(N2H4)。氨用于生产硝酸、铵盐、纯碱等;Mg3N2与水反应生成NH3,液氨发生微弱电离产生NH,液氨能与碱金属(如Na、K)反应产生氢气。肼具有强还原性,是一种常用的火箭推进剂的燃料,其标准燃烧热为-624kJ/mol。工业上常用尿素CO(NH2)2、NaClO和NaOH溶液一起反应制得N2H4。
4.氮及其化合物的转化具有重要应用。下列说法不正确的是
A. 自然固氮、人工固氮都是N2转化为NH3
B. NH3具有还原性,用浓氨水检验氯气管道是否泄漏
C. 工业上通过NH3催化氧化等反应生产HNO3
D. 多种形态的氮及其化合物间的转化形成了自然界的“氮循环”
5.下列化学反应表示正确的是
A. 金属钠和液氨反应:2NH3+2Na=2NaNH2+H2↑
B. 氨水和过量SO2反应:SO2+2NH3·H2O=(NH4)2SO3+H2O
C. N2H4的燃烧热热化学方程为:N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-624 kJ mol-1
D. 尿素、NaClO和NaOH溶液制得N2H4:CO(NH2)2+ClO-=N2H4+CO2+Cl-
6.下列说法正确的是
A. 向氨饱和的食盐水中通入CO2气体可得到纯碱沉淀
B. 制取肼时,应向溶液中滴加尿素和的混合溶液
C. Mg3N2与水反应生成NH3和MgO
D. 将蘸有浓氨水与浓盐酸的玻璃棒相互靠近时会有白烟生成
7.为了探究反应的能量变化情况,某同学设计了
以下实验装置(如图),当将A、B两试剂混合时,现象为:看到U形管
中左侧液面下降,右侧液面上升。
下列有关说法正确的是
A.装置中的试剂:A为稀硫酸,B为锌粒
B.根据现象判断,该反应为吸热反应
C.反应物化学键键能总和小于生成物化学键键能总和
D.实验过程中,参加反应的和具有的总能量低于生成的和具有的总能量
将1 mol氨基甲酸铵(H2NCOONH4)置于密闭容器中(假设容器体积不变,固体试样体积忽略不计)。在恒定温度下使其分解达到平衡:H2NCOONH4(s)2NH3(g)+CO2(g)。
下列能说明该化学反应达到平衡状态的是
A.反应开始时正反应速率大于逆反应速率 B.体系压强保持不变
C.c(NH3)∶c(CO2)=2∶1 D.CO2的体积分数保持不变
9.碱性锌锰电池的总反应为,
电池构造示意图如图所示。下列有关说法不正确的是
A. 电池工作时,MnO2发生还原反应
B. 电池工作时,OH-通过隔膜向负极移动
C. 反应中每生成1molMnOOH,转移电子数为6.02×1023
D. 将该电池的正极与惰性电极相连,负极与钢铁件相连,将两极
放于食盐水中,进行模拟牺牲阳极的阴极保护法实验
10.二氧化碳加氢制甲醇的总反应可表示为
CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H,
认为通过如下步骤来实现:
①CO2(g)+H2(g)CO(g)+H2O(g) △H1
②CO(g)+2H2(g)CH3OH(g) △H2
体系能量变化如图所示。下列有关说法不正确的是
A. △H1>△H2
B. 反应②逆反应的活化能大于反应①逆反应的活化能
C. 总反应的△H>0
D. 二氧化碳加氢制甲醇的反应有利于实现“碳中和”
11. 室温下,根据下列实验过程及现象,能验证相应实验结论的是
选项 实验过程及现象 实验结论
A 往某溶液中加入盐酸产生无色气体 该溶液一定含有
B 将湿润的有色布条放入干燥的氯气,布条褪色 氯气具有漂白性
C 用洁净的铂丝蘸取某溶液灼烧,火焰呈黄色 溶液中不含钾元素
D 向蔗糖中滴加几滴蒸馏水,再加入浓硫酸,产生海绵状黑色物质,并产生刺激性气味气体 浓硫酸体现了吸水性、脱水性和强氧化性
A. A B. B C. C D. D
12.工业用溶液刻蚀电路板的废液中主要含有、、、,实验室从废液中回收某些物质的流程如下:
下列说法正确的是
A. 还原过程中,溶液中可能存在的阳离子只有、、
B. 溶解过程中反应的离子方程式:
C. 滤液1、滤液2合并后通入过量的重新获得溶液
D. 滤渣的成分为Fe和Cu
13.在恒温恒压密闭容器中充入1.0 mol HCl和0.3 mol O2,
初始体积为2.0 L,加入催化剂发生反应4HCl(g)+O2(g)
2Cl2(g)+2H2O(g),HCl、O2的物质的量随时间的变
化曲线如图所示。下列说法正确的是
A.t2时,v正=v逆
B.t1时,容器内气体的体积比t2时的大
C.加入催化剂正反应速率增大,逆反应速率不变
D.t3时,容器中c(Cl2)=c(H2O)=0.2 mol·L-1
二、非选择题:(本大题共4小题,共61分。)
14.(15分)铁及其化合物与我们的生活生产息息相关。
(1)纳米铁粉可用于处理废水中的:酸性条件下,纳米铁粉与废水中反应生成与,其反应的离子方程式是 ▲ 。
(2)以硫铁矿(主要成分为)为原料制备硫酸亚铁晶体()的工艺流程如下:
①焙烧所得矿渣的成分为、和,写出酸溶时Fe3O4发生反应的化学方程式 ▲ 。
②酸溶时,若其他条件不变,下列措施中能提高单位时间内铁元素溶出率的有 ▲ 。
A.将稀硫酸换成浓硫酸 B.适当加快搅拌速率 C.将焙烧所得的矿渣粉碎
③加入铁粉的目的是 ▲ (用离子方程式表达)。
(3)铁的化合物之一聚合硫酸铁{}广泛用于水的净化。以FeSO4 H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。将一定量的FeSO4 H2O溶于稀硫酸,在约70℃时边搅拌边缓慢加入一定量的H2O2溶液继续反应一段时间,得到红棕色黏稠的聚合硫酸铁液体。
①写出制备聚合硫酸铁的化学方程式 ▲ 。
②简述聚合硫酸铁的净水原理 ▲ 。
15.(15分)空气中含量的控制和资源利用具有重要意义。合成尿素[]是利用的途径之一。尿素合成主要通过下列反应实现:
反应Ⅰ:2NH3(g) + CO2(g)H2NCOONH4(s) 氨基甲酸铵 ΔH1=-272
反应Ⅱ:H2NCOONH4(s) CO(NH2)2(s)+H2O(g) ΔH2=
总反应III:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g) H3
(1)该反应的H3 = ▲ 。
(2)研究反应Ⅰ的逆反应对提高尿素产率有重要意义。某研究学习小组把一定量的氨基甲酸铵固体放入容积为2 L的密闭容器中,在T℃下分解:NH2COONH4(s)2NH3(g) + CO2(g),t1时达到化学平衡。c(CO2)随时间t变化曲线如图中曲线①所示。
①在0~t1时间内该化学反应速率v (NH3) = ▲ 。
②请在图中画出0~t2时间内c(NH3)随时间t变化的曲线。
③利用电解装置可以将尾气中的NO转化为尿素[尿素的
化学式为CO(NH2)2,其中碳的化合价为+4价,属于非电解
质],工作原理如图。
ⅰ.a电极的名称为 ▲ 。
ⅱ.该电解反应的化学方程式为 ▲ 。
16.(15分)浩瀚的大海中蕴藏着丰富的化学资源。
(1)“吹出法”是工业上常用的一种海水提溴技术,该技术主要流程如下:
①热空气吹出溴是利用了 ▲ (填溴的一种物理性质)。
②写出“吸收”步骤中反应的化学方程式: ▲ 。
③“分离”操作名称为 ▲ 。
“吹出法”中的“吸收”及后续步骤的工艺也可采用如下流程:
写出步骤②中反应的离子方程式: ▲ 。
(3)溴量法测定废水中苯酚()含量(每升水中含苯酚的质量,单位)的过程如下(废水中不含干扰测定的物质)。
步骤1 向盛有溶液的锥形瓶中加入过量,加酸化一段时间:
步骤2 加入废水,充分反应;
步骤3 向锥形瓶中加入过量,生成的恰好和反应。
计算该废水中苯酚的含量(写出计算过程) ▲ (己知:)。
(16分)有效去除大气中的氮氧化物(NOx)和水体中
的氮是环境保护的重要课题。
(1)乙烯还原法。目前,科学家在研究一种以乙烯作为还
原剂的脱硝(NO)原理,其脱硝机理示意图如图1所示。
写出该脱硝原理总反应的化学方程式: ▲ ;
NaClO2氧化法。按一定流速将含NO的废气通过
碱性NaClO2溶液中,NO可转化成被吸收。
请写出NO与反应的离子方程式 ▲ ;
(3)氢气催化还原法。
主反应:2NO(g) +2 H2(g)N2 (g)+ 2H2O(g) ΔH1= a
副反应:2NO(g) + H2(g)N2O (g)+ H2O(g) ΔH2= b
①则反应:2NO(g)+N2(g) 2N2O(g) = ▲ 。
②某温度下的体积分数对还原NO反应的影响如图2所示。当的体积分数大于时,的体积分数呈下降趋势,原因是 ▲ ;
(4)煤焦吸附还原法。煤焦吸附还原含NO烟气,将原煤经热解、冷却得到煤焦,NO的脱除主要含吸附和化学还原两个过程,煤焦表面存在的官能团有利于NO的吸附,其数量与煤焦中氢碳质量比的值密切相关。热解温度为500℃、900℃得到的煤焦分别用S-500、S-900表示,相关信息如表:
煤焦 元素分析(%)
C H
S-500 80.79 2.76
S-900 84.26 0.82
则相同温度下,S-900对NO的脱除率比S-500的低,可能的原因是 ▲ ;
(5)有人研究了用纳米零价铁去除水体中。控制其他条件不变,用纳米零价铁还原水体中的,测得溶液中、、浓度随时间变化如图4所示。与初始溶液中氮浓度相比,反应过程中溶液中的总氮(、、)浓度减少,其可能原因是 ▲ 。
2024-2025学年第二学期高一年级期中考试
化学参考答案
一.选择题(每小题3分,共39分)
1.A 2.B 3.B 4.A 5.A 6.D 7.C 8.B 9.D 10.C 11.D 12.C 13.B
二.非选择题(共61分)
14.(15分)(1) (3分)
(2)① Fe3O4+4H2SO4 = FeSO4 + Fe2(SO4)3 + 4H2O (3分)
②. BC (2分)
③. (2分)
(3)①.2mFeSO4 H2O + (n–2)mH2SO4 + mH2O2 [Fe2(OH)6-2n(SO4)n]m + 2m(n–1)H2O(3分)
②.聚合硫酸铁溶于水形成胶体,胶体中的胶粒比表面积较大,具有吸附性,能吸附水中的悬浮颗粒物并沉降。(2分)
15.(15分)(1) -134 (3分)
(2) ①. 0.10/t1 mol·L-1·s-1 (3分)
②. (3分)
③ ⅰ. 阴极 (3分)
ⅱ. CO2+2NO+5H2 CO(NH2)2+3H2O (3分)
16.(15分)
(1)①. 溴易挥发 (2分)
②. (3分)
③. 蒸馏 (2分)
(2) (3分)
(3) (5分)
n(Na2S2O3)=4.80×10-3 L × 0.001 mol L-1 = 4.8×10-6 mol
n(I2) = 2.4×10-6 mol (1分)
n(KBrO3)=5.00×10-3 L × 0.0002 mol L-1 = 1×10-6 mol
n(Br2)总 = 3×10-6 mol (1分)
与苯酚反应的溴物质的量:
n(Br2) = 3×10-6 mol- 2.4×10-6 mol = 0.6×10-6 mol (1分)
n(C6H6O) = 0.2×10-6 mol (1分)
m(C6H6O) = 0.2×10-6 mol ×94g/ mol = 18.8×10-6 g
苯酚的含量: 0.376 mg/L (1分)
17.(16分)(1) (3分)
(2)4NO+3ClO2-+4OH- = 4NO3-+3Cl-+2H2O (3分)
①. 2b-a kJ mol-1 (2分)
②. 过量氢气与氮气反应生成了氨气 (2分)
(4)S-900热解温度更高,煤焦中氢碳质量比的值小,表面官能团数量减少,不利于吸附 (3分)
(5) 部分硝酸根被还原为氮气或一氧化氮逸出水体 (3分)
说明:化学方程式或离子方程式书写反应物生成物化学式正确,配平或条件不正确扣1分;
计算和文字表述答案合理同样给分;其它按答案给分。
同课章节目录
