1.1 原子结构模型 课件(共40张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 1.1 原子结构模型 课件(共40张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修2 |

|
|
| 格式 | ppt | ||
| 文件大小 | 6.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-27 14:05:59 | ||
图片预览









文档简介
(共40张PPT)
第1章 原子结构与元素性质
第1节 原子结构模型
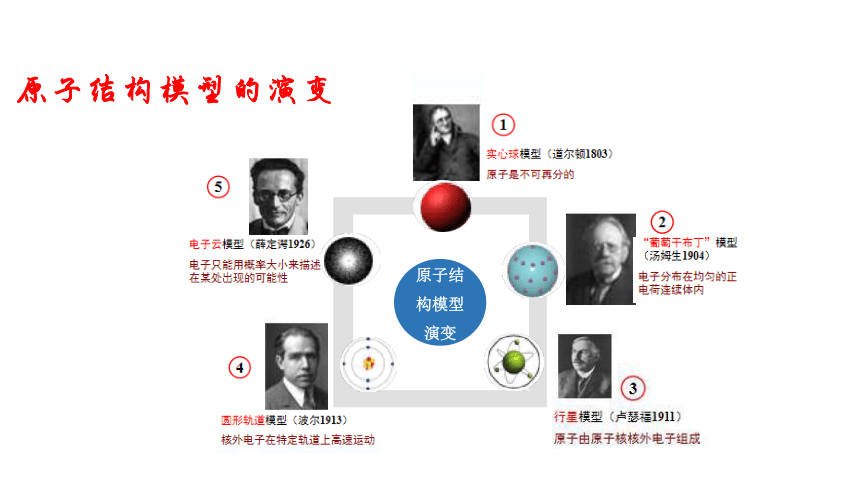
原子结构模型的演变
公元前5世纪,希腊哲学家德谟克利特等人认为 :万物是由大量的不可分割的微粒构成的,即原子。
【思考】人类对原子结构的认识是如何演变的呢?
1.了解有关核外电子运动模型的历史发展过程,认识核外电子的运动特点。
2.知道电子运动的能量状态具有量子化的特征(能量不连续),电子可以处于不同的能级,在一定条件下会发生激发与跃迁。
3.知道电子的运动状态(空间分布及能量)可通过原子轨道和电子云模型来描述。
1.通过认识原子结构及核外电子排布,辨识微观粒子与宏观物体的运动状态的不同。(宏观辨识与微观探析)
2.结合原子结构模型的演变过程,能论证证据与模型的建立及其发展之间的关系。(证据推理与模型认知)
3.体会在对物质微观结构的科学探究中经历基于实验证据建立、优化甚至是重构模型的过程,既需要严谨的科学推理,又需要大胆的科学猜想。(科学探究与创新)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
探究学习一 原子结构模型的演变
原子结构模型的演变
原子结构模型演变
探究学习二 光谱
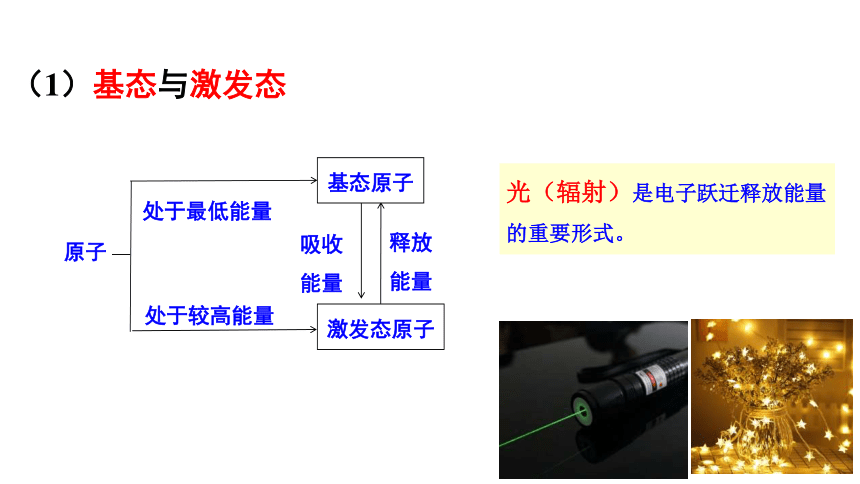
(1)基态与激发态
原子
基态原子
激发态原子
吸收能量
释放能量
处于最低能量
处于较高能量
光(辐射)是电子跃迁释放能量的重要形式。
(2)光谱
利用仪器将物质吸收的光或发射的光的波长和强度分布记录下来,就得到所谓的光谱。
①定义:不同元素的原子,电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的发射光谱或吸收光谱,总称原子光谱。
发射光谱
吸收光谱
暗背景
亮线
线状不连续
亮背景
暗线
线状不连续
原子光谱
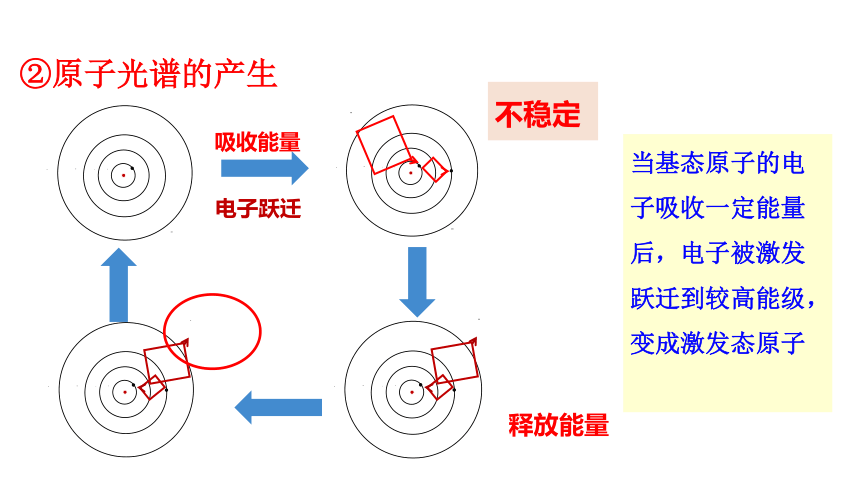
②原子光谱的产生
基态
K
L
M
N
激发态
K
L
M
N
能量
能量
K
L
M
N
光
K
L
M
N
不稳定
吸收能量
电子跃迁
释放能量
当基态原子的电子吸收一定能量后,电子被激发跃迁到较高能级,变成激发态原子
氢原子光谱是由具有特定波长、彼此分立的谱线组成的线状光谱。
卢瑟福原子结构核式模型推论
原子的光谱应当是连续光谱,即波长的变化呈连续分布。
氢原子光谱特点
③原子光谱的应用
He 氦
发现新元素
检验元素
不同元素的焰色试验
烟火
生产生活
霓虹灯
霓虹灯发光的原理是什么?
提示:充有氖气的霓虹灯能发出红光,产生这一现象的原因是通电后在电场作用下,放电管里氖原子中的电子吸收能量后跃迁到能量较高的能级,且处在能量较高的能级上的电子会很快地以光的形式释放能量而跃迁回能量较低的能级上,该光的波长恰好处于可见光区域中的红色波段。
【思考与讨论】
探究学习三
量子力学对原子核外电子运动状态的描述
原子是由原子核和核外电子组成的;
核外电子是分层排布的;
离核越远的电子,能量越高。
【温故知新】
电子层
能层
能层越高,电子的能量越高
(2)电子的能层由内向外排序,其序号、符号以及能容纳的最多电子数。
1.能层(shell)(电子层)
(1)用来描述电子离核的远近,量子数n表示的电子的运动状态通常称为电子层(能层)。
能层序数1、2、3、4、5、6、7分别用K、L、M、N、O、P、Q表示。能层越高,电子的能量越高。能量的高低顺序为E(K)能层 一 二 三 四 五 六 七
符号 K L M N O P Q
最多电子数 2=2×12
8=2×22 18=2×32
32=2×42 50=2×52 72=2×62 98=2×72
离核由近及远
能量由低到高
2.能级 (电子亚层、原子轨道的形状)
在多电子的原子中,同一能层的电子,能量也可能不同,据此把它们分为不同的能级
(也叫电子亚层)(同一个能层中电子的能量相同的电子亚层)。
分别用字母s、p、d、f等表示。
能层 K L M N O
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p …
最多电子数 2 2 6 2 6 10 2 6 10 14 2 6 …
①同一能层的电子,又被分成不同能级,分别用相应能层的序数和字母表示, 如n能层的能级按能量由低到高的排列顺序为ns、np、nd、nf等表示。能级数=能层序数,任一能层的能级总是从s能级开始,能级的字 母代号按s、p、d、f……排序,每个能级最多可容纳的电子数依次为自然数1、3、5、7……的2倍。
②每一能层中最多容纳的电子数为2n2(n代表能层序数)。
③不同能层中符号相同的能级所容纳的最多电子数相同。
能层与能级的组成以及能量的关系
(1)任一能层的能级总是从s能级开始,能级数=能层序数,即第一能层只有1个能级(1s),第二能层有2个能级(2s和2p),第三能层有3个能级(3s、3p和3d),依此次类推。
(2)在每一个能层中,能级符号的顺序是ns、np、nd、nf......(n为能层序数)。
1
2
3
4
3.原子轨道 (电子云的伸展方向或电子的空间运动状态)
(1)描述原子中单个电子的空间运动状态
不同能级含有轨道数
s
p
d
f
1个
3个
5个
7个
px
py
pz
能量相同
(2)原子轨道的图形描述
① s电子的原子轨道
s能级电子的原子轨道呈球形,即该原子轨道具有球对称性,电子层(能层)序数越大,原子轨道的半径越大。
② p电子的原子轨道
P电子的原子轨道是纺锤形(哑铃形)形的,每个P原子轨道有3个轨道(伸展方向),它们互相垂直, P轨道在空间的分布特点是分别相对于x、y、z轴对称, P原子轨道在空间的分布分别沿x、y、z方向。P原子轨道的平均半径也随电子层序数增大而增大。
【大开眼界】
d能级原子轨道有5个
S能级的原子轨道
P能级的原子轨道
d能级原子轨道有5个
f能级原子轨道有7个
【大开眼界】
4.核外电子的自旋量子化状态
描述在能量完全相同时运动的特殊状态,简称为电子自旋状态。
处于同一原子轨道上的电子,自旋状态只有两种,分别用符号“↑”和“↓”表示。
电子层 原子轨道类型 原子轨道数目 可容纳电子数
1 1s 1 2
2 2s,2p 4 8
3 3s,3p,3d 9 18
4 4s,4p,4d,4f 16 32
n - n2 2n2
容纳电子数=2n2
原子轨道数=n2
注意:电子自旋并不是像地球等行星一样“自转”,其实质还在探索中。
(5)核外电子的运动状态:电子层、能级、原子轨道、自旋状态
1.一个能层的能级数与能层序数(n)间存在什么关系?一个能层最多可容纳的电子数与能层序数(n)间存在什么关系
2.以s、p、d、f为符号的能级分别最多可容纳多少个电子 ?3d、4d、5d能级所能容纳的最多电子数是否相同?
3.第五能层最多可容纳多少个电子?它们分别容纳在几个能级中?各能级最多容纳多少个电子?
【思考交流】
提示:能层的能级数等于该能层序数。一个能层最多可容纳的电子数为2n2个。
提示:以s、p、d、f为符号的各能级可容纳的最多电子数依次为1、3、5、7的二倍。3d、4d、5d能级所能容纳的最多电子数相同。
提示:第五能层最多可容纳50个电子;5个能级;各能级最多容纳电子数分别为2,6,10,14,18个。
联想质疑
原子轨道可以用波函数来表示,那么,又该如何理解波函数 怎样形象地描述电子在空间中的运动与分布呢 宏观物体与微观粒子的运动状态有什么区别?
探究学习四
量子力学对原子核外电子运动状态的描述
电子云图:
描述电子在核外空间某处单位体积内的概率分布的图形。
①点密集的地方,表示电子在此处单位体积内出现的概率大;
②点稀疏的地方,表示电子在此处单位体积内出现的概率小。
含义:
电子在核外的空间分布
氢原子的1s电子在原子核外出现的概率分布图
把电子出现的概率约为90%的空间圈出来,人们把这种电子云轮廓图称为原子轨道。
电子云和原子轨道的关系:
注意:量子力学中轨道的含义与玻尔轨道的含义不同,它既不是圆周轨道,也不是其他经典意义上的固定轨迹。
拓展视野
量子力学诞生于1925年末至1926年初,它是由两组物理学家相互独立地用不同方法建立的。直接因量子力学而获得诺贝尔物理学奖的就有六位∶德布罗意(L.V.de Broglie,1929年)、海森堡(W.Heisenberg,1932年)、狄拉克(P.A.Dirac,1933年)和薛定谔(E.Schr dinger,1933年)、泡利(W.E.Pauli,1945年)和玻恩(M.Born,1954年)。
德布罗意
海森堡
狄拉克
薛定谔
泡利
玻恩
能级
基态与激发态
原子光谱
构 造原理
1.下列说法中有错误的是( )
A.某原子K层上只有一个电子
B.某离子M层和L层上的电子数均为K层的4倍
C.某原子M层上的电子数为L层电子数的4倍
D.存在核电荷数与最外层电子数相等的离子
C
2.下列多电子原子不同能级能量高低的比较错误的是( )
A.1s<2s<3s B.2p<3p<4p
C.3s<3p<3d D.4s>3d>3p
D
3.以下现象与核外电子的跃迁有关的是( )
①霓虹灯发出有色光 ②棱镜分光 ③激光器产生激光 ④石油蒸馏 ⑤凸透镜聚光 ⑥燃放的焰火,在夜空中呈现五彩缤纷的礼花 ⑦日光灯通电发光 ⑧冷却结晶
A.①③⑥⑦ B.②④⑤⑧
C.①③⑤⑥⑦ D.①②③⑤⑥⑦
A
4.(双选)下列有关能层和能级的叙述中正确的是( )
A.M能层有s、p共2个能级,最多能容纳8个电子
B.3d能级最多容纳10个电子,4f能级最多容纳14个电子
C.无论哪一能层的s能级最多容纳的电子数均为2
D.任一能层都有s、p能级,但不一定有d能级
BC
第1章 原子结构与元素性质
第1节 原子结构模型
原子结构模型的演变
公元前5世纪,希腊哲学家德谟克利特等人认为 :万物是由大量的不可分割的微粒构成的,即原子。
【思考】人类对原子结构的认识是如何演变的呢?
1.了解有关核外电子运动模型的历史发展过程,认识核外电子的运动特点。
2.知道电子运动的能量状态具有量子化的特征(能量不连续),电子可以处于不同的能级,在一定条件下会发生激发与跃迁。
3.知道电子的运动状态(空间分布及能量)可通过原子轨道和电子云模型来描述。
1.通过认识原子结构及核外电子排布,辨识微观粒子与宏观物体的运动状态的不同。(宏观辨识与微观探析)
2.结合原子结构模型的演变过程,能论证证据与模型的建立及其发展之间的关系。(证据推理与模型认知)
3.体会在对物质微观结构的科学探究中经历基于实验证据建立、优化甚至是重构模型的过程,既需要严谨的科学推理,又需要大胆的科学猜想。(科学探究与创新)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
探究学习一 原子结构模型的演变
原子结构模型的演变
原子结构模型演变
探究学习二 光谱
(1)基态与激发态
原子
基态原子
激发态原子
吸收能量
释放能量
处于最低能量
处于较高能量
光(辐射)是电子跃迁释放能量的重要形式。
(2)光谱
利用仪器将物质吸收的光或发射的光的波长和强度分布记录下来,就得到所谓的光谱。
①定义:不同元素的原子,电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的发射光谱或吸收光谱,总称原子光谱。
发射光谱
吸收光谱
暗背景
亮线
线状不连续
亮背景
暗线
线状不连续
原子光谱
②原子光谱的产生
基态
K
L
M
N
激发态
K
L
M
N
能量
能量
K
L
M
N
光
K
L
M
N
不稳定
吸收能量
电子跃迁
释放能量
当基态原子的电子吸收一定能量后,电子被激发跃迁到较高能级,变成激发态原子
氢原子光谱是由具有特定波长、彼此分立的谱线组成的线状光谱。
卢瑟福原子结构核式模型推论
原子的光谱应当是连续光谱,即波长的变化呈连续分布。
氢原子光谱特点
③原子光谱的应用
He 氦
发现新元素
检验元素
不同元素的焰色试验
烟火
生产生活
霓虹灯
霓虹灯发光的原理是什么?
提示:充有氖气的霓虹灯能发出红光,产生这一现象的原因是通电后在电场作用下,放电管里氖原子中的电子吸收能量后跃迁到能量较高的能级,且处在能量较高的能级上的电子会很快地以光的形式释放能量而跃迁回能量较低的能级上,该光的波长恰好处于可见光区域中的红色波段。
【思考与讨论】
探究学习三
量子力学对原子核外电子运动状态的描述
原子是由原子核和核外电子组成的;
核外电子是分层排布的;
离核越远的电子,能量越高。
【温故知新】
电子层
能层
能层越高,电子的能量越高
(2)电子的能层由内向外排序,其序号、符号以及能容纳的最多电子数。
1.能层(shell)(电子层)
(1)用来描述电子离核的远近,量子数n表示的电子的运动状态通常称为电子层(能层)。
能层序数1、2、3、4、5、6、7分别用K、L、M、N、O、P、Q表示。能层越高,电子的能量越高。能量的高低顺序为E(K)
符号 K L M N O P Q
最多电子数 2=2×12
8=2×22 18=2×32
32=2×42 50=2×52 72=2×62 98=2×72
离核由近及远
能量由低到高
2.能级 (电子亚层、原子轨道的形状)
在多电子的原子中,同一能层的电子,能量也可能不同,据此把它们分为不同的能级
(也叫电子亚层)(同一个能层中电子的能量相同的电子亚层)。
分别用字母s、p、d、f等表示。
能层 K L M N O
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p …
最多电子数 2 2 6 2 6 10 2 6 10 14 2 6 …
①同一能层的电子,又被分成不同能级,分别用相应能层的序数和字母表示, 如n能层的能级按能量由低到高的排列顺序为ns、np、nd、nf等表示。能级数=能层序数,任一能层的能级总是从s能级开始,能级的字 母代号按s、p、d、f……排序,每个能级最多可容纳的电子数依次为自然数1、3、5、7……的2倍。
②每一能层中最多容纳的电子数为2n2(n代表能层序数)。
③不同能层中符号相同的能级所容纳的最多电子数相同。
能层与能级的组成以及能量的关系
(1)任一能层的能级总是从s能级开始,能级数=能层序数,即第一能层只有1个能级(1s),第二能层有2个能级(2s和2p),第三能层有3个能级(3s、3p和3d),依此次类推。
(2)在每一个能层中,能级符号的顺序是ns、np、nd、nf......(n为能层序数)。
1
2
3
4
3.原子轨道 (电子云的伸展方向或电子的空间运动状态)
(1)描述原子中单个电子的空间运动状态
不同能级含有轨道数
s
p
d
f
1个
3个
5个
7个
px
py
pz
能量相同
(2)原子轨道的图形描述
① s电子的原子轨道
s能级电子的原子轨道呈球形,即该原子轨道具有球对称性,电子层(能层)序数越大,原子轨道的半径越大。
② p电子的原子轨道
P电子的原子轨道是纺锤形(哑铃形)形的,每个P原子轨道有3个轨道(伸展方向),它们互相垂直, P轨道在空间的分布特点是分别相对于x、y、z轴对称, P原子轨道在空间的分布分别沿x、y、z方向。P原子轨道的平均半径也随电子层序数增大而增大。
【大开眼界】
d能级原子轨道有5个
S能级的原子轨道
P能级的原子轨道
d能级原子轨道有5个
f能级原子轨道有7个
【大开眼界】
4.核外电子的自旋量子化状态
描述在能量完全相同时运动的特殊状态,简称为电子自旋状态。
处于同一原子轨道上的电子,自旋状态只有两种,分别用符号“↑”和“↓”表示。
电子层 原子轨道类型 原子轨道数目 可容纳电子数
1 1s 1 2
2 2s,2p 4 8
3 3s,3p,3d 9 18
4 4s,4p,4d,4f 16 32
n - n2 2n2
容纳电子数=2n2
原子轨道数=n2
注意:电子自旋并不是像地球等行星一样“自转”,其实质还在探索中。
(5)核外电子的运动状态:电子层、能级、原子轨道、自旋状态
1.一个能层的能级数与能层序数(n)间存在什么关系?一个能层最多可容纳的电子数与能层序数(n)间存在什么关系
2.以s、p、d、f为符号的能级分别最多可容纳多少个电子 ?3d、4d、5d能级所能容纳的最多电子数是否相同?
3.第五能层最多可容纳多少个电子?它们分别容纳在几个能级中?各能级最多容纳多少个电子?
【思考交流】
提示:能层的能级数等于该能层序数。一个能层最多可容纳的电子数为2n2个。
提示:以s、p、d、f为符号的各能级可容纳的最多电子数依次为1、3、5、7的二倍。3d、4d、5d能级所能容纳的最多电子数相同。
提示:第五能层最多可容纳50个电子;5个能级;各能级最多容纳电子数分别为2,6,10,14,18个。
联想质疑
原子轨道可以用波函数来表示,那么,又该如何理解波函数 怎样形象地描述电子在空间中的运动与分布呢 宏观物体与微观粒子的运动状态有什么区别?
探究学习四
量子力学对原子核外电子运动状态的描述
电子云图:
描述电子在核外空间某处单位体积内的概率分布的图形。
①点密集的地方,表示电子在此处单位体积内出现的概率大;
②点稀疏的地方,表示电子在此处单位体积内出现的概率小。
含义:
电子在核外的空间分布
氢原子的1s电子在原子核外出现的概率分布图
把电子出现的概率约为90%的空间圈出来,人们把这种电子云轮廓图称为原子轨道。
电子云和原子轨道的关系:
注意:量子力学中轨道的含义与玻尔轨道的含义不同,它既不是圆周轨道,也不是其他经典意义上的固定轨迹。
拓展视野
量子力学诞生于1925年末至1926年初,它是由两组物理学家相互独立地用不同方法建立的。直接因量子力学而获得诺贝尔物理学奖的就有六位∶德布罗意(L.V.de Broglie,1929年)、海森堡(W.Heisenberg,1932年)、狄拉克(P.A.Dirac,1933年)和薛定谔(E.Schr dinger,1933年)、泡利(W.E.Pauli,1945年)和玻恩(M.Born,1954年)。
德布罗意
海森堡
狄拉克
薛定谔
泡利
玻恩
能级
基态与激发态
原子光谱
构 造原理
1.下列说法中有错误的是( )
A.某原子K层上只有一个电子
B.某离子M层和L层上的电子数均为K层的4倍
C.某原子M层上的电子数为L层电子数的4倍
D.存在核电荷数与最外层电子数相等的离子
C
2.下列多电子原子不同能级能量高低的比较错误的是( )
A.1s<2s<3s B.2p<3p<4p
C.3s<3p<3d D.4s>3d>3p
D
3.以下现象与核外电子的跃迁有关的是( )
①霓虹灯发出有色光 ②棱镜分光 ③激光器产生激光 ④石油蒸馏 ⑤凸透镜聚光 ⑥燃放的焰火,在夜空中呈现五彩缤纷的礼花 ⑦日光灯通电发光 ⑧冷却结晶
A.①③⑥⑦ B.②④⑤⑧
C.①③⑤⑥⑦ D.①②③⑤⑥⑦
A
4.(双选)下列有关能层和能级的叙述中正确的是( )
A.M能层有s、p共2个能级,最多能容纳8个电子
B.3d能级最多容纳10个电子,4f能级最多容纳14个电子
C.无论哪一能层的s能级最多容纳的电子数均为2
D.任一能层都有s、p能级,但不一定有d能级
BC
