1.2.2 核外电子排布与元素周期表 课件(共25张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 1.2.2 核外电子排布与元素周期表 课件(共25张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修2 |

|
|
| 格式 | ppt | ||
| 文件大小 | 5.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-27 14:07:34 | ||
图片预览







文档简介
(共25张PPT)
第二节 原子结构与元素周期表
第二课时 核外电子排布与元素周期表
德米特里·伊万诺维奇·门捷列夫
(1834-1907)是俄罗斯伟大的化学家,自然科学基本定律化学元素周期表的创始人。
1869年3月2日,门捷列夫经过苦苦思索,惊喜地发现,当所有的已知元素按相对原子质量递增的顺序排列起来,并且性质相似元素依一定的间隔出现。世界上第一章元素周期表出现了。
1.通过认识原子结构及价电子排布与元素在周期表中位置的关系,建立原子核外电子排布规律(结构)与元素周期表中族、周期划分(位置)的周期性变化规律(性质)的深层关联。(宏观辨识与微观探析)
2.能够根据价电子排布式推断元素在周期表中的位置。(证据推理与模型认知)
1.知道元素周期表中分区、周期和族的元素原子核外电子排布特征。
2.了解元素周期表的应用价值。
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
写出下列元素、离子的核外电子排布式
【课前练习】
①钪Sc ②钛Ti ③钒V ④铬 Cr ⑤锰Mn ⑥铁 Fe ⑦钴 Co ⑧镍Ni ⑨ 铜 Cu ⑩锌 Zn Fe2+ Fe3+ 钾K 钙Ca
①Sc 1s22s22p63s23p63d14s2; ②Ti 1s22s22p63s23p63d24s2;
③V 1s22s22p63s23p63d34s2; ④Cr 1s22s22p63s23p63d54s1;
⑤Mn 1s22s22p63s23p63d54s2 ; ⑥Fe 1s22s22p63s23p63d64s2;
⑦Co 1s22s22p63s23p63d74s2 ; ⑧Ni 1s22s22p63s23p63d84s2;
⑨Cu 1s22s22p63s23p63d104s1 ; ⑩Zn 1s22s22p63s23p63d104s2;
K 1s22s22p63s23p64s1 Ca 1s22s22p63s23p64s2
元素周期表三次重要发展
门捷列夫周期表
维尔纳的特长式周期表
波尔元素周期表
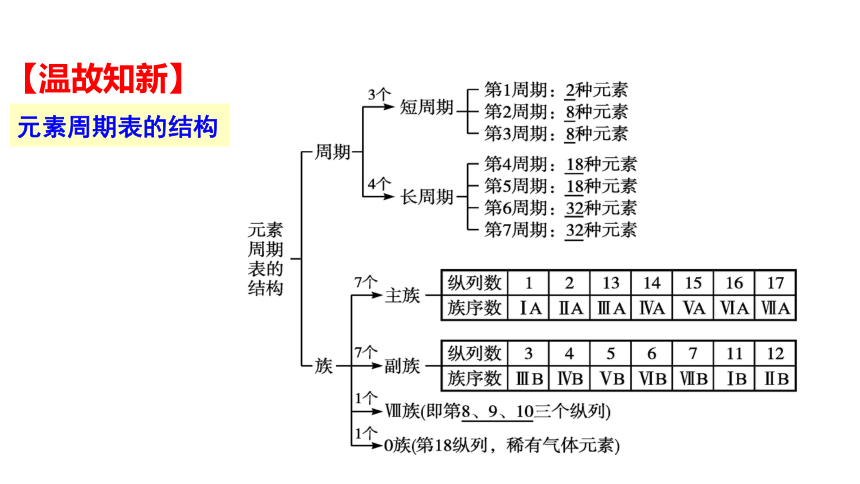
【温故知新】
元素周期表的结构
原子核外电子排布、原子轨道的能级与周期表之间有什么样的关系?
【活动探究】
阅读教材,了解鲍林近似能级图,能级组与元素周期表的周期之间的对应关系,同一能级组和不同能级组间的能量关系。
价电子的概念,主族元素和过渡元素的原子的价电子的组成,价电子的表示方法。
原子核外的电子排布与周期表的周期划分的本质联系,周期与量子数n的关系。
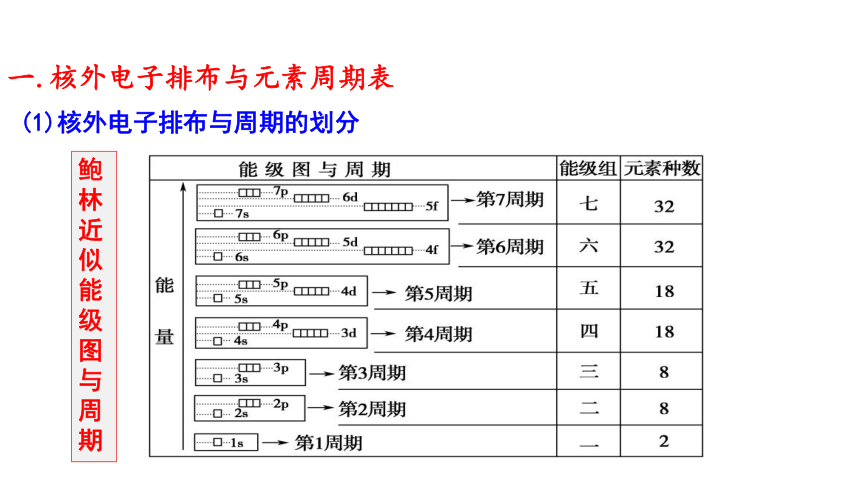
(1)核外电子排布与周期的划分
鲍林近似能级图与周期
一.核外电子排布与元素周期表
周期序数 对应能级组 原子轨道数 最多容纳电子数 价电子排布式 元素种数
ⅠA族 0族
1 1s
2 2s2p
3 3s3p
4 4s3d4p
5 5s4d5p
6 6s4f5d6p
7 7s5f6d7p
1
4
4
9
9
16
16
2
8
8
18
18
32
32
1s1
2s1
3s1
4s1
5s1
6s1
7s1
1s2
2s22p6
3s23p6
4s24p6
5s25p6
6s26p6
7s27p6
2
8
8
18
18
32
32
周期与能级组、原子轨道的对应关系
1.各周期均以填充 s 轨道开始, 以p 轨道结束(第1周期除外)
2.周期元素数目=相应能级组中原子轨道所能容纳的电子总数
3.周期数=电子层数
元素种数
关于原子中电子的能级高低,我国化学家徐光宪对这一问题也进行过深入的研究,提出判断外层电子能级高低的(n+0.7 )规则。其中n就是代表电子层的量子数, 是用于描述电子运动状态的另一个量子数,对于s、p、d、f能级, 分别取 0、1、2、3。就原子的外层电子来说,(n+0.7 )越大,则能级越高。将(n+0.7 )值的第一位数字相同的能级合并为一组,称为"能级组"。例如,4s、3d和4p的(n+0.7 )依次等于4.0、4.4和4.7,它们的第一位数字都是 4,故都属于第四能级组。由此,徐光宪做出与鲍林相同的能级排序和能级组划分。值得注意的是,不同原子的原子轨道能级顺序不尽相同,并不存在一个普适的能级顺序,不论是鲍林还是徐光宪所列出的能级顺序都只有近似意义。
徐光宪外层电子能级顺序与能级组
资料在线
(2)核外电子与族的划分
请你仔细观察元素周期表中各族元素的价电子排布情况,思考核外电子排布与族的划分之间有什么内在联系。
【交流研讨】
1.主族元素原子的价电子排布与过渡元素原子的价电子排布有什么区别?
2.同一主族元素原子的价电子排布有什么特点?主族序数与什么有关?
3.同一族过渡元素原子的价电子排布有什么特点?其族序数与什么有关?
① 族的划分与核外电子排布的关系
族的划分与原子的价电子数目和价电子排布密切相关。
② 各族核外电子排布的特点
价电子排布为ns2np6(He除外)
ns1~2或ns2np1~5
价电子数
(n-1)d1~10ns1~2
主族元素
过渡元素
稀有气体元素:
价电子排布:
族序数=
价电子排布:
族序数
ⅢB~ⅦB族:族序数=
ⅠB族和ⅡB族:族序数=
价电子数
ns电子数
(2)核外电子与族的划分
元素周期表分为5个区,以最后填入电子的轨道能级符号作为该区的符号。
(3)元素周期表的分区
分区 价电子排布 元素分布
s区 ns1~2 ⅠA、ⅡA族、He
p区 ns2np1~6 ⅢA族~ⅦA族、0族(He除外)
d区 (n-1)d1~9ns1~2(Pd除外) ⅢB族~ⅦB族、Ⅷ族(镧系、锕系除外)
ds区 (n-1)d10ns1~2 ⅠB族、ⅡB族
f区 (n-2)f0~14(n-1)d0~2ns2 镧系、锕系
各区元素的原子最外层电子排布特点
【归纳总结】
②非金属元素的最高正化合价和它的最低负化合价的绝对值之和等于8。
(4)元素化合价与价电子排布的关系
①除Ⅷ族、ⅠB族的某些元素和0族元素外,(主族)元素的最高化合价等于所在的族序数。
③稀有气体元素原子的电子层结构是稳定结构,因此稀有气体元素的化合价在通常情况下为0。
拓展视野
核外电子排布与元素周期表的分区
根据各区元素所处的位置,可以总结出每个区的元素的原子最外层电子排布的特点,以及它们可能具有的化学性质。
s区元素∶主要包括元素周期表中的IA 族碱金属元素和ⅡA族碱土金属元素,它们的原子的价电子分布在s轨道上,价电子排布为ns1~2。这些元素的原子分别容易失去1个或2个电子,形成 +1价或 +2 价阳离子。除氢外,这些元素都是活泼金属元素。
p 区元素∶包括元素周期表中ⅢA族、ⅣA 族、VA族、ⅥA 族、WA 族和0族共6族元素,它们原子的价电子排布为 ns2np1-6(氦除外)。随着最外层电子数目的增加,原子越来越难失电子,越来越容易得电子。
s区元素、p区元素包括所有的主族元素及0族元素,其共同的特点是原子的价电子都排布在最外电子层上。因此,这两区元素的原子通常是最外层电子参与化学反应。
拓展视野
核外电子排布与元素周期表的分区
d区元素∶包括除镧系、锕系外的从ⅢB 族到Ⅷ族的元素。该区元素原子的价电子排布为(n-1)d1~9ns1-2。一般地,最外层有1~2个电子,元素原子的核外电子排布的差别主要在(n-1)d轨道上。由于d轨道都未充满电子,因此d轨道可以不同程度地参与化学键的形成。
ds 区元素∶包括IB族、IIB 族元素,它们的原子的(n-1)d轨道为充满电子的轨道,价电子排布为(n-1)d10ns1~2。
f区元素∶包括镧系元素和钢系元素,它们的原子的价电子排布为(n-2)f0-14(n-1)d0~2ns ,最后填入的电子进入(n-2)f原子轨道。由于最外层的电子数基本相同,(n-1)d的电子数也基本相同,因此镧系元素的化学性质非常相近,钢系元素的化学性质也非常相近。
核外电子排布与元素周期表
周期
周期序数=电子层数
周期序数=电子层数
族
族序数=价电子数
主族元素
价电子排布:ns1~2或ns2np1~5
ⅢB族~ⅦB族序数=价电子数 ⅠB、ⅡB族族序数=ns电子数
过渡元素
价电子排布:(n-1)d1~10ns1~2
稀有元素
价电子排布为ns2np6(He除外)
周期表的分区
s区 ns1~2
p区 ns2np1~6
d区 (n-1)d1~9ns1~2
ds区 (n-1)d10ns1~2
ds区 (n-2)f0~14(n-1)d0~2ns2
1.指出下列元素在周期表中的位置:
(1)基态原子的电子排布式为1s22s22p63s23p64s1的元素:
第___周期、____族。
(2)基态原子的电子排布式为1s22s22p63s23p63d34s2的元素:
第____周期、____族。
(3)基态原子的电子排布式为1s22s22p63s23p63d104s1的元素:
第_____周期、_____族。
(4)基态原子的电子排布式为1s22s22p63s23p5的元素:
第_____周期、_____族。
4
ⅠA
4
ⅤB
4
ⅠB
3
ⅦA
2.下列说法不正确的是( )
A.某基态原子外围电子排布式为4f75d16s2,该元素位于周期表中第6
周期ⅢB族
B.在元素周期表中,s区、d区和ds区的元素都是金属元素
C.当碳原子的核外电子排布 由
转变为 时,释放能量,由激发态转化成基态。
D.非金属元素形成的共价化合物中,原子的最外层电子数不一定是2或8
B
3.已知某元素+3价离子的核外电子排布式为1s22s22p63s23p63d5,则该元素在元素周期表中的位置是( )
A.第3周期Ⅷ族,p区
B.第3周期ⅤB族,ds区
C.第4周期Ⅷ族,d区
D.第4周期ⅤB族,f区
C
4.(双选)下列关于原子核外电子排布与元素在周期表中位置关系的表述中,正确的是( )
A.基态原子的N层上只有一个电子的元素一定是ⅠA族元素
B.基态原子的价电子排布式为(n-1)d10ns2的元素一定是副族元素
C.基态原子的p能级半充满的元素一定位于p区
D.基态原子的价电子排布式为(n-1)dxnsy的元素的族序数一定为x+y
BC
5.甲元素原子的L电子层上只有一个空原子轨道;乙元素原子的核电荷数为33。根据甲、乙两元素的信息,回答有关问题:
(1)甲的元素符号是________;其轨道表示式为________________。
(2)乙元素原子的最外层电子排布式为____________,其在元素周期表中的位置是____________________。
(3)甲属于________区元素,乙属于________区元素。
C
4s24p3
第4周期ⅤA族
p
p
第二节 原子结构与元素周期表
第二课时 核外电子排布与元素周期表
德米特里·伊万诺维奇·门捷列夫
(1834-1907)是俄罗斯伟大的化学家,自然科学基本定律化学元素周期表的创始人。
1869年3月2日,门捷列夫经过苦苦思索,惊喜地发现,当所有的已知元素按相对原子质量递增的顺序排列起来,并且性质相似元素依一定的间隔出现。世界上第一章元素周期表出现了。
1.通过认识原子结构及价电子排布与元素在周期表中位置的关系,建立原子核外电子排布规律(结构)与元素周期表中族、周期划分(位置)的周期性变化规律(性质)的深层关联。(宏观辨识与微观探析)
2.能够根据价电子排布式推断元素在周期表中的位置。(证据推理与模型认知)
1.知道元素周期表中分区、周期和族的元素原子核外电子排布特征。
2.了解元素周期表的应用价值。
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
写出下列元素、离子的核外电子排布式
【课前练习】
①钪Sc ②钛Ti ③钒V ④铬 Cr ⑤锰Mn ⑥铁 Fe ⑦钴 Co ⑧镍Ni ⑨ 铜 Cu ⑩锌 Zn Fe2+ Fe3+ 钾K 钙Ca
①Sc 1s22s22p63s23p63d14s2; ②Ti 1s22s22p63s23p63d24s2;
③V 1s22s22p63s23p63d34s2; ④Cr 1s22s22p63s23p63d54s1;
⑤Mn 1s22s22p63s23p63d54s2 ; ⑥Fe 1s22s22p63s23p63d64s2;
⑦Co 1s22s22p63s23p63d74s2 ; ⑧Ni 1s22s22p63s23p63d84s2;
⑨Cu 1s22s22p63s23p63d104s1 ; ⑩Zn 1s22s22p63s23p63d104s2;
K 1s22s22p63s23p64s1 Ca 1s22s22p63s23p64s2
元素周期表三次重要发展
门捷列夫周期表
维尔纳的特长式周期表
波尔元素周期表
【温故知新】
元素周期表的结构
原子核外电子排布、原子轨道的能级与周期表之间有什么样的关系?
【活动探究】
阅读教材,了解鲍林近似能级图,能级组与元素周期表的周期之间的对应关系,同一能级组和不同能级组间的能量关系。
价电子的概念,主族元素和过渡元素的原子的价电子的组成,价电子的表示方法。
原子核外的电子排布与周期表的周期划分的本质联系,周期与量子数n的关系。
(1)核外电子排布与周期的划分
鲍林近似能级图与周期
一.核外电子排布与元素周期表
周期序数 对应能级组 原子轨道数 最多容纳电子数 价电子排布式 元素种数
ⅠA族 0族
1 1s
2 2s2p
3 3s3p
4 4s3d4p
5 5s4d5p
6 6s4f5d6p
7 7s5f6d7p
1
4
4
9
9
16
16
2
8
8
18
18
32
32
1s1
2s1
3s1
4s1
5s1
6s1
7s1
1s2
2s22p6
3s23p6
4s24p6
5s25p6
6s26p6
7s27p6
2
8
8
18
18
32
32
周期与能级组、原子轨道的对应关系
1.各周期均以填充 s 轨道开始, 以p 轨道结束(第1周期除外)
2.周期元素数目=相应能级组中原子轨道所能容纳的电子总数
3.周期数=电子层数
元素种数
关于原子中电子的能级高低,我国化学家徐光宪对这一问题也进行过深入的研究,提出判断外层电子能级高低的(n+0.7 )规则。其中n就是代表电子层的量子数, 是用于描述电子运动状态的另一个量子数,对于s、p、d、f能级, 分别取 0、1、2、3。就原子的外层电子来说,(n+0.7 )越大,则能级越高。将(n+0.7 )值的第一位数字相同的能级合并为一组,称为"能级组"。例如,4s、3d和4p的(n+0.7 )依次等于4.0、4.4和4.7,它们的第一位数字都是 4,故都属于第四能级组。由此,徐光宪做出与鲍林相同的能级排序和能级组划分。值得注意的是,不同原子的原子轨道能级顺序不尽相同,并不存在一个普适的能级顺序,不论是鲍林还是徐光宪所列出的能级顺序都只有近似意义。
徐光宪外层电子能级顺序与能级组
资料在线
(2)核外电子与族的划分
请你仔细观察元素周期表中各族元素的价电子排布情况,思考核外电子排布与族的划分之间有什么内在联系。
【交流研讨】
1.主族元素原子的价电子排布与过渡元素原子的价电子排布有什么区别?
2.同一主族元素原子的价电子排布有什么特点?主族序数与什么有关?
3.同一族过渡元素原子的价电子排布有什么特点?其族序数与什么有关?
① 族的划分与核外电子排布的关系
族的划分与原子的价电子数目和价电子排布密切相关。
② 各族核外电子排布的特点
价电子排布为ns2np6(He除外)
ns1~2或ns2np1~5
价电子数
(n-1)d1~10ns1~2
主族元素
过渡元素
稀有气体元素:
价电子排布:
族序数=
价电子排布:
族序数
ⅢB~ⅦB族:族序数=
ⅠB族和ⅡB族:族序数=
价电子数
ns电子数
(2)核外电子与族的划分
元素周期表分为5个区,以最后填入电子的轨道能级符号作为该区的符号。
(3)元素周期表的分区
分区 价电子排布 元素分布
s区 ns1~2 ⅠA、ⅡA族、He
p区 ns2np1~6 ⅢA族~ⅦA族、0族(He除外)
d区 (n-1)d1~9ns1~2(Pd除外) ⅢB族~ⅦB族、Ⅷ族(镧系、锕系除外)
ds区 (n-1)d10ns1~2 ⅠB族、ⅡB族
f区 (n-2)f0~14(n-1)d0~2ns2 镧系、锕系
各区元素的原子最外层电子排布特点
【归纳总结】
②非金属元素的最高正化合价和它的最低负化合价的绝对值之和等于8。
(4)元素化合价与价电子排布的关系
①除Ⅷ族、ⅠB族的某些元素和0族元素外,(主族)元素的最高化合价等于所在的族序数。
③稀有气体元素原子的电子层结构是稳定结构,因此稀有气体元素的化合价在通常情况下为0。
拓展视野
核外电子排布与元素周期表的分区
根据各区元素所处的位置,可以总结出每个区的元素的原子最外层电子排布的特点,以及它们可能具有的化学性质。
s区元素∶主要包括元素周期表中的IA 族碱金属元素和ⅡA族碱土金属元素,它们的原子的价电子分布在s轨道上,价电子排布为ns1~2。这些元素的原子分别容易失去1个或2个电子,形成 +1价或 +2 价阳离子。除氢外,这些元素都是活泼金属元素。
p 区元素∶包括元素周期表中ⅢA族、ⅣA 族、VA族、ⅥA 族、WA 族和0族共6族元素,它们原子的价电子排布为 ns2np1-6(氦除外)。随着最外层电子数目的增加,原子越来越难失电子,越来越容易得电子。
s区元素、p区元素包括所有的主族元素及0族元素,其共同的特点是原子的价电子都排布在最外电子层上。因此,这两区元素的原子通常是最外层电子参与化学反应。
拓展视野
核外电子排布与元素周期表的分区
d区元素∶包括除镧系、锕系外的从ⅢB 族到Ⅷ族的元素。该区元素原子的价电子排布为(n-1)d1~9ns1-2。一般地,最外层有1~2个电子,元素原子的核外电子排布的差别主要在(n-1)d轨道上。由于d轨道都未充满电子,因此d轨道可以不同程度地参与化学键的形成。
ds 区元素∶包括IB族、IIB 族元素,它们的原子的(n-1)d轨道为充满电子的轨道,价电子排布为(n-1)d10ns1~2。
f区元素∶包括镧系元素和钢系元素,它们的原子的价电子排布为(n-2)f0-14(n-1)d0~2ns ,最后填入的电子进入(n-2)f原子轨道。由于最外层的电子数基本相同,(n-1)d的电子数也基本相同,因此镧系元素的化学性质非常相近,钢系元素的化学性质也非常相近。
核外电子排布与元素周期表
周期
周期序数=电子层数
周期序数=电子层数
族
族序数=价电子数
主族元素
价电子排布:ns1~2或ns2np1~5
ⅢB族~ⅦB族序数=价电子数 ⅠB、ⅡB族族序数=ns电子数
过渡元素
价电子排布:(n-1)d1~10ns1~2
稀有元素
价电子排布为ns2np6(He除外)
周期表的分区
s区 ns1~2
p区 ns2np1~6
d区 (n-1)d1~9ns1~2
ds区 (n-1)d10ns1~2
ds区 (n-2)f0~14(n-1)d0~2ns2
1.指出下列元素在周期表中的位置:
(1)基态原子的电子排布式为1s22s22p63s23p64s1的元素:
第___周期、____族。
(2)基态原子的电子排布式为1s22s22p63s23p63d34s2的元素:
第____周期、____族。
(3)基态原子的电子排布式为1s22s22p63s23p63d104s1的元素:
第_____周期、_____族。
(4)基态原子的电子排布式为1s22s22p63s23p5的元素:
第_____周期、_____族。
4
ⅠA
4
ⅤB
4
ⅠB
3
ⅦA
2.下列说法不正确的是( )
A.某基态原子外围电子排布式为4f75d16s2,该元素位于周期表中第6
周期ⅢB族
B.在元素周期表中,s区、d区和ds区的元素都是金属元素
C.当碳原子的核外电子排布 由
转变为 时,释放能量,由激发态转化成基态。
D.非金属元素形成的共价化合物中,原子的最外层电子数不一定是2或8
B
3.已知某元素+3价离子的核外电子排布式为1s22s22p63s23p63d5,则该元素在元素周期表中的位置是( )
A.第3周期Ⅷ族,p区
B.第3周期ⅤB族,ds区
C.第4周期Ⅷ族,d区
D.第4周期ⅤB族,f区
C
4.(双选)下列关于原子核外电子排布与元素在周期表中位置关系的表述中,正确的是( )
A.基态原子的N层上只有一个电子的元素一定是ⅠA族元素
B.基态原子的价电子排布式为(n-1)d10ns2的元素一定是副族元素
C.基态原子的p能级半充满的元素一定位于p区
D.基态原子的价电子排布式为(n-1)dxnsy的元素的族序数一定为x+y
BC
5.甲元素原子的L电子层上只有一个空原子轨道;乙元素原子的核电荷数为33。根据甲、乙两元素的信息,回答有关问题:
(1)甲的元素符号是________;其轨道表示式为________________。
(2)乙元素原子的最外层电子排布式为____________,其在元素周期表中的位置是____________________。
(3)甲属于________区元素,乙属于________区元素。
C
4s24p3
第4周期ⅤA族
p
p
