2.1.2 键参数 课件(共24张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 2.1.2 键参数 课件(共24张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修2 |

|
|
| 格式 | ppt | ||
| 文件大小 | 6.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-27 14:08:33 | ||
图片预览








文档简介
(共24张PPT)
第2章 微粒间的相互作用于物质性质
第1节 共价键模型
第2课时 键参数
诺贝尔物理学奖得主理查德·费曼曾说过,假如发生了大灾难,人类全部的科学知识只能概括为一句话传诸后世,那么这句话应该是“万物皆由原子构成”。
【思考】原子是如何构成物质的?
1.知道键能、键长、键角可以用来描述键的强弱和分子的空间结构。
2.认识微观粒子间的相互作用与物质性质的关系。
3.能利用键长、键能、键角等说明简单分子的某些性质。
1.知道影响共价键键能强弱的因素,知道键能与键长的关系。(宏观辨识与微观探析)
2.能够通过键角判断分子的空间结构。(证据推理与模型认知)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
一、共价键的形成与特征
【知识回顾】
1、共价键
原子间通过共用电子形成的化学键。
2、共价键的特征
⑴饱和性:每个原子所能形成共价键的总数或以单键连接的原子数目是一定的,这称为共价键的饱和性。
⑵方向性:共价键尽可能沿着电子出现概率最大的方向形成,这就是共价键的方向性。
⑴σ键:
二、共价键的类型
⑵π键:
原子轨道以“头碰头”方式相互重叠导致电子在核间出现的概率增大而形成的共价键叫σ键。形成σ键的原子轨道有s-s、s-p、p-p等类型;σ键可以沿键轴旋转;σ键较稳定,存在于一切共价键中。
原子轨道以“肩并肩”方式重叠导致导致电子在核间出现的概率增大而形成的共价键叫叫π键。电子云重叠程度不及σ键,较活泼;π键必须与σ键共存;π键不能自由旋转。
(3)非极性键和极性键
形成元素 电子对偏移 原子电性
非极性键 同种元素 因两原子电负性相同,共用电子对不偏移 两原子均不显电性
极性键 不同种元素 电子对偏向电负性大的原子 电负性较大的原子显负电性
⑴按两成键原子核间的共用电子对是否偏移,可将共价键分为极性键和非极性键。
⑵非极性键和极性键的对比
⑶分子中共价键的极性强弱对物质的性质的影响
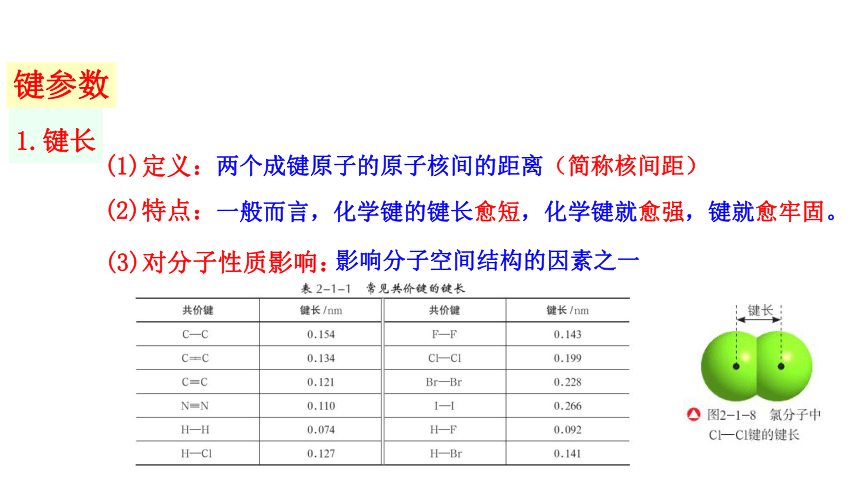
键参数
1.键长
(1)定义:
(2)特点:
(3)对分子性质影响:
两个成键原子的原子核间的距离(简称核间距)
一般而言,化学键的键长愈短,化学键就愈强,键就愈牢固。
影响分子空间结构的因素之一
(4)应用:
(5)定性判断键长的方法
①判断共价键的稳定性:键长是衡量共价键稳定性的另一个重要参数。键长越短,往往键能越大,表明共价键越稳定。
②判断分子的空间结构:键长是影响分子空间结构的因素之一。
①根据原子半径进行判断。在其他条件相同时,成键原子的半径越小,键长越短。
②根据共用电子对数判断。相同的两原子形成共价键时,单键键长>双键键长>三键键长。
2.键角
(1)定义:
在多原子分子中,两个化学键的夹角
(2)意义:
键角可反映分子的空间结构,是描述分子空间结构的重要参数,分子的许多性质都与键角有关。
直线形
角形
三角锥形
正四面体形
CH4
109028'
(3)常见分子的键角及分子空间结构:
分子 键角 空间结构
CO2 (O=C=O)180° 直线形
H2O (H-O)104.5° V形(或称角形)
NH3 (N-H)107.3° 三角锥形
P4 (P-P)60 正四面体形
CH4 (C-H)109 28 正四面体形
(4)测定方法:键长和键角的数值可通过晶体的X射线衍射实验获得。
多原子分子的键角一定,表明共价键具有方向性
3.键能
(1)定义:
在 101.3 kPa、298 K 条件下,断开1mol AB(g)分子中的化学键,使其分别生成气态A原子和气态B原子所吸收的能量称为A—B键的键能。
(2)表示方法:
EA—B
(3)测定方法:键能可通过实验测定,更多的却是推算获得的
(4)应用:
定量地表示化学键的强弱
键能愈大,断开时需要的能量就愈多,化学键就愈牢固;
键能愈小,断开时需要的能量就愈少,化学键就愈不牢固。
一般情况下,键长越短,键能越大,共价键越牢固
特殊情况
如F-F键、H-H键
原因:由于原子半径小,键长短,但由于键长短,两原子形成共价键时,原子核之间的距离小,排斥力大,键能小
⑴由原子半径和共用电子对数判断:成键原子的原子半径越小,共用电子对数越多,则共价键越牢固,含有该共价键的分子越稳定。
共价键强弱的判断
⑵由键能判断:共价键的键能越大,共价键越牢固。
⑶由键长判断:共价键的键长越短,共价键越牢固(一般情况)。
⑷由电负性判断:元素的电负性越大,该元素的原子对共用电子对的吸引力越大,形成的共价键越稳定。
拓展提高
⑴根据原子半径判断:在其他条件相同时,成键原子的半径越小,
键长越短。
分子的稳定性与键能和键长有关,而由分子构成的物质的熔、沸点高低与键能和键长无关(取决于分子间作用力大小)。
键长的判断方法
⑵根据共用电子对数判断:相同的两原子形成共价键时,
单键键长>双键键长>叁键键长。
波长为 300 nm 的紫外光的光子所具有的能量约为 399 kJ·mol',这一能量比蛋白质分子中重要的化学键,如C—C键、C—N键和C—S键的键能都大。因此,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子。
紫外光为什么会对人体有害
化学与生命
防晒霜之所以能有效地减轻紫外光对人体的伤害,其原因之一是它的有效成分的分子中有π 键。这些分子中的 π键的 电子在吸收紫外光后被激发,从而能阻挡部分紫外光。
化学与技术
分子光谱
定义:分子从一种能级改变到另一种能级时吸收或发射的光谱。
影响因素:分子内部的运动;分子中键长、键角、电荷分布等
应用:测定和鉴别分子结构、测定物质浓度
分类:远红外光谱或微波谱
红外光谱
紫外—可见光谱
分子转动
分子中原子间的振动
分子中电子在不同能级的分子轨道间跃迁
键参数
键长
键能
键角
决定
分子的稳定性
决定
分子的空间结构
决定
分子的性质
1.下列叙述中的距离属于键长的是( )
A.氨分子中两个氢原子间的距离
B.氯分子中两个氯原子核间的距离
C.金刚石中任意两个碳原子核间的距离
D.氯化钠中相邻的氯离子和钠离子核间的距离
B
2.下列分子中的键角最大的是( )
A.CO2 B.NH3 C.H2O D.CH2=CH2
A
3.NH3分子的空间结构是三角锥形结构而不是平面正三角形结构,最充分的理由是( )
A.NH3分子内3个N—H键长均相等
B.NH3分子内3个价键的键角和键长均相等
C.NH3分子内3个N—H的键长相等,键角都等于107°
D.NH3分子内3个N—H的键长相等,键角都等于120°
C
4.(双选)键长、键角和键能是描述共价键的三个重要参数,下列叙述正确的是( )
A.键角是描述分子空间结构的重要参数
B.因为H-O键的键能小于H-F键的键能,所以O2、F2与H2反应的能力逐渐增强
C.水分子可表示为H-O-H,分子中的键角为180°
D.H-O键的键能为463kJ·mo1-1,即18gH2O分解成H2和O2时,消耗的能量为2×463kJ
AB
5、碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
化学键 C—C C—H C—O Si—Si Si—H Si—O
键能/kJ·mol-1 347 413 358 226 318 452
回答下列问题:
(1)硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是
_____________________________________________________________
_____________________________________________________________。
C—C键和C—H键较强,所形成的烷烃稳定,而硅烷中
Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成。
第2章 微粒间的相互作用于物质性质
第1节 共价键模型
第2课时 键参数
诺贝尔物理学奖得主理查德·费曼曾说过,假如发生了大灾难,人类全部的科学知识只能概括为一句话传诸后世,那么这句话应该是“万物皆由原子构成”。
【思考】原子是如何构成物质的?
1.知道键能、键长、键角可以用来描述键的强弱和分子的空间结构。
2.认识微观粒子间的相互作用与物质性质的关系。
3.能利用键长、键能、键角等说明简单分子的某些性质。
1.知道影响共价键键能强弱的因素,知道键能与键长的关系。(宏观辨识与微观探析)
2.能够通过键角判断分子的空间结构。(证据推理与模型认知)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
一、共价键的形成与特征
【知识回顾】
1、共价键
原子间通过共用电子形成的化学键。
2、共价键的特征
⑴饱和性:每个原子所能形成共价键的总数或以单键连接的原子数目是一定的,这称为共价键的饱和性。
⑵方向性:共价键尽可能沿着电子出现概率最大的方向形成,这就是共价键的方向性。
⑴σ键:
二、共价键的类型
⑵π键:
原子轨道以“头碰头”方式相互重叠导致电子在核间出现的概率增大而形成的共价键叫σ键。形成σ键的原子轨道有s-s、s-p、p-p等类型;σ键可以沿键轴旋转;σ键较稳定,存在于一切共价键中。
原子轨道以“肩并肩”方式重叠导致导致电子在核间出现的概率增大而形成的共价键叫叫π键。电子云重叠程度不及σ键,较活泼;π键必须与σ键共存;π键不能自由旋转。
(3)非极性键和极性键
形成元素 电子对偏移 原子电性
非极性键 同种元素 因两原子电负性相同,共用电子对不偏移 两原子均不显电性
极性键 不同种元素 电子对偏向电负性大的原子 电负性较大的原子显负电性
⑴按两成键原子核间的共用电子对是否偏移,可将共价键分为极性键和非极性键。
⑵非极性键和极性键的对比
⑶分子中共价键的极性强弱对物质的性质的影响
键参数
1.键长
(1)定义:
(2)特点:
(3)对分子性质影响:
两个成键原子的原子核间的距离(简称核间距)
一般而言,化学键的键长愈短,化学键就愈强,键就愈牢固。
影响分子空间结构的因素之一
(4)应用:
(5)定性判断键长的方法
①判断共价键的稳定性:键长是衡量共价键稳定性的另一个重要参数。键长越短,往往键能越大,表明共价键越稳定。
②判断分子的空间结构:键长是影响分子空间结构的因素之一。
①根据原子半径进行判断。在其他条件相同时,成键原子的半径越小,键长越短。
②根据共用电子对数判断。相同的两原子形成共价键时,单键键长>双键键长>三键键长。
2.键角
(1)定义:
在多原子分子中,两个化学键的夹角
(2)意义:
键角可反映分子的空间结构,是描述分子空间结构的重要参数,分子的许多性质都与键角有关。
直线形
角形
三角锥形
正四面体形
CH4
109028'
(3)常见分子的键角及分子空间结构:
分子 键角 空间结构
CO2 (O=C=O)180° 直线形
H2O (H-O)104.5° V形(或称角形)
NH3 (N-H)107.3° 三角锥形
P4 (P-P)60 正四面体形
CH4 (C-H)109 28 正四面体形
(4)测定方法:键长和键角的数值可通过晶体的X射线衍射实验获得。
多原子分子的键角一定,表明共价键具有方向性
3.键能
(1)定义:
在 101.3 kPa、298 K 条件下,断开1mol AB(g)分子中的化学键,使其分别生成气态A原子和气态B原子所吸收的能量称为A—B键的键能。
(2)表示方法:
EA—B
(3)测定方法:键能可通过实验测定,更多的却是推算获得的
(4)应用:
定量地表示化学键的强弱
键能愈大,断开时需要的能量就愈多,化学键就愈牢固;
键能愈小,断开时需要的能量就愈少,化学键就愈不牢固。
一般情况下,键长越短,键能越大,共价键越牢固
特殊情况
如F-F键、H-H键
原因:由于原子半径小,键长短,但由于键长短,两原子形成共价键时,原子核之间的距离小,排斥力大,键能小
⑴由原子半径和共用电子对数判断:成键原子的原子半径越小,共用电子对数越多,则共价键越牢固,含有该共价键的分子越稳定。
共价键强弱的判断
⑵由键能判断:共价键的键能越大,共价键越牢固。
⑶由键长判断:共价键的键长越短,共价键越牢固(一般情况)。
⑷由电负性判断:元素的电负性越大,该元素的原子对共用电子对的吸引力越大,形成的共价键越稳定。
拓展提高
⑴根据原子半径判断:在其他条件相同时,成键原子的半径越小,
键长越短。
分子的稳定性与键能和键长有关,而由分子构成的物质的熔、沸点高低与键能和键长无关(取决于分子间作用力大小)。
键长的判断方法
⑵根据共用电子对数判断:相同的两原子形成共价键时,
单键键长>双键键长>叁键键长。
波长为 300 nm 的紫外光的光子所具有的能量约为 399 kJ·mol',这一能量比蛋白质分子中重要的化学键,如C—C键、C—N键和C—S键的键能都大。因此,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子。
紫外光为什么会对人体有害
化学与生命
防晒霜之所以能有效地减轻紫外光对人体的伤害,其原因之一是它的有效成分的分子中有π 键。这些分子中的 π键的 电子在吸收紫外光后被激发,从而能阻挡部分紫外光。
化学与技术
分子光谱
定义:分子从一种能级改变到另一种能级时吸收或发射的光谱。
影响因素:分子内部的运动;分子中键长、键角、电荷分布等
应用:测定和鉴别分子结构、测定物质浓度
分类:远红外光谱或微波谱
红外光谱
紫外—可见光谱
分子转动
分子中原子间的振动
分子中电子在不同能级的分子轨道间跃迁
键参数
键长
键能
键角
决定
分子的稳定性
决定
分子的空间结构
决定
分子的性质
1.下列叙述中的距离属于键长的是( )
A.氨分子中两个氢原子间的距离
B.氯分子中两个氯原子核间的距离
C.金刚石中任意两个碳原子核间的距离
D.氯化钠中相邻的氯离子和钠离子核间的距离
B
2.下列分子中的键角最大的是( )
A.CO2 B.NH3 C.H2O D.CH2=CH2
A
3.NH3分子的空间结构是三角锥形结构而不是平面正三角形结构,最充分的理由是( )
A.NH3分子内3个N—H键长均相等
B.NH3分子内3个价键的键角和键长均相等
C.NH3分子内3个N—H的键长相等,键角都等于107°
D.NH3分子内3个N—H的键长相等,键角都等于120°
C
4.(双选)键长、键角和键能是描述共价键的三个重要参数,下列叙述正确的是( )
A.键角是描述分子空间结构的重要参数
B.因为H-O键的键能小于H-F键的键能,所以O2、F2与H2反应的能力逐渐增强
C.水分子可表示为H-O-H,分子中的键角为180°
D.H-O键的键能为463kJ·mo1-1,即18gH2O分解成H2和O2时,消耗的能量为2×463kJ
AB
5、碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
化学键 C—C C—H C—O Si—Si Si—H Si—O
键能/kJ·mol-1 347 413 358 226 318 452
回答下列问题:
(1)硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是
_____________________________________________________________
_____________________________________________________________。
C—C键和C—H键较强,所形成的烷烃稳定,而硅烷中
Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成。
