3.2.3 共价晶体 课件(共21张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 3.2.3 共价晶体 课件(共21张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修2 |

|
|
| 格式 | ppt | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-27 00:00:00 | ||
图片预览








文档简介
(共21张PPT)
第3章 不同聚集状态的物质与性质
第2节 几种简单的晶体结构模型
第3课时 共价晶体
氮化硅(Si3N4)
碳化硅(SiC)砂轮
金刚石(C)
思考:
氮化硅、碳化硅、金刚石等具有质地坚硬、耐高温等性能,在国防建设、日常生活生产中具有重要的作用。它们额微观结构是怎样的呐?
航天耐高温材料
了解共价晶体的结构与性质;能借助共价晶体的模型说明晶体中的微粒及其微粒间的相互作用。
1.了解共价晶体的结构与性质。(宏观辨识与微观探析)
2.通过对共价晶体,能描述共价晶体的结构与性质。(证据推理与模型认知)
3.体会现代实验手段在化学研究中的应用,认识借助实验获得证据进而建立物质结构模型的过程,感受化学研究创新发展的前沿与方向。(科学探究与创新意识)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
三、共价晶体
联想 质疑
科学研究表明,30 亿年前,在地壳下 200 km 左右的地幔中,处在高温、高压岩浆中的碳元素逐渐形成了具有正四面体结构的金刚石。火山爆发时,金刚石夹在岩浆中上升到接近地表时冷却,形成含有少量金刚石的原生矿床。金刚石具有诸多不同凡响的优良性质∶ 熔点高,不导电,硬度极高。这些性质显然是由金刚石的结构决定的。那么,金刚石具有怎样的结构呢
思考:
在金刚石晶体中每个碳原子周围紧邻的碳原子有多少个?
2. 在金刚石晶体中每个碳原子连接有几个共价键?
3. 在金刚石晶体中碳原子个数与C-C共价键个数之比是多少?
键角
键长
空间立体网状结构
C原子均为sp3杂化
4
4
1:2
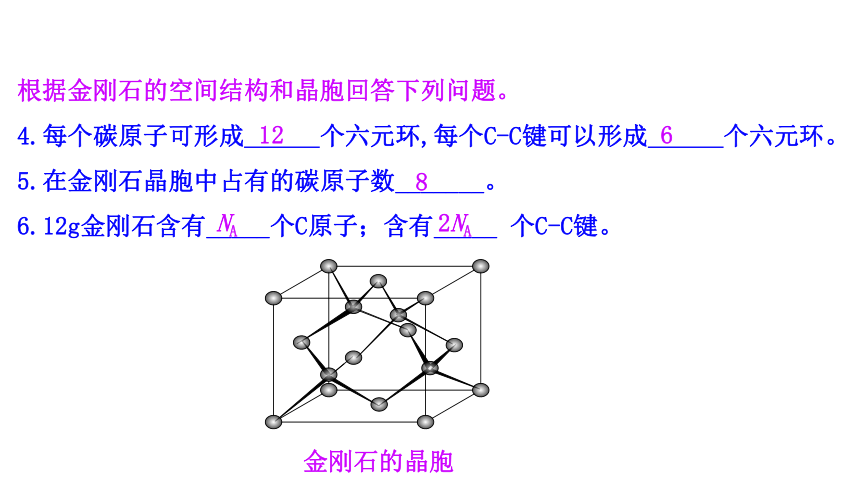
根据金刚石的空间结构和晶胞回答下列问题。
4.每个碳原子可形成 个六元环,每个C-C键可以形成 个六元环。
5.在金刚石晶胞中占有的碳原子数_______。
6.12g金刚石含有_____个C原子;含有_____ 个C-C键。
金刚石的晶胞
12
6
8
NA
2NA
1.共价晶体的概念:
相邻原子间以共价键结合而形成的具有空间立体网状结构的晶体。
2.共价晶体的结构特点:
(1)由于共价键的饱和性与方向性,使得每个中心原子周围排列的原子数目是有限的。
(2)由于所有原子间均以共价键相结合,所以晶体中不存在单个分子。
除了金刚石外,通常情况下,晶体硅(Si)、晶体锗(Ge)、晶体硼(B)、碳化硅(SiC)、二氧化硅(SiO2)等都属于共价晶体。
碳化硅
2.性质:
碳化硅晶体与金刚石结构相似,其空间结构中碳原子和硅原子交替排列;碳原子和硅原子个数之比为1∶1。
1.结构特点:
硬度大,具有耐热性、耐氧化性和耐腐蚀性。
3.用途:
磨料、耐火材料、电热元件,制造机械工程的结构件、化学工程中的密封件。
二氧化硅的结构
109 28
共价键
空间立体网状结构
键角
二氧化硅的结构特点:
①在二氧化硅晶体里,硅原子和氧原子交替排列,不会出现Si—Si键和O—O键,而只有Si—O键,即1个硅原子与4个氧原子形成4个共价键,每个氧原子与2个硅原子形成2个共价键。
②每个硅原子与相邻的4个氧原子以共价键相结合构成正四面体结构,硅原子在正四面体的中心,4个氧原子在正四面体的4个顶点,则每个正四面体占有1个完整的硅原子、2个氧原子。因此,二氧化硅晶体中硅原子和氧原子的个数比为1∶2,化学式为SiO2 ,不存在单个的分子。
交流 研讨
从表 3-2-4 中的数据可以看出,尽管金刚石、碳化硅和晶体硅都是共价晶体且它们的结构相似,但是它们的熔点和硬度有较大差异,请讨论产生这种差异的原因。
键能:C—C>C—Si>Si—Si;
熔点:金刚石>碳化硅>晶体硅;
硬度:金刚石>碳化硅>晶体硅。
从表 3-2-4 中的数据可以看出,金刚石、碳化硅和晶体硅的键能、熔点和硬度比较如下:
由此可见影响共价晶体熔点和硬度的主要因素为共价键,对结构相似的共价晶体来说,原子半径越小,键长越短,键能越大,晶体的熔点就越高。
共价晶体
概念
结构特点
例子
金刚石
碳化硅
二氧化硅
空间结构
性质比较
1.透明高硬度防弹铝材料(化学式为AlON)硬度为石英玻璃的4倍。氮氧化铝(AlON)属共价晶体,是一种超强透明材料。下列描述错误的是( )
A.AlON和石英的化学键类型相同
B.AlON和石英晶体类型相同
C.AlON和Al2O3的化学键类型不同
D.AlON和Al2O3晶体类型相同
D
2.下列有关共价晶体的叙述错误的是( )
A.共价晶体中,只存在共价键
B.共价晶体具有空间网状结构
C.共价晶体中不存在独立的分子
D.共价晶体熔化时不破坏共价键
D
3.下表是某些共价晶体的熔点和硬度:
分析表中的数据,判断下列叙述正确的是( )
①构成共价晶体的原子种类越多,晶体的熔点越高 ②构成共价晶体的原子间的共价键键能越大,晶体的熔点越高 ③构成共价晶体的原子的半径越大,晶体的硬度越大 ④构成共价晶体的原子的半径越小,晶体的硬度越大
A.①② B.③④ C.①③ D.②④
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/℃ 3 900 3 000 2 700 1 710 1 410 1 211
硬度 10 9.5 9.5 7 6.5 6.0
D
4.科学家用激光将置于铁室中石墨靶上的碳原子炸松,与此同时再用射频电火花喷射氮气,此时碳、氮原子结合成碳氮化合物薄膜。据称,这种化合物可能比金刚石更坚硬。其原因可能是 ( )
A.碳、氮原子构成平面结构的晶体
B.碳氮键键长比金刚石中的碳碳键键长更短
C.氮原子电子数比碳原子电子数多
D.碳、氮单质的化学性质均不活泼
B
5.我们可以将SiO2的晶体结构想象为在晶体硅的Si—Si键之间插入O原子。根据SiO2晶体结构图,下列说法不正确的是( )
A.石英晶体中每个Si原子通过Si—O极性键与4个O原子作用
B.每个O原子也通过Si—O极性键与2个Si原子作用
C.石英晶体中Si原子与O原子的原子个数比为1∶2,可用“SiO2”来表示石英的组成
D.在晶体中存在石英分子,故石英的分子式为SiO2
D
6.已知氮化碳晶体是新发现的高硬度材料,且构成该晶体的微粒间只以单键结合。下列关于该晶体的说法错误的是( )
A.氮化碳属于共价晶体,比金刚石的硬度更大
B.该晶体中每个碳原子与4个氮原子相连,每个氮原子与3个碳原子相连,氮化碳的化学式为C3N4
C.该晶体中碳原子和氮原子的最外层都满足8电子结构
D.该晶体与金刚石相似,都是原子间以非极性键形成空间网状结构
D
7.下列有关共价晶体的叙述不正确的是( )
A.金刚石和二氧化硅晶体的最小结构单元都是正四面体
B.含1 mol C的金刚石中C—C键数目是2NA,1 mol SiO2晶体中Si—O键数目是4NA
C.水晶和干冰在熔化时,晶体中的共价键都会断裂
D.SiO2晶体是共价晶体,所以晶体中不存在分子,SiO2不是它的分子式
C
第3章 不同聚集状态的物质与性质
第2节 几种简单的晶体结构模型
第3课时 共价晶体
氮化硅(Si3N4)
碳化硅(SiC)砂轮
金刚石(C)
思考:
氮化硅、碳化硅、金刚石等具有质地坚硬、耐高温等性能,在国防建设、日常生活生产中具有重要的作用。它们额微观结构是怎样的呐?
航天耐高温材料
了解共价晶体的结构与性质;能借助共价晶体的模型说明晶体中的微粒及其微粒间的相互作用。
1.了解共价晶体的结构与性质。(宏观辨识与微观探析)
2.通过对共价晶体,能描述共价晶体的结构与性质。(证据推理与模型认知)
3.体会现代实验手段在化学研究中的应用,认识借助实验获得证据进而建立物质结构模型的过程,感受化学研究创新发展的前沿与方向。(科学探究与创新意识)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
三、共价晶体
联想 质疑
科学研究表明,30 亿年前,在地壳下 200 km 左右的地幔中,处在高温、高压岩浆中的碳元素逐渐形成了具有正四面体结构的金刚石。火山爆发时,金刚石夹在岩浆中上升到接近地表时冷却,形成含有少量金刚石的原生矿床。金刚石具有诸多不同凡响的优良性质∶ 熔点高,不导电,硬度极高。这些性质显然是由金刚石的结构决定的。那么,金刚石具有怎样的结构呢
思考:
在金刚石晶体中每个碳原子周围紧邻的碳原子有多少个?
2. 在金刚石晶体中每个碳原子连接有几个共价键?
3. 在金刚石晶体中碳原子个数与C-C共价键个数之比是多少?
键角
键长
空间立体网状结构
C原子均为sp3杂化
4
4
1:2
根据金刚石的空间结构和晶胞回答下列问题。
4.每个碳原子可形成 个六元环,每个C-C键可以形成 个六元环。
5.在金刚石晶胞中占有的碳原子数_______。
6.12g金刚石含有_____个C原子;含有_____ 个C-C键。
金刚石的晶胞
12
6
8
NA
2NA
1.共价晶体的概念:
相邻原子间以共价键结合而形成的具有空间立体网状结构的晶体。
2.共价晶体的结构特点:
(1)由于共价键的饱和性与方向性,使得每个中心原子周围排列的原子数目是有限的。
(2)由于所有原子间均以共价键相结合,所以晶体中不存在单个分子。
除了金刚石外,通常情况下,晶体硅(Si)、晶体锗(Ge)、晶体硼(B)、碳化硅(SiC)、二氧化硅(SiO2)等都属于共价晶体。
碳化硅
2.性质:
碳化硅晶体与金刚石结构相似,其空间结构中碳原子和硅原子交替排列;碳原子和硅原子个数之比为1∶1。
1.结构特点:
硬度大,具有耐热性、耐氧化性和耐腐蚀性。
3.用途:
磨料、耐火材料、电热元件,制造机械工程的结构件、化学工程中的密封件。
二氧化硅的结构
109 28
共价键
空间立体网状结构
键角
二氧化硅的结构特点:
①在二氧化硅晶体里,硅原子和氧原子交替排列,不会出现Si—Si键和O—O键,而只有Si—O键,即1个硅原子与4个氧原子形成4个共价键,每个氧原子与2个硅原子形成2个共价键。
②每个硅原子与相邻的4个氧原子以共价键相结合构成正四面体结构,硅原子在正四面体的中心,4个氧原子在正四面体的4个顶点,则每个正四面体占有1个完整的硅原子、2个氧原子。因此,二氧化硅晶体中硅原子和氧原子的个数比为1∶2,化学式为SiO2 ,不存在单个的分子。
交流 研讨
从表 3-2-4 中的数据可以看出,尽管金刚石、碳化硅和晶体硅都是共价晶体且它们的结构相似,但是它们的熔点和硬度有较大差异,请讨论产生这种差异的原因。
键能:C—C>C—Si>Si—Si;
熔点:金刚石>碳化硅>晶体硅;
硬度:金刚石>碳化硅>晶体硅。
从表 3-2-4 中的数据可以看出,金刚石、碳化硅和晶体硅的键能、熔点和硬度比较如下:
由此可见影响共价晶体熔点和硬度的主要因素为共价键,对结构相似的共价晶体来说,原子半径越小,键长越短,键能越大,晶体的熔点就越高。
共价晶体
概念
结构特点
例子
金刚石
碳化硅
二氧化硅
空间结构
性质比较
1.透明高硬度防弹铝材料(化学式为AlON)硬度为石英玻璃的4倍。氮氧化铝(AlON)属共价晶体,是一种超强透明材料。下列描述错误的是( )
A.AlON和石英的化学键类型相同
B.AlON和石英晶体类型相同
C.AlON和Al2O3的化学键类型不同
D.AlON和Al2O3晶体类型相同
D
2.下列有关共价晶体的叙述错误的是( )
A.共价晶体中,只存在共价键
B.共价晶体具有空间网状结构
C.共价晶体中不存在独立的分子
D.共价晶体熔化时不破坏共价键
D
3.下表是某些共价晶体的熔点和硬度:
分析表中的数据,判断下列叙述正确的是( )
①构成共价晶体的原子种类越多,晶体的熔点越高 ②构成共价晶体的原子间的共价键键能越大,晶体的熔点越高 ③构成共价晶体的原子的半径越大,晶体的硬度越大 ④构成共价晶体的原子的半径越小,晶体的硬度越大
A.①② B.③④ C.①③ D.②④
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/℃ 3 900 3 000 2 700 1 710 1 410 1 211
硬度 10 9.5 9.5 7 6.5 6.0
D
4.科学家用激光将置于铁室中石墨靶上的碳原子炸松,与此同时再用射频电火花喷射氮气,此时碳、氮原子结合成碳氮化合物薄膜。据称,这种化合物可能比金刚石更坚硬。其原因可能是 ( )
A.碳、氮原子构成平面结构的晶体
B.碳氮键键长比金刚石中的碳碳键键长更短
C.氮原子电子数比碳原子电子数多
D.碳、氮单质的化学性质均不活泼
B
5.我们可以将SiO2的晶体结构想象为在晶体硅的Si—Si键之间插入O原子。根据SiO2晶体结构图,下列说法不正确的是( )
A.石英晶体中每个Si原子通过Si—O极性键与4个O原子作用
B.每个O原子也通过Si—O极性键与2个Si原子作用
C.石英晶体中Si原子与O原子的原子个数比为1∶2,可用“SiO2”来表示石英的组成
D.在晶体中存在石英分子,故石英的分子式为SiO2
D
6.已知氮化碳晶体是新发现的高硬度材料,且构成该晶体的微粒间只以单键结合。下列关于该晶体的说法错误的是( )
A.氮化碳属于共价晶体,比金刚石的硬度更大
B.该晶体中每个碳原子与4个氮原子相连,每个氮原子与3个碳原子相连,氮化碳的化学式为C3N4
C.该晶体中碳原子和氮原子的最外层都满足8电子结构
D.该晶体与金刚石相似,都是原子间以非极性键形成空间网状结构
D
7.下列有关共价晶体的叙述不正确的是( )
A.金刚石和二氧化硅晶体的最小结构单元都是正四面体
B.含1 mol C的金刚石中C—C键数目是2NA,1 mol SiO2晶体中Si—O键数目是4NA
C.水晶和干冰在熔化时,晶体中的共价键都会断裂
D.SiO2晶体是共价晶体,所以晶体中不存在分子,SiO2不是它的分子式
C
