第1章 微项目 甲醛的危害与去除——利用电负性分析与预测物质性质 课件(共18张PPT) 2024-2025学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 第1章 微项目 甲醛的危害与去除——利用电负性分析与预测物质性质 课件(共18张PPT) 2024-2025学年高二化学鲁科版(2019)选择性必修2 |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-27 14:13:54 | ||
图片预览



文档简介
(共18张PPT)
微项目 甲醛的危害与去除
—利用电负性分析与预测物质性质
有关资料表明:室内空气污染比室外高5~10倍,室内空气污染物多达500多种。室内空气污染已成为多种疾病的诱因,而甲醛则是造成室内空气污染的一个主要方面。甲醛的主要危害表现为对皮肤黏膜的刺激作用,甲醛是能与蛋白质结合、高浓度吸入时出现呼吸道严重的刺激和水肿、眼刺激、头痛。甲醛与蛋白质结合的原理是什么呢?
1.认识如何借助电负性分析化学键中电荷的分布。
2.体会借助电负性认识与预测有机化合物某些性质的思路和方法。
3.了解甲醛的性质、对人体健康的危害以及去除方法。
知识体系
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
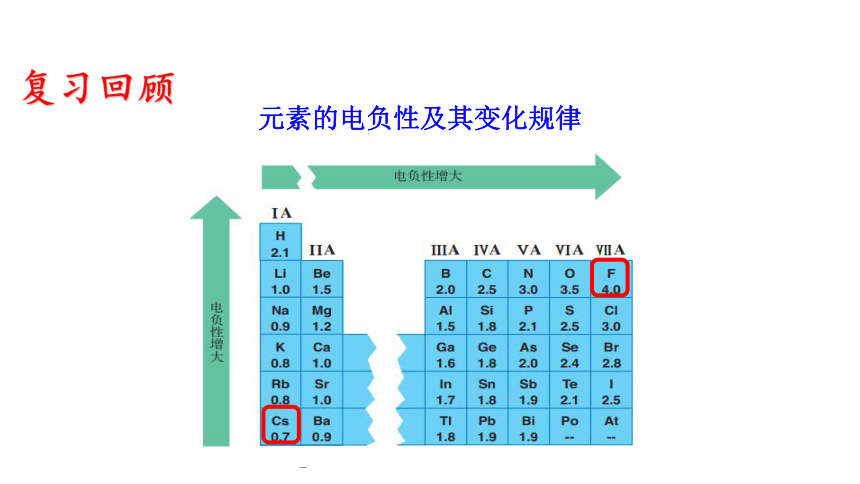
电负性的周期性变化
元素的电负性及其变化规律
复习回顾
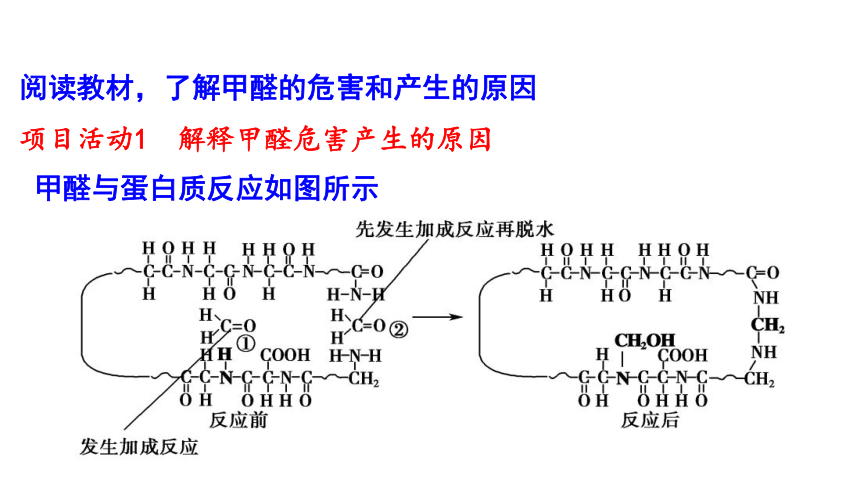
阅读教材,了解甲醛的危害和产生的原因
甲醛与蛋白质反应如图所示
项目活动1 解释甲醛危害产生的原因
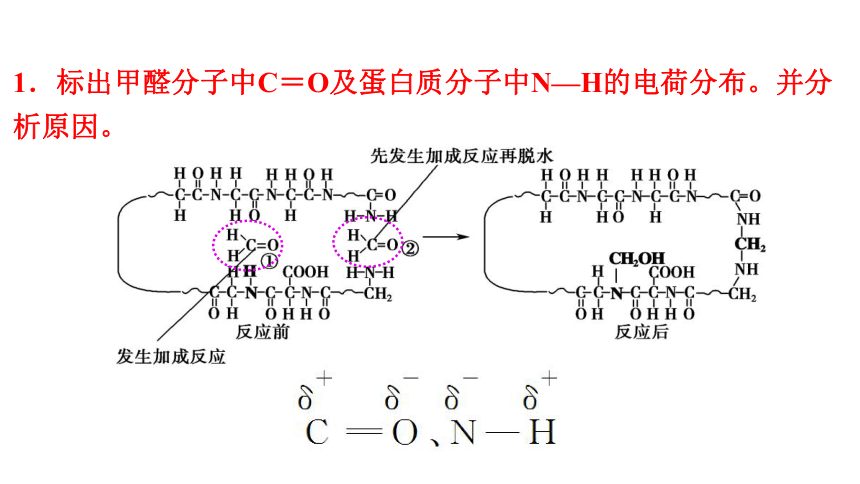
1.标出甲醛分子中C=O及蛋白质分子中N—H的电荷分布。并分析原因。
2.分析发生反应时①的化学键变化。
根据图中反应前后对比看出N—H断裂,C=O中的一个键断裂,同时形成C—N和O—H。
3.②处 先与一个—NH2发生加成反应,其产物又与另一个—NH2发生取代反应脱去一个H2O分子。试分析发生反应时②处的化学键变化。
发生加成反应时,断裂N—H和C=O中的一条键,形成C—N和O—H;加成产物继续反应时断裂C—O和N—H,同时形成C—N和H—O(生成了H2O)。
4.通过上述加成反应和取代反应分析,断键后的分子片断是如何重组的?
带部分正电荷的原子或基团,与带部分负电荷的原子或基团相连、重组。遵循“正找负”“负找正”的规律。如
阅读教材,了解甲醛的检测和去除的方法
项目活动2 室内空气中甲醛的检测与去除
检测室内空气中的甲醛含量时常用的检测试剂是3 甲基 2苯并噻唑啉酮腙盐酸盐水合物(MBTH)。该方法的原理是甲醛与MBTH反应生成物质A,A再参与一系列反应,最终生成蓝绿色化合物。
1、室内空气中甲醛的检测方法
2、室内空气中甲醛的去除方法
①氨、胺类、酚类物质均可与甲醛发生加成反应,继而发生消去反应,生成水和一种稳定的有机物,从而除去甲醛。
④某些植物可吸收甲醛如吊兰、芦荟、虎尾兰等。
②利用氧化剂将甲醛氧化除去如KMnO4、K2Cr2O7等。
③利用多孔材料通过物理吸附的方法除甲醛,如活性炭等。
利用电负性认识和预测物质性质的流程
借助电负性认识与预测有机化合物某些性质的思路和方法
找到可能发生反应的断键部位
利用电负性分析断键部位电荷的分布
依据“正”“负”结合的规律推测断键后的分子片段如何重组
单键部位发生取代反应
双键部位发生加成反应
1.在入住装修过的新房之前,下列做法中错误的是( )
①紧闭门窗,防止装修面干裂、变质
②适度开窗通气,充分地进行内外空气对流
③用高浓度的甲醛溶液对室内环境消毒
④在各个房间内均匀地放置适量的吊兰、芦荟等植物
A.①② B.①③
C.①④ D.②④
B
2.对A、B两种主族元素(除ⅠA族)来说,下列叙述中正确的是( )
A.若A的电负性大于B,则A的第一电离能一定大于B
B.若A的电负性大于B,则A的失电子能力大于B
C.若A的电负性大于B,则A的得电子能力大于B
D.若A的电负性大于B,则A的原子半径一定小于B
C
3.元素的电负性(用γ表示)和元素的化合价一样,也是元素的一种性质。下表给出了14种元素的电负性:
元素 Al B Be C Cl F H
电负性 1.5 2.0 1.5 2.5 3.0 4.0 2.1
元素 Mg N Na O P K Si
电负性 1.2 3.0 0.9 3.5 2.1 0.8 1.8
已知:两成键元素间电负性差值大于1.7时,一般形成离子键;两成键元素间电负性差值小于1.7时,一般形成共价键。
(1)根据表中给出的数据,可推知元素的电负性具有的变化规律是__________________________________________________________________________________________________________。
(2)请指出下列化合物中显正价的元素:
NaH:________、NH3:________、CH4:_______、ICl_______。
同周期从左到右,元素的电负性逐渐增大,同主族从上到下,
元素的电负性逐渐减小
Na
H
H
I
(3)表中符合“对角线规则”的元素有Be和________、B和________,它们的性质分别有一定的相似性,原因是________________________,写出表示Be(OH)2显两性的离子方程式:_____________________________________________________
_________________________________________________。
Al
Si
电负性值相近
Be(OH)2+2OH- ==== [Be(OH)4]2-
Be(OH)2+2H+ ==== Be2++2H2O
微项目 甲醛的危害与去除
—利用电负性分析与预测物质性质
有关资料表明:室内空气污染比室外高5~10倍,室内空气污染物多达500多种。室内空气污染已成为多种疾病的诱因,而甲醛则是造成室内空气污染的一个主要方面。甲醛的主要危害表现为对皮肤黏膜的刺激作用,甲醛是能与蛋白质结合、高浓度吸入时出现呼吸道严重的刺激和水肿、眼刺激、头痛。甲醛与蛋白质结合的原理是什么呢?
1.认识如何借助电负性分析化学键中电荷的分布。
2.体会借助电负性认识与预测有机化合物某些性质的思路和方法。
3.了解甲醛的性质、对人体健康的危害以及去除方法。
知识体系
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
电负性的周期性变化
元素的电负性及其变化规律
复习回顾
阅读教材,了解甲醛的危害和产生的原因
甲醛与蛋白质反应如图所示
项目活动1 解释甲醛危害产生的原因
1.标出甲醛分子中C=O及蛋白质分子中N—H的电荷分布。并分析原因。
2.分析发生反应时①的化学键变化。
根据图中反应前后对比看出N—H断裂,C=O中的一个键断裂,同时形成C—N和O—H。
3.②处 先与一个—NH2发生加成反应,其产物又与另一个—NH2发生取代反应脱去一个H2O分子。试分析发生反应时②处的化学键变化。
发生加成反应时,断裂N—H和C=O中的一条键,形成C—N和O—H;加成产物继续反应时断裂C—O和N—H,同时形成C—N和H—O(生成了H2O)。
4.通过上述加成反应和取代反应分析,断键后的分子片断是如何重组的?
带部分正电荷的原子或基团,与带部分负电荷的原子或基团相连、重组。遵循“正找负”“负找正”的规律。如
阅读教材,了解甲醛的检测和去除的方法
项目活动2 室内空气中甲醛的检测与去除
检测室内空气中的甲醛含量时常用的检测试剂是3 甲基 2苯并噻唑啉酮腙盐酸盐水合物(MBTH)。该方法的原理是甲醛与MBTH反应生成物质A,A再参与一系列反应,最终生成蓝绿色化合物。
1、室内空气中甲醛的检测方法
2、室内空气中甲醛的去除方法
①氨、胺类、酚类物质均可与甲醛发生加成反应,继而发生消去反应,生成水和一种稳定的有机物,从而除去甲醛。
④某些植物可吸收甲醛如吊兰、芦荟、虎尾兰等。
②利用氧化剂将甲醛氧化除去如KMnO4、K2Cr2O7等。
③利用多孔材料通过物理吸附的方法除甲醛,如活性炭等。
利用电负性认识和预测物质性质的流程
借助电负性认识与预测有机化合物某些性质的思路和方法
找到可能发生反应的断键部位
利用电负性分析断键部位电荷的分布
依据“正”“负”结合的规律推测断键后的分子片段如何重组
单键部位发生取代反应
双键部位发生加成反应
1.在入住装修过的新房之前,下列做法中错误的是( )
①紧闭门窗,防止装修面干裂、变质
②适度开窗通气,充分地进行内外空气对流
③用高浓度的甲醛溶液对室内环境消毒
④在各个房间内均匀地放置适量的吊兰、芦荟等植物
A.①② B.①③
C.①④ D.②④
B
2.对A、B两种主族元素(除ⅠA族)来说,下列叙述中正确的是( )
A.若A的电负性大于B,则A的第一电离能一定大于B
B.若A的电负性大于B,则A的失电子能力大于B
C.若A的电负性大于B,则A的得电子能力大于B
D.若A的电负性大于B,则A的原子半径一定小于B
C
3.元素的电负性(用γ表示)和元素的化合价一样,也是元素的一种性质。下表给出了14种元素的电负性:
元素 Al B Be C Cl F H
电负性 1.5 2.0 1.5 2.5 3.0 4.0 2.1
元素 Mg N Na O P K Si
电负性 1.2 3.0 0.9 3.5 2.1 0.8 1.8
已知:两成键元素间电负性差值大于1.7时,一般形成离子键;两成键元素间电负性差值小于1.7时,一般形成共价键。
(1)根据表中给出的数据,可推知元素的电负性具有的变化规律是__________________________________________________________________________________________________________。
(2)请指出下列化合物中显正价的元素:
NaH:________、NH3:________、CH4:_______、ICl_______。
同周期从左到右,元素的电负性逐渐增大,同主族从上到下,
元素的电负性逐渐减小
Na
H
H
I
(3)表中符合“对角线规则”的元素有Be和________、B和________,它们的性质分别有一定的相似性,原因是________________________,写出表示Be(OH)2显两性的离子方程式:_____________________________________________________
_________________________________________________。
Al
Si
电负性值相近
Be(OH)2+2OH- ==== [Be(OH)4]2-
Be(OH)2+2H+ ==== Be2++2H2O
