第2章 微项目补铁剂中铁元素的检验 课件(共23张PPT) 2024-2025学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 第2章 微项目补铁剂中铁元素的检验 课件(共23张PPT) 2024-2025学年高二化学鲁科版(2019)选择性必修2 |

|
|
| 格式 | ppt | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-27 14:14:45 | ||
图片预览







文档简介
(共23张PPT)
微项目 补铁剂中铁元素的检验
-应用配合物进行物质检验
思考:
正常补铁剂中铁元素的价态是+2,怎样检验补铁剂中铁元素的价态是否发生了变化?
1.了解金属离子可以形成丰富多彩的配合物,许多配合物都具有颜色;知道可以利用形成的配合物的特征颜色对金属离子进行定性检验。
2.了解配合物的稳定性各不相同,配合物之间可以发生转化;知道如何在实验过程中根据配合物的稳定性及转化关系选择实验条件。
能结合宏观实验现象从微粒之间相互作用等角度描述和分析配位反应和平衡,并能说明其在实际问题中的应用。 (变化观念与平衡思想)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
配位化学的发展推动了化学各分支学科的发展。例如,在分析化学中,配合物的形成(或配位反应)通常用于鉴定、分离某些离子,或对溶液进行比色分析,以测定有关离子的浓度。
在本项目活动中,将利用配合物的特征颜色来检验补贴药片中的Fe2+和Fe3+,并测定Fe2+的含量,体会配合物的使用价值。
补铁药物种类繁多,常见的有效成分有硫酸亚铁、琥珀酸亚铁、富马酸亚铁、葡萄糖酸亚铁等,其中多种为亚铁离子的配合物。在补铁药物中也有铁离子的配合物,如蛋白琥珀酸铁等。
由于Fe2+具有还原性,药品在保存过程中可能生成Fe3+。Fe2+与Fe3+在水溶液中均有颜色,但是在浓度较低时肉眼几乎观察不到;不过,它们形成配合物后往往会显示特征颜色,且颜色较深。例如,向几乎无色的0.001mol L-1Fe3+溶液中滴加KSCN溶液后,溶液立即变红,这便是利用具有特殊颜色的配合物进行离子检验的实例。
实验方案设计与实施
请设计实验方案,检验补铁药片(如琥珀酸亚铁)中铁元素是否为二价,并检验药片在保存过程中铁元素是否部分氧化为三价。
项目活动1 补铁药片中铁元素价态的检验
试验任务 实验方案(一) 实验现象 实验结论
1.溶解固体样品
2.检验Fe2+
3.检验Fe3+
将琥珀酸亚铁药片充分研磨,并用稀硫酸溶解。
得到悬浊液,静置分层。
琥珀酸亚铁药片中含有难溶物质。
取少量上清液于试管中,滴加适量酸性KMnO4溶液。
酸性KMnO4溶液褪色。
琥珀酸亚铁药片中含有Fe2+。
另取少量上清液于试管中,滴加适量KSCN溶液。
试管中溶液变红。
琥珀酸亚铁药片中含有Fe3+。
试验任务 实验方案(二) 实验现象 实验结论
1.溶解固体样品
2.检验Fe2+
3.检验Fe3+
将同一批琥珀酸亚铁药片充分研磨,并用蒸馏水溶解。
得到悬浊液,静置分层。
琥珀酸亚铁药片中含有难溶物质。
取少量上清液于试管中,滴加适量酸性KMnO4溶液。
酸性KMnO4溶液褪色。
琥珀酸亚铁药片中含有Fe2+。
另取少量上清液于试管中,滴加适量KSCN溶液。
试管中溶液不变红。
琥珀酸亚铁药片中不含有Fe3+。
讨论
1.对于同一批药片,用KSCN溶液检验Fe3+,有的小组观察到溶液变红,说明药片被氧化,但也有的小组没有观察到该现象。对比实验过程发现:用酸溶解药片配制成悬浊液的小组,用KSCN溶液检验Fe3+观察到溶液变红,而用蒸馏水溶解药片的小组没有观察到溶液变红。请讨论这种差异的原因,以及对于实验条件的选取有哪些启示。
Fe3+的水合离子[Fe(H2O)6]3+成淡紫色(稀溶液时为无色),但因Fe3+极易水解,故未充分酸化的水溶液会由于有[Fe(OH)6]2+存在而成黄色。随pH升高,Fe3+水解程度增大,可生成Fe(OH)3胶体或沉淀。由于OH-更易与Fe3+结合,在pH>3时,SCN-无法竞争到Fe3+,在pH<3时,OH-浓度很小,这时SCN-可以竞争到Fe3+,从而观察到溶液变红。由此可知,用SCN-检验Fe3+须在酸性条件下进行。
讨论
2.有小组利用能使酸性KMnO4溶液褪色的方法检验Fe2+,但是受到了一些同学的质疑。你认为这一检验方法的原因是什么,应如何真实、复杂的体系中便捷地检验Fe2+。
在检验Fe2+时,酸性KMnO4溶液褪色只能说明溶液中存在具有还原性的物质,考虑到补铁药片中可能含有其他还原剂,因此无法说明溶液中含有Fe2+。
也就是说以上方案一和方案二中用酸性KMnO4溶液检验Fe2+,最终无法说明溶液中含有Fe2+。前面你了解到很多配合物具有特征颜色,可以在离子检验中发挥作用。那么,能否利用配合物直接检验Fe2+呢?
项目活动2 寻找更优的检验试剂
筛选检验试剂的思路:
配合物的颜色越深,越有利于检验出金属离子;稳定性越强,受环境干扰越小。
实验方案设计与实施
1.请你预测以下物质是否可能与Fe2+、Fe3+形成配合物。如果能形成,会是与哪个原子形成配位键?
供选用的试剂:苯酚、硫氰酸钾(KSCN)、邻二氮菲(phen, )、乙二胺四乙酸二钠盐(EDTA-2Na)。
试验任务 实验方案 实验现象 实验结论
1.检验试剂是否与Fe2+形成配位键
2.检验试剂是否与Fe3+形成配位键
分别取等体积、等浓度的Fe2+溶液置于四只①②③④相同的洁净试管中,依次滴加3滴苯酚、硫氰酸钾、邻二氮菲、乙二胺四乙酸二钠盐溶液。
分别取等体积、等浓度的Fe3+溶液置于四只ABCD相同的洁净试管中,依次滴加3滴苯酚、硫氰酸钾、邻二氮菲、乙二胺四乙酸二钠盐溶液。
①试管中:无现象
②试管中:无现象
③试管中:橙红色
④试管中:淡绿色
与Fe2+能形成配位键:苯酚、硫氰酸钾不能;邻二氮菲、乙二胺四乙酸二钠盐能。
A试管中:紫色
B试管中:红色
C试管中:无现象
D试管中:黄色
与Fe3+能形成配位键:苯酚、硫氰酸钾、乙二胺四乙酸二钠盐能;邻二氮菲不能。
1.Fe2+具有空轨道,邻二氮菲中的氮原子、乙二胺四乙酸二钠盐中的氮原子和氧原子具有孤电子对,都可以与Fe2+形成配位键而呈现特定的颜色。
2.Fe3+具有空轨道,苯酚羟基中的氧原子、硫氰酸钾中的氮原子、乙二胺四乙酸二钠盐中的氮原子和氧原子具有孤电子对,都可以与Fe3+形成配位键而呈现特定的颜色。
2.酸碱性对于你选出的检验试剂形成配合物的显色是否会产生影响?请根据.Fe2+或Fe3+的性质以及所选试剂的结构特点作出预测,并设计探索该配体作为检验试剂的适用范围。
实验方案 实验现象 实验结论
1.取5mL含有邻二氮菲亚铁离子的橙红色溶液,置于洁净试管中,逐滴滴加稀硫酸,并测其pH。
1.另取5mL含有邻二氮菲亚铁离子的橙红色溶液,置于洁净试管中,逐滴滴加NaOH溶液,并测其pH。
橙红色逐渐变浅,最终褪色,且褪色时pH=2。
当H+浓度较高时,邻二氮菲中的氮原子优先与H+形成配位键,导致邻二氮菲与Fe2+的配位能力减弱。
橙红色逐渐变浅,最终褪色,且褪色时pH=9。
当OH-浓度较高时,OH-又会与Fe2+作用,同邻二氮菲中形成竞争,导致邻二氮菲与Fe2+的配位能力减弱。
除硫氰酸钾和邻二氮菲分别作为检验Fe3+、Fe2+的检验试剂外,亚铁氰化钾K4[Fe(CN)6]、铁氰化钾K3[Fe(CN)6]可以分别为Fe3+和Fe2+生成蓝色沉淀,也常作为两种离子的检验试剂。
螯合物
1.概念理解:EDTA-2Na溶液中,每个EDTA2-可以电离出2个H+,生成EDTA4-,然后与金属离子配位。EDTA4-中的2个N、4个O都可以与金属离子结合,这类配体称为多齿配体,形成的配合物称为螯合物。
2.作用:螯合物比金属离子与其配体生成的类似配合物有更高的稳定性,由螯合作用得到的某些金属螯合剂用途更广。例如,EDTA为六齿螯合剂,可用于水的软化、食物的保存等;环状配体冠醚类螯合剂适用于碱金属、碱土金属(IIA族)的分离和分析。
拓展视野
比色法
由于溶液颜色的深浅与有色物质的浓度有关,可以通过比较颜色深浅确定有色物质的浓度,这种方法称为比色法,其中最简单的是目视比色法。目视比色法的基本思路为:用该物质的已知浓度且浓度较大的溶液通过稀释配制一系列浓度呈等差分布的溶液,在一定条件下显色后作为标准色阶;然后将待测溶液在相同条件下显色,并与标准色阶进行比较,从而确定待测物质的浓度。目视比色法操作简便迅速、受杂质影响较小,适合混合体系中微量组分的测定。目视比色法在环境监测、疾病控制以及食品或药品的质量控制等领域得到广泛应用。
项目成果展示
请结合本微项目的学习,归纳总结配合物在物质检验中的应用及其与它们性质的关联,可从以下视角进行归纳总结:
应用配合物进行物质检验
筛选检验试剂思路
Fe2+检验
稳定性强
颜色深
邻二氮菲
EDTA-2Na
Fe3+检验
苯酚
KSCN
项目成果
1.(双选)如图所示,a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物,b为EDTA与Ca2+形成的螯合物。下列叙述正确的是( )
A.a和b中N原子均采取sp3杂化 B.b中Ca2+的配位数为6
C.a中配位原子是C原子 D.b中含有共价键、离子键和配位键
AB
2.选择合适试剂完成甲、乙两组实验。
甲组:检验含Fe3+的溶液中是否含有Fe2+;
乙组:检验含Fe2+的溶液中是否含有Fe3+。
下列试剂及加入试剂顺序能达到实验目的的是( )
试剂选项 甲组 乙组
A 新制氯水、KSCN溶液 NaOH溶液
B 酸性KMnO4溶液 KSCN溶液
C KOH溶液 溴水
D 溴水 酸性KMnO4溶液
B
3.下列说法正确的是( )
A.苯酚中的C原子与Fe3+形成配位键
B.硫氰酸钾中的K原子提供孤电子对与Fe3+形成配位键
C.邻二氮菲中的N原子提供孤电子对与Fe2+形成配位键
D.EDTA-2Na中只有N原子提供孤电子对与Fe2+形成配位键
C
4.下列说法错误的是( )
A.邻二氮菲中的N原子为sp2杂化
B.Fe2+与邻二氮菲形成稳定的橙红色配合物
C.亚铁氰化钾与Fe2+形成蓝色沉淀
D.EDTA4-为多齿配体
C
5.下列说法正确的是( )
A.邻二氮菲能检测任意酸碱环境中的Fe2+
B.铁氰化钾与Fe2+形成蓝色的配合物
C.EDTA可用于水的硬化和食物保存
D.EDTA与邻二氮菲中的N原子均为sp2杂化
B
微项目 补铁剂中铁元素的检验
-应用配合物进行物质检验
思考:
正常补铁剂中铁元素的价态是+2,怎样检验补铁剂中铁元素的价态是否发生了变化?
1.了解金属离子可以形成丰富多彩的配合物,许多配合物都具有颜色;知道可以利用形成的配合物的特征颜色对金属离子进行定性检验。
2.了解配合物的稳定性各不相同,配合物之间可以发生转化;知道如何在实验过程中根据配合物的稳定性及转化关系选择实验条件。
能结合宏观实验现象从微粒之间相互作用等角度描述和分析配位反应和平衡,并能说明其在实际问题中的应用。 (变化观念与平衡思想)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
配位化学的发展推动了化学各分支学科的发展。例如,在分析化学中,配合物的形成(或配位反应)通常用于鉴定、分离某些离子,或对溶液进行比色分析,以测定有关离子的浓度。
在本项目活动中,将利用配合物的特征颜色来检验补贴药片中的Fe2+和Fe3+,并测定Fe2+的含量,体会配合物的使用价值。
补铁药物种类繁多,常见的有效成分有硫酸亚铁、琥珀酸亚铁、富马酸亚铁、葡萄糖酸亚铁等,其中多种为亚铁离子的配合物。在补铁药物中也有铁离子的配合物,如蛋白琥珀酸铁等。
由于Fe2+具有还原性,药品在保存过程中可能生成Fe3+。Fe2+与Fe3+在水溶液中均有颜色,但是在浓度较低时肉眼几乎观察不到;不过,它们形成配合物后往往会显示特征颜色,且颜色较深。例如,向几乎无色的0.001mol L-1Fe3+溶液中滴加KSCN溶液后,溶液立即变红,这便是利用具有特殊颜色的配合物进行离子检验的实例。
实验方案设计与实施
请设计实验方案,检验补铁药片(如琥珀酸亚铁)中铁元素是否为二价,并检验药片在保存过程中铁元素是否部分氧化为三价。
项目活动1 补铁药片中铁元素价态的检验
试验任务 实验方案(一) 实验现象 实验结论
1.溶解固体样品
2.检验Fe2+
3.检验Fe3+
将琥珀酸亚铁药片充分研磨,并用稀硫酸溶解。
得到悬浊液,静置分层。
琥珀酸亚铁药片中含有难溶物质。
取少量上清液于试管中,滴加适量酸性KMnO4溶液。
酸性KMnO4溶液褪色。
琥珀酸亚铁药片中含有Fe2+。
另取少量上清液于试管中,滴加适量KSCN溶液。
试管中溶液变红。
琥珀酸亚铁药片中含有Fe3+。
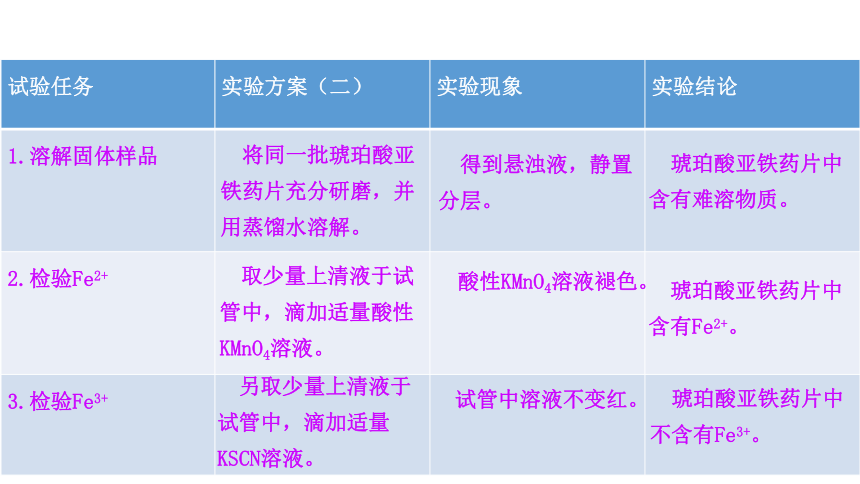
试验任务 实验方案(二) 实验现象 实验结论
1.溶解固体样品
2.检验Fe2+
3.检验Fe3+
将同一批琥珀酸亚铁药片充分研磨,并用蒸馏水溶解。
得到悬浊液,静置分层。
琥珀酸亚铁药片中含有难溶物质。
取少量上清液于试管中,滴加适量酸性KMnO4溶液。
酸性KMnO4溶液褪色。
琥珀酸亚铁药片中含有Fe2+。
另取少量上清液于试管中,滴加适量KSCN溶液。
试管中溶液不变红。
琥珀酸亚铁药片中不含有Fe3+。
讨论
1.对于同一批药片,用KSCN溶液检验Fe3+,有的小组观察到溶液变红,说明药片被氧化,但也有的小组没有观察到该现象。对比实验过程发现:用酸溶解药片配制成悬浊液的小组,用KSCN溶液检验Fe3+观察到溶液变红,而用蒸馏水溶解药片的小组没有观察到溶液变红。请讨论这种差异的原因,以及对于实验条件的选取有哪些启示。
Fe3+的水合离子[Fe(H2O)6]3+成淡紫色(稀溶液时为无色),但因Fe3+极易水解,故未充分酸化的水溶液会由于有[Fe(OH)6]2+存在而成黄色。随pH升高,Fe3+水解程度增大,可生成Fe(OH)3胶体或沉淀。由于OH-更易与Fe3+结合,在pH>3时,SCN-无法竞争到Fe3+,在pH<3时,OH-浓度很小,这时SCN-可以竞争到Fe3+,从而观察到溶液变红。由此可知,用SCN-检验Fe3+须在酸性条件下进行。
讨论
2.有小组利用能使酸性KMnO4溶液褪色的方法检验Fe2+,但是受到了一些同学的质疑。你认为这一检验方法的原因是什么,应如何真实、复杂的体系中便捷地检验Fe2+。
在检验Fe2+时,酸性KMnO4溶液褪色只能说明溶液中存在具有还原性的物质,考虑到补铁药片中可能含有其他还原剂,因此无法说明溶液中含有Fe2+。
也就是说以上方案一和方案二中用酸性KMnO4溶液检验Fe2+,最终无法说明溶液中含有Fe2+。前面你了解到很多配合物具有特征颜色,可以在离子检验中发挥作用。那么,能否利用配合物直接检验Fe2+呢?
项目活动2 寻找更优的检验试剂
筛选检验试剂的思路:
配合物的颜色越深,越有利于检验出金属离子;稳定性越强,受环境干扰越小。
实验方案设计与实施
1.请你预测以下物质是否可能与Fe2+、Fe3+形成配合物。如果能形成,会是与哪个原子形成配位键?
供选用的试剂:苯酚、硫氰酸钾(KSCN)、邻二氮菲(phen, )、乙二胺四乙酸二钠盐(EDTA-2Na)。
试验任务 实验方案 实验现象 实验结论
1.检验试剂是否与Fe2+形成配位键
2.检验试剂是否与Fe3+形成配位键
分别取等体积、等浓度的Fe2+溶液置于四只①②③④相同的洁净试管中,依次滴加3滴苯酚、硫氰酸钾、邻二氮菲、乙二胺四乙酸二钠盐溶液。
分别取等体积、等浓度的Fe3+溶液置于四只ABCD相同的洁净试管中,依次滴加3滴苯酚、硫氰酸钾、邻二氮菲、乙二胺四乙酸二钠盐溶液。
①试管中:无现象
②试管中:无现象
③试管中:橙红色
④试管中:淡绿色
与Fe2+能形成配位键:苯酚、硫氰酸钾不能;邻二氮菲、乙二胺四乙酸二钠盐能。
A试管中:紫色
B试管中:红色
C试管中:无现象
D试管中:黄色
与Fe3+能形成配位键:苯酚、硫氰酸钾、乙二胺四乙酸二钠盐能;邻二氮菲不能。
1.Fe2+具有空轨道,邻二氮菲中的氮原子、乙二胺四乙酸二钠盐中的氮原子和氧原子具有孤电子对,都可以与Fe2+形成配位键而呈现特定的颜色。
2.Fe3+具有空轨道,苯酚羟基中的氧原子、硫氰酸钾中的氮原子、乙二胺四乙酸二钠盐中的氮原子和氧原子具有孤电子对,都可以与Fe3+形成配位键而呈现特定的颜色。
2.酸碱性对于你选出的检验试剂形成配合物的显色是否会产生影响?请根据.Fe2+或Fe3+的性质以及所选试剂的结构特点作出预测,并设计探索该配体作为检验试剂的适用范围。
实验方案 实验现象 实验结论
1.取5mL含有邻二氮菲亚铁离子的橙红色溶液,置于洁净试管中,逐滴滴加稀硫酸,并测其pH。
1.另取5mL含有邻二氮菲亚铁离子的橙红色溶液,置于洁净试管中,逐滴滴加NaOH溶液,并测其pH。
橙红色逐渐变浅,最终褪色,且褪色时pH=2。
当H+浓度较高时,邻二氮菲中的氮原子优先与H+形成配位键,导致邻二氮菲与Fe2+的配位能力减弱。
橙红色逐渐变浅,最终褪色,且褪色时pH=9。
当OH-浓度较高时,OH-又会与Fe2+作用,同邻二氮菲中形成竞争,导致邻二氮菲与Fe2+的配位能力减弱。
除硫氰酸钾和邻二氮菲分别作为检验Fe3+、Fe2+的检验试剂外,亚铁氰化钾K4[Fe(CN)6]、铁氰化钾K3[Fe(CN)6]可以分别为Fe3+和Fe2+生成蓝色沉淀,也常作为两种离子的检验试剂。
螯合物
1.概念理解:EDTA-2Na溶液中,每个EDTA2-可以电离出2个H+,生成EDTA4-,然后与金属离子配位。EDTA4-中的2个N、4个O都可以与金属离子结合,这类配体称为多齿配体,形成的配合物称为螯合物。
2.作用:螯合物比金属离子与其配体生成的类似配合物有更高的稳定性,由螯合作用得到的某些金属螯合剂用途更广。例如,EDTA为六齿螯合剂,可用于水的软化、食物的保存等;环状配体冠醚类螯合剂适用于碱金属、碱土金属(IIA族)的分离和分析。
拓展视野
比色法
由于溶液颜色的深浅与有色物质的浓度有关,可以通过比较颜色深浅确定有色物质的浓度,这种方法称为比色法,其中最简单的是目视比色法。目视比色法的基本思路为:用该物质的已知浓度且浓度较大的溶液通过稀释配制一系列浓度呈等差分布的溶液,在一定条件下显色后作为标准色阶;然后将待测溶液在相同条件下显色,并与标准色阶进行比较,从而确定待测物质的浓度。目视比色法操作简便迅速、受杂质影响较小,适合混合体系中微量组分的测定。目视比色法在环境监测、疾病控制以及食品或药品的质量控制等领域得到广泛应用。
项目成果展示
请结合本微项目的学习,归纳总结配合物在物质检验中的应用及其与它们性质的关联,可从以下视角进行归纳总结:
应用配合物进行物质检验
筛选检验试剂思路
Fe2+检验
稳定性强
颜色深
邻二氮菲
EDTA-2Na
Fe3+检验
苯酚
KSCN
项目成果
1.(双选)如图所示,a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物,b为EDTA与Ca2+形成的螯合物。下列叙述正确的是( )
A.a和b中N原子均采取sp3杂化 B.b中Ca2+的配位数为6
C.a中配位原子是C原子 D.b中含有共价键、离子键和配位键
AB
2.选择合适试剂完成甲、乙两组实验。
甲组:检验含Fe3+的溶液中是否含有Fe2+;
乙组:检验含Fe2+的溶液中是否含有Fe3+。
下列试剂及加入试剂顺序能达到实验目的的是( )
试剂选项 甲组 乙组
A 新制氯水、KSCN溶液 NaOH溶液
B 酸性KMnO4溶液 KSCN溶液
C KOH溶液 溴水
D 溴水 酸性KMnO4溶液
B
3.下列说法正确的是( )
A.苯酚中的C原子与Fe3+形成配位键
B.硫氰酸钾中的K原子提供孤电子对与Fe3+形成配位键
C.邻二氮菲中的N原子提供孤电子对与Fe2+形成配位键
D.EDTA-2Na中只有N原子提供孤电子对与Fe2+形成配位键
C
4.下列说法错误的是( )
A.邻二氮菲中的N原子为sp2杂化
B.Fe2+与邻二氮菲形成稳定的橙红色配合物
C.亚铁氰化钾与Fe2+形成蓝色沉淀
D.EDTA4-为多齿配体
C
5.下列说法正确的是( )
A.邻二氮菲能检测任意酸碱环境中的Fe2+
B.铁氰化钾与Fe2+形成蓝色的配合物
C.EDTA可用于水的硬化和食物保存
D.EDTA与邻二氮菲中的N原子均为sp2杂化
B
