2025年湖南省永州市祁阳市浯溪二中中考化学专题训练——工艺流程题(二)(含解析)
文档属性
| 名称 | 2025年湖南省永州市祁阳市浯溪二中中考化学专题训练——工艺流程题(二)(含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 731.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-27 15:26:00 | ||
图片预览




文档简介
2025年湖南省祁阳市浯溪二中中考化学专题训练——工艺流程题(二)
1.煤中硫的存在形态分为有机硫和无机硫(CaSO4、硫化物及微量单质硫等)。库仑滴定法是常用的快速检测煤中全硫含量的方法,其主要过程如图所示。
(1)煤样需研磨成细小粉末,目的是 。
(2)在催化剂作用下,煤在管式炉中充分燃烧,出口气体中主要含有 、O2、H2O、N2、SO2。
(3)高温下,煤中的FeS2完全转化为SO2,补全该反应的化学方程式:4FeS2+11O2 +8SO2。
2.工业上可利用物料循环的方法实现烟气的脱硫处理,工艺流程如图所示。
(1)操作Ⅰ是 。
(2)由二氧化硫转化为CaSO3固体后,硫元素化合价 (填“升高”、“降低”或“不变”)。
(3)绿色化学提倡物料循环,以上流程中,可用于循环的物质有 。
3.煤炭被人们誉为“工业的粮食”,是18世纪以来人类使用的主要能源,但燃煤会产生严重的大气污染。如图是某燃煤发电厂烟气处理的流程图。
(1)煤属于 再生能源(填“可”或“不可”)。
(2)烟气处理过程中,生成氧化钙的化学方程式为 。
(3)烟气处理过程中,上述物质的元素化合价发生改变的是 (填元素符号)。
(4)日常生活中,常将煤块制成蜂窝煤后燃烧,其目的是 。
4.有毒的H2S气体常用脱硫液吸收进行处理。一种用FeCl3溶液循环脱硫工艺的物质转化如图所示。
(1)图中X物质可能是 (填化学式)。
(2)写出该脱硫总反应的化学方程式: 。
5.工业上常用双氧水处理含SO2的烟气,排放出浓度较高的硫酸作工业原料,脱硫过程发生的反应有:①SO2+H2O=H2SO3 ②H2O2+H2SO3=H2SO4+H2O。
(1)该烟气不经过处理直接排放会导致 等环境问题。
(2)脱硫过程中化合价没有发生改变的是反应 。(填“①”或“②”)
(3)若排放出100千克溶质质量分数为29.4%的硫酸,需要用溶质质量分数为34%的双氧水多少千克?(写出计算过程)
(4)工业上还有种脱硫法——“双碱法脱硫”,该工艺是先将含SO2的烟气通过排烟机送入脱硫塔,与NaOH、Na2CO3、Na2SO3等水溶液充分接触后与烟气中的SO2反应。将吸收液送至石灰反应器,进行吸收液的再生和固体副产品的析出。吸收过程中涉及的反应方程式:
用NaOH吸收:2NaOH+SO2=Na2SO3+H2O
用Na2CO3吸收:Na2CO3+SO2=Na2SO3+CO2
用Na2SO3吸收:Na2SO3+SO2+H2O=2NaHSO3
若在脱硫塔内吸收等质量的含SO2的烟气,用 吸收所需要的原料质量最少。
6.酸雨的危害很大,硫酸型酸雨的形成有以下两种途径:
(1)正常雨水略显酸性,主要原因是 。
(2)pH< 的降水称为酸雨,它会使土壤酸化。
(3)SO2通入碘水(I2的水溶液)会生成硫酸(H2SO4)和氢碘酸(HI),我们可利用此原理来测定空气中SO2的含量,请写出该反应的化学方程式: 。
(4)近年来我国很多地区经常发生雾霾天气,所以治理污染刻不容缓。PM2.5是指大气中微粒直径小于2.5微米的颗粒物。你认为下列会形成PM2.5的是 。
A.焚烧秸秆
B.汽车尾气排放
C.太阳能发电
7.历经三年的新冠疫情,在2022年底终于告一段落,多年未聚的亲朋好友们在度过一个喜庆的兔年春节的同时,也尽情的燃放了大量的烟花爆竹。烟花特有的气味提升了年味,同时也给大气增加了不少污染物。
(1)爆竹的主要成分是黑火药,其中含有一定量的硫磺,请写出硫在空气中燃烧的反应生成物溶于水后,水溶液的pH 7(选填:<、=、>)。
(2)二氧化硫是造成酸雨的原因之一,溶于水后形成的亚硫酸(H2SO3)会在空气中进一步氧化,通过化合反应生成硫酸,相应的反应方程式为 ,造成土壤进一步酸化。为了保护环境,我们常用一种碱来改良酸性土壤,它的俗称是 ;请写出用此碱改良酸性土壤的反应方程式 。(土壤酸性物质以H2SO4计)
(3)氯气是一种有毒气体,它在物质分类上属于 (选填“单质”或“化合物”),它主要通过呼吸道侵入人体,与在黏膜中所含的水分反应,生成次氯酸(HClO)和盐酸,请写出相应的反应方程式 。
8.矿山废水中含有大量的H2SO4和CuSO4,直接排放会影响水体酸碱性,并造成重金属污染。通过处理可以回收金属铜,并使废水pH和重金属含量达到排放标准。
已知:Cu(OH)2是蓝色不溶于水的固体:步骤Ⅰ无蓝色沉淀生成。
(1)步骤Ⅱ和步骤Ⅲ都需进行的操作是 。
(2)步骤Ⅱ得到金属铜的反应的化学方程式为 。
(3)步骤Ⅲ需加入Na2S才能使废水达到排放标准,由此推测废水③不达标的主要原因是其中含有 (填离子符号)。
9.航天梦,中国梦。中国航天,又站在了一个新的起点。
(1)制造太阳能电池板需要使用铝合金,铝合金加工成铝箔利用了金属的 性。
(2)空间站的太阳能电池在充电过程中的能量转化:太阳能→ →化学能。
(3)神舟十三号载人飞船由长征二号F遥十三运载火箭发射升空。运载火箭由三级火箭组成。一级和二级火箭的推进剂为偏二甲肼(C2H8N2)和四氧化二氮(N2O4),其反应的化学方程式为:C2H8N2+2N2O4=3N2+2X+4H2O,则X的化学式是 。
(4)航天员在《天宫课堂》为我们进行太空授课时,将半片泡腾片(含某种酸和碳酸氢钠)塞入一个蓝色水球里,水球里立即产生很多气泡,该气体能使澄清石灰水变浑浊。请写出该气体与澄清石灰水反应的化学方程式 。
(5)空间站中科学家采用水气整合系统实现CO2的清除和O2的再生,流程如下图所示。
①O2再生系统中,运用电解水的方法制取氧气,反应的化学方程式为 。
②在流程图所示的物质转化中,进入O2再生系统发生电解的水的质量 (填“大于”“等于”或“小于”)CO2清除系统中生成水的质量。
10.【基础实验与跨学科实践】
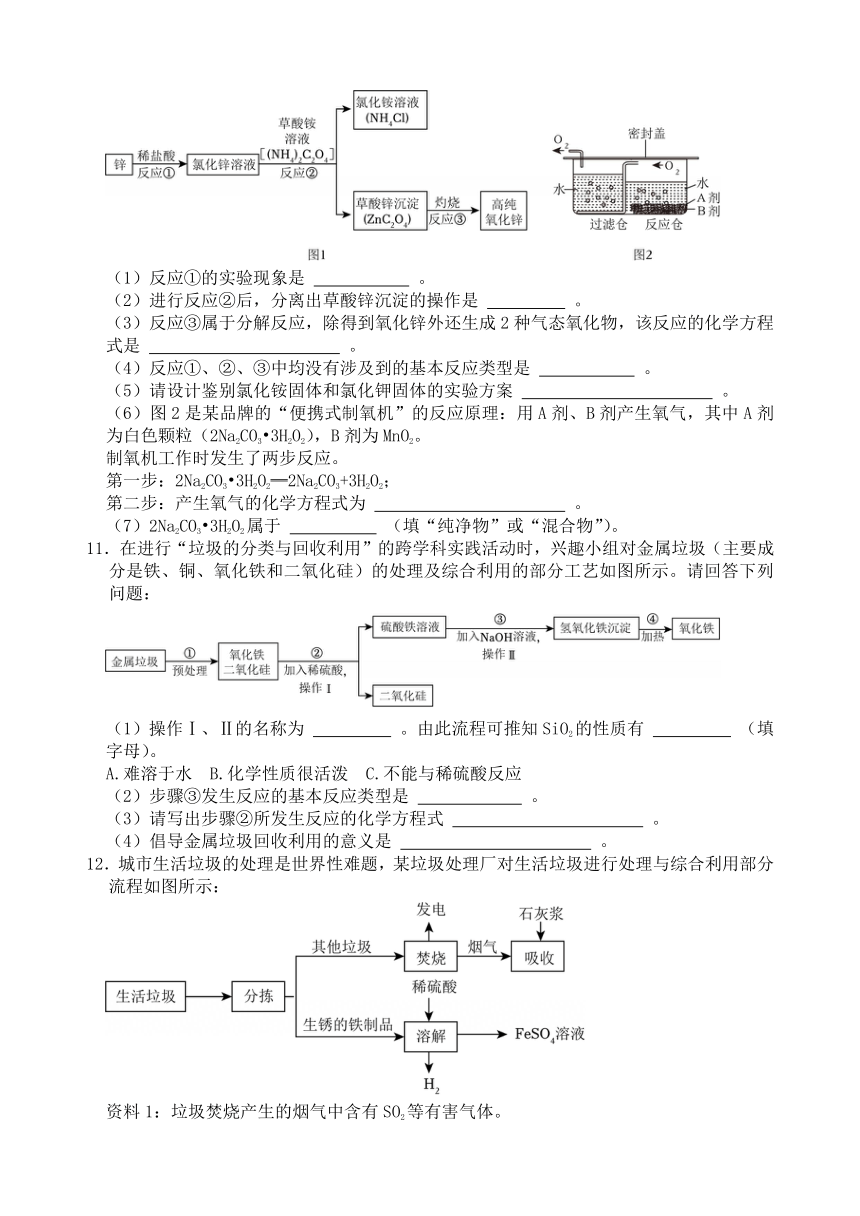
高纯氧化锌广泛应用于电子工业,某研究小组设计如图1所示流程制备高纯氧化锌。
(1)反应①的实验现象是 。
(2)进行反应②后,分离出草酸锌沉淀的操作是 。
(3)反应③属于分解反应,除得到氧化锌外还生成2种气态氧化物,该反应的化学方程式是 。
(4)反应①、②、③中均没有涉及到的基本反应类型是 。
(5)请设计鉴别氯化铵固体和氯化钾固体的实验方案 。
(6)图2是某品牌的“便携式制氧机”的反应原理:用A剂、B剂产生氧气,其中A剂为白色颗粒(2Na2CO3 3H2O2),B剂为MnO2。
制氧机工作时发生了两步反应。
第一步:2Na2CO3 3H2O2═2Na2CO3+3H2O2;
第二步:产生氧气的化学方程式为 。
(7)2Na2CO3 3H2O2属于 (填“纯净物”或“混合物”)。
11.在进行“垃圾的分类与回收利用”的跨学科实践活动时,兴趣小组对金属垃圾(主要成分是铁、铜、氧化铁和二氧化硅)的处理及综合利用的部分工艺如图所示。请回答下列问题:
(1)操作Ⅰ、Ⅱ的名称为 。由此流程可推知SiO2的性质有 (填字母)。
A.难溶于水 B.化学性质很活泼 C.不能与稀硫酸反应
(2)步骤③发生反应的基本反应类型是 。
(3)请写出步骤②所发生反应的化学方程式 。
(4)倡导金属垃圾回收利用的意义是 。
12.城市生活垃圾的处理是世界性难题,某垃圾处理厂对生活垃圾进行处理与综合利用部分流程如图所示:
资料1:垃圾焚烧产生的烟气中含有SO2等有害气体。
资料2:FeSO4容易被空气中的O2氧化。
回答下列问题:
(1)发电厂是利用垃圾焚烧产生的 转变成电能。
(2)生锈的铁制品经粉碎后再加入稀硫酸的目的是 。
(3)溶解步骤中,生锈的铁制品在足量的稀硫酸中充分反应后有黑色固体剩余,写出铁锈与稀硫酸反应的化学方程式 ;剩余黑色固体的主要成分是 (写化学式)。
(4)将所得硫酸亚铁溶液在氮气环境中加热蒸发浓缩、冷却结晶、过滤,得到硫酸亚铁晶体,其中氮气的作用是 。
(5)政府倡导垃圾分类,其好处是: 。(写一点)
13.某垃圾处理广对生活垃圾进行处理与综合利用的部分流程如下:
资料1:垃圾焚烧产生的烟气中含有SO2、HCl等有害气体。
资料2:+2价的铁元素容易被空气中的氧气氧化。
回答下列问题
(1)发电厂是利用垃圾焚烧产生的 转变为电能。
(2)吸收步骤中,石灰浆的作用是 ,用石灰浆不用石灰水的原因是 。
(3)“溶解”步骤中,产生的H2的化学方程式为 ,除此反应外,溶解步骤还能发生两个反应:①Fe2O3+3H2SO4=Fe(SO4)3+3H2O②Fe+Fe2(SO4)3=3FeSO4,其中属于复分解反应的是 (填序号)。反应前后铁元素的化合价改变的是 (填序号)。
(4)将所得硫酸亚铁溶液在氮气环境中加热蒸发浓缩、冷却结晶、 (填操作名称),得到硫酸亚铁晶体,其中氮气的作用是 。
14.从古至今,家用燃料经历了巨大的变化。
(1)家用燃料(括号内表示燃料的主要成分)更新历程如下图所示。
写出甲烷(CH4)在空气中充分燃烧的化学方程式 。
(2)氨基钠(NaNH2)是合成维生素A的原料。工业上以煤、空气为原料合成氨基钠的工艺流程如图所示。
①炭化塔中H2、N2不参加反应,写出炭化塔中发生反应的化学方程式 ;
②反应釜中的反应属于基本反应类型中的 反应。
15.氢气的发现、生产和应用极大地推动了人类社会的发展。
(1)18世纪,科学家利用铁和稀盐酸反应得到“易燃空气”,之后命名为氢气。发现氢气后,人们一直追求将氢气作为一种绿色能源,其理由是 。
(2)1969年,科学家利用催化剂TiO2实现光分解水制氢气。该反应的化学方程式为 。
(3)氢气储运成本较高,2023年我国建成首座氨制氢加氢站。氨制氢的一种生产流程如图所示。
①步骤Ⅱ的反应属于 (填基本反应类型)。
②步骤Ⅲ的分子筛只让氢分子通过而阻止其他分子通过,该过程属于 (填“物理”或“化学”)变化。
③利用氨生产氢气的优点有 (写出一个即可)。
16.“笔墨纸砚”被誉为文房四宝,承载着优秀的中国传统文化。
笔:《辞源》中记载:“恬始作笔,以枯木为管,鹿毛为柱,羊毛为被。”
(1)枯木含有纤维素,纤维素属于 (填字母)。
A.维生素 B.糖类C.油脂
(2)点燃鹿毛和羊毛,均能闻到 气味。
墨:《天工开物》中记载:“凡墨,烧烟凝质而为之。”
(3)松烟由松木 (填“完全”或“不完全”)燃烧形成,古人用墨作画,经百年不褪色的原因是常温下碳单质的化学性质 (填“活泼”或“稳定”)。
纸:如图为一种植物纤维造纸流程。
(4)“浸泡”的目的是软化纤维。竹子含有纤维素[C6H10O5]n,纤维素 (填“是”或“不是”)有机高分子化合物。
(5)“蒸煮”时,生石灰变成熟石灰的过程是 过程(填“吸热”或“放热”)。利用石灰浆[主要成分为Ca(OH)2]和纯碱(Na2CO3)溶液的碱性,达到除去木素的目的。将石灰浆和纯碱溶液混合后效果更好,原因是 。
(6)“捞纸”与化学实验中物质分离的 操作相似。
(7)透火烘干是将150~300℃高温气流穿透湿纸页快速脱水,纸的着火点为180~230℃。透火烘干过程中纸张没有燃烧的原因可能是 。
砚:《释名》中对砚的释义为“砚者研也,可以研墨和之濡也。”
(8)这说明砚的硬度 (填“>”、“=”或“<”)墨条。
17.化学科学已经日益渗透到社会生活的各个方面,它与我们的生产、生活息息相关。
(1)秉承“节能环保”原则,新能源汽车引领汽车产业转型,我国在此领域取得显著成就。2024年11月,中国新能源汽车年产量首次突破1000万辆。
①钢铁是生产汽车不可或缺的原材料之一。工业上常用CO来还原赤铁矿(主要成分是Fe2O3)冶炼金属铁,其发生反应的化学方程式为 。
②传统燃油汽车大多采用从石油里提炼的汽油或柴油作为燃料,石油属于 (填“可再生”或“不可再生”)能源。
③新能源汽车的普及和发展备受关注,电池是电动汽车的灵魂,大部分电动汽车使用锂电池驱动。磷酸亚铁锂(化学式为LiFePO4)是构成锂电池电极的一种新型材料,其中锂元素的化合价为+1,则磷元素的化合价为 价。
④氢燃料电车其原理是通过固态储氢装置将氢气高压加注到汽车中。从微观角度解释,氢气能被压缩加注的原因是 。
⑤汽车的配件中有a.合成橡胶轮胎,b.铝合金轮毂,c.塑料保险杠,d钢架车门,e.玻璃车窗,f.高强度丙纶纤维安全带等;其中主要由有机合成材料制成的是 (填选项序号)。
(2)农谚“雷雨发庄稼”是指空气中的氮气在雷电环境下,能转变为含氮化合物,最终生成的硝酸随雨水淋洒到大地上,同土壤中的矿物相互作用,生成可溶于水的硝酸盐,其中氮元素是植物生长所需的重要的营养元素。硝酸的形成过程如图所示。
①图中单质X是一种常见气体,其化学式为 。
②反应Ⅱ在常温下即可发生,该反应的化学方程式为 ,该反应属于 (填“化合”“分解”“置换”“氧化”中的两项)反应。
③为了提高氮原子的利用率,图中可循环利用的物质是 (填化学式)。
④在实验室通常采用以下方法制取NO:4NH3+5O24NO+xR,其中x= ,R的化学式为 。
18.化学在我国工业发展中发挥着重要作用。
Ⅰ.化学与航天 (1)火箭的动力来源(以液氧液氢为例)
①利用沸点不同,从液态空气中获得液氧,属于 (填“物理”或“化学”)变化。
②写出氢气燃烧的化学方程式 。氢气被认为是理想的燃料,理由为 (写出一条)。
(2)航天器的材料
①航天器外壳通常使用铝合金,它属于 (填字母)。
A.金属材料 B.合成材料 C.非金属材料 D.复合材料
②航天器中的电机、发电机等设备需要使用石墨电刷来传输电流。石墨与金刚石都是由碳元素组成的单质,但物理性质差异很大,原因是 。
Ⅱ.化学与化工
甲烷(CH4)可作为清洁燃料和化工原料。煤综合利用获得甲烷的一种简化工艺流程图如图所示。
(3)直接燃烧煤,排放的 (填化学式)、氮的氧化物等溶于雨水,会形成酸雨,煤的综合利用可有效缓解该问题。
(4)在“反应室3”中,一氧化碳和氢气在催化剂、加热条件下生成水和甲烷,该反应的化学方程式为 。
参考答案及解析
1.(1)增大接触面积,加快反应速率,使反应更充分;
(2)CO2;
(3)2Fe2O3。
【解析】解:(l)将煤研磨呈细小粉末是为了增大煤与氧气的接触面积,从而提高煤的使用效率,加快反应速率,使反应更充分。
(2)煤的主要成分之一是碳,碳在空气中燃烧生成二氧化碳,因此出口气体中二氧化碳也是主要成分,化学式为:CO2。
(3)在化学反应前原子的种类和数目分别为:Fe:4个,O:22个,S:8个,反应后原子的种类和数目分别为:S:8个,O:16个,所以根据质量守恒定律,化学反应前后原子的种类和数目不变可得:2个分子中含有4个Fe和6个O,所以1个中含有2个Fe和3个O,化学式为Fe2O3。
2.(1)过滤;
(2)不变;
(3)NaOH。
【解析】解:(1)操作Ⅰ是分离难溶性固体与液体的方法,即过滤操作;
(2)二氧化硫中,氧元素显﹣2价,由化合物中各元素正负化合价的代数和为零原则可知,其中硫元素显+4价;在CaSO3中,钙元素显+2价,氧元素显﹣2价,设其中硫元素的化合价为x,则:(+2)+x+(﹣2)×3=0,x=+4,即硫元素的化合价没有改变;
(3)绿色化学提倡物料循环,以上流程中NaOH既是反应物又是生成物,则可用于循环的物质是NaOH。
3.(1)不可;
(2)CaCO3CaO+CO2↑;
(3)O、S;
(4)增大煤与氧气的接触面积,使燃料充分燃烧。
【解析】解:(1)煤属于化石燃料,不能短时期内从自然界得到补充,属于不可再生能源。
(2)碳酸钙高温分解生成氧化钙和二氧化碳,反应的化学方程式为CaCO3CaO+CO2↑。
(3)烟气处理过程中亚硫酸钙与氧气反应生成硫酸钙,氧元素由0价变成﹣2价,硫元素由+4价变成+6价,则上述物质的元素化合价发生改变的是O、S。
(4)日常生活中,常将煤块制成蜂窝煤后燃烧,其目的是增大煤与氧气的接触面积,使燃料充分燃烧。
4.(1)HCl。
(2)2H2S+O22S+2H2O。
【解析】解:(1)根据原子守恒,FeCl3中铁、氯原子个数比为1:3,而FeCl2中铁、氯原子个数比为1:2,且反应物中含有氢原子,则X中一定含有氢原子和氯原子,则X可能为HCl。
(2)由图可知,H2S和O2在FeCl3催化作用下生成S,根据元素守恒,可知还有另一种物质,为水,则反应的化学方程式为2H2S+O22S+2H2O。
故答案为:(1)HCl。
(2)2H2S+O22S+2H2O。
5.(1)酸雨;
(2)①;
(3)30kg;
(4)氢氧化钠或NaOH。
【解析】解:(1)二氧化硫排放到空气中会导致酸雨的形成,故答案为:酸雨;
(2)根据化合物中各元素化合价代数和为0.,氢元素和氧元素化合价一般不可变,①反应前后硫元素化合价是+4价,氧元素是﹣2价,氢元素是+1价,各元素的化合价均未改变;反应②中反应前硫元素是+4价,反应后是+6价;过氧化氢中,氧元素显﹣1价,反应后氧元素的化合价为﹣2价,故答案为:①;
(3)硫酸中溶质质量是100kg×29.4%=29.4kg,设质量分数为34%的双氧水质量为x,则:
H2O2+H2SO3=H2SO4+H2O
34 98
34%×x 29.4kg
x=30kg
答:需要用溶质质量分数为34%的双氧水30kg;
(4)由化学方程式2NaOH+SO2=Na2SO3+H2O、Na2CO3+SO2=Na2SO3+CO2、Na2SO3+SO2+H2O=2NaHSO3可知:
2NaOH~SO2
80 64
Na2CO3~SO2
106 64
Na2SO3+SO2+H
123 64
可知吸收相同的二氧化硫消耗氢氧化钠的质量最小,故答案为:氢氧化钠或NaOH。
6.(1)二氧化碳和水反应产生碳酸,碳酸的溶液显酸性;
(2)5.6;
(3)AB。
【解析】解:(1)正常雨水略显酸性,主要原因是二氧化碳和水反应产生碳酸,碳酸的溶液显酸性;
(2)pH<5.6的降水称为酸雨,它会使土壤酸化;
(3)SO2通入碘水(I2的水溶液)会生成硫酸(H2SO4)和氢碘酸(HI),该反应的化学方程式:SO2+I2+2H2O=H2SO4+2HI;
(4)A.焚烧秸秆产生烟尘,会形成PM2.5,故正确;
B.汽车尾气排放会产生烟尘,会形成PM2.5,故正确;
C.太阳能发电,不会形成PM2.5,故错误;
故选AB;
7.(1)<;
(2)2H2SO3+O2=2H2SO4;熟石灰;H2SO4+Ca(OH)2=CaSO4+2H2O;
(3)单质;Cl2+H2O=HClO+HCl。
【解析】解:(1)硫在空气中燃烧,生成二氧化硫,二氧化硫与水反应生成亚硫酸,其水溶液显酸性,溶液的pH<7;
(2)二氧化硫溶于水后形成的亚硫酸(H2SO3)会在空气中进一步氧化,通过化合反应生成硫酸,反应的化学方程式为2H2SO3+O2=2H2SO4,硫酸造成土壤进一步酸化,为了保护环境,我们常用氢氧化钙改良酸性土壤,它的俗称是熟石灰;氢氧化钙与硫酸反应生成硫酸钙和水,反应的方程式为:H2SO4+Ca(OH)2=CaSO4+2H2O;
(3)氯气是由一种元素组成的纯净物,属于单质;氯气与水反应生成次氯酸(HClO)和盐酸,反应的方程式为:Cl2+H2O=HClO+HCl;
8.(1)过滤;
(2)Fe+CuSO4=Cu+FeSO4;
(3)Cu2+。
【解析】解:(1)步骤Ⅱ和步骤Ⅲ都将固体和液体分离,所以操作为过滤;故答案为:过滤;
(2)铁与硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=Cu+FeSO4;故答案为:Fe+CuSO4=Cu+FeSO4;
(3)由于步骤Ⅲ加入Na2S后产生CuS,说明原废水③中含有CuSO4(或Cu2+),硫酸铜与硫化钠反应生成硫酸钠和硫化铜沉淀;故答案为:Cu2+。
9.(1)延展;
(2)电能;
(3)CO2;
(4)CO2+Ca(OH)2=CaCO3↓+H2O;
(5);大于。
【解析】解:(1)铝合金能加工成铝箔,是因为铝具有延展性;故答案为:延展;
(2)天阳能电池在充电过程中,太阳能转化为电能,电能再转化为化学能;故答案为:电能;
(3)反应前后原子的种类和个数不变,等号左边C、H、N、O的个数分别为2、8、6、8,等号右边除2X外,C、H、N、O的个数分别为0、8、6、4,则2X中含有2个碳原子和4个氧原子,则X的化学式为CO2。故答案为:CO2;
(4)二氧化碳能使澄清石灰水变浑浊,则该气体为二氧化碳,二氧化碳和石灰水中的氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O。故答案为:CO2+Ca(OH)2=CaCO3↓+H2O;
(5)①电解水生成氢气和氧气,反应的化学方程式为:;故答案为:;
②如流程图所示,二氧化碳清除系统中除了生成水,还能生成甲烷,甲烷中含有氢元素,根据反应前后元素的种类和质量不变,则说明生成的水的质量小于发生电解水的质量。故答案为:大于。
10.(1)产生气泡;
(2)过滤;
(3)ZnC2O4ZnO+CO2↑+CO↑;
(4)化合反应;
(5)分别取两种化肥样品于两个研钵中,加入熟石灰研磨;一个研钵中有刺激性气味气体产生,另一个研钵中无明显现象;有刺激性气味产生的白色固体为氯化铵,无气味的白色固体为氯化钾;
(6)2H2O22H2O+O2↑;
(7)纯净物。
【解析】解:(1)锌与稀盐酸反应生成氯化锌和氢气,反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑,现象为产生气泡;故答案为:产生气泡;
(2)反应②后进行的分离操作名称是过滤;故答案为:过滤;
(3)反应③属于分解反应,除得到氧化锌外还生成2种常见气体,由质量守恒定律,反应前后元素种类不变,则2种常见气体为一氧化碳、二氧化碳,该反应的化学方程式为ZnC2O4ZnO+CO2↑+CO↑;故答案为:ZnC2O4ZnO+CO2↑+CO↑;
(4)①锌与稀盐酸反应生成氯化锌和氢气,属于置换反应;由流程图和物质间的反应可知:②是氯化锌和草酸铵相互交换成分生成氯化铵和草酸锌沉淀,属于复分解反应;反应③属于分解反应,草酸锌分解除得到氧化锌外还生成二氧化碳、CO;因此未涉及的反应类型是化合反应;故答案为:化合反应;
(5)氯化铵和氯化钾外观相似,可以根据铵态氮肥的检验方法来设计实验鉴别这两种化肥。实验步骤:分别取两种化肥样品于两个研钵中,加入熟石灰研磨;一个研钵中有刺激性气味气体产生,另一个研钵中无明显现象,有刺激性气味产生的白色固体为氯化铵,无气味的白色固体为氯化钾。
故答案为:分别取两种化肥样品于两个研钵中,加入熟石灰研磨;一个研钵中有刺激性气味气体产生,另一个研钵中无明显现象;有刺激性气味产生的白色固体为氯化铵,无气味的白色固体为氯化钾。
(6)产生氧气的反应为过氧化氢在二氧化锰催化的条件下分解产生水和氧气,反应的化学方程式为2H2O22H2O+O2↑;
故答案为:2H2O22H2O+O2↑;
(7)2Na2CO3 3H2O2有固定的组成和化学式,是由一种物质组成的,属于纯净物;
故答案为:纯净物。
11.(1)过滤;AC;
(2)复分解反应;
(3)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(4)既可以减少环境的污染,又可以节约资源和能源。
【解析】解:(1)根据题目给出的流程图和信息:I、II均将固液分离,为过滤操作;由流程中加入稀硫酸后,二氧化硅为固体形式未变,可知二氧化硅难溶于水、不能与稀硫酸反应,不能得出化学性质很活泼的结论;
(2)步骤③中,硫酸铁和氢氧化钠反应生成氢氧化铁和硫酸钠,属于复分解反应;
(3)步骤②中,氧化铁和硫酸反应生成硫酸铁和水,化学方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(4)倡导金属垃圾回收利用既可以减少环境的污染,又可以节约资源和能源。
12.(1)热能;
(2)增大铁制品与稀硫酸反应的接触面积,使反应更充分;
(3)Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;C;
(4)作保护气,避免+2价的铁元素被空气中的氧气氧化;
(5)可减少环境污染(合理即可)。
【解析】解:(1)发电厂是利用垃圾焚烧产生的热能转变成电能;
(2)生锈的铁制品经粉碎后再加入稀硫酸的目的是增大铁制品与稀硫酸反应的接触面积,使反应更充分;
(3)铁锈中的氧化铁与硫酸反应生成硫酸铁和水,化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;生铁中含有少量的碳,生锈的铁制品在足量的稀硫酸中充分反应后的黑色固体是碳,化学式为C;
(4)氮气的化学性质稳定,氮气的作用是作保护气,避免+2价的铁元素被空气中的氧气氧化;
(5)政府倡导垃圾分类,可减少环境污染(合理即可)。
13.(1)热能;
(2)除去烟气中含有的SO2、HCl;氢氧化钙微溶于水,石灰水中氢氧化钙的含量少;
(3)Fe+H2SO4═FeSO4+H2↑;①; ②;
(4)过滤;保护气,避免+2价的铁元素被空气中的氧气氧化。
【解析】解:(1)发电厂是利用垃圾焚烧产生的热能转变为电能;
(2)石灰浆显碱性,能够吸收酸性气体,所以吸收步骤中,石灰浆的作用是除去烟气中含有的SO2、HCl,用石灰浆不用石灰水的原因是氢氧化钙微溶于水,石灰水中氢氧化钙的含量少;
(3)溶解步骤中,硫酸与铁反应,生成氢气,所以产生的H2的化学方程式为Fe+H2SO4═FeSO4+H2↑;
②复分解反应是两种化合物相互交换成分,生成另外两种新的化合物的反应;②Fe+Fe2(SO4)3=3FeSO4中有单质参与的反应,铁元素的化合价发生变化;
(4)操作②的目的是得到硫酸亚铁晶体,基本操作步骤:加热浓缩,然后冷却结晶;再过滤;最后洗涤干燥,得到硫酸亚铁晶体,其中氮气的作用是作保护气,避免+2价的铁元素被空气中的氧气氧化;
14.(1)CH4+2O22H2O+CO2;
(2)①NH3+CO2+H2O=NH4HCO3;
②置换。
【解析】解:(1)甲烷和氧气在点燃的条件下生成二氧化碳和水,反应的化学方程式为:CH4+2O22H2O+CO2。
(2)①炭化塔中H2、N2不参加反应,根据流程图可知,碳化塔中氨气、二氧化碳和水反应生成碳酸氢铵,反应的化学方程式为:NH3+CO2+H2O=NH4HCO3。
②根据流程图可知,反应釜内氨气(化合物)和钠(单质)发生反应生成氨基钠(化合物)和氢气(单质),该反应符合单换单、价改变的特点,基本反应类型属于置换反应。
15.(1)燃烧产物无污染(答案不唯一);
(2)2H2O2H2↑+O2↑;
(3)①分解反应;②物理;③生产成本较低或储运成本降低或储运相对容易(答案不唯一)。
【解析】解:(1)题干提到人们一直追求将氢气作为一种绿色能源,绿色能源的特点通常是对环境友好等。氢气燃烧时生成水,其燃烧产物仅仅是水,不会像一些化石燃料燃烧那样产生如一氧化碳、二氧化硫、氮氧化物等污染环境的物质,所以理由是氢气的燃烧产物是水,不会污染环境(答案不唯一)。故答案为:燃烧产物无污染(答案不唯一);
(2)用催化剂TiO2实现光分解水制氢气。根据化学反应前后原子种类和数目不变的原则,对反应进行配平,可得化学方程式为2H2O2H2↑+O2↑;故答案为:2H2O2H2↑+O2↑;
(3)①观察氨制氢的生产流程图,步骤Ⅱ中是氨气在铁基催化剂、410℃的条件下反应生成氢气、氮气。一种物质反应生成多种物质的反应属于分解反应,氨气在该条件下分解产生了多种物质,所以步骤Ⅱ的反应属于分解反应。
②步骤Ⅲ中分子筛只让氢分子通过而阻止其他分子通过,在这个过程中,没有新物质生成,只是将氢气和其他气体进行了分离,物质本身的化学性质没有发生改变。根据物理变化的定义,没有新物质生成的变化属于物理变化,所以该过程属于物理变化。
③对于利用氨生产氢气的优点,氨在常温常压下是气态,但通过加压等方式可使其液化,液化后的氨便于储存和运输,所以可以说氨储运相对容易(答案不唯一)。
故答案为:①分解反应;②物理;③生产成本较低或储运成本降低或储运相对容易(答案不唯一)。
16.(1)B;(2)烧焦羽毛;(3)不完全;稳定;(4)是;(5)放热;氢氧化钙与碳酸钠反应生成的氢氧化钠具有更强的碱性,能够更有效地除去木素;
(6)过滤;(7)温度没有达到纸的着火点;(8)>。
【解析】解:(1)纤维素是由葡萄糖组成的大分子多糖,属于糖类,故选B;
(2)鹿毛和羊毛的主要成分都是蛋白质,点燃都会有烧焦羽毛气味;
(3)烟是固体小颗粒,松木不完全燃烧会产生碳颗粒,即能看到黑烟,松烟墨的主要成分是炭黑, 其中含碳,碳在常温下化学性质稳定,故不易褪色;
(4)对分子质量达到几万到几十万,甚至高达几百万甚至更高的有机物,属于有机高分子化合物,由纤维素的化学式可知,纤维素属于聚合物,为有机高分子化合物;
(5)生石灰与水反应生成熟石灰,属于放热反应;
氢氧化钙与碳酸钠反应生成的氢氧化钠具有更强的碱性,能够更有效地除去木素因此混合后效果更好;
(6)抄纸是把浆料加入竹帘中,形成薄层,水由竹帘流出,即实现了固液分离,其原理与实验室的过滤相同;
(7)透火烘干过程中纸张没有燃烧,是因为纸张上的水分蒸发吸收热量,使纸的温度没有达到着火点;
(8)砚能用于研墨,说明砚的硬度>墨条。
17.(1)①3CO+Fe2O32Fe+3CO2;②不可再生;③+5;④氢分子间存在着间隔,压强增大,氢分子间的间隔变小;⑤acf;(2)①O2;②2NO+O2=2NO2;化合、氧化;③NO;④6;H2O。
【解析】解:(1)①在高温下CO和氧化铁反应生成铁和二氧化碳,反应的化学方程式为3CO+Fe2O32Fe+3CO2;故答案为:3CO+Fe2O32Fe+3CO2;
②石油是一种化石能源,在短期内得不到补充,属于不可再生能源;故答案为:不可再生;
③在磷酸亚铁锂(LiFePO4)中,锂元素的化合价为+1,铁元素的化合价为+2,氧元素的化合价为﹣2,设磷元素的化合价为x,由化合物中正负化合价的代数和为0可知,(+1)+(+2)+x+(﹣2)×4=0,解得x=+5;故答案为:+5;
④从微观角度解释,氢气能被压缩加注的原因是氢分子间存在着间隔,压强增大,氢分子间的间隔变小;故答案为:氢分子间存在着间隔,压强增大,氢分子间的间隔变小;
⑤有机合成材料包括塑料、合成纤维、合成橡胶,a.合成橡胶轮胎属于合成橡胶,c.塑料保险杠属于塑料,f.高强度丙纶纤维安全带属于合成纤维,所以主要由有机合成材料制成的是acf;故答案为:acf;
(2)①根据质量守恒定律,化学反应前后元素的种类不变,氮气和单质X反应生成一氧化氮,则单质X是氧气,化学式为O2;故答案为:O2;
②反应Ⅱ是一氧化氮和氧气在常温下反应生成二氧化氮,反应的化学方程式为:2NO+O2=2NO2。该反应符合多变一的特征,属于化合反应,同时也属于氧化反应;故答案为:2NO+O2=2NO2;化合、氧化;
③由图中信息可知,一氧化氮既是反应物又是生成物,所以可循环利用的物质是一氧化氮,化学式为NO;故答案为:NO;
④由质量守恒定律可知,化学反应前后原子的种类和个数不变,该反应前含有10个O原子,4个N原子,12个H原子;反应后含有4个N原子,4个O原子,则xR处应该为6个O原子,12个H原子,则x=6,R为H2O;故答案为:6;H2O。
18.(1)①物理;
②2H2+O22H2O;氢气燃烧的产物是水,无污染(合理即可);
(2)①A;
②碳原子的排列方式不同;
(3)SO2;
(4)CO+3H2CH4+H2O。
【解析】解:(1)①利用沸点不同,从液态空气中获得液氧,该变化没有生成新物质,属于物理变化。
②氢气燃烧生成了水,反应的化学方程式是:2H2+O22H2O。氢气被认为是理想的燃料,理由为 氢气无毒、热值高、燃烧后的产物是水,不会污染空气,也不会向大气排放二氧化碳等。
(2)①航天器外壳通常使用铝合金,它属于金属材料,故选A;
②石墨与金刚石都是由碳元素组成的单质,但物理性质差异很大,原因是碳原子的排列方式不同。
(3)煤中含有硫、氮等杂质,直接燃烧煤,排放的SO2、氮的氧化物等溶于雨水,会形成酸雨,煤的综合利用可有效缓解该问题。
(4)在“反应室3”中,一氧化碳和氢气在催化剂、加热条件下生成水和甲烷,该反应的化学方程式为:CO+3H2CH4+H2O。
1.煤中硫的存在形态分为有机硫和无机硫(CaSO4、硫化物及微量单质硫等)。库仑滴定法是常用的快速检测煤中全硫含量的方法,其主要过程如图所示。
(1)煤样需研磨成细小粉末,目的是 。
(2)在催化剂作用下,煤在管式炉中充分燃烧,出口气体中主要含有 、O2、H2O、N2、SO2。
(3)高温下,煤中的FeS2完全转化为SO2,补全该反应的化学方程式:4FeS2+11O2 +8SO2。
2.工业上可利用物料循环的方法实现烟气的脱硫处理,工艺流程如图所示。
(1)操作Ⅰ是 。
(2)由二氧化硫转化为CaSO3固体后,硫元素化合价 (填“升高”、“降低”或“不变”)。
(3)绿色化学提倡物料循环,以上流程中,可用于循环的物质有 。
3.煤炭被人们誉为“工业的粮食”,是18世纪以来人类使用的主要能源,但燃煤会产生严重的大气污染。如图是某燃煤发电厂烟气处理的流程图。
(1)煤属于 再生能源(填“可”或“不可”)。
(2)烟气处理过程中,生成氧化钙的化学方程式为 。
(3)烟气处理过程中,上述物质的元素化合价发生改变的是 (填元素符号)。
(4)日常生活中,常将煤块制成蜂窝煤后燃烧,其目的是 。
4.有毒的H2S气体常用脱硫液吸收进行处理。一种用FeCl3溶液循环脱硫工艺的物质转化如图所示。
(1)图中X物质可能是 (填化学式)。
(2)写出该脱硫总反应的化学方程式: 。
5.工业上常用双氧水处理含SO2的烟气,排放出浓度较高的硫酸作工业原料,脱硫过程发生的反应有:①SO2+H2O=H2SO3 ②H2O2+H2SO3=H2SO4+H2O。
(1)该烟气不经过处理直接排放会导致 等环境问题。
(2)脱硫过程中化合价没有发生改变的是反应 。(填“①”或“②”)
(3)若排放出100千克溶质质量分数为29.4%的硫酸,需要用溶质质量分数为34%的双氧水多少千克?(写出计算过程)
(4)工业上还有种脱硫法——“双碱法脱硫”,该工艺是先将含SO2的烟气通过排烟机送入脱硫塔,与NaOH、Na2CO3、Na2SO3等水溶液充分接触后与烟气中的SO2反应。将吸收液送至石灰反应器,进行吸收液的再生和固体副产品的析出。吸收过程中涉及的反应方程式:
用NaOH吸收:2NaOH+SO2=Na2SO3+H2O
用Na2CO3吸收:Na2CO3+SO2=Na2SO3+CO2
用Na2SO3吸收:Na2SO3+SO2+H2O=2NaHSO3
若在脱硫塔内吸收等质量的含SO2的烟气,用 吸收所需要的原料质量最少。
6.酸雨的危害很大,硫酸型酸雨的形成有以下两种途径:
(1)正常雨水略显酸性,主要原因是 。
(2)pH< 的降水称为酸雨,它会使土壤酸化。
(3)SO2通入碘水(I2的水溶液)会生成硫酸(H2SO4)和氢碘酸(HI),我们可利用此原理来测定空气中SO2的含量,请写出该反应的化学方程式: 。
(4)近年来我国很多地区经常发生雾霾天气,所以治理污染刻不容缓。PM2.5是指大气中微粒直径小于2.5微米的颗粒物。你认为下列会形成PM2.5的是 。
A.焚烧秸秆
B.汽车尾气排放
C.太阳能发电
7.历经三年的新冠疫情,在2022年底终于告一段落,多年未聚的亲朋好友们在度过一个喜庆的兔年春节的同时,也尽情的燃放了大量的烟花爆竹。烟花特有的气味提升了年味,同时也给大气增加了不少污染物。
(1)爆竹的主要成分是黑火药,其中含有一定量的硫磺,请写出硫在空气中燃烧的反应生成物溶于水后,水溶液的pH 7(选填:<、=、>)。
(2)二氧化硫是造成酸雨的原因之一,溶于水后形成的亚硫酸(H2SO3)会在空气中进一步氧化,通过化合反应生成硫酸,相应的反应方程式为 ,造成土壤进一步酸化。为了保护环境,我们常用一种碱来改良酸性土壤,它的俗称是 ;请写出用此碱改良酸性土壤的反应方程式 。(土壤酸性物质以H2SO4计)
(3)氯气是一种有毒气体,它在物质分类上属于 (选填“单质”或“化合物”),它主要通过呼吸道侵入人体,与在黏膜中所含的水分反应,生成次氯酸(HClO)和盐酸,请写出相应的反应方程式 。
8.矿山废水中含有大量的H2SO4和CuSO4,直接排放会影响水体酸碱性,并造成重金属污染。通过处理可以回收金属铜,并使废水pH和重金属含量达到排放标准。
已知:Cu(OH)2是蓝色不溶于水的固体:步骤Ⅰ无蓝色沉淀生成。
(1)步骤Ⅱ和步骤Ⅲ都需进行的操作是 。
(2)步骤Ⅱ得到金属铜的反应的化学方程式为 。
(3)步骤Ⅲ需加入Na2S才能使废水达到排放标准,由此推测废水③不达标的主要原因是其中含有 (填离子符号)。
9.航天梦,中国梦。中国航天,又站在了一个新的起点。
(1)制造太阳能电池板需要使用铝合金,铝合金加工成铝箔利用了金属的 性。
(2)空间站的太阳能电池在充电过程中的能量转化:太阳能→ →化学能。
(3)神舟十三号载人飞船由长征二号F遥十三运载火箭发射升空。运载火箭由三级火箭组成。一级和二级火箭的推进剂为偏二甲肼(C2H8N2)和四氧化二氮(N2O4),其反应的化学方程式为:C2H8N2+2N2O4=3N2+2X+4H2O,则X的化学式是 。
(4)航天员在《天宫课堂》为我们进行太空授课时,将半片泡腾片(含某种酸和碳酸氢钠)塞入一个蓝色水球里,水球里立即产生很多气泡,该气体能使澄清石灰水变浑浊。请写出该气体与澄清石灰水反应的化学方程式 。
(5)空间站中科学家采用水气整合系统实现CO2的清除和O2的再生,流程如下图所示。
①O2再生系统中,运用电解水的方法制取氧气,反应的化学方程式为 。
②在流程图所示的物质转化中,进入O2再生系统发生电解的水的质量 (填“大于”“等于”或“小于”)CO2清除系统中生成水的质量。
10.【基础实验与跨学科实践】
高纯氧化锌广泛应用于电子工业,某研究小组设计如图1所示流程制备高纯氧化锌。
(1)反应①的实验现象是 。
(2)进行反应②后,分离出草酸锌沉淀的操作是 。
(3)反应③属于分解反应,除得到氧化锌外还生成2种气态氧化物,该反应的化学方程式是 。
(4)反应①、②、③中均没有涉及到的基本反应类型是 。
(5)请设计鉴别氯化铵固体和氯化钾固体的实验方案 。
(6)图2是某品牌的“便携式制氧机”的反应原理:用A剂、B剂产生氧气,其中A剂为白色颗粒(2Na2CO3 3H2O2),B剂为MnO2。
制氧机工作时发生了两步反应。
第一步:2Na2CO3 3H2O2═2Na2CO3+3H2O2;
第二步:产生氧气的化学方程式为 。
(7)2Na2CO3 3H2O2属于 (填“纯净物”或“混合物”)。
11.在进行“垃圾的分类与回收利用”的跨学科实践活动时,兴趣小组对金属垃圾(主要成分是铁、铜、氧化铁和二氧化硅)的处理及综合利用的部分工艺如图所示。请回答下列问题:
(1)操作Ⅰ、Ⅱ的名称为 。由此流程可推知SiO2的性质有 (填字母)。
A.难溶于水 B.化学性质很活泼 C.不能与稀硫酸反应
(2)步骤③发生反应的基本反应类型是 。
(3)请写出步骤②所发生反应的化学方程式 。
(4)倡导金属垃圾回收利用的意义是 。
12.城市生活垃圾的处理是世界性难题,某垃圾处理厂对生活垃圾进行处理与综合利用部分流程如图所示:
资料1:垃圾焚烧产生的烟气中含有SO2等有害气体。
资料2:FeSO4容易被空气中的O2氧化。
回答下列问题:
(1)发电厂是利用垃圾焚烧产生的 转变成电能。
(2)生锈的铁制品经粉碎后再加入稀硫酸的目的是 。
(3)溶解步骤中,生锈的铁制品在足量的稀硫酸中充分反应后有黑色固体剩余,写出铁锈与稀硫酸反应的化学方程式 ;剩余黑色固体的主要成分是 (写化学式)。
(4)将所得硫酸亚铁溶液在氮气环境中加热蒸发浓缩、冷却结晶、过滤,得到硫酸亚铁晶体,其中氮气的作用是 。
(5)政府倡导垃圾分类,其好处是: 。(写一点)
13.某垃圾处理广对生活垃圾进行处理与综合利用的部分流程如下:
资料1:垃圾焚烧产生的烟气中含有SO2、HCl等有害气体。
资料2:+2价的铁元素容易被空气中的氧气氧化。
回答下列问题
(1)发电厂是利用垃圾焚烧产生的 转变为电能。
(2)吸收步骤中,石灰浆的作用是 ,用石灰浆不用石灰水的原因是 。
(3)“溶解”步骤中,产生的H2的化学方程式为 ,除此反应外,溶解步骤还能发生两个反应:①Fe2O3+3H2SO4=Fe(SO4)3+3H2O②Fe+Fe2(SO4)3=3FeSO4,其中属于复分解反应的是 (填序号)。反应前后铁元素的化合价改变的是 (填序号)。
(4)将所得硫酸亚铁溶液在氮气环境中加热蒸发浓缩、冷却结晶、 (填操作名称),得到硫酸亚铁晶体,其中氮气的作用是 。
14.从古至今,家用燃料经历了巨大的变化。
(1)家用燃料(括号内表示燃料的主要成分)更新历程如下图所示。
写出甲烷(CH4)在空气中充分燃烧的化学方程式 。
(2)氨基钠(NaNH2)是合成维生素A的原料。工业上以煤、空气为原料合成氨基钠的工艺流程如图所示。
①炭化塔中H2、N2不参加反应,写出炭化塔中发生反应的化学方程式 ;
②反应釜中的反应属于基本反应类型中的 反应。
15.氢气的发现、生产和应用极大地推动了人类社会的发展。
(1)18世纪,科学家利用铁和稀盐酸反应得到“易燃空气”,之后命名为氢气。发现氢气后,人们一直追求将氢气作为一种绿色能源,其理由是 。
(2)1969年,科学家利用催化剂TiO2实现光分解水制氢气。该反应的化学方程式为 。
(3)氢气储运成本较高,2023年我国建成首座氨制氢加氢站。氨制氢的一种生产流程如图所示。
①步骤Ⅱ的反应属于 (填基本反应类型)。
②步骤Ⅲ的分子筛只让氢分子通过而阻止其他分子通过,该过程属于 (填“物理”或“化学”)变化。
③利用氨生产氢气的优点有 (写出一个即可)。
16.“笔墨纸砚”被誉为文房四宝,承载着优秀的中国传统文化。
笔:《辞源》中记载:“恬始作笔,以枯木为管,鹿毛为柱,羊毛为被。”
(1)枯木含有纤维素,纤维素属于 (填字母)。
A.维生素 B.糖类C.油脂
(2)点燃鹿毛和羊毛,均能闻到 气味。
墨:《天工开物》中记载:“凡墨,烧烟凝质而为之。”
(3)松烟由松木 (填“完全”或“不完全”)燃烧形成,古人用墨作画,经百年不褪色的原因是常温下碳单质的化学性质 (填“活泼”或“稳定”)。
纸:如图为一种植物纤维造纸流程。
(4)“浸泡”的目的是软化纤维。竹子含有纤维素[C6H10O5]n,纤维素 (填“是”或“不是”)有机高分子化合物。
(5)“蒸煮”时,生石灰变成熟石灰的过程是 过程(填“吸热”或“放热”)。利用石灰浆[主要成分为Ca(OH)2]和纯碱(Na2CO3)溶液的碱性,达到除去木素的目的。将石灰浆和纯碱溶液混合后效果更好,原因是 。
(6)“捞纸”与化学实验中物质分离的 操作相似。
(7)透火烘干是将150~300℃高温气流穿透湿纸页快速脱水,纸的着火点为180~230℃。透火烘干过程中纸张没有燃烧的原因可能是 。
砚:《释名》中对砚的释义为“砚者研也,可以研墨和之濡也。”
(8)这说明砚的硬度 (填“>”、“=”或“<”)墨条。
17.化学科学已经日益渗透到社会生活的各个方面,它与我们的生产、生活息息相关。
(1)秉承“节能环保”原则,新能源汽车引领汽车产业转型,我国在此领域取得显著成就。2024年11月,中国新能源汽车年产量首次突破1000万辆。
①钢铁是生产汽车不可或缺的原材料之一。工业上常用CO来还原赤铁矿(主要成分是Fe2O3)冶炼金属铁,其发生反应的化学方程式为 。
②传统燃油汽车大多采用从石油里提炼的汽油或柴油作为燃料,石油属于 (填“可再生”或“不可再生”)能源。
③新能源汽车的普及和发展备受关注,电池是电动汽车的灵魂,大部分电动汽车使用锂电池驱动。磷酸亚铁锂(化学式为LiFePO4)是构成锂电池电极的一种新型材料,其中锂元素的化合价为+1,则磷元素的化合价为 价。
④氢燃料电车其原理是通过固态储氢装置将氢气高压加注到汽车中。从微观角度解释,氢气能被压缩加注的原因是 。
⑤汽车的配件中有a.合成橡胶轮胎,b.铝合金轮毂,c.塑料保险杠,d钢架车门,e.玻璃车窗,f.高强度丙纶纤维安全带等;其中主要由有机合成材料制成的是 (填选项序号)。
(2)农谚“雷雨发庄稼”是指空气中的氮气在雷电环境下,能转变为含氮化合物,最终生成的硝酸随雨水淋洒到大地上,同土壤中的矿物相互作用,生成可溶于水的硝酸盐,其中氮元素是植物生长所需的重要的营养元素。硝酸的形成过程如图所示。
①图中单质X是一种常见气体,其化学式为 。
②反应Ⅱ在常温下即可发生,该反应的化学方程式为 ,该反应属于 (填“化合”“分解”“置换”“氧化”中的两项)反应。
③为了提高氮原子的利用率,图中可循环利用的物质是 (填化学式)。
④在实验室通常采用以下方法制取NO:4NH3+5O24NO+xR,其中x= ,R的化学式为 。
18.化学在我国工业发展中发挥着重要作用。
Ⅰ.化学与航天 (1)火箭的动力来源(以液氧液氢为例)
①利用沸点不同,从液态空气中获得液氧,属于 (填“物理”或“化学”)变化。
②写出氢气燃烧的化学方程式 。氢气被认为是理想的燃料,理由为 (写出一条)。
(2)航天器的材料
①航天器外壳通常使用铝合金,它属于 (填字母)。
A.金属材料 B.合成材料 C.非金属材料 D.复合材料
②航天器中的电机、发电机等设备需要使用石墨电刷来传输电流。石墨与金刚石都是由碳元素组成的单质,但物理性质差异很大,原因是 。
Ⅱ.化学与化工
甲烷(CH4)可作为清洁燃料和化工原料。煤综合利用获得甲烷的一种简化工艺流程图如图所示。
(3)直接燃烧煤,排放的 (填化学式)、氮的氧化物等溶于雨水,会形成酸雨,煤的综合利用可有效缓解该问题。
(4)在“反应室3”中,一氧化碳和氢气在催化剂、加热条件下生成水和甲烷,该反应的化学方程式为 。
参考答案及解析
1.(1)增大接触面积,加快反应速率,使反应更充分;
(2)CO2;
(3)2Fe2O3。
【解析】解:(l)将煤研磨呈细小粉末是为了增大煤与氧气的接触面积,从而提高煤的使用效率,加快反应速率,使反应更充分。
(2)煤的主要成分之一是碳,碳在空气中燃烧生成二氧化碳,因此出口气体中二氧化碳也是主要成分,化学式为:CO2。
(3)在化学反应前原子的种类和数目分别为:Fe:4个,O:22个,S:8个,反应后原子的种类和数目分别为:S:8个,O:16个,所以根据质量守恒定律,化学反应前后原子的种类和数目不变可得:2个分子中含有4个Fe和6个O,所以1个中含有2个Fe和3个O,化学式为Fe2O3。
2.(1)过滤;
(2)不变;
(3)NaOH。
【解析】解:(1)操作Ⅰ是分离难溶性固体与液体的方法,即过滤操作;
(2)二氧化硫中,氧元素显﹣2价,由化合物中各元素正负化合价的代数和为零原则可知,其中硫元素显+4价;在CaSO3中,钙元素显+2价,氧元素显﹣2价,设其中硫元素的化合价为x,则:(+2)+x+(﹣2)×3=0,x=+4,即硫元素的化合价没有改变;
(3)绿色化学提倡物料循环,以上流程中NaOH既是反应物又是生成物,则可用于循环的物质是NaOH。
3.(1)不可;
(2)CaCO3CaO+CO2↑;
(3)O、S;
(4)增大煤与氧气的接触面积,使燃料充分燃烧。
【解析】解:(1)煤属于化石燃料,不能短时期内从自然界得到补充,属于不可再生能源。
(2)碳酸钙高温分解生成氧化钙和二氧化碳,反应的化学方程式为CaCO3CaO+CO2↑。
(3)烟气处理过程中亚硫酸钙与氧气反应生成硫酸钙,氧元素由0价变成﹣2价,硫元素由+4价变成+6价,则上述物质的元素化合价发生改变的是O、S。
(4)日常生活中,常将煤块制成蜂窝煤后燃烧,其目的是增大煤与氧气的接触面积,使燃料充分燃烧。
4.(1)HCl。
(2)2H2S+O22S+2H2O。
【解析】解:(1)根据原子守恒,FeCl3中铁、氯原子个数比为1:3,而FeCl2中铁、氯原子个数比为1:2,且反应物中含有氢原子,则X中一定含有氢原子和氯原子,则X可能为HCl。
(2)由图可知,H2S和O2在FeCl3催化作用下生成S,根据元素守恒,可知还有另一种物质,为水,则反应的化学方程式为2H2S+O22S+2H2O。
故答案为:(1)HCl。
(2)2H2S+O22S+2H2O。
5.(1)酸雨;
(2)①;
(3)30kg;
(4)氢氧化钠或NaOH。
【解析】解:(1)二氧化硫排放到空气中会导致酸雨的形成,故答案为:酸雨;
(2)根据化合物中各元素化合价代数和为0.,氢元素和氧元素化合价一般不可变,①反应前后硫元素化合价是+4价,氧元素是﹣2价,氢元素是+1价,各元素的化合价均未改变;反应②中反应前硫元素是+4价,反应后是+6价;过氧化氢中,氧元素显﹣1价,反应后氧元素的化合价为﹣2价,故答案为:①;
(3)硫酸中溶质质量是100kg×29.4%=29.4kg,设质量分数为34%的双氧水质量为x,则:
H2O2+H2SO3=H2SO4+H2O
34 98
34%×x 29.4kg
x=30kg
答:需要用溶质质量分数为34%的双氧水30kg;
(4)由化学方程式2NaOH+SO2=Na2SO3+H2O、Na2CO3+SO2=Na2SO3+CO2、Na2SO3+SO2+H2O=2NaHSO3可知:
2NaOH~SO2
80 64
Na2CO3~SO2
106 64
Na2SO3+SO2+H
123 64
可知吸收相同的二氧化硫消耗氢氧化钠的质量最小,故答案为:氢氧化钠或NaOH。
6.(1)二氧化碳和水反应产生碳酸,碳酸的溶液显酸性;
(2)5.6;
(3)AB。
【解析】解:(1)正常雨水略显酸性,主要原因是二氧化碳和水反应产生碳酸,碳酸的溶液显酸性;
(2)pH<5.6的降水称为酸雨,它会使土壤酸化;
(3)SO2通入碘水(I2的水溶液)会生成硫酸(H2SO4)和氢碘酸(HI),该反应的化学方程式:SO2+I2+2H2O=H2SO4+2HI;
(4)A.焚烧秸秆产生烟尘,会形成PM2.5,故正确;
B.汽车尾气排放会产生烟尘,会形成PM2.5,故正确;
C.太阳能发电,不会形成PM2.5,故错误;
故选AB;
7.(1)<;
(2)2H2SO3+O2=2H2SO4;熟石灰;H2SO4+Ca(OH)2=CaSO4+2H2O;
(3)单质;Cl2+H2O=HClO+HCl。
【解析】解:(1)硫在空气中燃烧,生成二氧化硫,二氧化硫与水反应生成亚硫酸,其水溶液显酸性,溶液的pH<7;
(2)二氧化硫溶于水后形成的亚硫酸(H2SO3)会在空气中进一步氧化,通过化合反应生成硫酸,反应的化学方程式为2H2SO3+O2=2H2SO4,硫酸造成土壤进一步酸化,为了保护环境,我们常用氢氧化钙改良酸性土壤,它的俗称是熟石灰;氢氧化钙与硫酸反应生成硫酸钙和水,反应的方程式为:H2SO4+Ca(OH)2=CaSO4+2H2O;
(3)氯气是由一种元素组成的纯净物,属于单质;氯气与水反应生成次氯酸(HClO)和盐酸,反应的方程式为:Cl2+H2O=HClO+HCl;
8.(1)过滤;
(2)Fe+CuSO4=Cu+FeSO4;
(3)Cu2+。
【解析】解:(1)步骤Ⅱ和步骤Ⅲ都将固体和液体分离,所以操作为过滤;故答案为:过滤;
(2)铁与硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=Cu+FeSO4;故答案为:Fe+CuSO4=Cu+FeSO4;
(3)由于步骤Ⅲ加入Na2S后产生CuS,说明原废水③中含有CuSO4(或Cu2+),硫酸铜与硫化钠反应生成硫酸钠和硫化铜沉淀;故答案为:Cu2+。
9.(1)延展;
(2)电能;
(3)CO2;
(4)CO2+Ca(OH)2=CaCO3↓+H2O;
(5);大于。
【解析】解:(1)铝合金能加工成铝箔,是因为铝具有延展性;故答案为:延展;
(2)天阳能电池在充电过程中,太阳能转化为电能,电能再转化为化学能;故答案为:电能;
(3)反应前后原子的种类和个数不变,等号左边C、H、N、O的个数分别为2、8、6、8,等号右边除2X外,C、H、N、O的个数分别为0、8、6、4,则2X中含有2个碳原子和4个氧原子,则X的化学式为CO2。故答案为:CO2;
(4)二氧化碳能使澄清石灰水变浑浊,则该气体为二氧化碳,二氧化碳和石灰水中的氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O。故答案为:CO2+Ca(OH)2=CaCO3↓+H2O;
(5)①电解水生成氢气和氧气,反应的化学方程式为:;故答案为:;
②如流程图所示,二氧化碳清除系统中除了生成水,还能生成甲烷,甲烷中含有氢元素,根据反应前后元素的种类和质量不变,则说明生成的水的质量小于发生电解水的质量。故答案为:大于。
10.(1)产生气泡;
(2)过滤;
(3)ZnC2O4ZnO+CO2↑+CO↑;
(4)化合反应;
(5)分别取两种化肥样品于两个研钵中,加入熟石灰研磨;一个研钵中有刺激性气味气体产生,另一个研钵中无明显现象;有刺激性气味产生的白色固体为氯化铵,无气味的白色固体为氯化钾;
(6)2H2O22H2O+O2↑;
(7)纯净物。
【解析】解:(1)锌与稀盐酸反应生成氯化锌和氢气,反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑,现象为产生气泡;故答案为:产生气泡;
(2)反应②后进行的分离操作名称是过滤;故答案为:过滤;
(3)反应③属于分解反应,除得到氧化锌外还生成2种常见气体,由质量守恒定律,反应前后元素种类不变,则2种常见气体为一氧化碳、二氧化碳,该反应的化学方程式为ZnC2O4ZnO+CO2↑+CO↑;故答案为:ZnC2O4ZnO+CO2↑+CO↑;
(4)①锌与稀盐酸反应生成氯化锌和氢气,属于置换反应;由流程图和物质间的反应可知:②是氯化锌和草酸铵相互交换成分生成氯化铵和草酸锌沉淀,属于复分解反应;反应③属于分解反应,草酸锌分解除得到氧化锌外还生成二氧化碳、CO;因此未涉及的反应类型是化合反应;故答案为:化合反应;
(5)氯化铵和氯化钾外观相似,可以根据铵态氮肥的检验方法来设计实验鉴别这两种化肥。实验步骤:分别取两种化肥样品于两个研钵中,加入熟石灰研磨;一个研钵中有刺激性气味气体产生,另一个研钵中无明显现象,有刺激性气味产生的白色固体为氯化铵,无气味的白色固体为氯化钾。
故答案为:分别取两种化肥样品于两个研钵中,加入熟石灰研磨;一个研钵中有刺激性气味气体产生,另一个研钵中无明显现象;有刺激性气味产生的白色固体为氯化铵,无气味的白色固体为氯化钾。
(6)产生氧气的反应为过氧化氢在二氧化锰催化的条件下分解产生水和氧气,反应的化学方程式为2H2O22H2O+O2↑;
故答案为:2H2O22H2O+O2↑;
(7)2Na2CO3 3H2O2有固定的组成和化学式,是由一种物质组成的,属于纯净物;
故答案为:纯净物。
11.(1)过滤;AC;
(2)复分解反应;
(3)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(4)既可以减少环境的污染,又可以节约资源和能源。
【解析】解:(1)根据题目给出的流程图和信息:I、II均将固液分离,为过滤操作;由流程中加入稀硫酸后,二氧化硅为固体形式未变,可知二氧化硅难溶于水、不能与稀硫酸反应,不能得出化学性质很活泼的结论;
(2)步骤③中,硫酸铁和氢氧化钠反应生成氢氧化铁和硫酸钠,属于复分解反应;
(3)步骤②中,氧化铁和硫酸反应生成硫酸铁和水,化学方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(4)倡导金属垃圾回收利用既可以减少环境的污染,又可以节约资源和能源。
12.(1)热能;
(2)增大铁制品与稀硫酸反应的接触面积,使反应更充分;
(3)Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;C;
(4)作保护气,避免+2价的铁元素被空气中的氧气氧化;
(5)可减少环境污染(合理即可)。
【解析】解:(1)发电厂是利用垃圾焚烧产生的热能转变成电能;
(2)生锈的铁制品经粉碎后再加入稀硫酸的目的是增大铁制品与稀硫酸反应的接触面积,使反应更充分;
(3)铁锈中的氧化铁与硫酸反应生成硫酸铁和水,化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;生铁中含有少量的碳,生锈的铁制品在足量的稀硫酸中充分反应后的黑色固体是碳,化学式为C;
(4)氮气的化学性质稳定,氮气的作用是作保护气,避免+2价的铁元素被空气中的氧气氧化;
(5)政府倡导垃圾分类,可减少环境污染(合理即可)。
13.(1)热能;
(2)除去烟气中含有的SO2、HCl;氢氧化钙微溶于水,石灰水中氢氧化钙的含量少;
(3)Fe+H2SO4═FeSO4+H2↑;①; ②;
(4)过滤;保护气,避免+2价的铁元素被空气中的氧气氧化。
【解析】解:(1)发电厂是利用垃圾焚烧产生的热能转变为电能;
(2)石灰浆显碱性,能够吸收酸性气体,所以吸收步骤中,石灰浆的作用是除去烟气中含有的SO2、HCl,用石灰浆不用石灰水的原因是氢氧化钙微溶于水,石灰水中氢氧化钙的含量少;
(3)溶解步骤中,硫酸与铁反应,生成氢气,所以产生的H2的化学方程式为Fe+H2SO4═FeSO4+H2↑;
②复分解反应是两种化合物相互交换成分,生成另外两种新的化合物的反应;②Fe+Fe2(SO4)3=3FeSO4中有单质参与的反应,铁元素的化合价发生变化;
(4)操作②的目的是得到硫酸亚铁晶体,基本操作步骤:加热浓缩,然后冷却结晶;再过滤;最后洗涤干燥,得到硫酸亚铁晶体,其中氮气的作用是作保护气,避免+2价的铁元素被空气中的氧气氧化;
14.(1)CH4+2O22H2O+CO2;
(2)①NH3+CO2+H2O=NH4HCO3;
②置换。
【解析】解:(1)甲烷和氧气在点燃的条件下生成二氧化碳和水,反应的化学方程式为:CH4+2O22H2O+CO2。
(2)①炭化塔中H2、N2不参加反应,根据流程图可知,碳化塔中氨气、二氧化碳和水反应生成碳酸氢铵,反应的化学方程式为:NH3+CO2+H2O=NH4HCO3。
②根据流程图可知,反应釜内氨气(化合物)和钠(单质)发生反应生成氨基钠(化合物)和氢气(单质),该反应符合单换单、价改变的特点,基本反应类型属于置换反应。
15.(1)燃烧产物无污染(答案不唯一);
(2)2H2O2H2↑+O2↑;
(3)①分解反应;②物理;③生产成本较低或储运成本降低或储运相对容易(答案不唯一)。
【解析】解:(1)题干提到人们一直追求将氢气作为一种绿色能源,绿色能源的特点通常是对环境友好等。氢气燃烧时生成水,其燃烧产物仅仅是水,不会像一些化石燃料燃烧那样产生如一氧化碳、二氧化硫、氮氧化物等污染环境的物质,所以理由是氢气的燃烧产物是水,不会污染环境(答案不唯一)。故答案为:燃烧产物无污染(答案不唯一);
(2)用催化剂TiO2实现光分解水制氢气。根据化学反应前后原子种类和数目不变的原则,对反应进行配平,可得化学方程式为2H2O2H2↑+O2↑;故答案为:2H2O2H2↑+O2↑;
(3)①观察氨制氢的生产流程图,步骤Ⅱ中是氨气在铁基催化剂、410℃的条件下反应生成氢气、氮气。一种物质反应生成多种物质的反应属于分解反应,氨气在该条件下分解产生了多种物质,所以步骤Ⅱ的反应属于分解反应。
②步骤Ⅲ中分子筛只让氢分子通过而阻止其他分子通过,在这个过程中,没有新物质生成,只是将氢气和其他气体进行了分离,物质本身的化学性质没有发生改变。根据物理变化的定义,没有新物质生成的变化属于物理变化,所以该过程属于物理变化。
③对于利用氨生产氢气的优点,氨在常温常压下是气态,但通过加压等方式可使其液化,液化后的氨便于储存和运输,所以可以说氨储运相对容易(答案不唯一)。
故答案为:①分解反应;②物理;③生产成本较低或储运成本降低或储运相对容易(答案不唯一)。
16.(1)B;(2)烧焦羽毛;(3)不完全;稳定;(4)是;(5)放热;氢氧化钙与碳酸钠反应生成的氢氧化钠具有更强的碱性,能够更有效地除去木素;
(6)过滤;(7)温度没有达到纸的着火点;(8)>。
【解析】解:(1)纤维素是由葡萄糖组成的大分子多糖,属于糖类,故选B;
(2)鹿毛和羊毛的主要成分都是蛋白质,点燃都会有烧焦羽毛气味;
(3)烟是固体小颗粒,松木不完全燃烧会产生碳颗粒,即能看到黑烟,松烟墨的主要成分是炭黑, 其中含碳,碳在常温下化学性质稳定,故不易褪色;
(4)对分子质量达到几万到几十万,甚至高达几百万甚至更高的有机物,属于有机高分子化合物,由纤维素的化学式可知,纤维素属于聚合物,为有机高分子化合物;
(5)生石灰与水反应生成熟石灰,属于放热反应;
氢氧化钙与碳酸钠反应生成的氢氧化钠具有更强的碱性,能够更有效地除去木素因此混合后效果更好;
(6)抄纸是把浆料加入竹帘中,形成薄层,水由竹帘流出,即实现了固液分离,其原理与实验室的过滤相同;
(7)透火烘干过程中纸张没有燃烧,是因为纸张上的水分蒸发吸收热量,使纸的温度没有达到着火点;
(8)砚能用于研墨,说明砚的硬度>墨条。
17.(1)①3CO+Fe2O32Fe+3CO2;②不可再生;③+5;④氢分子间存在着间隔,压强增大,氢分子间的间隔变小;⑤acf;(2)①O2;②2NO+O2=2NO2;化合、氧化;③NO;④6;H2O。
【解析】解:(1)①在高温下CO和氧化铁反应生成铁和二氧化碳,反应的化学方程式为3CO+Fe2O32Fe+3CO2;故答案为:3CO+Fe2O32Fe+3CO2;
②石油是一种化石能源,在短期内得不到补充,属于不可再生能源;故答案为:不可再生;
③在磷酸亚铁锂(LiFePO4)中,锂元素的化合价为+1,铁元素的化合价为+2,氧元素的化合价为﹣2,设磷元素的化合价为x,由化合物中正负化合价的代数和为0可知,(+1)+(+2)+x+(﹣2)×4=0,解得x=+5;故答案为:+5;
④从微观角度解释,氢气能被压缩加注的原因是氢分子间存在着间隔,压强增大,氢分子间的间隔变小;故答案为:氢分子间存在着间隔,压强增大,氢分子间的间隔变小;
⑤有机合成材料包括塑料、合成纤维、合成橡胶,a.合成橡胶轮胎属于合成橡胶,c.塑料保险杠属于塑料,f.高强度丙纶纤维安全带属于合成纤维,所以主要由有机合成材料制成的是acf;故答案为:acf;
(2)①根据质量守恒定律,化学反应前后元素的种类不变,氮气和单质X反应生成一氧化氮,则单质X是氧气,化学式为O2;故答案为:O2;
②反应Ⅱ是一氧化氮和氧气在常温下反应生成二氧化氮,反应的化学方程式为:2NO+O2=2NO2。该反应符合多变一的特征,属于化合反应,同时也属于氧化反应;故答案为:2NO+O2=2NO2;化合、氧化;
③由图中信息可知,一氧化氮既是反应物又是生成物,所以可循环利用的物质是一氧化氮,化学式为NO;故答案为:NO;
④由质量守恒定律可知,化学反应前后原子的种类和个数不变,该反应前含有10个O原子,4个N原子,12个H原子;反应后含有4个N原子,4个O原子,则xR处应该为6个O原子,12个H原子,则x=6,R为H2O;故答案为:6;H2O。
18.(1)①物理;
②2H2+O22H2O;氢气燃烧的产物是水,无污染(合理即可);
(2)①A;
②碳原子的排列方式不同;
(3)SO2;
(4)CO+3H2CH4+H2O。
【解析】解:(1)①利用沸点不同,从液态空气中获得液氧,该变化没有生成新物质,属于物理变化。
②氢气燃烧生成了水,反应的化学方程式是:2H2+O22H2O。氢气被认为是理想的燃料,理由为 氢气无毒、热值高、燃烧后的产物是水,不会污染空气,也不会向大气排放二氧化碳等。
(2)①航天器外壳通常使用铝合金,它属于金属材料,故选A;
②石墨与金刚石都是由碳元素组成的单质,但物理性质差异很大,原因是碳原子的排列方式不同。
(3)煤中含有硫、氮等杂质,直接燃烧煤,排放的SO2、氮的氧化物等溶于雨水,会形成酸雨,煤的综合利用可有效缓解该问题。
(4)在“反应室3”中,一氧化碳和氢气在催化剂、加热条件下生成水和甲烷,该反应的化学方程式为:CO+3H2CH4+H2O。
同课章节目录
