第17讲 化学反应的热效应 学案(含答案)2026届高三化学一轮总复习
文档属性
| 名称 | 第17讲 化学反应的热效应 学案(含答案)2026届高三化学一轮总复习 |  | |
| 格式 | doc | ||
| 文件大小 | 928.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-27 20:49:38 | ||
图片预览


文档简介
第17讲 化学反应的热效应
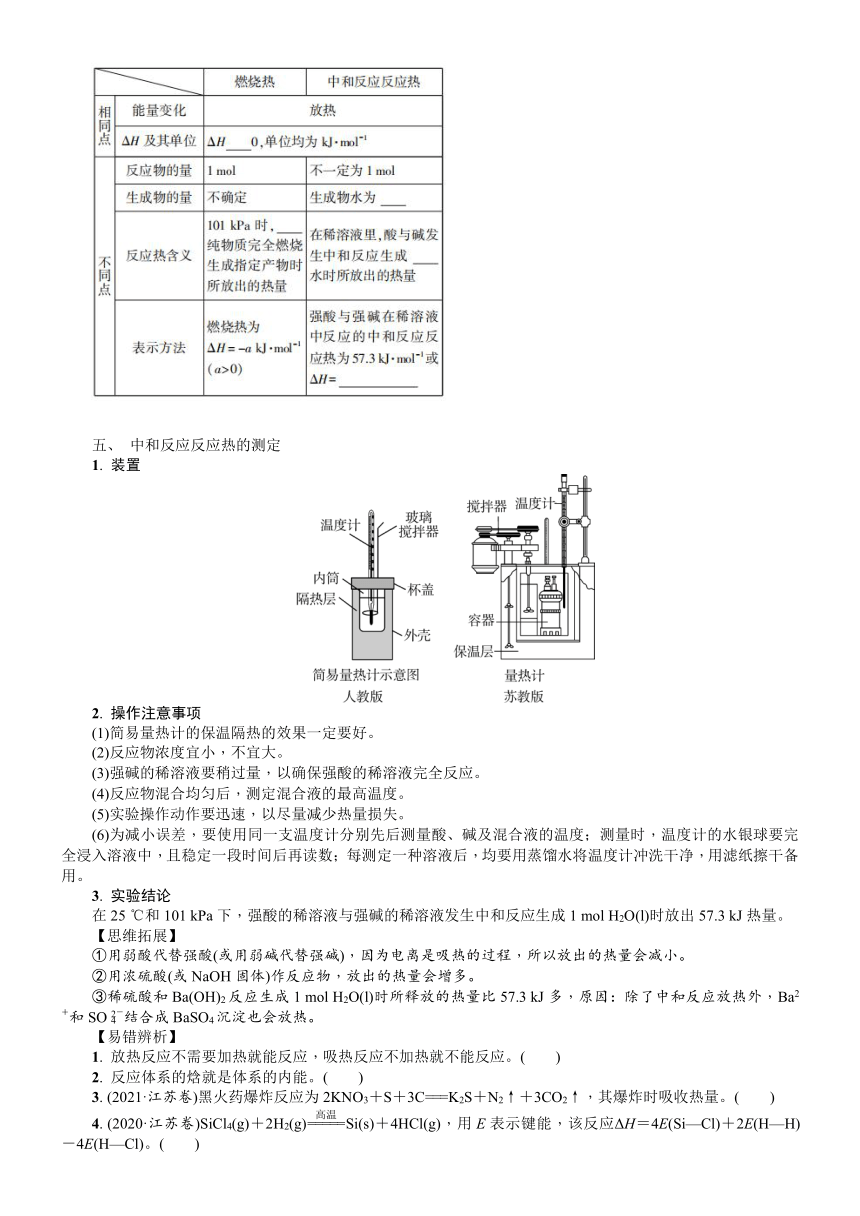
复习要求 1. 了解化学反应中能量转化的原因及常见的能量转化形式。2. 了解吸热反应、放热反应、反应热等概念。3. 了解反应热的概念,知道化学反应的热效应与焓变的关系。4. 了解热化学方程式的含义,能正确书写热化学方程式。5. 能依据盖斯定律进行反应热的简单计算。
知识体系
考点一 反应热 ΔH(焓变)
一、 反应热和焓变
1. 反应热:在等温条件下,化学反应体系向环境释放或从环境________的热量。
2. 焓变
(1)焓(H):与内能有关的物理量。
(2)焓变(ΔH):生成物的焓与反应物的焓之差。
(3)焓变与反应热的关系
等压条件下的反应热等于反应的焓变,常用________表示反应热,常用单位:________。
二、 放热反应和吸热反应
1. 放热、吸热的理论分析
(1)从微观角度分析
(2)从宏观角度分析
放热反应(ΔH<0) 吸热反应(ΔH>0)
图示
解释与说明 ①E1代表反应物断键吸收的能量,即反应物的键能之和。过渡态理论认为E1为正反应的活化能②E2代表形成化学键时释放的能量,即生成物的键能之和。过渡态理论认为E2为逆反应的活化能③ΔH为该反应过程的反应热ΔH=∑E(生成物)-∑E(反应物)ΔH=反应物的总键能-生成物的总键能ΔH=E(正反应活化能)-E(逆反应活化能)
【思维拓展】
比较反应热大小注意事项
a. 在比较反应热(ΔH)的大小时,应带符号比较。
b. 同一物质,不同聚集状态时具有的能量不同,相同量的某物质的能量关系:
E(物质R,g)>E(物质R,l)>E(物质R,s)。
c. 同一化学反应,反应物的用量越多,|ΔH|越大。对于可逆反应,因反应不能进行完全,实际反应过程中放出或吸收的热量要小于理论数值。
d. 等量的可燃物完全燃烧所放出的热量比不完全燃烧所放出的热量多,则完全燃烧的ΔH较小。
2. 常见的放热反应和吸热反应
放热反应 ①可燃物的燃烧;②酸碱中和反应;③大多数化合反应;④金属与水或酸的置换反应;⑤物质的缓慢氧化等
吸热反应 ①大多数分解反应;②盐的水解;③Ba(OH)2·8H2O与NH4Cl反应;④盐酸与碳酸氢钠的反应;⑤碳和水蒸气、C和CO2的反应等
三、 热化学方程式
1. 概念:能够表示反应热的化学方程式。
2. 意义:既表明了化学反应中的________变化,也表明了化学反应中的________变化。
如2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1表示在25 ℃、101 kPa条件下,______________________________________________________________________。
3. 书写步骤:
(1)写化学方程式。
(2)标各物质的状态。
(3)标ΔH。
【注意】
①需要注明反应时的温度和压强,但一般用25 ℃和101 kPa时的数据,因此可不特别注明;
②注明物质的聚集状态:常用s、l、g、aq分别表示固态、液态、气态、溶液;
③各物质化学式前面的化学计量数表示物质的量,可以是整数,也可以是分数,化学计量数与ΔH数值相对应,ΔH应包括“+”或“-”、数值和单位(kJ·mol-1);
④一般不要求写反应条件,不用标“↑”和“↓”,生成符号不用“―→”,而用“===”或“??”;
⑤如果是可逆反应,那么正反应和逆反应ΔH的数值相等,符号相反。
如CO(g)+H2O(g)??CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1,
则CO2(g)+H2(g)??CO(g)+H2O(g) ΔH=+41.2 kJ·mol-1。
4. 热化学方程式中的热效应都是指物质按化学方程式完全反应时的热效应。如可逆反应:N2(g)+3H2(g)??2NH3(g) ΔH=-92.4 kJ·mol-1,表示1 mol N2(g)和3 mol H2(g)完全转化为2 mol NH3(g)放出92.4 kJ热量。
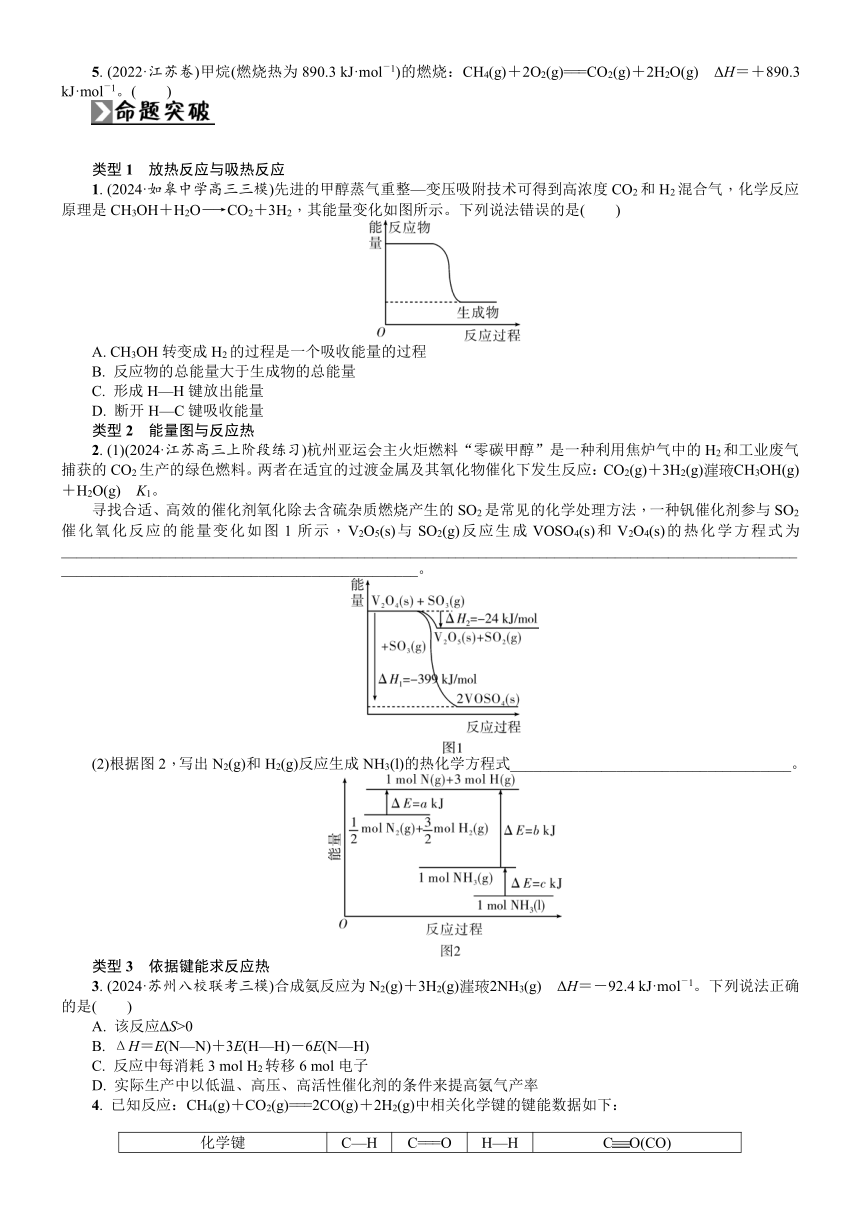
四、 燃烧热和中和反应反应热的比较
五、 中和反应反应热的测定
1. 装置
2. 操作注意事项
(1)简易量热计的保温隔热的效果一定要好。
(2)反应物浓度宜小,不宜大。
(3)强碱的稀溶液要稍过量,以确保强酸的稀溶液完全反应。
(4)反应物混合均匀后,测定混合液的最高温度。
(5)实验操作动作要迅速,以尽量减少热量损失。
(6)为减小误差,要使用同一支温度计分别先后测量酸、碱及混合液的温度;测量时,温度计的水银球要完全浸入溶液中,且稳定一段时间后再读数;每测定一种溶液后,均要用蒸馏水将温度计冲洗干净,用滤纸擦干备用。
3. 实验结论
在25 ℃和101 kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1 mol H2O(l)时放出57.3 kJ热量。
【思维拓展】
①用弱酸代替强酸(或用弱碱代替强碱),因为电离是吸热的过程,所以放出的热量会减小。
②用浓硫酸(或NaOH固体)作反应物,放出的热量会增多。
③稀硫酸和Ba(OH)2反应生成1 mol H2O(l)时所释放的热量比57.3 kJ多,原因:除了中和反应放热外,Ba2+和SO结合成BaSO4沉淀也会放热。
【易错辨析】
1. 放热反应不需要加热就能反应,吸热反应不加热就不能反应。( )
2. 反应体系的焓就是体系的内能。( )
3. (2021·江苏卷)黑火药爆炸反应为2KNO3+S+3C===K2S+N2↑+3CO2↑,其爆炸时吸收热量。( )
4. (2020·江苏卷)SiCl4(g)+2H2(g)Si(s)+4HCl(g),用E表示键能,该反应ΔH=4E(Si—Cl)+2E(H—H)-4E(H—Cl)。( )
5. (2022·江苏卷)甲烷(燃烧热为890.3 kJ·mol-1)的燃烧:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=+890.3 kJ·mol-1。( )
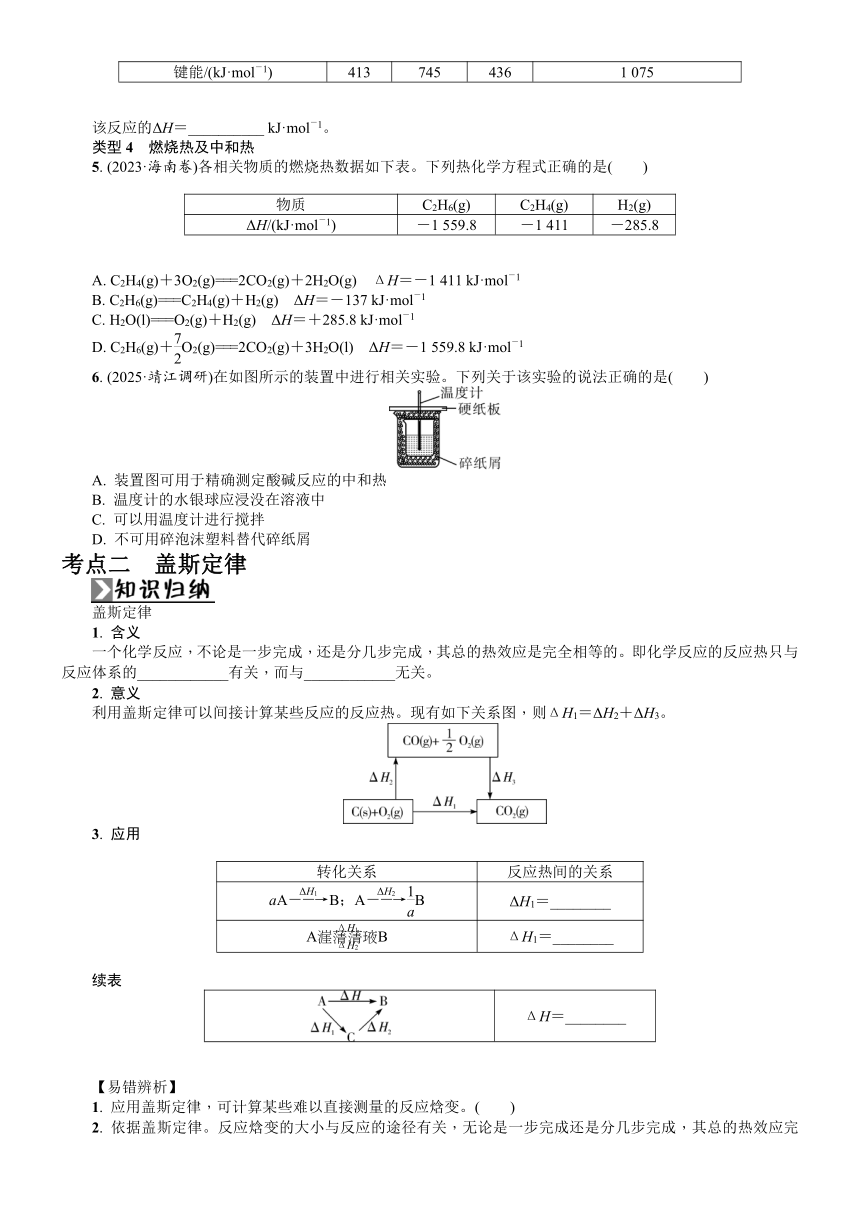
类型1 放热反应与吸热反应
1. (2024·如皋中学高三三模)先进的甲醇蒸气重整—变压吸附技术可得到高浓度CO2和H2混合气,化学反应原理是CH3OH+H2O―→CO2+3H2,其能量变化如图所示。下列说法错误的是( )
A. CH3OH转变成H2的过程是一个吸收能量的过程
B. 反应物的总能量大于生成物的总能量
C. 形成H—H键放出能量
D. 断开H—C键吸收能量
类型2 能量图与反应热
2. (1)(2024·江苏高三上阶段练习)杭州亚运会主火炬燃料“零碳甲醇”是一种利用焦炉气中的H2和工业废气捕获的CO2生产的绿色燃料。两者在适宜的过渡金属及其氧化物催化下发生反应:CO2(g)+3H2(g)??CH3OH(g)+H2O(g) K1。
寻找合适、高效的催化剂氧化除去含硫杂质燃烧产生的SO2是常见的化学处理方法,一种钒催化剂参与SO2催化氧化反应的能量变化如图1所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为________________________________________________________________________________________________________________________________________________。
(2)根据图2,写出N2(g)和H2(g)反应生成NH3(l)的热化学方程式_____________________________________。
类型3 依据键能求反应热
3. (2024·苏州八校联考三模)合成氨反应为N2(g)+3H2(g)??2NH3(g) ΔH=-92.4 kJ·mol-1。下列说法正确的是( )
A. 该反应ΔS>0
B. ΔH=E(N—N)+3E(H—H)-6E(N—H)
C. 反应中每消耗3 mol H2转移6 mol电子
D. 实际生产中以低温、高压、高活性催化剂的条件来提高氨气产率
4. 已知反应:CH4(g)+CO2(g)===2CO(g)+2H2(g)中相关化学键的键能数据如下:
化学键 C—H C===O H—H CO(CO)
键能/(kJ·mol-1) 413 745 436 1 075
该反应的ΔH=__________ kJ·mol-1。
类型4 燃烧热及中和热
5. (2023·海南卷)各相关物质的燃烧热数据如下表。下列热化学方程式正确的是( )
物质 C2H6(g) C2H4(g) H2(g)
ΔH/(kJ·mol-1) -1 559.8 -1 411 -285.8
A. C2H4(g)+3O2(g)===2CO2(g)+2H2O(g) ΔH=-1 411 kJ·mol-1
B. C2H6(g)===C2H4(g)+H2(g) ΔH=-137 kJ·mol-1
C. H2O(l)===O2(g)+H2(g) ΔH=+285.8 kJ·mol-1
D. C2H6(g)+O2(g)===2CO2(g)+3H2O(l) ΔH=-1 559.8 kJ·mol-1
6. (2025·靖江调研)在如图所示的装置中进行相关实验。下列关于该实验的说法正确的是( )
A. 装置图可用于精确测定酸碱反应的中和热
B. 温度计的水银球应浸没在溶液中
C. 可以用温度计进行搅拌
D. 不可用碎泡沫塑料替代碎纸屑
考点二 盖斯定律
盖斯定律
1. 含义
一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相等的。即化学反应的反应热只与反应体系的____________有关,而与____________无关。
2. 意义
利用盖斯定律可以间接计算某些反应的反应热。现有如下关系图,则ΔH1=ΔH2+ΔH3。
3. 应用
转化关系 反应热间的关系
aAB;AB ΔH1=________
AB ΔH1=________
续表
ΔH=________
【易错辨析】
1. 应用盖斯定律,可计算某些难以直接测量的反应焓变。( )
2. 依据盖斯定律。反应焓变的大小与反应的途径有关,无论是一步完成还是分几步完成,其总的热效应完全相同。( )
3. 已知:①CO(g)+2H2(g)===CH3OH(g) ΔH1=-90.5 kJ·mol-1,②CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2=-41.1 kJ·mol-1,则CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-49.4 kJ·mol-1。( )
4. 在25 、101 kPa时,C(s)、H2(g)、CH3COOH(l)的标准燃烧热分别为-393.5 kJ·mol-1、-285.8 kJ·mol-1、-870.3 kJ·mol-1,则2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为488.3 kJ·mol-1。( )
5. 向Na2CO3溶液中滴加盐酸,反应过程中能量变化如图所示,CO(aq)+2H+(aq)===CO2(g)+H2O(l) ΔH=ΔH1+ΔH2+ΔH3。( )
类型1 利用盖斯定律求解反应热
1. (1)CH4与CO2重整的主要反应的热化学方程式为
反应Ⅰ:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+246.5 kJ·mol-1
反应Ⅱ:H2(g)+CO2(g)===CO(g)+H2O(g) ΔH=+41.2 kJ·mol-1
反应Ⅲ:2CO(g)===CO2(g)+C(s) ΔH=-172.5 kJ·mol-1
在CH4与CO2重整体系中通入适量H2O(g),可减少C(s)的生成,反应3CH4(g)+CO2(g)+2H2O(g)===4CO(g)+8H2(g)的ΔH=____________。
(2)(2024·上海卷)已知反应Al2Br6(l)??2Al(g)+6Br(g) ΔH。
①Al2Br6(s)??Al2Br6(l) ΔH1
②Al(s)??Al(g) ΔH2
③Br2(l)??Br2(g) ΔH3
④Br2(g)??2Br(g) ΔH4
⑤2Al(s)+3Br2(l)??Al2Br6(s) ΔH5
则ΔH=________________________________。
(3)(2025·泰州阶段检测)已知:
反应Ⅰ:2NO(g)+O2(g)===2NO2(g) ΔH1=a kJ·mol-1
反应Ⅱ:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH2=b kJ·mol-1
反应Ⅲ:CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH3=c kJ·mol-1
则反应:CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH4=________________ kJ·mol-1。
类型2 利用盖斯定律比较反应热的大小
2. 下列各组热化学方程式中,化学反应的ΔH前者小于后者的是( )
①S(g)+O2(g)===SO2(g);S(s)+O2(g)===SO2(g)
②C(s)+O2(g)===CO(g);C(s)+O2(g)===CO2(g)
③2KOH(aq)+H2SO4(浓)===K2SO4(aq)+2H2O(l);2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l)
④2H2(g)+O2(g)===2H2O(l);H2(g)+O2(g)===H2O(l)
A. ①③④
B. ②③④
C. ①②③
D. ①②③④
类型3 利用反应历程中活化能求反应热
3. (1)以NH3和CO2为原料合成化肥——尿素[CO(NH2)2],两步反应的能量变化如图所示:
①写出合成CO(NH2)2(s)的热化学方程式:___________________________________________
________________________________________________________________________;
②已知第二步反应决定了生产尿素的快慢,可推测E1________E3(填“>”“<”或“=”)。
(2)Cr2O3催化丙烷脱氢过程中,部分反应历程如图所示,X(g)―→Y(g)过程的焓变为________________(列式表示)。
素 养 评 估
1. 工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3气体,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是( )
A. 2SO2(g)+O2(g)??2SO3(g)
ΔH=-196.6 kJ·mol-1
B. 2SO2(g)+O2(g)??2SO3(g)
ΔH=-98.3 kJ·mol-1
C. SO2(g)+O2(g)??SO3(g)
ΔH=-98.3 kJ·mol-1
D. SO2(g)+O2(g)??SO3(g)
ΔH=-196.6 kJ·mol-1
2. 研究表明,在一定条件下,气态HCN(a)与HNC(b)两种分子的互变反应过程能量变化如图所示。下列说法正确的是( )
A. HNC比HCN更稳定
B. HCN转化为HNC,反应条件一定要加热
C. HNC(g)??HCN(g) ΔH=-59.3 kJ·mol-1
D. 加入催化剂,可以减小反应的热效应
3. (1)以太阳能为热源,金属氧化物为催化剂可以分解水制H2和O2,实现能源绿色化,其过程如下:
过程Ⅰ:2Fe2O3(s)===4FeO(s)+O2(g)
ΔH1=+138 kJ·mol-1
过程Ⅱ:2FeO(s)+H2O(l)===H2(g)+Fe2O3(s)
ΔH2
总反应:2H2O(l)===2H2(g)+O2(g)
ΔH=+571 kJ·mol-1
则过程Ⅱ的ΔH2=____________________。
(2)已知:4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH=-905.0 kJ·mol-1(Ⅰ),N2(g)+O2(g)===2NO(g) ΔH=+180.5 kJ·mol-1(Ⅱ)。有氧条件下,NH3与NO反应生成N2,相关热化学方程式为4NH3(g)+4NO(g)+O2(g)===4N2(g)+6H2O(g) ΔH=__________ kJ·mol-1。
(3)CO2与H2在某催化剂的作用下反应如图所示:
化学键
键能/(kJ·mol-1) 436 326 803 464 414
该反应的热化学方程式为CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH。则ΔH=__________。
4. 依据事实,写出下列反应的热化学方程式。
(1)0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量_________________________________。
(2)1 g碳与适量水蒸气反应生成CO和H2,吸收10.94 kJ热量_________________________________________。
(3)23 g某液态有机物和一定量的氧气混合点燃,恰好完全反应,生成27 g液态水和22.4 L(标准状况)CO2并放出683.5 kJ的热量_____________________________________________________________。
(4)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化的示意图,请写出NO2和CO反应的热化学方程式:______________________________________________________________________。
第17讲 化学反应的热效应
考点一 反应热 ΔH(焓变)
知识归纳
一、 1. 吸收
2. (3)ΔH kJ·mol-1
二、 1. (1)吸热 放热
三、 2. 物质 能量 2 mol H2(g)与1 mol O2(g)反应生成2 mol液态水时放出的热量为571.6 kJ
四、 < 1 mol 1 mol 1 mol -57.3 kJ·mol-1
【易错辨析】
1. × 2. × 3. × 4. × 5. ×
命题突破
1. A 解析:图示能量变化趋势可知,反应物的总能量大于生成物的总能量,所以CH3OH转变成H2的过程是一个放出热量的过程,A错误;反应物的总能量大于生成物的总能量,B正确;化学键的形成需要释放能量,所以形成H—H键放出能量,C正确;化学键的断裂需要吸收能量,D正确。
2. (1)2V2O5(s)+2SO2(g)2VOSO4(s)+V2O4(s) ΔH=-351 kJ·mol-1
(2)N2(g)+3H2(g)2NH3(l) ΔH=-2(c+b-a) kJ·mol-1
解析:(1)根据图示可知①V2O4(s)+SO3(g)V2O5(s)+SO2(g) ΔH2=-24 kJ·mol-1;②V2O4(s)+2SO3(g)??2VOSO4(s) ΔH1=-399 kJ·mol-1;根据盖斯定律②-①×2得2V2O5(s)+2SO2(g)2VOSO4(s)+V2O4(s),则ΔH=ΔH1-2ΔH2=(-399 kJ·mol-1)-(-24 kJ·mol-1)×2=-351 kJ·mol-1。
(2)由图可知, mol N2(g)+ mol H2(g)比1 mol NH3(l)能量高(c+b-a) kJ,该反应放热,ΔH为负值,故N2(g)+3H2(g)2NH3(l) ΔH=-2(c+b-a) kJ·mol-1。
3. C 解析:该反应为气体体积减小的反应,ΔS<0,A错误;ΔH=反应物键能总和-生成物键能总和,ΔH=E(NN)+3E(H—H)-6E(N—H),B错误;该反应中,H2中的H失电子化合价从0价转化为+1价,每消耗3 mol H2转移6 mol电子,C正确;该反应为气体体积减小的放热反应,低温、高压化学平衡正向移动,但是使用高活性催化剂对化学平衡没有影响,无法提高氨气产率,D错误。
4. +120
解析:ΔH=(413 kJ·mol-1×4+745 kJ·mol-1×2)-(1 075 kJ·mol-1×2+436 kJ·mol-1×2)=+120 kJ·mol-1。
5. D 解析:H2O应该为液态,A错误;C2H6(g)===C2H4(g)+H2(g) ΔH=+137 kJ·mol-1,B错误;氢气的燃烧热为285.8 kJ·mol-1,则H2O(l)===O2(g)+H2(g) ΔH=+285.8 kJ·mol-1,C错误;C2H6(g)+O2(g)===2CO2(g)+3H2O(l) ΔH=-1 559.8 kJ·mol-1,D正确。故选D。
6. B 解析:装置图缺少玻璃搅拌器,且小烧杯与大烧杯的上沿不齐平,该装置图不可用于精确测定酸碱反应的中和热,A错误;温度计的水银球应浸于溶液中,准确测量温度,B正确;温度计用于测定溶液温度,不能用于搅拌溶液,C错误;碎泡沫塑料可以起隔热作用,能替代碎纸屑,D错误。
考点二 盖斯定律
知识归纳
1. 始态和终态 反应的途径
3. aΔH2 -ΔH2 ΔH1+ΔH2
【易错辨析】
1. √ 2. × 3. √ 4. × 5. √
命题突破
1. (1)+657.1 kJ·mol-1 (2)-ΔH1+2ΔH2+3ΔH3+3ΔH4-ΔH5 (3)2a+2c-b
解析:(1)反应Ⅰ:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=246.5 kJ·mol-1,反应Ⅱ:H2(g)+CO2(g)===CO(g)+H2O(g) ΔH=41.2 kJ·mol-1
依据盖斯定律可知Ⅰ×3-Ⅱ×2即得到反应3CH4(g)+CO2(g)+2H2O(g)===4CO(g)+8H2(g)的ΔH=+657.1 kJ·mol-1。
(2)由题中所给的热化学方程式,根据盖斯定律可知,目标热化学方程式可由①×(-1)+②×2+③×3+④×3+⑤×(-1)得到,故ΔH=-ΔH1+2ΔH2+3ΔH3+3ΔH4-ΔH5。
(3)由盖斯定律可知,Ⅰ×2+Ⅲ×2-Ⅱ可得目标热化学方程式,则ΔH4=ΔH1×2+ΔH3×2-ΔH2=(2a+2c-b) kJ·mol-1。
2. A 解析:①S(g)+O2(g)===SO2(g);S(s)+O2(g)===SO2(g),由于S(g)―→S(s)放热,则前者放出的热量多,ΔH前者<ΔH后者,故选①;②C(s)+O2(g)===CO(g);C(s)+O2(g)===CO2(g),后者完全反应,放出的热量多,ΔH前者>ΔH后者,故不选②;③2KOH(aq)+H2SO4(浓)===K2SO4(aq)+2H2O(l);2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l),浓硫酸稀释放热,所以ΔH前者<ΔH后者,故选③;④2H2(g)+O2(g)===2H2O(l);H2(g)+O2(g)===H2O(l),消耗的氢气越多,放出的热量越多,ΔH前者<ΔH后者,故选④。化学反应的ΔH前者小于后者的是①③④,选A。
3. (1)①2NH3(g)+CO2(g)===H2O(g)+CO(NH2)2(s) ΔH=-(E4+E2-E1-E3) kJ·mol-1 ②< (2)E1-E2+ΔH+E3-E4
解析:(1)ΔH=吸收的能量总和-放出的能量总和,则热化学方程式为2NH3(g)+CO2(g)===H2O(g)+CO(NH2)2(s) ΔH=-(E4+E2-E1-E3) kJ·mol-1。活化能大的反应决定了反应速率的快慢,已知第二步反应决定了生产尿素的快慢,则可推测活化能E1(2)由图可知,X(g)―→Y(g)过程分为3个阶段,第一步反应的焓变ΔH1=E1-E2,第二步反应的焓变ΔH2=ΔH,第三步反应的焓变ΔH3=E3-E4,根据盖斯定律计算总反应的焓变为E1-E2+ΔH+E3-E4。
素养评估
1. C 解析:2 mol SO3、1 mol O2充入恒容容器中,达平衡时,SO2的转化率为50%,则反应了的SO2的物质的量为1 mol,放出热量98.3 kJ,故热化学方程式为2SO2(g)+O2(g)2SO3(g) ΔH=-196.6 kJ·mol-1或SO2(g)+O2(g)SO3(g) ΔH=-98.3 kJ·mol-1。故选C。
2. C 解析:能量越低越稳定,根据图示,等物质的量的HNC比HCN的能量高,HCN比HNC更稳定,A错误;HCN转化为HNC是吸热反应,吸热反应的发生不一定需要加热,B错误;加入催化剂,能降低反应的活化能,反应的热效应不变,D错误。故选C。
3. (1)+216.5 kJ·mol-1 (2)-1 627 (3)-46 kJ·mol-1
解析:(1)根据盖斯定律知Ⅰ+2×Ⅱ=总反应,故过程Ⅱ的ΔH2=(ΔH-ΔH1)=(571-138) kJ·mol-1=+216.5 kJ·mol-1。
(2)根据盖斯定律,反应Ⅰ-4×反应Ⅱ可得到热化学方程式:4NH3(g)+4NO(g)+O2(g)===4N2(g)+6H2O(g) ΔH=(-905.0-4×180.5) kJ·mol-1=-1 627 kJ·mol-1。
(3)由反应图示可知图形与化学键对应关系为
H—H C—O C===O O—H C—H
ΔH=反应物总键能-生成物总键能=2×803 kJ·mol-1+3×436 kJ·mol-1-3×414 kJ·mol-1-326 kJ·mol-1-3×464 kJ·mol-1=-46 kJ·mol-1。
4. (1)N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1 C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.28 kJ·mol-1 (3)C2H6O(l)+3O2(g)===2CO2(g)+3H2O(l)
ΔH=-1 367 kJ·mol-1 (4)NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ·mol-1 解析:(1)1 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ×4=534 kJ热量,即N2H4(g)+O2(g)===N2(g)+2H2O(g)
ΔH=-534 kJ·mol-1。
(2)12 g碳与适量水蒸气反应生成CO和H2,吸收10.94 kJ×12=131.28 kJ热量,即C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.28 kJ·mol-1。
(3)燃烧生成1.5 mol H2O(l)水和1 mol CO2,23 g有机物中O的质量为:23 g-3 g-12 g=8 g,该液态有机物中C、H、O原子个数比为1∶3∶0.5,化学式为C2H6O,热化学方程式为C2H6O(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1 367 kJ·mol-1。
(4)由图可知其热化学方程式为NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=E1-E2=134 kJ·mol-1-368 kJ·mol-1=-234 kJ·mol-1。
复习要求 1. 了解化学反应中能量转化的原因及常见的能量转化形式。2. 了解吸热反应、放热反应、反应热等概念。3. 了解反应热的概念,知道化学反应的热效应与焓变的关系。4. 了解热化学方程式的含义,能正确书写热化学方程式。5. 能依据盖斯定律进行反应热的简单计算。
知识体系
考点一 反应热 ΔH(焓变)
一、 反应热和焓变
1. 反应热:在等温条件下,化学反应体系向环境释放或从环境________的热量。
2. 焓变
(1)焓(H):与内能有关的物理量。
(2)焓变(ΔH):生成物的焓与反应物的焓之差。
(3)焓变与反应热的关系
等压条件下的反应热等于反应的焓变,常用________表示反应热,常用单位:________。
二、 放热反应和吸热反应
1. 放热、吸热的理论分析
(1)从微观角度分析
(2)从宏观角度分析
放热反应(ΔH<0) 吸热反应(ΔH>0)
图示
解释与说明 ①E1代表反应物断键吸收的能量,即反应物的键能之和。过渡态理论认为E1为正反应的活化能②E2代表形成化学键时释放的能量,即生成物的键能之和。过渡态理论认为E2为逆反应的活化能③ΔH为该反应过程的反应热ΔH=∑E(生成物)-∑E(反应物)ΔH=反应物的总键能-生成物的总键能ΔH=E(正反应活化能)-E(逆反应活化能)
【思维拓展】
比较反应热大小注意事项
a. 在比较反应热(ΔH)的大小时,应带符号比较。
b. 同一物质,不同聚集状态时具有的能量不同,相同量的某物质的能量关系:
E(物质R,g)>E(物质R,l)>E(物质R,s)。
c. 同一化学反应,反应物的用量越多,|ΔH|越大。对于可逆反应,因反应不能进行完全,实际反应过程中放出或吸收的热量要小于理论数值。
d. 等量的可燃物完全燃烧所放出的热量比不完全燃烧所放出的热量多,则完全燃烧的ΔH较小。
2. 常见的放热反应和吸热反应
放热反应 ①可燃物的燃烧;②酸碱中和反应;③大多数化合反应;④金属与水或酸的置换反应;⑤物质的缓慢氧化等
吸热反应 ①大多数分解反应;②盐的水解;③Ba(OH)2·8H2O与NH4Cl反应;④盐酸与碳酸氢钠的反应;⑤碳和水蒸气、C和CO2的反应等
三、 热化学方程式
1. 概念:能够表示反应热的化学方程式。
2. 意义:既表明了化学反应中的________变化,也表明了化学反应中的________变化。
如2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1表示在25 ℃、101 kPa条件下,______________________________________________________________________。
3. 书写步骤:
(1)写化学方程式。
(2)标各物质的状态。
(3)标ΔH。
【注意】
①需要注明反应时的温度和压强,但一般用25 ℃和101 kPa时的数据,因此可不特别注明;
②注明物质的聚集状态:常用s、l、g、aq分别表示固态、液态、气态、溶液;
③各物质化学式前面的化学计量数表示物质的量,可以是整数,也可以是分数,化学计量数与ΔH数值相对应,ΔH应包括“+”或“-”、数值和单位(kJ·mol-1);
④一般不要求写反应条件,不用标“↑”和“↓”,生成符号不用“―→”,而用“===”或“??”;
⑤如果是可逆反应,那么正反应和逆反应ΔH的数值相等,符号相反。
如CO(g)+H2O(g)??CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1,
则CO2(g)+H2(g)??CO(g)+H2O(g) ΔH=+41.2 kJ·mol-1。
4. 热化学方程式中的热效应都是指物质按化学方程式完全反应时的热效应。如可逆反应:N2(g)+3H2(g)??2NH3(g) ΔH=-92.4 kJ·mol-1,表示1 mol N2(g)和3 mol H2(g)完全转化为2 mol NH3(g)放出92.4 kJ热量。
四、 燃烧热和中和反应反应热的比较
五、 中和反应反应热的测定
1. 装置
2. 操作注意事项
(1)简易量热计的保温隔热的效果一定要好。
(2)反应物浓度宜小,不宜大。
(3)强碱的稀溶液要稍过量,以确保强酸的稀溶液完全反应。
(4)反应物混合均匀后,测定混合液的最高温度。
(5)实验操作动作要迅速,以尽量减少热量损失。
(6)为减小误差,要使用同一支温度计分别先后测量酸、碱及混合液的温度;测量时,温度计的水银球要完全浸入溶液中,且稳定一段时间后再读数;每测定一种溶液后,均要用蒸馏水将温度计冲洗干净,用滤纸擦干备用。
3. 实验结论
在25 ℃和101 kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1 mol H2O(l)时放出57.3 kJ热量。
【思维拓展】
①用弱酸代替强酸(或用弱碱代替强碱),因为电离是吸热的过程,所以放出的热量会减小。
②用浓硫酸(或NaOH固体)作反应物,放出的热量会增多。
③稀硫酸和Ba(OH)2反应生成1 mol H2O(l)时所释放的热量比57.3 kJ多,原因:除了中和反应放热外,Ba2+和SO结合成BaSO4沉淀也会放热。
【易错辨析】
1. 放热反应不需要加热就能反应,吸热反应不加热就不能反应。( )
2. 反应体系的焓就是体系的内能。( )
3. (2021·江苏卷)黑火药爆炸反应为2KNO3+S+3C===K2S+N2↑+3CO2↑,其爆炸时吸收热量。( )
4. (2020·江苏卷)SiCl4(g)+2H2(g)Si(s)+4HCl(g),用E表示键能,该反应ΔH=4E(Si—Cl)+2E(H—H)-4E(H—Cl)。( )
5. (2022·江苏卷)甲烷(燃烧热为890.3 kJ·mol-1)的燃烧:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=+890.3 kJ·mol-1。( )
类型1 放热反应与吸热反应
1. (2024·如皋中学高三三模)先进的甲醇蒸气重整—变压吸附技术可得到高浓度CO2和H2混合气,化学反应原理是CH3OH+H2O―→CO2+3H2,其能量变化如图所示。下列说法错误的是( )
A. CH3OH转变成H2的过程是一个吸收能量的过程
B. 反应物的总能量大于生成物的总能量
C. 形成H—H键放出能量
D. 断开H—C键吸收能量
类型2 能量图与反应热
2. (1)(2024·江苏高三上阶段练习)杭州亚运会主火炬燃料“零碳甲醇”是一种利用焦炉气中的H2和工业废气捕获的CO2生产的绿色燃料。两者在适宜的过渡金属及其氧化物催化下发生反应:CO2(g)+3H2(g)??CH3OH(g)+H2O(g) K1。
寻找合适、高效的催化剂氧化除去含硫杂质燃烧产生的SO2是常见的化学处理方法,一种钒催化剂参与SO2催化氧化反应的能量变化如图1所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为________________________________________________________________________________________________________________________________________________。
(2)根据图2,写出N2(g)和H2(g)反应生成NH3(l)的热化学方程式_____________________________________。
类型3 依据键能求反应热
3. (2024·苏州八校联考三模)合成氨反应为N2(g)+3H2(g)??2NH3(g) ΔH=-92.4 kJ·mol-1。下列说法正确的是( )
A. 该反应ΔS>0
B. ΔH=E(N—N)+3E(H—H)-6E(N—H)
C. 反应中每消耗3 mol H2转移6 mol电子
D. 实际生产中以低温、高压、高活性催化剂的条件来提高氨气产率
4. 已知反应:CH4(g)+CO2(g)===2CO(g)+2H2(g)中相关化学键的键能数据如下:
化学键 C—H C===O H—H CO(CO)
键能/(kJ·mol-1) 413 745 436 1 075
该反应的ΔH=__________ kJ·mol-1。
类型4 燃烧热及中和热
5. (2023·海南卷)各相关物质的燃烧热数据如下表。下列热化学方程式正确的是( )
物质 C2H6(g) C2H4(g) H2(g)
ΔH/(kJ·mol-1) -1 559.8 -1 411 -285.8
A. C2H4(g)+3O2(g)===2CO2(g)+2H2O(g) ΔH=-1 411 kJ·mol-1
B. C2H6(g)===C2H4(g)+H2(g) ΔH=-137 kJ·mol-1
C. H2O(l)===O2(g)+H2(g) ΔH=+285.8 kJ·mol-1
D. C2H6(g)+O2(g)===2CO2(g)+3H2O(l) ΔH=-1 559.8 kJ·mol-1
6. (2025·靖江调研)在如图所示的装置中进行相关实验。下列关于该实验的说法正确的是( )
A. 装置图可用于精确测定酸碱反应的中和热
B. 温度计的水银球应浸没在溶液中
C. 可以用温度计进行搅拌
D. 不可用碎泡沫塑料替代碎纸屑
考点二 盖斯定律
盖斯定律
1. 含义
一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相等的。即化学反应的反应热只与反应体系的____________有关,而与____________无关。
2. 意义
利用盖斯定律可以间接计算某些反应的反应热。现有如下关系图,则ΔH1=ΔH2+ΔH3。
3. 应用
转化关系 反应热间的关系
aAB;AB ΔH1=________
AB ΔH1=________
续表
ΔH=________
【易错辨析】
1. 应用盖斯定律,可计算某些难以直接测量的反应焓变。( )
2. 依据盖斯定律。反应焓变的大小与反应的途径有关,无论是一步完成还是分几步完成,其总的热效应完全相同。( )
3. 已知:①CO(g)+2H2(g)===CH3OH(g) ΔH1=-90.5 kJ·mol-1,②CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2=-41.1 kJ·mol-1,则CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-49.4 kJ·mol-1。( )
4. 在25 、101 kPa时,C(s)、H2(g)、CH3COOH(l)的标准燃烧热分别为-393.5 kJ·mol-1、-285.8 kJ·mol-1、-870.3 kJ·mol-1,则2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为488.3 kJ·mol-1。( )
5. 向Na2CO3溶液中滴加盐酸,反应过程中能量变化如图所示,CO(aq)+2H+(aq)===CO2(g)+H2O(l) ΔH=ΔH1+ΔH2+ΔH3。( )
类型1 利用盖斯定律求解反应热
1. (1)CH4与CO2重整的主要反应的热化学方程式为
反应Ⅰ:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+246.5 kJ·mol-1
反应Ⅱ:H2(g)+CO2(g)===CO(g)+H2O(g) ΔH=+41.2 kJ·mol-1
反应Ⅲ:2CO(g)===CO2(g)+C(s) ΔH=-172.5 kJ·mol-1
在CH4与CO2重整体系中通入适量H2O(g),可减少C(s)的生成,反应3CH4(g)+CO2(g)+2H2O(g)===4CO(g)+8H2(g)的ΔH=____________。
(2)(2024·上海卷)已知反应Al2Br6(l)??2Al(g)+6Br(g) ΔH。
①Al2Br6(s)??Al2Br6(l) ΔH1
②Al(s)??Al(g) ΔH2
③Br2(l)??Br2(g) ΔH3
④Br2(g)??2Br(g) ΔH4
⑤2Al(s)+3Br2(l)??Al2Br6(s) ΔH5
则ΔH=________________________________。
(3)(2025·泰州阶段检测)已知:
反应Ⅰ:2NO(g)+O2(g)===2NO2(g) ΔH1=a kJ·mol-1
反应Ⅱ:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH2=b kJ·mol-1
反应Ⅲ:CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH3=c kJ·mol-1
则反应:CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH4=________________ kJ·mol-1。
类型2 利用盖斯定律比较反应热的大小
2. 下列各组热化学方程式中,化学反应的ΔH前者小于后者的是( )
①S(g)+O2(g)===SO2(g);S(s)+O2(g)===SO2(g)
②C(s)+O2(g)===CO(g);C(s)+O2(g)===CO2(g)
③2KOH(aq)+H2SO4(浓)===K2SO4(aq)+2H2O(l);2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l)
④2H2(g)+O2(g)===2H2O(l);H2(g)+O2(g)===H2O(l)
A. ①③④
B. ②③④
C. ①②③
D. ①②③④
类型3 利用反应历程中活化能求反应热
3. (1)以NH3和CO2为原料合成化肥——尿素[CO(NH2)2],两步反应的能量变化如图所示:
①写出合成CO(NH2)2(s)的热化学方程式:___________________________________________
________________________________________________________________________;
②已知第二步反应决定了生产尿素的快慢,可推测E1________E3(填“>”“<”或“=”)。
(2)Cr2O3催化丙烷脱氢过程中,部分反应历程如图所示,X(g)―→Y(g)过程的焓变为________________(列式表示)。
素 养 评 估
1. 工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3气体,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是( )
A. 2SO2(g)+O2(g)??2SO3(g)
ΔH=-196.6 kJ·mol-1
B. 2SO2(g)+O2(g)??2SO3(g)
ΔH=-98.3 kJ·mol-1
C. SO2(g)+O2(g)??SO3(g)
ΔH=-98.3 kJ·mol-1
D. SO2(g)+O2(g)??SO3(g)
ΔH=-196.6 kJ·mol-1
2. 研究表明,在一定条件下,气态HCN(a)与HNC(b)两种分子的互变反应过程能量变化如图所示。下列说法正确的是( )
A. HNC比HCN更稳定
B. HCN转化为HNC,反应条件一定要加热
C. HNC(g)??HCN(g) ΔH=-59.3 kJ·mol-1
D. 加入催化剂,可以减小反应的热效应
3. (1)以太阳能为热源,金属氧化物为催化剂可以分解水制H2和O2,实现能源绿色化,其过程如下:
过程Ⅰ:2Fe2O3(s)===4FeO(s)+O2(g)
ΔH1=+138 kJ·mol-1
过程Ⅱ:2FeO(s)+H2O(l)===H2(g)+Fe2O3(s)
ΔH2
总反应:2H2O(l)===2H2(g)+O2(g)
ΔH=+571 kJ·mol-1
则过程Ⅱ的ΔH2=____________________。
(2)已知:4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH=-905.0 kJ·mol-1(Ⅰ),N2(g)+O2(g)===2NO(g) ΔH=+180.5 kJ·mol-1(Ⅱ)。有氧条件下,NH3与NO反应生成N2,相关热化学方程式为4NH3(g)+4NO(g)+O2(g)===4N2(g)+6H2O(g) ΔH=__________ kJ·mol-1。
(3)CO2与H2在某催化剂的作用下反应如图所示:
化学键
键能/(kJ·mol-1) 436 326 803 464 414
该反应的热化学方程式为CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH。则ΔH=__________。
4. 依据事实,写出下列反应的热化学方程式。
(1)0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量_________________________________。
(2)1 g碳与适量水蒸气反应生成CO和H2,吸收10.94 kJ热量_________________________________________。
(3)23 g某液态有机物和一定量的氧气混合点燃,恰好完全反应,生成27 g液态水和22.4 L(标准状况)CO2并放出683.5 kJ的热量_____________________________________________________________。
(4)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化的示意图,请写出NO2和CO反应的热化学方程式:______________________________________________________________________。
第17讲 化学反应的热效应
考点一 反应热 ΔH(焓变)
知识归纳
一、 1. 吸收
2. (3)ΔH kJ·mol-1
二、 1. (1)吸热 放热
三、 2. 物质 能量 2 mol H2(g)与1 mol O2(g)反应生成2 mol液态水时放出的热量为571.6 kJ
四、 < 1 mol 1 mol 1 mol -57.3 kJ·mol-1
【易错辨析】
1. × 2. × 3. × 4. × 5. ×
命题突破
1. A 解析:图示能量变化趋势可知,反应物的总能量大于生成物的总能量,所以CH3OH转变成H2的过程是一个放出热量的过程,A错误;反应物的总能量大于生成物的总能量,B正确;化学键的形成需要释放能量,所以形成H—H键放出能量,C正确;化学键的断裂需要吸收能量,D正确。
2. (1)2V2O5(s)+2SO2(g)2VOSO4(s)+V2O4(s) ΔH=-351 kJ·mol-1
(2)N2(g)+3H2(g)2NH3(l) ΔH=-2(c+b-a) kJ·mol-1
解析:(1)根据图示可知①V2O4(s)+SO3(g)V2O5(s)+SO2(g) ΔH2=-24 kJ·mol-1;②V2O4(s)+2SO3(g)??2VOSO4(s) ΔH1=-399 kJ·mol-1;根据盖斯定律②-①×2得2V2O5(s)+2SO2(g)2VOSO4(s)+V2O4(s),则ΔH=ΔH1-2ΔH2=(-399 kJ·mol-1)-(-24 kJ·mol-1)×2=-351 kJ·mol-1。
(2)由图可知, mol N2(g)+ mol H2(g)比1 mol NH3(l)能量高(c+b-a) kJ,该反应放热,ΔH为负值,故N2(g)+3H2(g)2NH3(l) ΔH=-2(c+b-a) kJ·mol-1。
3. C 解析:该反应为气体体积减小的反应,ΔS<0,A错误;ΔH=反应物键能总和-生成物键能总和,ΔH=E(NN)+3E(H—H)-6E(N—H),B错误;该反应中,H2中的H失电子化合价从0价转化为+1价,每消耗3 mol H2转移6 mol电子,C正确;该反应为气体体积减小的放热反应,低温、高压化学平衡正向移动,但是使用高活性催化剂对化学平衡没有影响,无法提高氨气产率,D错误。
4. +120
解析:ΔH=(413 kJ·mol-1×4+745 kJ·mol-1×2)-(1 075 kJ·mol-1×2+436 kJ·mol-1×2)=+120 kJ·mol-1。
5. D 解析:H2O应该为液态,A错误;C2H6(g)===C2H4(g)+H2(g) ΔH=+137 kJ·mol-1,B错误;氢气的燃烧热为285.8 kJ·mol-1,则H2O(l)===O2(g)+H2(g) ΔH=+285.8 kJ·mol-1,C错误;C2H6(g)+O2(g)===2CO2(g)+3H2O(l) ΔH=-1 559.8 kJ·mol-1,D正确。故选D。
6. B 解析:装置图缺少玻璃搅拌器,且小烧杯与大烧杯的上沿不齐平,该装置图不可用于精确测定酸碱反应的中和热,A错误;温度计的水银球应浸于溶液中,准确测量温度,B正确;温度计用于测定溶液温度,不能用于搅拌溶液,C错误;碎泡沫塑料可以起隔热作用,能替代碎纸屑,D错误。
考点二 盖斯定律
知识归纳
1. 始态和终态 反应的途径
3. aΔH2 -ΔH2 ΔH1+ΔH2
【易错辨析】
1. √ 2. × 3. √ 4. × 5. √
命题突破
1. (1)+657.1 kJ·mol-1 (2)-ΔH1+2ΔH2+3ΔH3+3ΔH4-ΔH5 (3)2a+2c-b
解析:(1)反应Ⅰ:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=246.5 kJ·mol-1,反应Ⅱ:H2(g)+CO2(g)===CO(g)+H2O(g) ΔH=41.2 kJ·mol-1
依据盖斯定律可知Ⅰ×3-Ⅱ×2即得到反应3CH4(g)+CO2(g)+2H2O(g)===4CO(g)+8H2(g)的ΔH=+657.1 kJ·mol-1。
(2)由题中所给的热化学方程式,根据盖斯定律可知,目标热化学方程式可由①×(-1)+②×2+③×3+④×3+⑤×(-1)得到,故ΔH=-ΔH1+2ΔH2+3ΔH3+3ΔH4-ΔH5。
(3)由盖斯定律可知,Ⅰ×2+Ⅲ×2-Ⅱ可得目标热化学方程式,则ΔH4=ΔH1×2+ΔH3×2-ΔH2=(2a+2c-b) kJ·mol-1。
2. A 解析:①S(g)+O2(g)===SO2(g);S(s)+O2(g)===SO2(g),由于S(g)―→S(s)放热,则前者放出的热量多,ΔH前者<ΔH后者,故选①;②C(s)+O2(g)===CO(g);C(s)+O2(g)===CO2(g),后者完全反应,放出的热量多,ΔH前者>ΔH后者,故不选②;③2KOH(aq)+H2SO4(浓)===K2SO4(aq)+2H2O(l);2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l),浓硫酸稀释放热,所以ΔH前者<ΔH后者,故选③;④2H2(g)+O2(g)===2H2O(l);H2(g)+O2(g)===H2O(l),消耗的氢气越多,放出的热量越多,ΔH前者<ΔH后者,故选④。化学反应的ΔH前者小于后者的是①③④,选A。
3. (1)①2NH3(g)+CO2(g)===H2O(g)+CO(NH2)2(s) ΔH=-(E4+E2-E1-E3) kJ·mol-1 ②< (2)E1-E2+ΔH+E3-E4
解析:(1)ΔH=吸收的能量总和-放出的能量总和,则热化学方程式为2NH3(g)+CO2(g)===H2O(g)+CO(NH2)2(s) ΔH=-(E4+E2-E1-E3) kJ·mol-1。活化能大的反应决定了反应速率的快慢,已知第二步反应决定了生产尿素的快慢,则可推测活化能E1
素养评估
1. C 解析:2 mol SO3、1 mol O2充入恒容容器中,达平衡时,SO2的转化率为50%,则反应了的SO2的物质的量为1 mol,放出热量98.3 kJ,故热化学方程式为2SO2(g)+O2(g)2SO3(g) ΔH=-196.6 kJ·mol-1或SO2(g)+O2(g)SO3(g) ΔH=-98.3 kJ·mol-1。故选C。
2. C 解析:能量越低越稳定,根据图示,等物质的量的HNC比HCN的能量高,HCN比HNC更稳定,A错误;HCN转化为HNC是吸热反应,吸热反应的发生不一定需要加热,B错误;加入催化剂,能降低反应的活化能,反应的热效应不变,D错误。故选C。
3. (1)+216.5 kJ·mol-1 (2)-1 627 (3)-46 kJ·mol-1
解析:(1)根据盖斯定律知Ⅰ+2×Ⅱ=总反应,故过程Ⅱ的ΔH2=(ΔH-ΔH1)=(571-138) kJ·mol-1=+216.5 kJ·mol-1。
(2)根据盖斯定律,反应Ⅰ-4×反应Ⅱ可得到热化学方程式:4NH3(g)+4NO(g)+O2(g)===4N2(g)+6H2O(g) ΔH=(-905.0-4×180.5) kJ·mol-1=-1 627 kJ·mol-1。
(3)由反应图示可知图形与化学键对应关系为
H—H C—O C===O O—H C—H
ΔH=反应物总键能-生成物总键能=2×803 kJ·mol-1+3×436 kJ·mol-1-3×414 kJ·mol-1-326 kJ·mol-1-3×464 kJ·mol-1=-46 kJ·mol-1。
4. (1)N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1 C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.28 kJ·mol-1 (3)C2H6O(l)+3O2(g)===2CO2(g)+3H2O(l)
ΔH=-1 367 kJ·mol-1 (4)NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ·mol-1 解析:(1)1 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ×4=534 kJ热量,即N2H4(g)+O2(g)===N2(g)+2H2O(g)
ΔH=-534 kJ·mol-1。
(2)12 g碳与适量水蒸气反应生成CO和H2,吸收10.94 kJ×12=131.28 kJ热量,即C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.28 kJ·mol-1。
(3)燃烧生成1.5 mol H2O(l)水和1 mol CO2,23 g有机物中O的质量为:23 g-3 g-12 g=8 g,该液态有机物中C、H、O原子个数比为1∶3∶0.5,化学式为C2H6O,热化学方程式为C2H6O(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1 367 kJ·mol-1。
(4)由图可知其热化学方程式为NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=E1-E2=134 kJ·mol-1-368 kJ·mol-1=-234 kJ·mol-1。
同课章节目录
