第18讲 原电池及其应用 学案(含答案)2026届高三化学一轮总复习
文档属性
| 名称 | 第18讲 原电池及其应用 学案(含答案)2026届高三化学一轮总复习 |
|
|
| 格式 | doc | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-27 00:00:00 | ||
图片预览



文档简介
第18讲 原电池及其应用
复习要求 1. 理解原电池的构成、工作原理及应用。2. 能书写电极反应和总反应方程式。3. 了解常见化学电源的种类及其工作原理。4. 认识金属腐蚀的危害,了解电化学腐蚀的原因,能利用原电池知识防止金属腐蚀。
知识体系
考点一 原电池工作原理
一、 概念
原电池是将________能转变为________能的装置,其反应实质是自发进行的氧化还原反应。
二、 原电池工作原理
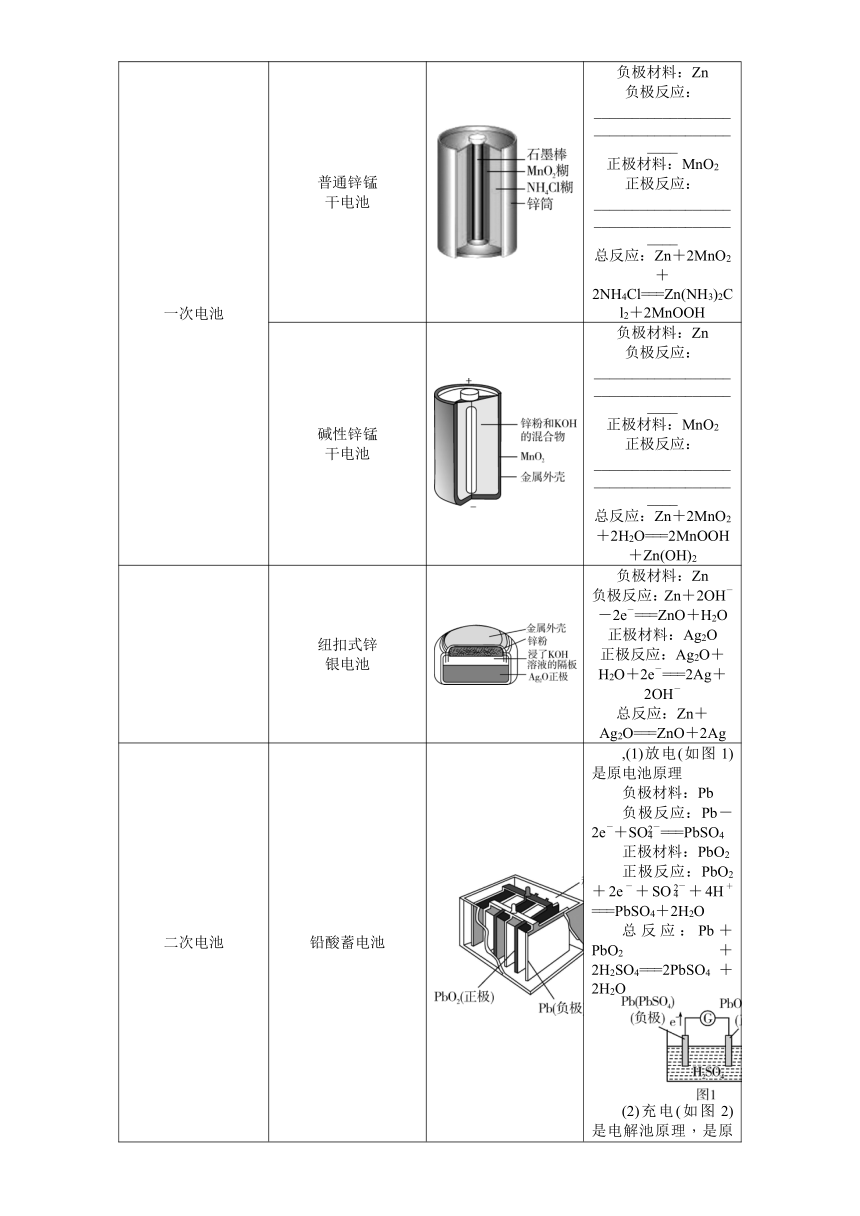
1. 构成条件
2. 构建原电池模型(以锌铜原电池为例)
电极名称 负极 正极
电极材料 锌片 铜片
电极反应 ________________ ________________
续表
反应类型 __________ __________
电子流向 由Zn片沿导线流向Cu片
盐桥中离子移向 盐桥含饱和KCl溶液,K+移向________极,Cl-移向________极
盐桥作用 ①连接内电路,形成闭合回路;②平衡电荷,使原电池不断产生电流
【思维拓展】
原电池正、负极的判断依据
a. 依据电子流向:电子由负极出发经导线流向正极(溶液中无电子流动)。
b. 依据电流流向:电流由正极出发经导线流向负极,正极的电势高,负极的电势低。
c. 依据离子迁移方向(正正负负):阳离子向正极迁移;阴离子向负极迁移。
d. 依据两极材料:一般活泼金属作负极,活泼性较弱的金属或惰性电极作正极。
特例:Al—NaOH溶液—Mg原电池中,虽然Mg比Al活泼,但是Mg不与NaOH溶液反应,故Al作负极,Mg作正极。Fe(Al)—浓硝酸—Cu原电池中,虽然Fe、Al比Cu活泼,但是Fe、Al会在浓硝酸中钝化,故钝化后,Cu作负极,Fe或Al作正极。
e. 依据电极现象:一般,电极逐渐溶解的为负极,电极增重或有气体放出的为正极。
f. 依据电极反应:失去电子发生氧化反应的一极是负极,得到电子发生还原反应的一极是正极。
g. 依据电解质溶液:能与电解质溶液反应的一极作负极,不能与电解质溶液反应的一极作正极。
【易错辨析】
1. 原电池内部电解质中的阴离子一定移向负极,阳离子一定移向正极。( )
2. 构成原电池两极的电极材料一定是活泼性不同的金属。( )
3. 原电池是化学能转化为电能的装置,其反应是自发的。( )
4. 使用盐桥可以提高电池的效率。( )
5. 下图能验证锌与硫酸铜反应过程中有电子转移。( )
类型1 原电池工作原理
1. (2023·广东卷)负载有Pt和Ag的活性炭,可选择性去除Cl-实现废酸的纯化,其工作原理如图。下列说法正确的是( )
A. Ag作原电池正极
B. 电子由Ag经活性炭流向Pt
C. Pt表面发生的电极反应:O2+2H2O+4e-===4OH-
D. 每消耗标准状况下11.2 L的O2,最多去除1 mol Cl-
类型2 原电池原理的应用
2. 有a、b、c、d四种金属,当a、b组成原电池时,电子流动方向a→b;当a、d组成原电池时,a为正极;b与c构成原电池时,电极反应式为c2++2e-===c、b-2e-===b2+,则a、b、c、d的金属性由强到弱的顺序为( )
A. a>b>c>d B. a>b>d>c
C. d>c>a>b D. d>a>b>c
考点二 常见的化学电源
常见的化学电源
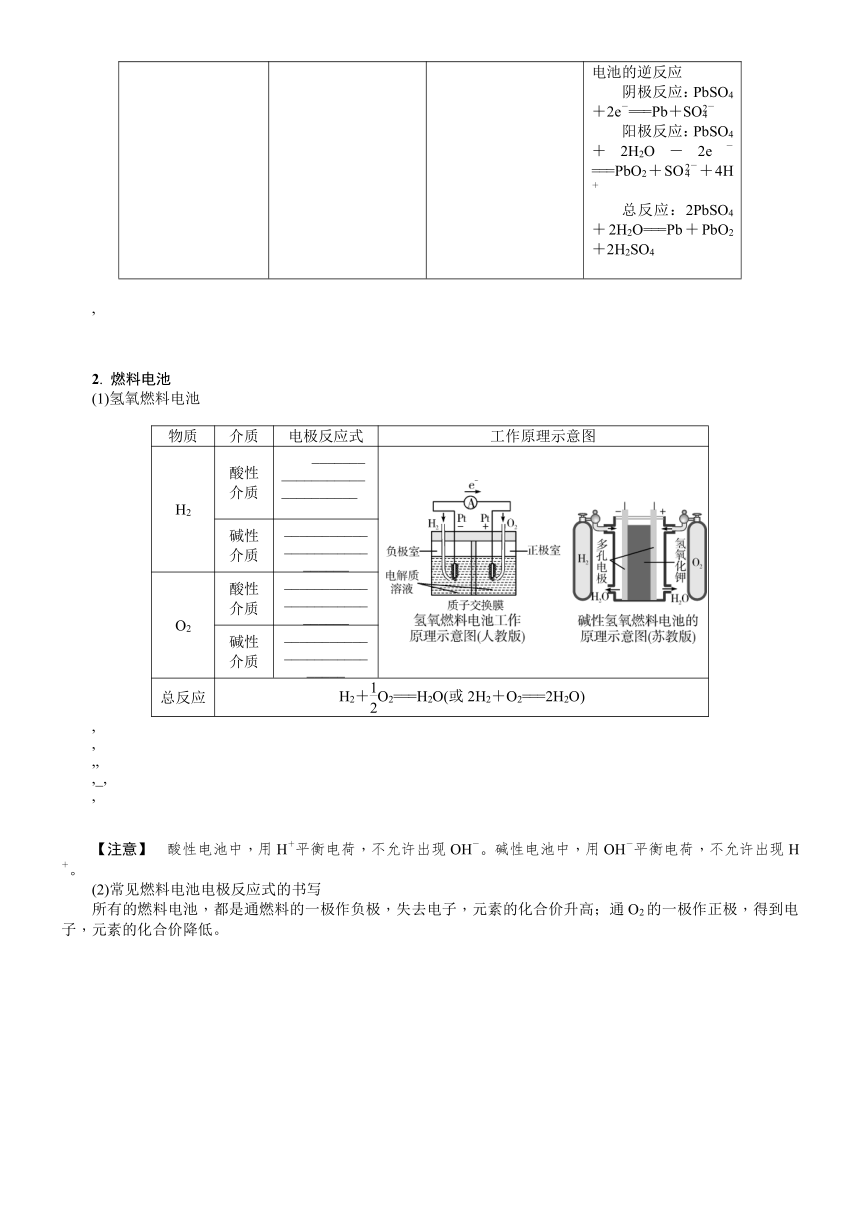
1. 一次电池和二次电池
类型 名称 装置图 电极材料及电极反应式
一次电池 普通锌锰干电池 负极材料:Zn负极反应:________________________________________正极材料:MnO2正极反应:________________________________________总反应:Zn+2MnO2+2NH4Cl===Zn(NH3)2Cl2+2MnOOH
碱性锌锰干电池 负极材料:Zn负极反应:________________________________________正极材料:MnO2正极反应:________________________________________总反应:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2
纽扣式锌银电池 负极材料:Zn负极反应:Zn+2OH--2e-===ZnO+H2O正极材料:Ag2O正极反应:Ag2O+H2O+2e-===2Ag+2OH-总反应:Zn+Ag2O===ZnO+2Ag
二次电池 铅酸蓄电池 ,(1)放电(如图1)是原电池原理负极材料:Pb负极反应:Pb-2e-+SO===PbSO4正极材料:PbO2正极反应:PbO2+2e-+SO+4H+===PbSO4+2H2O总反应:Pb+PbO2+2H2SO4===2PbSO4+2H2O(2)充电(如图2)是电解池原理,是原电池的逆反应阴极反应:PbSO4+2e-===Pb+SO阳极反应:PbSO4+2H2O-2e-===PbO2+SO+4H+总反应:2PbSO4+2H2O===Pb+PbO2+2H2SO4
,
2. 燃料电池
(1)氢氧燃料电池
物质 介质 电极反应式 工作原理示意图
H2 酸性介质 ____________________________
碱性介质 ____________________________
O2 酸性介质 ____________________________
碱性介质 ___________________________
总反应 H2+O2===H2O(或2H2+O2===2H2O)
,
,
,,
,_,
,
【注意】 酸性电池中,用H+平衡电荷,不允许出现OH-。碱性电池中,用OH-平衡电荷,不允许出现H+。
(2)常见燃料电池电极反应式的书写
所有的燃料电池,都是通燃料的一极作负极,失去电子,元素的化合价升高;通O2的一极作正极,得到电子,元素的化合价降低。
【思维拓展】
①如何判断有机物中C元素化合价:有机物中H元素一般定义为+1价,O元素一般定义为-2价,C元素算平均价态。如:CH3OH、CH3CH2OH中的C元素一般认定为-2价,C6H6中的C元素一般认定为-1价,HCOOH中的C元素一般认定为+2价。
②有机物在酸性电池中的含碳产物为CO2,一个电极消耗H+,另一个电极产生H+;在碱性电池中的含碳产物为CO,一个电极消耗OH-,另一个电极产生OH-。
(3)电解质为熔融碳酸盐或熔融氧化物的电极反应式的书写
①CH4熔融碳酸盐燃料电池
负极反应式:CH4-8e-+4CO===5CO2+2H2O
②CH4熔融氧化物燃料电池
负极反应式:CH4-8e-+4O2-===CO2+2H2O
【思维拓展】
离子交换膜类型和作用
(1)常见的离子交换膜
离子交换膜是一种含离子基团的、对溶液中的离子具有选择透过功能的膜,通常由特殊高分子材料制成。
离子交换膜分类如下:
(2)离子交换膜的作用
①平衡两边电极区的电荷。
②避免交换膜两边物质发生反应(反应物发生反应或产物发生反应)。
③形成交换膜两边电解质溶液浓度不同的浓差电池。
(3)分析方法
①根据膜的性质和离子在溶液中的迁移方向,画出离子透过膜的方向;②寻找迁出室溶液中浓度较大的迁移离子;③分析离子在迁入室的浓度增大和在迁出室的浓度减小,以及带来的实质变化。
(4)离子交换膜的应用——浓差电池
装置图及装置特点 用如图所示装置进行实验,观察到灵敏电流计的指针发生偏转。①a、b电极均为Ag单质。②左池为AgNO3稀溶液,右池为AgNO3浓溶液。两池AgNO3溶液的浓度不同,可以形成浓差电池。③离子交换膜作用:使两池Ag+浓度不同;平衡两池的电荷。④随着反应进行,左右两池浓度的差值逐渐减小,外电路中电流逐渐减小,电流计指针偏转幅度逐渐变小。当左右两池离子浓度相等时,电池将停止工作,不再有电流产生,此时左右两池硝酸银溶液的物质的量浓度相等
原理分析 ①Ag+浓度越大,氧化性越强,故b电极为正极,发生还原反应,b电极反应式为Ag++e-===Ag;a电极为负极,发生氧化反应,a电极反应式为Ag-e-===Ag+。②离子交换膜的类型和作用:不允许Ag+通过,只允许NO通过,是阴离子交换膜。随着反应进行,NO穿过离子交换膜的速率将减小
【易错辨析】
1. 氢氧燃料电池放电时,化学能全部转化为电能。( )
2. (2022·江苏卷)铅酸蓄电池放电时的正极反应式为Pb-2e-+SO===PbSO4。( )
3. 二次电池充电时,阴极连接电源的负极,发生还原反应。( )
4. 镍镉电池不能随意丢弃的主要原因是镍、镉的资源有限,价格昂贵。( )
5. 手机、电脑中使用的锂离子电池属于一次电池。( )
类型1 电解质溶液燃料电池
1. 燃料电池是燃料(如CO、H2、CH4、C2H6等)跟氧气(或空气)起反应将化学能转变为电能的装置,若电解质溶液是强碱溶液,下面关于乙烷(C2H6)燃料电池的说法正确的是( )
A. 通入5.6 L O2完全反应后,有1 mol电子发生转移
B. 负极反应式:C2H6+18OH-+14e-===2CO+12H2O
C. 该电池工作时,正极附近溶液的碱性增强
D. 燃料电池的优点之一是燃料反应时化学能全部转化为电能
类型2 熔融碳酸盐燃料电池
2. 一种熔融碳酸盐燃料电池的工作原理如图所示。下列有关该电池的说法正确的是( )
A. 电极B是该电池的负极
B. 电池工作时,CO向电极A移动
C. 电极B上发生的电极反应为O2-4e-===2O2-
D. H2参与的电极反应为H2+2OH--2e-===2H2O
类型3 微生物燃料电池、离子交换膜的判断
3. 微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示。下列说法正确的是( )
A. 该微生物燃料电池,负极为b
B. 为保证该电池的供电速度,应在较高温度下工作
C. 当电路中有0.5 mol电子发生转移,则有1 mol的H+通过质子交换膜
D. 该电池正极电极反应式为O2+4e-+4H+===2H2O
类型4 如何判断装置是原电池
4. 下列装置中,不属于原电池的是( )
A. B.
C. D.
类型5 常见的化学电池
5. (2024·江苏卷)碱性锌锰电池的总反应为Zn+2MnO2+H2O===ZnO+2MnOOH,电池构造示意图如图所示。下列有关说法正确的是( )
A. 电池工作时,MnO2发生氧化反应
B. 电池工作时,OH-通过隔膜向正极移动
C. 环境温度过低,不利于电池放电
D. 反应中每生成1 mol MnOOH,转移电子数为2×6.02×1023
类型6 陌生原电池装置
6. (2024·南通如皋三模)一种可用于吸收CO2的电池,其工作时的原理如图所示。下列说法正确的是( )
A. 电极a上发生的电极反应为H2-2e-===2H+
B. Ⅰ室出口处溶液的pH大于入口处
C. 如果将Ⅰ室、Ⅱ室间改为阳离子交换膜,则电池工作时Ⅰ室可能有CaCO3沉淀生成
D. 该装置可以制取CaCl2和NaHCO3
素 养 评 估
1. 与甲、乙两套装置有关的下列说法正确的是( )
A. 甲、乙装置中,锌棒均作负极,发生氧化反应
B. 甲中锌棒直接与稀H2SO4接触,故甲生成气泡的速率更快
C. 甲、乙装置的电解质溶液中,阳离子均向碳棒定向迁移
D. 乙中盐桥设计的优点是迅速平衡电荷,提高电池效率
2. 气体的自动化检测中常常应用原电池原理的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。则下列说法中正确的是( )
待测气体 部分电极反应产物
NO2 NO
Cl2 HCl
CO CO2
H2S H2SO4
A. 上述气体检测时,敏感电极均作电池正极
B. 检测分别含H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同
C. 检测H2S时,对电极充入空气,对电极上的电极反应式为O2+2H2O+4e-===4OH-
D. 检测Cl2时,敏感电极的电极反应式为Cl2+2e-===2Cl-
3. 2023杭州亚运会赛区内使用氢燃料清洁能源车辆,这种车辆利用原电池原理提供清洁电能,某氢氧燃料电池工作原理如图所示。下列说法正确的是 ( )
A. 电极a为电池的正极
B. 电池工作过程中,K+向负极迁移
C. 电极b表面反应为O2+4e-+2H2O===4OH-
D. 氢氧燃料电池中正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
4. 利用反应6NO2+8NH3===7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,又能提供电能,装置如图所示。
(1)A电极的电极反应式为__________________________________。
(2)下列关于该电池的说法正确的是________。
A. 电子从右侧电极经过负载后流向左侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电池工作一段时间,溶液的pH不变
D. 当有4.48 L NO2被处理时,转移电子物质的量为0.8 mol
第18讲 原电池及其应用
考点一 原电池工作原理
知识归纳
一、 化学 电
二、 1. 自发进行
2. Zn-2e-===Zn2+ Cu2++2e-===Cu 氧化反应 还原反应 正 负
【易错辨析】
1. √ 2. × 3. √ 4. √ 5. √
命题突破
1. B 解析:O2在Pt得电子发生还原反应,Pt为正极,Ag失去电子与溶液中的Cl-反应,Ag为负极。由分析可知,Ag失去电子与溶液中的Cl-反应生成AgCl,Ag为负极,A错误;电子由负极Ag经活性炭流向正极Pt,B正确;溶液为酸性,故Pt表面发生的电极反应为O2+4H++4e-===2H2O,C错误;每消耗标准状况下11.2 L的O2,转移电子2 mol,而2 mol Ag失去2 mol电子,故最多去除2 mol Cl-,D错误。故选B。
2. D 解析:当a、b组成原电池时,电子流动方向a→b,则金属性:a>b;当a、d组成原电池时,a为正极,则金属性:d>a;b与c构成原电池时,电极反应式:c2++2e-===c、b-2e-===b2+,b失去电子,则金属性:b>c;综上所述,金属性:d>a>b>c,D正确。
考点二 常见的化学电源
知识归纳
1. Zn-2e-+2NH3===[Zn(NH3)2]2+ MnO2+e-+NH===MnO(OH)+NH3
Zn+2OH--2e-===Zn(OH)2 MnO2+H2O+e-===MnO(OH)+OH-
2. (1)H2-2e-===2H+ H2+2OH--2e-===2H2O O2+4e-+4H+===2H2O O2+4e-+2H2O===4OH- (2)CH4-8e-+2H2O===CO2+8H+
CH4-8e-+10OH-===CO+7H2O O2+4e-+4H+===2H2O O2+4e-+2H2O===4OH- CH4+2O2===CO2+2H2O CH4+2O2+2KOH===K2CO3+3H2O C2H5OH-12e-+3H2O===2CO2↑+12H+ C2H5OH-12e-+16OH-===2CO+11H2O O2+4e-+4H+===2H2O O2+4e-+2H2O===4OH- C2H5OH+3O2===2CO2+3H2O C2H5OH+3O2+4KOH===2K2CO3+5H2O C6H6-30e-+12H2O===6CO2↑+30H+ C6H6-30e-+42OH-===6CO+24H2O O2+4e-+4H+===2H2O O2+4e-+2H2O===4OH- 2C6H6+15O2===12CO2+6H2O 2C6H6+15O2+24KOH===12K2CO3+18H2O
【易错辨析】
1. × 2. × 3. √ 4. × 5. ×
命题突破
1. C 解析:燃料电池中,通入燃料的一极为负极,负极发生氧化反应,通入氧气的一极为正极,正极发生还原反应。气体所处的状态未知,不能计算5.6 L O2的物质的量,故A错误;乙烷燃料电池中,负极上乙烷失去电子发生氧化反应,电解质溶液为碱性,则其电极反应式为C2H6+18OH--14e-===2CO+12H2O,故B错误;该电池工作时,正极反应为O2+4e-+2H2O===4OH-,生成OH-,正极附近溶液的碱性增强,故C正确;燃料电池燃料的化学能不能全部转化为电能,还转化为热能等其他形式的能量,故D错误。故选C。
2. B 解析:电极B通入的是O2、CO2,则电极B为正极,电极A为负极,负极反应式为H2+CO-2e-===H2O+CO2、CO+CO-2e-===2CO2,正极反应式为O2+4e-+2CO2===2CO,A、C、D错误;原电池工作时,阴离子(CO)向负极(电极A)移动,B正确。
3. D 解析:该微生物燃料电池,b极通入氧气,氧气发生还原反应,则b为正极,故A错误;为保证微生物的活性,该电池不能在较高温度下工作,故B错误;根据电荷守恒,当电路中有0.5 mol电子发生转移,则有0.5 mol的H+通过质子交换膜,故C错误;b极通入氧气,氧气发生还原反应,则b为正极,正极电极反应式为O2+4e-+4H+===2H2O,故D正确。故选D。
4. D 解析:两电极材料不同,形成闭合回路,Cu能与氯化铁发生自发的氧化还原反应,故A正确;两电极材料不同,铁较活泼,海水是电解质,能发生自发的氧化还原反应,形成闭合回路,所以能形成原电池,故B正确;Zn与Cu活泼性不同,有盐桥形成闭合回路,Zn能与CuSO4溶液发生自发的氧化还原反应,故C正确;电解质应含有铜离子,而不是锌离子,否则不能发生自发的氧化还原反应,故D错误;故答案为:D。
5. C 解析:电池工作时,MnO2为正极,得到电子,发生还原反应,故A错误;电池工作时,OH-通过隔膜向负极移动,故B错误;环境温度过低,化学反应速率下降,不利于电池放电,故C正确;由电极反应式MnO2+e-+H2O===MnOOH+OH-可知,反应中每生成1 mol MnOOH,转移电子数为6.02×1023,故D错误。
6. D 解析:由图可知氢气在电极a上失电子,结合Ⅰ室中的氢氧根离子生成水,电极反应为H2-2e-+2OH-===2H2O。a极为负极,b极为正极,b电极上氢离子得电子生成氢气。由以上分析可知电极a上反应为H2-2e-+2OH-===2H2O,故A错误;Ⅰ室中氢氧根离子逐渐被消耗,溶液pH值逐渐减小,则出口处pH小于入口处,故B错误;如果将Ⅰ室、Ⅱ室间改为阳离子交换膜,则Ⅰ室中的钙离子通过交换膜向Ⅱ室移动,在Ⅱ室中结合碳酸根可能生成CaCO3沉淀,故C错误;该装置Ⅰ室中有钙离子,从Ⅱ室迁移来的氯离子,故Ⅰ室可以制取氯化钙;Ⅱ室中含钠离子和反应生成的碳酸氢根离子,可得到碳酸氢钠,故D正确。
素养评估
1. D 解析:甲不是原电池,A错误;甲中锌棒直接与稀H2SO4接触,发生化学腐蚀,乙中构成了原电池,负极失去电子的速率加快,因此正极放出氢气的速率增大,B错误;甲不是原电池,电解质溶液中的阳离子向锌移动,C错误;盐桥中离子的定向迁移构成了电流通路,盐桥既可沟通两方溶液,又能阻止反应物的直接接触,迅速平衡电荷,使由它连接的两溶液保持电中性,提高电池效率,D正确。故选D。
2. D 解析:原电池中的正极发生还原反应,得到电子,元素的化合价降低,而待测气体为CO时,反应产物为二氧化碳,C元素的化合价升高,发生氧化反应,所以此时敏感电极作电池负极,同理,待测气体为H2S时,S元素的化合价也升高,敏感电极作电池负极,A错误;H2S和CO体积分数相同,则二者物质的量相同,二者失去的电子的物质的量不同,CO失去2个电子,而H2S中S失去8个电子,所以在气体的扩散速度相同的前提下,传感器上产生的电流大小不同,B错误;检测H2S时,因为电极产物为H2SO4,所以电解质溶液为硫酸,对电极为正极,发生还原反应,充入空气,则正极反应式为O2+4H++4e-===2H2O,C错误;检测Cl2时,Cl元素的化合价降低,所以敏感电极作正极,则敏感电极的电极反应式是Cl2+2e-===2Cl-,D正确。故选D。
3. C 解析:由图可知,电极a为负极,电极反应式为H2-2e-+2OH-===2H2O,电极b为正极,电极反应式为O2+4e-+2H2O===4OH-,据此作答。电极a上氢元素失电子价态升高,故电极a为负极,A错误;原电池工作时,阴离子向负极移动,阳离子向正极移动,K+移向正极,故B错误;由分析可知,电极b为正极,电极反应式为O2+4e-+2H2O===4OH-,C正确;标准状况下22.4 L气体的物质的量为1 mol,结合选项C分析可知,正极消耗1 mol氧气,电路中通过的电子数目为4NA,D错误。故选C。
4. (1)2NH3-6e-+6OH-===N2+6H2O (2)B 解析:(1)根据总反应知NH3中N元素从-3价升高到0价,失去电子,因此A电极为负极,电极反应式为2NH3-6e-+6OH-===N2+6H2O;
(2)电极A为负极,电子从左侧电极经负载流向右侧电极,A错误;B极为正极,电极反应式为2NO2+8e-+4H2O===N2+8OH-,而负极则消耗OH-,为使电池持续供电,正极生成的OH-必须通过离子交换膜转移到负极区,故选用阴离子交换膜,B正确;根据总反应知,反应生成水,会稀释电解质溶液,因此溶液pH会改变,C错误;利用摩尔体积计算时,必须指明温度与压强,D错误。故选B。
复习要求 1. 理解原电池的构成、工作原理及应用。2. 能书写电极反应和总反应方程式。3. 了解常见化学电源的种类及其工作原理。4. 认识金属腐蚀的危害,了解电化学腐蚀的原因,能利用原电池知识防止金属腐蚀。
知识体系
考点一 原电池工作原理
一、 概念
原电池是将________能转变为________能的装置,其反应实质是自发进行的氧化还原反应。
二、 原电池工作原理
1. 构成条件
2. 构建原电池模型(以锌铜原电池为例)
电极名称 负极 正极
电极材料 锌片 铜片
电极反应 ________________ ________________
续表
反应类型 __________ __________
电子流向 由Zn片沿导线流向Cu片
盐桥中离子移向 盐桥含饱和KCl溶液,K+移向________极,Cl-移向________极
盐桥作用 ①连接内电路,形成闭合回路;②平衡电荷,使原电池不断产生电流
【思维拓展】
原电池正、负极的判断依据
a. 依据电子流向:电子由负极出发经导线流向正极(溶液中无电子流动)。
b. 依据电流流向:电流由正极出发经导线流向负极,正极的电势高,负极的电势低。
c. 依据离子迁移方向(正正负负):阳离子向正极迁移;阴离子向负极迁移。
d. 依据两极材料:一般活泼金属作负极,活泼性较弱的金属或惰性电极作正极。
特例:Al—NaOH溶液—Mg原电池中,虽然Mg比Al活泼,但是Mg不与NaOH溶液反应,故Al作负极,Mg作正极。Fe(Al)—浓硝酸—Cu原电池中,虽然Fe、Al比Cu活泼,但是Fe、Al会在浓硝酸中钝化,故钝化后,Cu作负极,Fe或Al作正极。
e. 依据电极现象:一般,电极逐渐溶解的为负极,电极增重或有气体放出的为正极。
f. 依据电极反应:失去电子发生氧化反应的一极是负极,得到电子发生还原反应的一极是正极。
g. 依据电解质溶液:能与电解质溶液反应的一极作负极,不能与电解质溶液反应的一极作正极。
【易错辨析】
1. 原电池内部电解质中的阴离子一定移向负极,阳离子一定移向正极。( )
2. 构成原电池两极的电极材料一定是活泼性不同的金属。( )
3. 原电池是化学能转化为电能的装置,其反应是自发的。( )
4. 使用盐桥可以提高电池的效率。( )
5. 下图能验证锌与硫酸铜反应过程中有电子转移。( )
类型1 原电池工作原理
1. (2023·广东卷)负载有Pt和Ag的活性炭,可选择性去除Cl-实现废酸的纯化,其工作原理如图。下列说法正确的是( )
A. Ag作原电池正极
B. 电子由Ag经活性炭流向Pt
C. Pt表面发生的电极反应:O2+2H2O+4e-===4OH-
D. 每消耗标准状况下11.2 L的O2,最多去除1 mol Cl-
类型2 原电池原理的应用
2. 有a、b、c、d四种金属,当a、b组成原电池时,电子流动方向a→b;当a、d组成原电池时,a为正极;b与c构成原电池时,电极反应式为c2++2e-===c、b-2e-===b2+,则a、b、c、d的金属性由强到弱的顺序为( )
A. a>b>c>d B. a>b>d>c
C. d>c>a>b D. d>a>b>c
考点二 常见的化学电源
常见的化学电源
1. 一次电池和二次电池
类型 名称 装置图 电极材料及电极反应式
一次电池 普通锌锰干电池 负极材料:Zn负极反应:________________________________________正极材料:MnO2正极反应:________________________________________总反应:Zn+2MnO2+2NH4Cl===Zn(NH3)2Cl2+2MnOOH
碱性锌锰干电池 负极材料:Zn负极反应:________________________________________正极材料:MnO2正极反应:________________________________________总反应:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2
纽扣式锌银电池 负极材料:Zn负极反应:Zn+2OH--2e-===ZnO+H2O正极材料:Ag2O正极反应:Ag2O+H2O+2e-===2Ag+2OH-总反应:Zn+Ag2O===ZnO+2Ag
二次电池 铅酸蓄电池 ,(1)放电(如图1)是原电池原理负极材料:Pb负极反应:Pb-2e-+SO===PbSO4正极材料:PbO2正极反应:PbO2+2e-+SO+4H+===PbSO4+2H2O总反应:Pb+PbO2+2H2SO4===2PbSO4+2H2O(2)充电(如图2)是电解池原理,是原电池的逆反应阴极反应:PbSO4+2e-===Pb+SO阳极反应:PbSO4+2H2O-2e-===PbO2+SO+4H+总反应:2PbSO4+2H2O===Pb+PbO2+2H2SO4
,
2. 燃料电池
(1)氢氧燃料电池
物质 介质 电极反应式 工作原理示意图
H2 酸性介质 ____________________________
碱性介质 ____________________________
O2 酸性介质 ____________________________
碱性介质 ___________________________
总反应 H2+O2===H2O(或2H2+O2===2H2O)
,
,
,,
,_,
,
【注意】 酸性电池中,用H+平衡电荷,不允许出现OH-。碱性电池中,用OH-平衡电荷,不允许出现H+。
(2)常见燃料电池电极反应式的书写
所有的燃料电池,都是通燃料的一极作负极,失去电子,元素的化合价升高;通O2的一极作正极,得到电子,元素的化合价降低。
【思维拓展】
①如何判断有机物中C元素化合价:有机物中H元素一般定义为+1价,O元素一般定义为-2价,C元素算平均价态。如:CH3OH、CH3CH2OH中的C元素一般认定为-2价,C6H6中的C元素一般认定为-1价,HCOOH中的C元素一般认定为+2价。
②有机物在酸性电池中的含碳产物为CO2,一个电极消耗H+,另一个电极产生H+;在碱性电池中的含碳产物为CO,一个电极消耗OH-,另一个电极产生OH-。
(3)电解质为熔融碳酸盐或熔融氧化物的电极反应式的书写
①CH4熔融碳酸盐燃料电池
负极反应式:CH4-8e-+4CO===5CO2+2H2O
②CH4熔融氧化物燃料电池
负极反应式:CH4-8e-+4O2-===CO2+2H2O
【思维拓展】
离子交换膜类型和作用
(1)常见的离子交换膜
离子交换膜是一种含离子基团的、对溶液中的离子具有选择透过功能的膜,通常由特殊高分子材料制成。
离子交换膜分类如下:
(2)离子交换膜的作用
①平衡两边电极区的电荷。
②避免交换膜两边物质发生反应(反应物发生反应或产物发生反应)。
③形成交换膜两边电解质溶液浓度不同的浓差电池。
(3)分析方法
①根据膜的性质和离子在溶液中的迁移方向,画出离子透过膜的方向;②寻找迁出室溶液中浓度较大的迁移离子;③分析离子在迁入室的浓度增大和在迁出室的浓度减小,以及带来的实质变化。
(4)离子交换膜的应用——浓差电池
装置图及装置特点 用如图所示装置进行实验,观察到灵敏电流计的指针发生偏转。①a、b电极均为Ag单质。②左池为AgNO3稀溶液,右池为AgNO3浓溶液。两池AgNO3溶液的浓度不同,可以形成浓差电池。③离子交换膜作用:使两池Ag+浓度不同;平衡两池的电荷。④随着反应进行,左右两池浓度的差值逐渐减小,外电路中电流逐渐减小,电流计指针偏转幅度逐渐变小。当左右两池离子浓度相等时,电池将停止工作,不再有电流产生,此时左右两池硝酸银溶液的物质的量浓度相等
原理分析 ①Ag+浓度越大,氧化性越强,故b电极为正极,发生还原反应,b电极反应式为Ag++e-===Ag;a电极为负极,发生氧化反应,a电极反应式为Ag-e-===Ag+。②离子交换膜的类型和作用:不允许Ag+通过,只允许NO通过,是阴离子交换膜。随着反应进行,NO穿过离子交换膜的速率将减小
【易错辨析】
1. 氢氧燃料电池放电时,化学能全部转化为电能。( )
2. (2022·江苏卷)铅酸蓄电池放电时的正极反应式为Pb-2e-+SO===PbSO4。( )
3. 二次电池充电时,阴极连接电源的负极,发生还原反应。( )
4. 镍镉电池不能随意丢弃的主要原因是镍、镉的资源有限,价格昂贵。( )
5. 手机、电脑中使用的锂离子电池属于一次电池。( )
类型1 电解质溶液燃料电池
1. 燃料电池是燃料(如CO、H2、CH4、C2H6等)跟氧气(或空气)起反应将化学能转变为电能的装置,若电解质溶液是强碱溶液,下面关于乙烷(C2H6)燃料电池的说法正确的是( )
A. 通入5.6 L O2完全反应后,有1 mol电子发生转移
B. 负极反应式:C2H6+18OH-+14e-===2CO+12H2O
C. 该电池工作时,正极附近溶液的碱性增强
D. 燃料电池的优点之一是燃料反应时化学能全部转化为电能
类型2 熔融碳酸盐燃料电池
2. 一种熔融碳酸盐燃料电池的工作原理如图所示。下列有关该电池的说法正确的是( )
A. 电极B是该电池的负极
B. 电池工作时,CO向电极A移动
C. 电极B上发生的电极反应为O2-4e-===2O2-
D. H2参与的电极反应为H2+2OH--2e-===2H2O
类型3 微生物燃料电池、离子交换膜的判断
3. 微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示。下列说法正确的是( )
A. 该微生物燃料电池,负极为b
B. 为保证该电池的供电速度,应在较高温度下工作
C. 当电路中有0.5 mol电子发生转移,则有1 mol的H+通过质子交换膜
D. 该电池正极电极反应式为O2+4e-+4H+===2H2O
类型4 如何判断装置是原电池
4. 下列装置中,不属于原电池的是( )
A. B.
C. D.
类型5 常见的化学电池
5. (2024·江苏卷)碱性锌锰电池的总反应为Zn+2MnO2+H2O===ZnO+2MnOOH,电池构造示意图如图所示。下列有关说法正确的是( )
A. 电池工作时,MnO2发生氧化反应
B. 电池工作时,OH-通过隔膜向正极移动
C. 环境温度过低,不利于电池放电
D. 反应中每生成1 mol MnOOH,转移电子数为2×6.02×1023
类型6 陌生原电池装置
6. (2024·南通如皋三模)一种可用于吸收CO2的电池,其工作时的原理如图所示。下列说法正确的是( )
A. 电极a上发生的电极反应为H2-2e-===2H+
B. Ⅰ室出口处溶液的pH大于入口处
C. 如果将Ⅰ室、Ⅱ室间改为阳离子交换膜,则电池工作时Ⅰ室可能有CaCO3沉淀生成
D. 该装置可以制取CaCl2和NaHCO3
素 养 评 估
1. 与甲、乙两套装置有关的下列说法正确的是( )
A. 甲、乙装置中,锌棒均作负极,发生氧化反应
B. 甲中锌棒直接与稀H2SO4接触,故甲生成气泡的速率更快
C. 甲、乙装置的电解质溶液中,阳离子均向碳棒定向迁移
D. 乙中盐桥设计的优点是迅速平衡电荷,提高电池效率
2. 气体的自动化检测中常常应用原电池原理的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。则下列说法中正确的是( )
待测气体 部分电极反应产物
NO2 NO
Cl2 HCl
CO CO2
H2S H2SO4
A. 上述气体检测时,敏感电极均作电池正极
B. 检测分别含H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同
C. 检测H2S时,对电极充入空气,对电极上的电极反应式为O2+2H2O+4e-===4OH-
D. 检测Cl2时,敏感电极的电极反应式为Cl2+2e-===2Cl-
3. 2023杭州亚运会赛区内使用氢燃料清洁能源车辆,这种车辆利用原电池原理提供清洁电能,某氢氧燃料电池工作原理如图所示。下列说法正确的是 ( )
A. 电极a为电池的正极
B. 电池工作过程中,K+向负极迁移
C. 电极b表面反应为O2+4e-+2H2O===4OH-
D. 氢氧燃料电池中正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
4. 利用反应6NO2+8NH3===7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,又能提供电能,装置如图所示。
(1)A电极的电极反应式为__________________________________。
(2)下列关于该电池的说法正确的是________。
A. 电子从右侧电极经过负载后流向左侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电池工作一段时间,溶液的pH不变
D. 当有4.48 L NO2被处理时,转移电子物质的量为0.8 mol
第18讲 原电池及其应用
考点一 原电池工作原理
知识归纳
一、 化学 电
二、 1. 自发进行
2. Zn-2e-===Zn2+ Cu2++2e-===Cu 氧化反应 还原反应 正 负
【易错辨析】
1. √ 2. × 3. √ 4. √ 5. √
命题突破
1. B 解析:O2在Pt得电子发生还原反应,Pt为正极,Ag失去电子与溶液中的Cl-反应,Ag为负极。由分析可知,Ag失去电子与溶液中的Cl-反应生成AgCl,Ag为负极,A错误;电子由负极Ag经活性炭流向正极Pt,B正确;溶液为酸性,故Pt表面发生的电极反应为O2+4H++4e-===2H2O,C错误;每消耗标准状况下11.2 L的O2,转移电子2 mol,而2 mol Ag失去2 mol电子,故最多去除2 mol Cl-,D错误。故选B。
2. D 解析:当a、b组成原电池时,电子流动方向a→b,则金属性:a>b;当a、d组成原电池时,a为正极,则金属性:d>a;b与c构成原电池时,电极反应式:c2++2e-===c、b-2e-===b2+,b失去电子,则金属性:b>c;综上所述,金属性:d>a>b>c,D正确。
考点二 常见的化学电源
知识归纳
1. Zn-2e-+2NH3===[Zn(NH3)2]2+ MnO2+e-+NH===MnO(OH)+NH3
Zn+2OH--2e-===Zn(OH)2 MnO2+H2O+e-===MnO(OH)+OH-
2. (1)H2-2e-===2H+ H2+2OH--2e-===2H2O O2+4e-+4H+===2H2O O2+4e-+2H2O===4OH- (2)CH4-8e-+2H2O===CO2+8H+
CH4-8e-+10OH-===CO+7H2O O2+4e-+4H+===2H2O O2+4e-+2H2O===4OH- CH4+2O2===CO2+2H2O CH4+2O2+2KOH===K2CO3+3H2O C2H5OH-12e-+3H2O===2CO2↑+12H+ C2H5OH-12e-+16OH-===2CO+11H2O O2+4e-+4H+===2H2O O2+4e-+2H2O===4OH- C2H5OH+3O2===2CO2+3H2O C2H5OH+3O2+4KOH===2K2CO3+5H2O C6H6-30e-+12H2O===6CO2↑+30H+ C6H6-30e-+42OH-===6CO+24H2O O2+4e-+4H+===2H2O O2+4e-+2H2O===4OH- 2C6H6+15O2===12CO2+6H2O 2C6H6+15O2+24KOH===12K2CO3+18H2O
【易错辨析】
1. × 2. × 3. √ 4. × 5. ×
命题突破
1. C 解析:燃料电池中,通入燃料的一极为负极,负极发生氧化反应,通入氧气的一极为正极,正极发生还原反应。气体所处的状态未知,不能计算5.6 L O2的物质的量,故A错误;乙烷燃料电池中,负极上乙烷失去电子发生氧化反应,电解质溶液为碱性,则其电极反应式为C2H6+18OH--14e-===2CO+12H2O,故B错误;该电池工作时,正极反应为O2+4e-+2H2O===4OH-,生成OH-,正极附近溶液的碱性增强,故C正确;燃料电池燃料的化学能不能全部转化为电能,还转化为热能等其他形式的能量,故D错误。故选C。
2. B 解析:电极B通入的是O2、CO2,则电极B为正极,电极A为负极,负极反应式为H2+CO-2e-===H2O+CO2、CO+CO-2e-===2CO2,正极反应式为O2+4e-+2CO2===2CO,A、C、D错误;原电池工作时,阴离子(CO)向负极(电极A)移动,B正确。
3. D 解析:该微生物燃料电池,b极通入氧气,氧气发生还原反应,则b为正极,故A错误;为保证微生物的活性,该电池不能在较高温度下工作,故B错误;根据电荷守恒,当电路中有0.5 mol电子发生转移,则有0.5 mol的H+通过质子交换膜,故C错误;b极通入氧气,氧气发生还原反应,则b为正极,正极电极反应式为O2+4e-+4H+===2H2O,故D正确。故选D。
4. D 解析:两电极材料不同,形成闭合回路,Cu能与氯化铁发生自发的氧化还原反应,故A正确;两电极材料不同,铁较活泼,海水是电解质,能发生自发的氧化还原反应,形成闭合回路,所以能形成原电池,故B正确;Zn与Cu活泼性不同,有盐桥形成闭合回路,Zn能与CuSO4溶液发生自发的氧化还原反应,故C正确;电解质应含有铜离子,而不是锌离子,否则不能发生自发的氧化还原反应,故D错误;故答案为:D。
5. C 解析:电池工作时,MnO2为正极,得到电子,发生还原反应,故A错误;电池工作时,OH-通过隔膜向负极移动,故B错误;环境温度过低,化学反应速率下降,不利于电池放电,故C正确;由电极反应式MnO2+e-+H2O===MnOOH+OH-可知,反应中每生成1 mol MnOOH,转移电子数为6.02×1023,故D错误。
6. D 解析:由图可知氢气在电极a上失电子,结合Ⅰ室中的氢氧根离子生成水,电极反应为H2-2e-+2OH-===2H2O。a极为负极,b极为正极,b电极上氢离子得电子生成氢气。由以上分析可知电极a上反应为H2-2e-+2OH-===2H2O,故A错误;Ⅰ室中氢氧根离子逐渐被消耗,溶液pH值逐渐减小,则出口处pH小于入口处,故B错误;如果将Ⅰ室、Ⅱ室间改为阳离子交换膜,则Ⅰ室中的钙离子通过交换膜向Ⅱ室移动,在Ⅱ室中结合碳酸根可能生成CaCO3沉淀,故C错误;该装置Ⅰ室中有钙离子,从Ⅱ室迁移来的氯离子,故Ⅰ室可以制取氯化钙;Ⅱ室中含钠离子和反应生成的碳酸氢根离子,可得到碳酸氢钠,故D正确。
素养评估
1. D 解析:甲不是原电池,A错误;甲中锌棒直接与稀H2SO4接触,发生化学腐蚀,乙中构成了原电池,负极失去电子的速率加快,因此正极放出氢气的速率增大,B错误;甲不是原电池,电解质溶液中的阳离子向锌移动,C错误;盐桥中离子的定向迁移构成了电流通路,盐桥既可沟通两方溶液,又能阻止反应物的直接接触,迅速平衡电荷,使由它连接的两溶液保持电中性,提高电池效率,D正确。故选D。
2. D 解析:原电池中的正极发生还原反应,得到电子,元素的化合价降低,而待测气体为CO时,反应产物为二氧化碳,C元素的化合价升高,发生氧化反应,所以此时敏感电极作电池负极,同理,待测气体为H2S时,S元素的化合价也升高,敏感电极作电池负极,A错误;H2S和CO体积分数相同,则二者物质的量相同,二者失去的电子的物质的量不同,CO失去2个电子,而H2S中S失去8个电子,所以在气体的扩散速度相同的前提下,传感器上产生的电流大小不同,B错误;检测H2S时,因为电极产物为H2SO4,所以电解质溶液为硫酸,对电极为正极,发生还原反应,充入空气,则正极反应式为O2+4H++4e-===2H2O,C错误;检测Cl2时,Cl元素的化合价降低,所以敏感电极作正极,则敏感电极的电极反应式是Cl2+2e-===2Cl-,D正确。故选D。
3. C 解析:由图可知,电极a为负极,电极反应式为H2-2e-+2OH-===2H2O,电极b为正极,电极反应式为O2+4e-+2H2O===4OH-,据此作答。电极a上氢元素失电子价态升高,故电极a为负极,A错误;原电池工作时,阴离子向负极移动,阳离子向正极移动,K+移向正极,故B错误;由分析可知,电极b为正极,电极反应式为O2+4e-+2H2O===4OH-,C正确;标准状况下22.4 L气体的物质的量为1 mol,结合选项C分析可知,正极消耗1 mol氧气,电路中通过的电子数目为4NA,D错误。故选C。
4. (1)2NH3-6e-+6OH-===N2+6H2O (2)B 解析:(1)根据总反应知NH3中N元素从-3价升高到0价,失去电子,因此A电极为负极,电极反应式为2NH3-6e-+6OH-===N2+6H2O;
(2)电极A为负极,电子从左侧电极经负载流向右侧电极,A错误;B极为正极,电极反应式为2NO2+8e-+4H2O===N2+8OH-,而负极则消耗OH-,为使电池持续供电,正极生成的OH-必须通过离子交换膜转移到负极区,故选用阴离子交换膜,B正确;根据总反应知,反应生成水,会稀释电解质溶液,因此溶液pH会改变,C错误;利用摩尔体积计算时,必须指明温度与压强,D错误。故选B。
同课章节目录
